Introducción
El manglar constituye un sistema ecológico abierto que interactúa con el mar, la tierra, la atmósfera y las aguas epicontinentales; es el punto de unión entre los ambientes marinos y terrestres (INEFAN/GEF, 1998). El ecosistema de manglar es una unidad ecológica integrada por un mosaico de parches de diferentes formaciones vegetales; estos parches son interdependientes y la transformación de uno de éstos provoca alteraciones en los otros, causando la destrucción del ecosistema como tal.
Este constituye hábitat, criadero de fauna marina en proceso de desarrollo; buena parte de la flora y fauna aún presente está en peligro de extinción; existen posibilidades para el turismo escénico,
recreativo y científico.
Según Ayón, et al., (1987), mencionan que el archipiélago de San Lorenzo abarca 425 de los 480 kilómetros de costa que ocupa el centro y norte de la franja indicada, correspondientes a los manglares que han sido extensiones muy exuberantes y que progresivamente se han talado en las islas estuarinas y barrera posterior para la construcción de piscinas camaroneras.
Cabe señalar que existen pocos trabajos concernientes al estudio del plancton en zonas de manglar en los estuarios en la provincia de Esmeraldas, entre ellos se mencionan los siguientes: Luzuriaga (1993), estudió la distribución y abundancia del zooplancton en los manglares de la región norte de la provincia de Esmeraldas entre la desembocadura del río
Cayapas y la boca del río Mataje, unos de los sistemas más densos en vegetación tropical de la costa ecuatoriana.
Naranjo & Tapia (2002), estudiaron la composición, distribución y abundancia del plancton en el estuario de San Lorenzo, Esmeraldas donde se estableció una considerable diversidad de grupos representados por 17 taxa zooplanctónicas, mientras el fitoplancton registró un promedio de
75 especies fitoplanctónicas, en el presente trabajo se observaron 13 grupos zooplanctónicos distribuidos en toda el área de estudio, reportando la mayor densidad poblacional hacia el sector de la salida del estuario de San Lorenzo, cercana a la comuna Pampanal y frente de la comuna el Viento.
Debido a la intensa actividad predadora de las medusas y sifonóforos, además de su rol fundamental en la estructura y dinámica del zooplancton (Mackie, 1976), se ha considerado necesario identificar y determinar la distribución de las especies de cnidarios en el estuario del río Mataje, Bahía Ancón de Sardinas y conocer el estado actual del mismo e incrementar la información existente.
Área de estudio:
El área de San Lorenzo, es una parroquia asentada en el norte de la provincia de Esmeraldas en la bahía de Pailón detrás de la isla Santa Rosa, se caracteriza por tener aguas tranquilas y por su gran vegetación principal- mente por manglares tanto en la bahía como en los canales y en las islas (INEFAN/GEF, 1998).
El canal de San Lorenzo constituye uno de los sistemas más densos en vegetación tropical de la costa ecuatoriana. Clitrón, G, I. Solís y C. Bonifaz (1976), menciona que los manglares de Esmeraldas forman parte del sistema de manglares que se inicia al sur del Cabo Corrientes.
Según Ayón, et al., (1987), en el mismo archipiélago y costa afuera la sedimentación de origen deltaico es muy pesada y se han formado bancos de arena de varios kilómetros mar adentro. En cambio las playas del archipiélago San Lorenzo son de arena fina las de origen marino que dificulta la navegación, en contraste con las estuarinas que son fangosas (Figura 1).
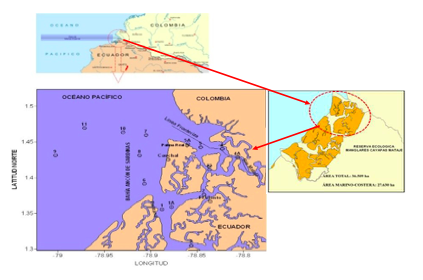 FIGURA 1
Ubicación
de las estaciones de monitoreo en el área de estudio- desembocadura del río
Mataje - San Lorenzo – Esmeraldas. Octubre 2012.
FIGURA 1
Ubicación
de las estaciones de monitoreo en el área de estudio- desembocadura del río
Mataje - San Lorenzo – Esmeraldas. Octubre 2012.
Materiales y métodos
Con la finalidad de establecer la biomasa se efectuaron un total de 11 estaciones donde se efectuaron arrastres superficiales, durante cinco minutos a una velocidad de dos nudos, únicamente durante la fase de flujo, para ello se utilizaron redes cónicas simples con un diámetro de boca de red de 0.30 m y con una apertura de malla de 335 µ, para el análisis del zooplancton las muestras fueron preservadas con formaldehído al 4 % neutralizado con Tetraborato de Sodio (Steedman 1976) y la temperatura fue tomada con termómetro de balde, con escala de
0.1 °C.
Se determinó la profundidad a la que se dejó de observar el disco de Secchi (Holmes 1970), como un indicador de la transparencia del agua.
Para determinar el volumen de agua filtrada se utilizó la siguiente fórmula:
a) Área de la superficie de la red mediante la fórmula del círculo.
S: π (r2)
Dónde:
r = radio boca red cónica simple. π = 3.1416
b) Volumen de agua filtrada.
Superficie de boca de red X distancia de arrastre
(m) X Eficiencia de filtración
c) Eficiencia de filtración: Se utilizó el estimado obtenido del Manual Zooplancton UNESCO Sampling (1968), utilizando un coeficiente de filtración de 0.9 para calcular el error de volumen de agua filtrada.
Para calcular la biomasa en el arrastre superficial se utilizó la siguiente fórmula:
En el laboratorio para el análisis de los grupos taxonómico, se comprobó el pH de las muestras que habían sido formolizadas y así asegurar las condiciones óptimas de los organismos gelatinosos y se utilizó un submuestreador de Folson (Mc Ewen et al., 1954), cuando la biomasa de zooplancton presentó un alto número de ejemplares en la muestra. Para determinar la biomasa y composición del zooplancton se realizó el contaje en la cámara de Bogorov.
Para la identificación taxonómica de los principales grupos del zooplancton se empleó los trabajos de Boltovskoy (1981). Tregouboff,
G. & M. Rose (1957); Pages F., et al. (1992); Bouillon, 1999; Kramp, 1968; Young, 2002; De Boyd, 1977.
Resultados
De forma general en el sector norte del estuario del río Mataje se reportaron 11 especies de cnidarios correspondientes a 4 órdenes, 10 familias.
Con carácter de dominante se evidenciaron a 2 especies del orden Leptomedusae, representada por Mitrocomella grandis con 54% de abundancia relativa, seguido de Eucheilota nemoni con el 19% de abundancia en toda el área de estudio, en menor distribución poblacional se registraron a Clytia hemisphaerica (Leptomedusae) con 7% y Bougainvillia muscus (Anthomedusae) con 6%. Mientras en menor abundancia relativa se observaron a Obelia sp con 4%, Rhopalonema velatum y Eutoninas cintillans con 3% cada una, Ectopleura dumortieri con 2%, Amphynema dinema (Anthomedusae) y Stomolophus meleagris (Rhizostomeae) con el 1% de abundancia relativa cada uno (Figura 2).
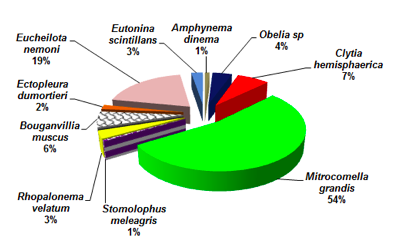 FIGURA 2
Abundancia relativa de las especies de cnidarios en el sector norte del Estuario del río Mataje – San Lorenzo, del 17 al 31 de octubre de 2012.
FIGURA 2
Abundancia relativa de las especies de cnidarios en el sector norte del Estuario del río Mataje – San Lorenzo, del 17 al 31 de octubre de 2012.
Este grupo en la zona externa evidenció la máxima densidad poblacional en la E-11 ubicado en el sector externo de la Bahía de Ancón de Sardinas reportó a Bouganvillia muscus y Eutonina scintillans con 109 ind. (100m3)-1 y mínima densidad poblacional se observó en la E- 7 frente a la comuna el Brujo con 55 ind.(100m3)-
1 reportando las mismas dos especies, estando ausente en la E-8, en la E-6 frente a la bocana del Canal Bolívar se reportan dos especies de cnidarios representados por Eucheilota nemoni y Eutonina scintillans con 27 y 9 ind.(100m3)-1 respectivamente. Mientras en las E-9 y 10 ubicadas en el sector externo de la Bahía de Ancón de Sardinas se reporta a Stomolophus meleagris con 9 ind.(100m3)-1, en la E-10 se observan 2 especies representadas por Obelia sp y Mitrocomella grandis con 5 y 9 ind.(100m3)-1 respectivamente.
En la zona interna se reporta la mayor densidad
poblacional en la E-5 diagonal a Palma real con 927 ind.(100m3)-1, representados por Mitrocomella grandis, las poblaciones decrecieron gradualmente en la E4 frontera con Colombia con 223 ind.(100m3)-1, seguido de la E-
2 frente a la comuna El Viento con 200 ind.(100m3)-1 y representados por 4 especies; Clytia hemisphaerica, Bouganvillia muscus, Ectopleura dumortieri y Eucheilota nemoni como dominante, la E-1 frente a la comuna de Pampanal con 109 ind.(100m3)-1 reportándose en esta estación a Obelia sp y Rhopalonema velatum.
Mientras las mínimas densidades poblacionales de cnidarios se reportó en la E-3 con 27 ind.(100m3)-1 representada por Clytia hemisphaerica, y la E-1A frente a la comuna Pampanal con 18 ind.(100m3)-1 y representada por Obelia sp., (Figura 3).
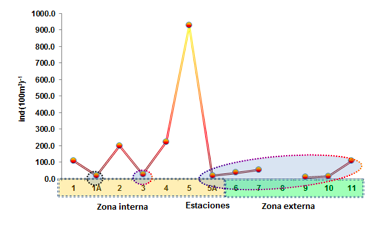 FIGURA 3
Distribución poblacional de las especies de cnidarios en el Estuario del río Mataje- San Lorenzo del 17 al 31 de octubre 2012.
FIGURA 3
Distribución poblacional de las especies de cnidarios en el Estuario del río Mataje- San Lorenzo del 17 al 31 de octubre 2012.
Sifonóforos
En términos de abundancia este grupo registró la mayor dominancia de Lensia conoidea con 46%,
seguido de Chelophyes contorta con 31% y Muggiaea atlantica con 15%, mientras en menor concentración se observó a Lensia multicristata con 8% de abundancia relativa (Figura 4).
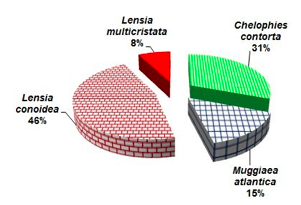 FIGURA 4
Abundancia relativa de las principales especies de sifonóforos en el Estuario del río Mataje - San Lorenzo del 17 al 31 de octubre 2012.
FIGURA 4
Abundancia relativa de las principales especies de sifonóforos en el Estuario del río Mataje - San Lorenzo del 17 al 31 de octubre 2012.
Este grupo registró ausencia de especies en la parte interna del estuario del río Mataje debido al alto contenido de sedimento en suspensión con un promedio de visibilidad de disco Secchi de 80 cm (Turbidez), evidenciando dos núcleos poblacionales en la parte externa del estuario en la E-9 con tres especies; Chelophyes contorta, Muggiaea atlantica y Lensia conoidea con
5 ind. (100m3)-1 cada especie, mientras en la E-10 se registraron 4 especies, y con carácter dominante se observa a Lensia conoidea con
23 ind. (100m3)-1 seguido de Chelophyes contorta con 14 ind. (100m3)-1, mientras Muggiaea atlantica y Lensia multicristata reportan 5 ind.(100m3)-1 respectivamente (Figura 5).
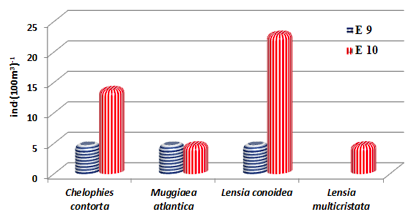 FIGURA 5
Distribución poblacional de los sifonóforos en el sector externo del Estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 5
Distribución poblacional de los sifonóforos en el sector externo del Estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
Composición del zooplancton
La biomasa zooplanctónica en la zona externa del estuario del río Mataje registró un pro- medio de 10 taxa zooplanctónica, identificándose la mayor biomasa en la E-8 con 73609 ind.(100m3)-1 y la E-11 con 70727 ind.(100m3)-1, decreciendo gradualmente en la E-6 a 65745 ind.(100m3)-1, mientras las menores densidades poblacionales se registraron en la E-9 con ind.(100m3)-1 y E-7 con 35559 ind.(100m3)-1.
En la zona interna las biomasas zooplanctónicas registraron la mayor biomasa poblacional en la E-2 con 128673 ind.(100m3)- 1, seguido de la E-1 con 121273 ind.(100m3)-1, decreciendo gradualmente en la E-3 a un valor de 86682 ind.(100m3)-1 y E-1A con 63182 ind.(100m3)-1.
Cabe mencionar que las poblaciones mínimas se registraron en la E-4 (Frontera con Colombia) con 25718 ind.(100m3)-1 y E-5 diagonal a la comuna Palma real con 19218 ind.(100m3)-1 (Figura 6).
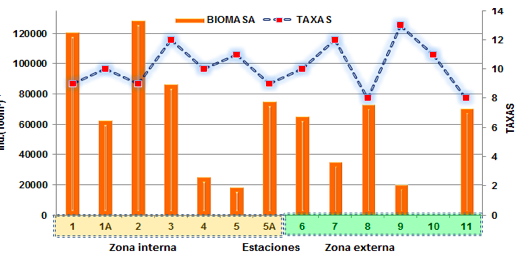 FIGURA 6
Distribución de las biomasas y taxa zooplanctónicas en la zona del Estuario del río Mataje- Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 6
Distribución de las biomasas y taxa zooplanctónicas en la zona del Estuario del río Mataje- Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
La composición del zooplancton en el área de estudio estuvo representada por tres grupos dominantes como los zoeas de braquiuros, copépodos y larvas de decápodos, distribuidos en todo el área de estudio siendo los responsables de la mayor biomasa del zooplancton. Entre los organismos de menor densidad poblacional se reportan a los quetognatos, nauplios de cirripedios, larvas de cirripedios, huevos de invertebrados, huevos de peces y porcelanidos; los organismos que fueron ligeramente representativos fueron los larvas de peces, cladóceros, medusas, sifonóforos, larvas de briozoos, cipris de cirripedios, doliolum, pterópodos y heterópodos, ostrácodos, anfípodos, megalopas, larvas de poliquetos, larvas de equinodermos, estomatópodos y poliquetos.
Distribución y Abundancia del zooplancton en el sector externo de la Reserva Ecológica Cayapas-Mataje.
La distribución de los grupos más abundantes y frecuentes en el sector externo de la Reserva Ecológica y por sitios de muestreo, permiten distinguir y caracterizar patrones de áreas de preferencia de los grupos zooplanctónicos en el área de estudio.
Zoeas de braquiuros.
En la zona externa este grupo registró su mayor biomasa en la E-11 con 37527 ind.(100m3)-1, mientras las densidades medias se observaron en la E-8 frente a la comuna El Cauchal y el Brujo con 17727
ind.(100m3)-1, seguido de la E-6 con 16036 ind.(100m3)-1 y la E-7 con 11792 ind.(100m3)-
1. Las estaciones mínimas se evidenciaron en la E-9 con 5373 ind.(100m3)-1 y estando ausente en la E-10.
En la zona interna de la Reserva Ecológica, sería posiblemente considerado como un indicador de nichos ecológicos de alta productividad, lo que es evidenciado también con la abundancia de copépodos, este comportamiento del zooplancton fue similar al reportado por Naranjo & Tapia (2002). Se podría tomar en consideración que el zooplancton es propio de un ecosistema de manglar, reportando un pico de alta productividad representado en la E-1 frente a la comuna Pampanal con 68727 ind.(100m3)- 1, mientras las estaciones medias se observaron en la E-2 frente a la comuna el Viento con 38564 ind.(100m3)-1, seguido de la E-1A frente a Pampanal con 26727 ind.(100m3)-1 y E-5A ubicada frente a la comuna Palma real con 26182 ind.(100m3)-1.
Las mínimas densidades poblacionales se registraron en la E-3 con 16855 ind.(100m3)- 1, seguido de la E-4 frontera con Colombia con 7991 ind.(100m3)-1 y E-5 frente a la comuna Pampanal con 7418 ind.(100m3)-1 (Figura 7).
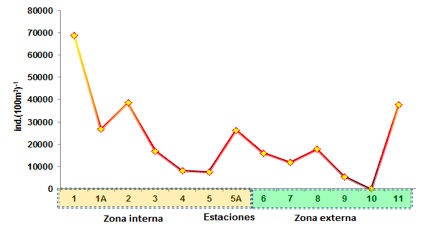 FIGURA 7
Abundancia relativa de Zoeas de braquiuros en el sector norte del estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 7
Abundancia relativa de Zoeas de braquiuros en el sector norte del estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
Copépodos calanoida
Este grupo de crustáceos en la zona externa evidenció 3 núcleos de alta densidad poblacional, representada por la E-8 diagonal a las comunas Cauchal y el Brujo con 42545 ind.(100m3)-1, seguido de la E-6 en la salida de la bocana del canal Bolívar con 33600 ind.(100m3)-1 y E-7 diagonal a la comuna el Brujo con 19964 ind.(100m3)-1. Mientras las mínimas densidades poblacionales se registraron en la E-11 con 3273 ind.(100m3)-1, seguido de la E-9 con 1800 ind. (100m3)-1 y E- 10 con 118 ind.(100m3)-1.
En la zona interna se registraron dos núcleos de alta densidad, evidenciando en la estación 2 frente a la comuna el Viento con ind.(100m3)- 1, seguido de la E-3 con 27273 ind.(100m3)-1, las poblaciones medias se reportaron en la E- 1A frente a la comuna Pampanal de Bolívar con 12327 ind.(100m3)-1, seguido de la E-1 (comuna Pampanal) con 8727 ind.(100m3)-1. Las mínimas densidades poblacionales se observaron en la E-4 (zona limítrofe con frontera con Colombia) con 2864 ind.(100m3)- 1, E-5 diagonal a la comuna Palma Real con 4745 ind.(100m3)-1y E-5A frente a Palma Real con 1745 ind.(100m3)-1 (Figura 8).
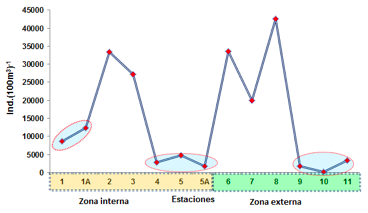 FIGURA 8
Abundancia relativa de Copépodos calanoida en el sector norte del Estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 8
Abundancia relativa de Copépodos calanoida en el sector norte del Estuario del río Mataje - Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
Larvas de decápodos
El núcleo de mayor abundancia poblacional se registró en la E-11 ubicado en la zona externa de la Bahía de Ancón de Sardinas con 12655 ind.(100m3)-1, mientras las densidades mínimas se observaron en la E-6 ubicado frente a bocana del Canal Bolívar con 6982 ind. (100m3)-1y E- 8 y ubicada frente a la comuna Palma Real con 39982 ind. (100m3)-1 (33%), seguido de la ubicado frente a la comuna el Cauchal con 5618 ind. (100m3)-1, E-7 con 1314 ind.(100m3)-1 y E- 9
y 10 ubicados en el sector externo de la Bahía de Ancón de Sardinas con 1145 y 91
ind.(100m3)-1.
En la zona interna se aprecia la mayor densidad poblacional en la E-5A frente a la comuna Palma real con 39982 ind.(100m3)-1, las poblaciones medias se registraron en la E-2 frente a la comuna El Viento con 19473 ind.(100m3)-1, seguido de la E-1 (frente a la comuna Pampanal) con 17018 ind.(100m3)-1, E-1A con 6545 ind.(100m3)-1 y E-3 con 7364 ind.(100m3)-1. Cabe mencionar que las densidades mínimas se observaron en la E-
5 (Diagonal a la comuna Palma real) con 2673 ind. (100m3)-1y E-4 frontera con Colombia con 1936 ind (100m3)-1 (Figura 9).
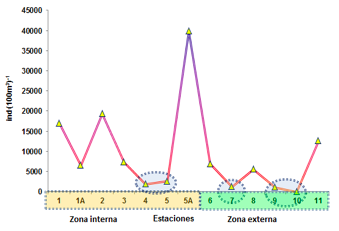 FIGURA 9
Distribución
de la Abundancia relativa de las larvas de decápoda en el sector norte del
Estuario del río Mataje-Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 9
Distribución
de la Abundancia relativa de las larvas de decápoda en el sector norte del
Estuario del río Mataje-Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
Ictioplancton
Huevos y Larvas de Peces
Este grupo representó un 2.09% de abundancia relativa en relación a la biomasa total, evidenciando un 1.85% para huevos de peces y 0.24% para larvas.
La distribución de los huevos de peces en la zona externa evidenció un núcleo de mayor densidad, representado en la E-9 ubicado en el sector externo de la Bahía de Ancón de Sardinas con 3464 huevos. (100m3)-1, mientras densidades medias se reportaron en la E-11 con 1309 huevos. (100m3)-1, seguido de la E-6 con 1091 huevos. (100m3)-1 y E-8 frente a la comuna El Cauchal con 927 huevos.(100m3)-1. Mientras las mínimas poblaciones se registraron en la E-7 ubicada en el sector externo de la Bahía Ancón de Sardinas con 82 huevos. (100m3)-1, E-10 con 18 huevos (100m3)-1.
En la zona interna la mayor densidad de huevos de peces se observó en la E-5A frente a la comuna Palma real con 5018 huevos (100m3)-1, las densidades medias se registraron en la E-1 frente a Pampanal con 1091 huevos. (100m3)-1, E-2 (Comuna El Viento) con 873 huevos. (100m3)-1.
Las densidades mínimas se reportaron en la E-1A con 382 huevos. (100m3)-1, E-3 con 236 huevos. (100m3)-1, E-4 y E-5 con un promedio de 34 huevos. (100m3)-1.
Las Larvas de peces en la zona externa registraron menor densidad poblacional en relación a toda el área de estudio, la mayor densidad poblacional se observó en la E-9 con 327 larvas.(100m3)-1, seguido de E-11 con 127 larvas.(100m3)-1. Las densidades mínimas se densidades mínimas fueron observadas en la E-1A con 73 larvas. (100m3)-1, seguido de la E- 3 con 55 larvas. (100m3)-1, E-4 con 32 larvas. (100m3)-1, E-5 y E-5A con un promedio de 18 larvas (100m3)-1 (Figura 10).
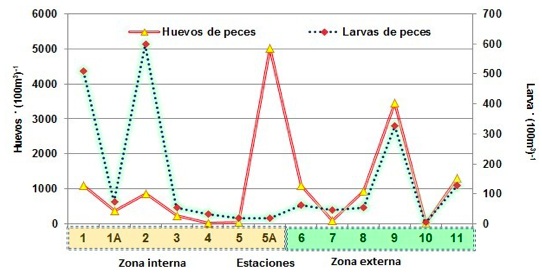 FIGURA 10
Distribución de huevos y larvas de peces en el sector norte del
Estuario del río Mataje-Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
FIGURA 10
Distribución de huevos y larvas de peces en el sector norte del
Estuario del río Mataje-Bahía Ancón de Sardinas, desde el 17 al 31 de octubre de 2012.
Discusión
Se colectaron a nivel superficial 10 especies de medusas de la clase Hydrozoa y una especie de la clase Scyphozoa en el río Mataje, considerada a la vez como nuevos registros para esta zona del estuario, las especies dominantes a lo largo del período de muestreo en el estuario del río Mataje-Bahía Ancón de Sardinas fueron: Mitrocomella grandis . Eucheilota nemoni.
Relaciones tróficas
De las especies de medusas que se registraron en el estuario del río Mataje- Bahía Ancón de Sardinas, la especie Amphinema dinema se alimenta de copépodos y quetognatos, Clytia hemisphaerica consume larvas de peces clupéidos, larvas de zoeas e incluso otras hydromeusas (Alvariño 1985). Naranjo & Tapia (2002), registraron que la abundancia zooplanctónica en el estuario del río Mataje fueron por copépodos, Torres & Andrade (2007) mencionan que fueron las zoeas de brachiuras y copépodos, pudiendo ser estas presas fáciles para medusas.
Las mayores abundancias poblacionales de medusas se registraron frente a la comuna Pampanal y Palma Real con respecto a otros sitios, podría atribuirse a la mayor disponibilidad de presas y a la estación climática.
Luzuriaga (1993), referido en Naranjo & Tapia (2002), menciona que el estudio del ictioplancton desarrollado al norte de Esmeraldas señala que la mayor cantidad de huevos de peces se presentó en el mes de agosto, siendo la familia Engraulidae la dominante. Coello (1983), señala que los máximos desoves de la familia Clupeidae se desarrollan en los meses de enero y abril y otro máximo de menor intensidad entre agosto y septiembre.
Mientras el segundo eslabón trófico (zooplancton) registró 13 grupos en toda el área de estudio evidenciando las mayores abundancias de zoeas de braquiuras (36%), copépodos (24%), y larvas de decápodos (16%) y una densidad de 1.84% de larvas de peces y 0.24% de huevos de peces; sin embargo Torres y Andrade (2007) reportaron 16 grupos zooplanctónicos y una abundancia de zoeas de braquiuras de 67%, copépodos (26%), quetognatos con 3.6%, mientras los huevos y larvas de peces reportaron una densidad menor al 1%. Sin embargo Naranjo & Tapia (2002) registraron la abundancia de copépodos con 59% de abundancia total, larvas de peces (22%), sin embargo en el presente estudio el número de taxa fue menor.
Conclusiones
La comunidad de las medusas (cnidarios) registró 2 especies dominantes representadas por Mitrocomella grandis . Eucheilota nemoni, de las 10 especies de la clase hidrozoa y una especie de la clase Scyphozoa.
Los sifonóforos evidenciaron la mayor densidad poblacional en la parte externa del estuario del río Mataje, registrando 3 especies dominantes, representadas por Lensia conoidea, Chelophyes contorta . Muggiaea atlantica.
La distribución de la biomasa zooplanctónica se caracterizó por ser muy variable, evidenciado 13 grupos del zooplancton distribuidos en toda el área de estudio, su mayor densidad poblacional se registró en la E-1 frente a la comuna Pampanal y E-2 frente a la comuna el Viento.
Su composición fue mayoritariamente por Copépodos, nauplios de cirripedios y larvas de decápoda en la E-2, mientras zoea de braquiura y larva de decápodos fue para E-1. Los estadíos de huevos de peces fueron abundantes en E-5A, posiblemente por encontrarse en una zona protegida de depredadores, ubicada frente a la comuna de Palma Real y parte externa de la Bahía de Ancón de Sardinas (E-9), mientras la mayor densidad de larvas de peces se evidenció frente a la comuna el Viento (E-2), Pampanal (E-1) parte externa de la Bahía de Ancón de Sardinas (E-9), sitios que podrían considerarse como nichos ecológicos de alta productividad biológica.














