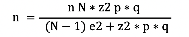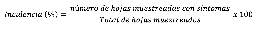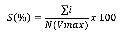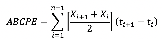I. Introducción
El plátano es un rubro de importancia económica por los ingresos que generan sus exportaciones a nivel mundial. Es producido en todo el globo y es alimento primordial para un sinnúmero de personas en el planeta (Frison y Sharrock, 1999).
En lo referente a productividad, representa uno de los primeros frutos de exportación y en materia económica ocupa el segundo lugar, a continuación de los cítricos, según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO, 2017).
Sigatoka negra, es la epifitia con mayor índice de agresividad en las plantaciones de musáceas del planeta. Provoca grandes daños en la biomasa de la planta, mermando la producción cuando no se ejercen estrategias para su control (Arias, 2003;Marín et al., 2003). En el departamento de Rivas se han reportado reducciones de hasta un 60% en el peso del racimo en plantaciones donde no se le controla (Asociación de Plataneros de Rivas [APLARI], 2013).
El método curativo más efectivo para controlar el patógeno es el realizado con pesticidas sistémicos, los cuales provocan contaminación ambiental en las parcelas establecidas (Astorga, 1999; Vindas et al., 2004).
En la actualidad la mejor técnica de sanidad de la enfermedad es mediante el método de control con pesticidas, realizándose hasta 40 aspersiones de saneamiento en el primer ciclo, lo que significa tres cuartos del precio de producción, causando genes de resistencia del patógeno ante los productos fúngicos (Sagder, 1995). Estos pesticidas están fabricados para aplicarse cada siete, catorce y veintiún días para romper el ciclo del hongo, lo que significa hasta 50 aplicaciones en la generación madre (Chica et al., 2004).
La contaminación ambiental es resultado del uso indiscriminado de pesticidas agrícolas, sus trazas en el manto friático, capa arable del suelo y condensación causa la muerte de muchos animales, además provoca enfermedades crónicas en humanos y a pesar de todos estos daños no se logra controlar la enfermedad satisfactoriamente (Michel, 2001).
Por otra parte, el mal uso de insumos de efecto fungicida ha provocado resistencia en el patógeno causando un aumento de la enfermedad en el tiempo, desarrollando el progreso de la epifitia, disminuyendo los índices de producción y aumentando los costos de cosecha (Marín et al., 2003).
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, 2013) reportó dos rechazos de plátano fresco de Rivas, por residuos de plaguicidas, con destino a Costa Rica. De igual manera, en 2019 reportó nuevamente rechazo de plátano con presencia de residuos que iban con destino a ese país (FDA, 2019).
Todo esto, más la exigencia de medidas de control ambientalmente seguras, hacen evidente la necesidad de investigar e implementar estrategias de manejo sostenibles como el control biológico. Actualmente se han reportado microorganismos que ejercen un control sobre el crecimiento de M. fijiensis y el desarrollo de la Sigatoka negra a escala de laboratorio, en invernadero y campo (Nadal-Medina et al., 2009; Osorio, 2006).
II. Revisión de literatura
Algunos trabajos vinculados a este tema son:
1. Estudios sobre combate biológico de Mycosphaerella fijiensis mediante bacterias epifitas (Jiménez et al., 1985).
2. Selección de microorganismos quitinolíticos en el control de la Sigatoka negra (Mycosphaerella fijiensis) en banano (González et al., 1996).
3. Evaluaciones de fungicidas para el control de la mancha marrón (Corynespora cassiicola) y la mancha negra (Asperisporium caricae) de la papaya en el extremo norte de Queensland, Australia (Grice & Peterson 2002).
4. El papel de los agentes de control biológico basados en Bacillus en los sistemas de manejo integrado de plagas: enfermedades de las plantas (Jacobsen, et al., 2004).
5. Potencial de Trichoderma harzianum para el control de patógenos fúngicos de la hoja de banano cuando se aplica con una fuente de alimento y un adyuvante orgánico (Castro-Gómez, 2015).
III. Materiales y métodos
Descripción del estudio desarrollado: Se llevó a cabo en la finca la Granja de la familia Pérez, ubicada en el municipio de Tola, Rivas, de febrero a junio del 2017.
En el experimento se evaluaron cinco tratamientos (Tabla 1), uno de ellos es el testigo, también Trichoderma sp y Bacillus subtilis, una mezcla de los dos y el producto químico NATIVO® SC 300, y el testigo sin ningún tipo de aplicación. Las dosis evaluadas fueron vía foliar cada treinta días por cinco meses.
Tabla 1: Tratamientos
Tabla 1
Tratamientos
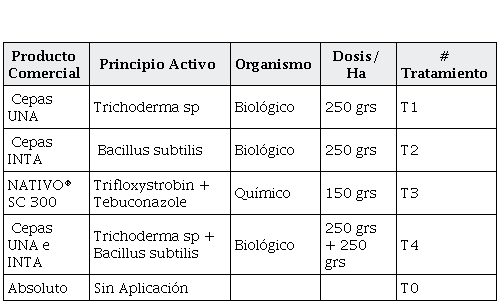
| Producto Comercial | Principio Activo
| Organismo | Dosis/ Ha | # Tratamiento |
|
Cepas UNA
|
Trichoderma sp
|
Biológico
|
250 grs
|
T1
|
|
Cepas INTA
|
Bacillus subtilis
|
Biológico
|
250 grs
|
T2
|
|
NATIVO® SC 300
|
Trifloxystrobin + Tebuconazole
|
Químico
|
150 grs
|
T3
|
|
Cepas UNA e INTA
|
Trichoderma sp + Bacillus
subtilis
|
Biológico
|
250 grs +
250 grs
|
T4
|
|
Absoluto
|
Sin Aplicación
| | |
T0
|
Fuente: elaboración propia
Selección de la muestra
La selección de la muestra se realizó mediante la fórmula de cálculo de muestra con población finita propuesta por Münch y Ángeles (1990), la cual se utiliza cuando se conoce el dato del universo o total de las unidades en estudio.
Donde:
n = Tamaño de la muestra
N = Población universo
Z = Nivel de confiabilidad del 95%
P = Estimación proporcional de la población
Q = (1-P)
E = Error estándar de la muestra, 5% (0.05)
Diseño experimental
Se utilizó un diseño experimental con distribución de Bloques Completamente al Azar (BCA), con 4 repeticiones de cada tratamiento, cada bloque tuvo 5 unidades experimentales, para un área de 783.2 m² por bloque.
La unidad experimental tenía un largo de 71.2 m, un ancho de 65.33 m.
La distancia entre cada unidad experimental era de 10.3 m, la distancia entre bloques es de 16.16 m y el área experimental una ronda de 6.4 m de ancho y 9.13 m de largo en el perímetro, establecida en un área comercial.
Evaluación de Sigatoka
Incidencia. Para determinar el porcentaje de incidencia de enfermedades se utilizó la siguiente fórmula:
Severidad. Con el fin de facilitar la realización de este estudio, se utilizó una escala para medir el nivel de daño foliar en plátano. Esta escala consistió en la estimación visual del porcentaje afectado de hojas, para obtener el grado porcentual de severidad se utilizó la fórmula general planteada por Vanderplank (1968).
Donde:
S = Porcentaje de severidad
∑i = Sumatoria de valores observados
N = Número de plantas muestreadas
Vmax = Valor máximo de la escala
Cálculo del Área Bajo la Curva de Progreso de la Enfermedad (ABCPE) para Sigatoka
Con los registros de severidad por tratamiento se calculó el Área Bajo la Curva de Progreso de la Enfermedad (ABCPE) para Sigatoka negra. La fórmula utilizada fue la propuesta por Shaner y Finney (1977).
Donde:
xi = Porcentaje de tejido afectado
t = Tiempo (días)
n = número de evaluaciones
Análisis estadístico de los datos. Después de colectados los datos, estos fueron arreglados por variables en una tabla de Excel, luego cada variable fue comparada entre tratamientos, efectuando un análisis de varianza, utilizando el programa de InfoStat (2020). El nivel de significancia usado en el análisis fue de: p = 0.05.
IV. Resultados y discusión
Comparación del promedio de incidencia de Sigatoka. En el análisis de la varianza, se encontró diferencia significativa (p=≤0.05). De manera general, se observa que el tratamiento químico tuvo mejor control sobre la enfermedad con (25.31%), seguido por el tratamiento de Trichoderma (25.52%); continuando Trichoderma sp + Bacillus subtilis (30.25) y el Testigo (42.37%), tal como se observa en la Tabla 2.
Tabla 2.: Evaluación del efecto de las bioformulaciones sobre Sigatoka
Tabla 2
Evaluación del efecto de las bioformulaciones sobre Sigatoka

| % Incidencia Sigatoka | % Severidad Sigatoka |
| Tratamiento
|
Media ± ES
|
Media ± ES
|
| Trichoderma sp |
25.52±1.87 a
|
34.45±2.36 ab
|
| Bacillus subtilis
|
30.25±1.87 a
|
38.93±2.36 a b
|
| NATIVO® SC 300
|
25.31±1.87 a
|
36.09±.36 ab
|
| Trichoderma sp + Bacillus
subtilis |
30.25±1.87 a
|
30.26±2.36 a
|
| Testigo
|
42.37±1.87 b
|
52.30±2.36 c
|
| C.V.
|
28.97
|
28.82
|
| p-valor
|
0.0001
|
0.0001
|
| F; df;
n |
16.42; 19; 20
|
12.60; 19; 20
|
ES=Error estándar; DS=Diferencia Significativa; C.V.=Coeficiente de Variación; p=Probabilidad; F=Fisher calculado; df=Grados de libertad del error; n=Número de datos utilizados en el análisis. *Medias con letras distintas: existe diferencias significativas.
Fuente: elaboración propia
Estudios realizados por Gutiérrez (2011) en su investigación: Evaluación de factores ambientales simulados sobre el desempeño de formulados de Bacillus subtilis, obtuvieron iguales resultados que este estudio con (36.3%). Sundin & Jacobs (1999) en su investigación Análisis de sensibilidad a la radiación ultravioleta (UVR) y estrategias de supervivencia de UVR de una comunidad bacteriana de la Filosfera de maní cultivado en el campo (Arachis hypogeae L.), encontraron que la ecología microbiana de los aislados fue susceptible a la formulación de B. subtilis la cual presentó el mejor desempeño en la prueba siendo igual que en esta investigación.
En estudios realizados por Parets (2002) en diferentes cultivos, entre ellos el tabaco (Nicotiana tabacum L.) y la papa (Solanum tuberosum L.) encontró resultados satisfactorios en el estímulo del crecimiento, con la aplicación de Trichoderma sp. Según estudios realizados por Castro-Gómez (2015) la formulación líquida del bioproducto de T. harzianum cepa CCCh-p1, aplicada sobre hojas de plantas de banano cv. ‘Williams’ produjo un efecto estimulante en la fase de crecimiento vegetativo de las plantas.
Comparación del promedio de severidad de Sigatoka. En el análisis de la varianza, se encontró diferencia significativa (p=≤0.05). De manera general, se observa que el tratamiento Trichoderma sp + Bacillus subtilis tuvo mejor control sobre la enfermedad con (30.26%), seguido por el tratamiento de Trichoderma (34.45%); luego el tratamiento químico (36.09%), continuando Bacillus subtilis (38.93) y el Testigo (52.30%) de severidad.
Según Kejela et al. (2016) en investigaciones desarrolladas con Bacillus sp se reduce la prevalencia de Colletotrichum gloeosporoides y F. oxysporum en plantaciones de vivero de café (Coffea arabica L.) con severidad del 90% y al usar esos biológicos su efectividad en recuperar la planta dañada fue de 100%.
Según Tejera et al. (2011), el género Bacillus genera ventajas para su utilización en la Biotecnología Agrícola como son la presencia de endosporas, la motilidad que le facilita la colonización de la planta, la capacidad de producir sustancias promotoras del crecimiento vegetal, y de sustancias responsables de su actividad.
Acosta et al. (2013) en su investigación Antagonismo in vitro de (Trichoderma harzianum Rifai) contra Mycosphaerella fijiensis Morelet, encontró acción antagonista sobre Sigatoka al igual que en los resultados de esta investigación.
Comparación del porcentaje de severidad de Sigatoka. La epifitia se presentó entre febrero a junio 2017. Se observa que la severidad de este agente causal reflejó un comportamiento similar en los tratamientos biológicos y químicos, a excepción del Testigo que aumentó significativamente de 47.7% a 58.15% en un lapso de 120 días. Con un r=0.087 % (día.1), como se muestra en la Figura 1.
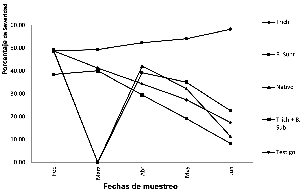 Figura 1
Porcentaje de Severidad de Sigatoka
Figura 1
Porcentaje de Severidad de Sigatoka
Figura 1: Porcentaje de Severidad de Sigatoka
Fuente: elaboración propia
Fonseca (2020) en su estudio Eficacia de dos fungicidas biológicos y un fungicida sintético sobre el progreso temporal de enfermedades foliares en maní (Arachis hypogaea L.), encontró que la enfermedad avanzó más rápido en comparación con los otros tratamientos donde se observó una tasa de incremento de la enfermedad de r = 0.02 (2% día.1) de la misma manera que esta investigación.
Grice & Peterson (2002) en su trabajo de investigación Evaluaciones de fungicidas para el control de la mancha marrón (Corynespora cassiicola) y la mancha negra (Asperisporium caricae) de la papaya indican que, en los tratamientos sin aplicación de fungicidas, el porcentaje de incremento de la enfermedad coincide con los resultados de esta investigación.
Pérez et al. (2000) en su estudio Epidemiología de la sigatoka negra (Mycosphaerella fijiensis Morelet) determinaron que los mayores valores de severidad de Sigatoka acumuladas fueron obtenidos en los meses de lluvia con porcentajes entre 36.3 % y 59.8 %, no coincidiendo con este estudio pues se presentó en meses de época seca, por causa a la humedad relativa del departamento de Rivas.
Comparación del Área Bajo la Curva del Progreso de la Enfermedad (ABCPE) de Sigatoka. La mayor área bajo la curva se presentó en el Testigo (Figura 2), seguido por la mezcla biológica de Trichoderma sp + Bacillus subtilis, luego por el tratamiento químico, en segundo lugar, Bacillus subtilis y con menor área Trichoderma, esto significa que el uso de Hipocreales favorece el parasitismo sobre el patógeno.
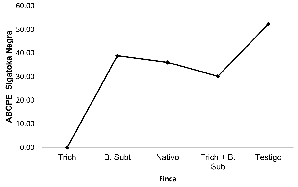 Figura 2
ABCE Sigatoka
Figura 2
ABCE Sigatoka
Figura 2: ABCE Sigatoka
Fuente: elaboración propia
Cuéllar et al. (2011), en su investigación sobre evaluación de resistencia de genotipos de plátano y banano a la Sigatoka negra (Mycosphaerella fijiensis Morelet.) realizada en Colombia, encontraron que el ABCPE se comporta de manera similar que en este estudio.
A la vez Carlier et al. (2000), en su estudio Mancha foliar por Septoria del banano: una enfermedad recientemente descubierta causada por Mycosphaerella eumusae Crous & X. Mourichon (Anamorph Septoria eumusae) en Tailandia, muestran que el comportamiento del ABCPE asciende en condiciones de humedad relativa, lo que discrepa de esta investigación porque el área aumentó en meses secos y con ausencia de aplicaciones.
V. Conclusiones
Se calculó la severidad y ABCPE de Sigatoka en cultivo de plátano. Se identificó Mycosphaerella como el principal agente patógeno de enfermedades asociadas a ese cultivo en Rivas, Nicaragua.
Se encontró que la prevalencia y crecimiento de la enfermedad ocurrió en época seca, no sólo en época lluviosa en el departamento de Rivas.
Con los resultados de este estudio se demuestra que el uso de organismos biológicos para controlar la enfermedad es igual de efectiva que los químicos y más seguro para el medio ambiente y salud pública.
Se demuestra que el crecimiento del patógeno presenta un avance de 0.087 % (día.1) en el departamento de Rivas, en época seca.
De los tratamientos biológicos se demuestra que el bioformulado Trichoderma sp + Bacillus subtilis es la mejor opción de manejo para controlar la epifitia, seguido del hongo entomopatógeno Trichoderma.
Agradecimientos
El autor de esta investigación
agradece a la empresa D’La granja, por la
financiación económica de este estudio y a la Universidad Nacional Agraria (UNA) por realizar análisis de laboratorio para
identificación del patógeno.
VI. Lista
de referencias
Acosta, M., Pichardo, T.,
Roque, B., Cruz, M., Mena, E., Leiva, M., y Alvarado, Y. (2013). Antagonismo in
vitro de Trichoderma harzianum Rifai
contra Mycosphaerella fijiensis Morelet. Biotecnologia
Vegetal, 13(4). https://revista.ibp.co.cu/index.php/BV/article/view/124/481
Asociación de Plataneros de
Rivas. (2013). Conglomerado del plátano en Nicaragua.
Arias,
P. (2003). The World Banana Economy, 1985-2002. FAO
Astorga, Y. (1999). Manejo de cultivos orgánicos de banano (según el proyecto de cultivo
alternativo de la ATC en Filipinas). Echos
du Cota.
Administración de Alimentos y
Medicamentos de los Estados Unidos. (2013). Introduction to FDA´s import refusal report
(IRR). https://www.accessdata.fda.gov/scripts/importrefusals/
Castro-Gómez, R. (2015). Bioproducto
a base de una cepa nativa de Trichoderma harzianum Rifai para el manejo de
la sigatoka negra (Mycosphaerella fijiensis Morelet) en
bananeras orgánicas [Tesis doctoral, Universidad Central “Marta Abreu”
de Las Villas]. Repositorio Institucional UCLV. http://dspace.uclv.edu.cu:8089/handle/123456789/7000
Carlier, J., Fouré, E., Gauhl,
F., Jones D. R., Lepoivre, P., Mourichon, X., Asberggauhl, C., y Romero, R. A. (2000). Black leaf streak. En D.R Jones (Ed.), Diseases of Banana,
Abacá and Enset (pp.
37-79). CAB
International.
Chica, R., Patiño, L.,
Herrera, H., Jiménez, I., Lizcano, S., y Montoya, J. A. (2004). Impacto y manejo de la Sigatoka Negra
en el cultivo del banano de exportación en Colombia [sesión de
conferencia]. XVI Reunión Internacional Asociación para la Cooperación en
Investigaciones de Bananos en el Caribe y la América Latina (ACORBAT), Oaxaca. https://www.musalit.org/viewPdf.php?file=IN050659_spa.pdf&id=9609
Fonseca Méndez, A. M. (2020). Eficacia de dos fungicidas biológicos y un fungicida
sintético sobre el progreso temporal de enfermedades foliares en maní (Arachis hypogaea L.), Chinandega
2019 [Tesis de maestría, Universidad Nacional Agraria]. Repositorio
Institucional UNA. https://repositorio.una.edu.ni/id/eprint/4221
Frison, E. A., y Sharrock, S. L. (1999). The
economic, social and nutritional importance of bananas in the world. En Picq, E. Fouré y E.A. Frison (eds.), Banana and food security (pp. 21-35). https://agritrop.cirad.fr/300693/1/ID300693.pdf
González, R., Bustamante, E.,
Shannon, P., Okumoto, S., y Leandro, G. (1996).
Selección de microorganismos quitinolíticos en el
control de la Sigatoka negra (Mycosphaerella fijiensis) en banano. Manejo
Integrado Plagas (40), 6-11. https://repositorio.catie.ac.cr/handle/11554/7412
Grice, K., y Peterson, R. A. (2002). Banana fungicide resistance.
Final report. Horticulture
Australia.
Gutiérrez Monsalve, J. A.
(2011). Evaluación de factores ambientales simulados
sobre el desempeño de formulados de Bacillus subtilis EA-CB0015 y su potencial como controlador
biológico de la Sigatoka negra [Tesis de
grado, Universidad EAFIT]. Repositorio Institucional Universidad EAFIT. http://hdl.handle.net/10784/8221
Jacobsen, B. J., Zidack, N. K., y Larson, B. J.
(2004). The role of
Bacillus-based biological control agents in integrated pest management systems:
plant diseases. Phytopathology, 94(11), 1272-1275. https://doi.org/10.1094/PHYTO.2004.94.11.1272
Jiménez, J. M., Galindo, J.,
Ramírez, C., Galindo, J. J., y Jaramillo Celis, R. (1985). Estudios
sobre combate biológico de Mycosphaerella fijiensis, mediante bacterias epifitas [sesión de
conferencia]. VII Reunión Internacional
Asociación para la Cooperación en Investigaciones de Bananos en el Caribe y la
América Latina (ACORBAT). San José, Costa Rica.
Kejela, T., Thakkar, V., y Parth,
T. (2016). Bacillus species (BT42) isolated
from Coffea arabica L. rhizosphere antagonizes
Colletotrichum gloeosporioides and Fusarium oxysporum and also exhibits multiple plant growth promoting
activit. BMC Microbiol, 16(277). https://doi.org/10.1186/s12866-016-0897-y
Marín, D. H., Romero, R. A., Guzman, M., y Sutton, T. B. (2003). Black Sigatoka: an increasing threat
to banana cultivation. Plant disease, 87(3),
208-222. https://doi.org/10.1094/PDIS.2003.87.3.208
Michel, A. (2001). Cepas nativas de Trichoderma spp., (Euascomicetes: Hypocreales), su Antibiosis y Micoparasitismo
sobre Fusarium subglutinans y F.oxysporum (Hyphomycetes: Hyphales) [Tesis doctoral, Universidad de Colima].
Münch, L., y Ángeles, E. (1990). Métodos y técnicas
de investigación. Trillas.
Nadal-Medina, R.,
Manzo-Sánchez, G., Orozco-Romero, J., Orozco-Santos, M., y Guzmán-González, S.
(2009). Diversidad genética de bananos y plátanos (Musa spp.)
determinada mediante marcadores RAPD. Revista
fitotecnia mexicana, 32(1), 01-07. http://www.scielo.org.mx/pdf/rfm/v32n1/v32n1a1.pd
Osorio Salamanca, G. P.
(2006). Evaluación de hongos endofíticos
y extractos botánicos para el control de la Sigatoka
negra (Mycosphaerella fijiensis Morelet) en banano [Tesis de maestría, Centro
Agronómico Tropical de Investigación y Enseñanza]. Repositorio CATIE. https://repositorio.catie.ac.cr/handle/11554/5095
Organización de las Naciones
Unidas para la Alimentación y la Agricultura. (2017). Global programme on banana Fusarium wilt disease: Protecting
banana production from the disease with focus on tropical race 4 (TR4). http://www.fao.org/3/a-i7921e.pdf
Parets, S. E. (2002). Evaluación agronómica de la coinoculación de micorrizas arbusculares,
Rhizobium phaseoli y Trichoderma harzianum en el
cultivo de fríjol común (Phaseolus vulgaris L.) [Tesis de maestría, Universidad Agraria
de La Habana].
Pérez, L., Mauri,
F., Hernández, A., Abreu, E. Y., y Porras, A. (2000). Epidemiología de la sigatoka negra (Mycosphaerella fijiensis Morelet) en Cuba. Pronóstico bioclimático de los
tratamientos en bananos (Musa acuminata AAA). Revista Mexicana de fitopatología, 18(1),
15-26. https://www.redalyc.org/articulo.oa?id=61218103
Sagder, J. (1995). Manual Operativo para el Control
de la Sigatoka Negra del plátano Mycosphaerella fijiensis Morelet en
México.
Shaner, G., y Finney, R. (1977). The effect of
Nitrogen fertilization on the expression of slow-mildewing resistance in knox wheat. Phytopathology,
(67), 1051-1056. https://www.doi.org/10.1094/Phyto-67-1051
Sundin, G. W., y Jacobs, J. L. (1999). Ultraviolet
radiation (UVR) sensitivity analysis and UVR survival strategies of a bacterial
community from the phyllosphere of field-grown peanut
(Arachis hypogeae L.). Microbial ecology, 38(1), 27-38. https://www.jstor.org/stable/4251656
Tejera-Hernández, B., Rojas-Badía, M. M., y Heydrich-Pérez,
M. (2011). Potencialidades del género Bacillus en la
promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. Revista CENIC.
Ciencias Biológicas, 42(3), 131-138.
Vanderplank, J. E. (1968). Disease Resistance Plants.
Academic Press.
Vindas, R., Ortiz, F., Ramírez, V., y Cuenca, P. (2004). Genotoxicidad de tres plaguicidas utilizados en la
actividad bananera de Costa Rica. Revista de biología
tropical, 52(3), 601-609. http://doi.org/10.15517/rbt.v1i2.15343
Notas de autor
1] Magister Scientiae Sanidad Vegetal,
docente investigador, Universidad Nacional Agraria
trinidad.castillo@ci.una.edu.ni