INTRODUCCIÓN
a enfermedad de Parkinson es el segundo trastorno
neurodegenerativo más común. Se caracteriza por inclusiones intracelulares de
α-sinucleína positivas denominadas cuerpos de Lewy y por pérdida de células nigroestriatales,
que provocan síntomas motores y no motores. Los síntomas motores cardinales
i
La enfermedad de Parkinson es el segundo trastorno neurodegenerativo más común. Se caracteriza por inclusiones intracelulares de α-sinucleína positivas denominadas cuerpos de Lewy y por pérdida de células nigroestriatales, que provocan síntomas motores y no motores. Los síntomas motores cardinales incluyen temblor en reposo, bradicinesia, rigidez e inestabilidad postural. 1
Recientemente, la atención se ha centrado cada vez más en la microbiota como un nuevo actor en la patogénesis de la enfermedad de Parkinson debido a su papel clave en la protección del huésped frente a los organismos patógenos.2
La enfermedad periodontal es una de las enfermedades inflamatorias crónicas más prevalentes, se cree que el papel patógeno principal lo desempeñan las bacterias gramnegativas. Estas producen diversas toxinas que aumentan la carga inflamatoria tanto a nivel local como sistémico. Existe una mayor producción de mediadores proinflamatorios como IL-1, IL-6, TNF-a y especies reactivas de oxígeno. Este desequilibrio en los mediadores inflamatorios ha formado la base del vínculo propuesto entre la enfermedad periodontal y diversas enfermedades sistémicas. También se ha propuesto un posible vínculo entre la enfermedad periodontal y el desarrollo y la progresión de la enfermedad de Parkinson, siendo el vínculo entre los dos la "inflamación.3
En el 2019 además, Adams et al, indicaron que, si bien la interacción entre la inflamación y la disfunción neuronal es compleja, existe una creciente evidencia de que la inflamación crónica con la desregulación acompañante de las moléculas inflamatorias circulantes y la respuesta inmune innata juega un papel destacado en la Enfermedad de Parkinson. También se está reconociendo que la inflamación periférica, así como la cerebral, contribuyen al inicio y progresión de los procesos neurodegenerativos observados en la Enfermedad de Parkinson.4
La importancia de haber elaborado esta investigación es conocer lo efectos de la disbiosis microbiana y la afectación que puede provocar en la Enfermedad de Parkinson y, asimismo esta puede agravar la alteración microbiana mediante la falta de higiene y la presencia de Enfermedades Periodontales. De ahí que, se puede observar cómo la alteración microbiana de la cavidad oral puede llegar a ocasionar sistémicamente afectaciones o empeorar enfermedades ya preexistentes. De esta manera, estarán listos y comprometidos en las clínicas odontológicas para mejorar los métodos diagnósticos y a su vez el tratamiento al paciente.
Por estas razones, la presente investigación científica tiene como objetivo Determinar los efectos de la disbiosis en cavidad oral y su relación con la Enfermedad de Parkinson, esto se lo realizará por medio de una revisión bibliográfica íntegra que ayudará a reconocer la importancia del problema de investigación.
MATERIALES
Y MÉTODOS
La investigación es de tipo bibliográfica
documental, como metodología para la realización de este artículo de revisión
sistemática, se utilizó un enfoque cualitativo . El tipo de
investigación es retrospectiva y el diseño de la investigación es
descriptivo y analítico.
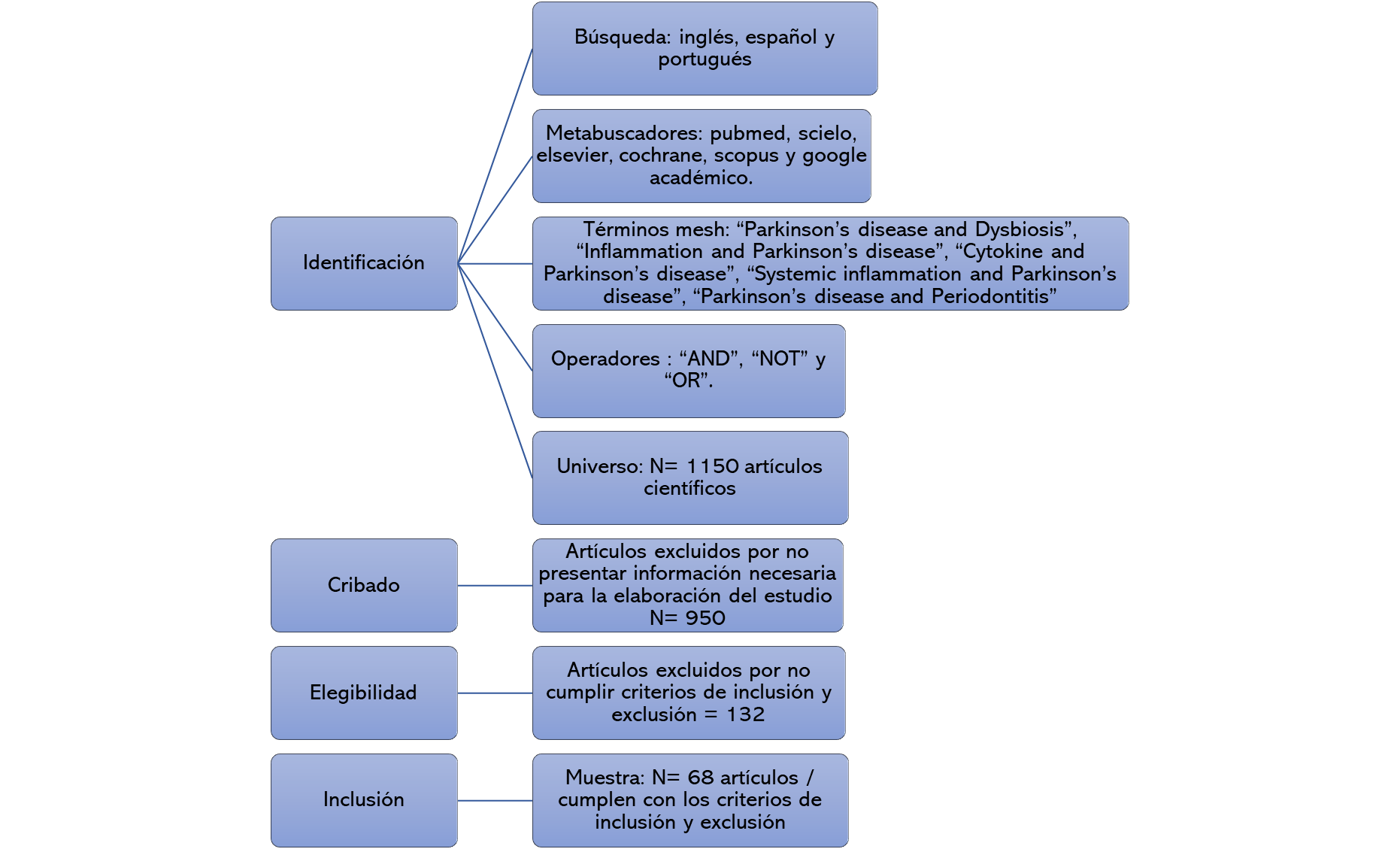 Ilustración 1 Flujograma de Búsqueda.
Elaborado por el autor
Ilustración 1 Flujograma de Búsqueda.
Elaborado por el autor
RESULTADOS
La disbiosis oral, inicia un proceso de inflamación sistémica,
dando como consecuencia una neuroinflamación crónica
para que finalmente sean estas las causas que lleven a una neurodegeneración
del paciente y ocasionar efectos de deterioro motor y cognitivo. Así mismo, el
efecto que tiene la E. de Parkinson sobre el periodonto. 3,5–9 (Fig. 1)
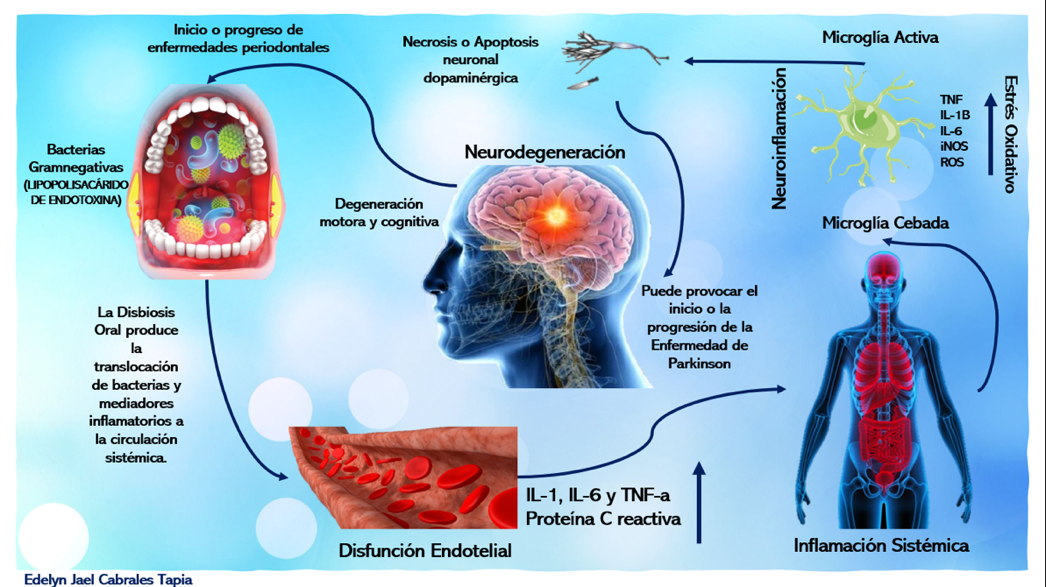 Fig. 1
Proceso inflamatorio de Enfermedad de Parkinson en consecuencia de la Disbiosis Oral. Elaborado por el autor.
Fig. 1
Proceso inflamatorio de Enfermedad de Parkinson en consecuencia de la Disbiosis Oral. Elaborado por el autor.
Se hace hincapié que la Porphyromonas Gingivalis tiene una mayor prevalencia, como microrganismo asociado a la neurodegeneración respecto a los demás patógenos. 3–5,10–20 . Las demás bacterias que se encuentran de manera alterada en cavidad oral, particularmente las del complejo rojo, también están involucradas en la neurodegeneración en la Enfermedad de Parkinson. 2,21–25
El LPS o más conocido como: Lipopolisacárido de endotoxina. 2 , 26 , 27 El Biomarcador Bacteriano es un elemento de la pared celular de las bacterias gramnegativas, además de ser un poderoso inductor de la respuesta inmune innata. 28 , 29 Es responsable a su vez, de la ruptura de la barrera hematoencefálica y la irrupción de las moléculas solubles como los granulocitos. 30–32 Autores como Fleurya et al,2 indican que existe la presencia de este biomarcador bacteriano, en otras investigaciones, a pesar de que no lo especifican, se podría aseverar de que se encuentra la presencia de este biomarcador pues está asociado a las bacterias gramnegativas.
Autores como Olsen et al,5 acerca de la presencia de los biomarcadores inflamatorios, indican que son causa de inflamación a nivel sistémico y neuronal, los cuales derivan de una alteración bacteriana a nivel bucal, expresan además que los más frecuentes son : las citocinas, el óxido nítrico sintasa, las especies de oxígeno reactivas y la formación de amiloide plasmático (Aβ). 30–33
Adicionalmente algunos estudios informan que las citocinas con mayor incidencia en la neurodegeneración son: la IL-1, la IL-1β, IL-1RA, IL-6, el factor de necrosis tumoral (TNF), y la proteína C reactiva (CRP), las cuales están también involucradas en la disbiosis oral, precisamente en la enfermedad periodontal. 3–5,7,34 .
De acuerdo con lo que demuestra la literatura, la neuroinflamación provocada por la disbiosis oral, se explica como una correlación de una inflamación sistémica crónica. 2 , 3 , 31 , 32 , 35 , 36 Por otro lado, autores como Kaur,3 revelan que las bacterias gramnegativas están directamente involucradas en el proceso de neurodegeneración. En otras investigaciones indican particularmente que concurre degeneración motora y cognitiva. 37–39
Como causas asociadas a la enfermedad periodontal en pacientes con enfermedad de Parkinson, se anotan las alteraciones salivales, las visitas al odontólogo, y la higiene oral. Se indica que los pacientes que sufren de Parkinson están afectados por xerostomía, además de sialorrea, se señala una frecuencia baja de visita al odontólogo, dificultad en la atención e higiene deficiente en otros no señalan causas específicas. 40–42 Adicionalmente se señala que a pacientes afectados de Parkinson se les dificulta la atención odontológica. 13,43,44 La higiene deficiente, es un punto focal como causa de enfermedades periodontales en pacientes que sufren de la enfermedad de Parkinson. 45–47
Como efectos negativos sobre el periodonto en el paciente se ve reflejado de manera específica, la periodontitis y la gingivitis. 48–51
 Ilustración 2 Mapa
conceptual acerca de la Disbiosis Oral y la
Enfermedad de Parkinson. Elaborado por el autor.
Ilustración 2 Mapa
conceptual acerca de la Disbiosis Oral y la
Enfermedad de Parkinson. Elaborado por el autor.
Algunas investigaciones, demostraron que hay mayor
incidencia de enfermedades periodontales en pacientes con Parkinson de género
masculino. Concretamente en grupos etarios mayores a 40 y mayores a 65. 49,50 , 44,45,52
DISCUSIÓN
Según el autor Cornelio et al, se define como enfermedad de Parkinson el trastorno neurodegenerativo el cual afectará de manera directa el sistema nervioso central y provocará la degeneración de neuronas, las cuales están ubicadas en la sustancia nigra. Estas producen dopamina, la cual está ligada al movimiento, lo que favorecerá a la aparición gradual de los síntomas motores típicos. 43
En un estudio de Cabrera, se menciona de manera concreta que las neuronas dopaminérgicas pueden llegarse a perder hasta en un 70 % de la sustancia negra y del núcleo estriado. 53
Algunos autores indican que una de las principales estructuras expuestas al medio ambiente es la boca, como se sabe en el aire se encuentran organismos, los cuales se hallan igualmente en la dieta, y por esta razón es uno de los primordiales sitios de ingreso de microorganismos patógenos; de consecuencia la microbiota oral es fundamental para conservar la salud oral y sistémica. 3–5
Las alteraciones que se presentan en los patógenos orales pueden ocasionar una disbiosis microbiana bucal, dando inicio a una inflamación crónica. 2
En la investigación de Fleurya at al, expresa que el estudio de la microbiota oral respecto a la microbiota intestinal, puede ofrecer mayores ventajas para una mejor comprensión del vínculo que existe entre la disbiosis oral y la enfermedad de Parkinson: 1) muestreo fácil; 2) figura como la segunda microbiota más grande y diversa después del intestino, y alberga más de 700 especies de bacterias; 3) es una de las microbiotas que muestra menor inestabilidad intrapersonal, permitiendo conclusiones más amplias; 4) se ubica de manera estratégica entre el ambiente exterior y los tractos respiratorio y digestivo.2
En varios estudios, afirman que las bacterias gramnegativas son las que se encuentran mayormente vinculadas a la neuroinflamación crónica, particularmente las del complejo rojo. 27–32
En el estudio de Pretorius et al, por ejemplo, informan que la periodontitis tiene una predisposición en sujetos a un riesgo mayor de desarrollar la enfermedad de Parkinson y destaca que la actividad de P. gingivalis y sus productos moleculares se encuentran presentes en la circulación de pacientes afectadas por la enfermedad de Parkinson. 4
En otro estudio, también se destacaron que hay un aumento de genes importantes para la patogenia de la periodontitis, como los genes afines con la proteólisis y aquellos para el transporte de péptidos y la ganancia de hierro y genes para la síntesis de lipopolisacáridos. Los cuales realzan el potencial proinflamatorio de la microbiota.5
En diferentes estudios, los autores indican que este el lipopolisacárido de endotoxina es potente inductor de la respuesta inmune innata y que adicionalmente induce la ruptura de la barrera hematocefálica y provoca una fuerte activación microglial y degeneración de la neurona dopaminérgica en el sistema nervioso del mesencéfalo. 2 , 26 , 27 El estudio menciona que este biomarcador causa muerte indirecta por reacción inflamatoria. Conjuntamente, destaca que, se vieron afectadas las neuronas dopaminérgicas del Sistema Nervioso. 54
Se sugiere que los lipopolisacáridos son las principales señales que se encuentran en la pared celular de los patógenos y el reconocimiento se encuentra mediado por un receptor de la célula huésped, el cual se ubica en la superficie y es un receptor tipo toll. 4,5,7
Posteriormente las enzimas y las toxinas de los bacterias, ingresan al torrente sanguíneo del sujeto mediante el epitelio ulcerado de la bolsa periodontal. Desde ese punto, las bacterias gramnegativas ingresan al torrente sanguíneo proyectando toxinas e provocando una respuesta inmune ocasionando la liberación de biomarcadores bacterianos. 7, 30–32
La disbiosis en la enfermedad de Parkinson podría originar la activación inmunitaria y la inflamación a nivel sistémico, lo que podría exacerbar los procesos patógenos al instaurar un medio neuroinflamatorio crónico. 2, 5–9
En concordancia otros estudios han destacado la importancia de la respuesta inflamatoria en la progresión de la Enfermedad de Parkinson su patogenia y progresión. Efectivamente, existe una producción mayor de biomarcadores proinflamatorios como: IL-1, IL-6, TNF-a y especies reactivas de oxígeno. A causa de este desequilibrio de los biomarcadores, se ha formado la base del vínculo propuesto entre la enfermedad periodontal y diversas enfermedades sistémicas. 3, 30–33
Autores mencionan que la inflamación crónica, que causa la desregulación de las moléculas inflamatorias circulantes y una respuesta inmune innata, parecen ser características importantes en la Enfermedad de Parkinson. Tanto la inflamación periférica como la cerebral contribuyen al inicio y progresión de la neurodegeneración. Asimismo, se indica que los niveles dominantes de interleuquinas como la IL-1β, IL-2, IL-10, IL-6, IL-4, TNF-α, la proteína C reactiva e interferón- gamma, acompañada de estrés oxidativo. Inducen a la inflamación periférica y la cerebral contribuyendo al inicio y progresión de la neurodegeneración. 30–33
Existe hipercoagulabilidad y un potencial de coagulación anormal en pacientes que sufren de Parkinson, además de la presencia de depósito de β-amiloide en el plasma. 3 , 31 , 32
En el estudio de Adams et al., se halló que los individuos afectados por Parkinson tenían un perfil desregulado de biomarcadores inflamatorios. Su sangre se encontraba hipercoagulada con plaquetas sanguíneas hiperactivas y en su contenido fibrinógeno con características amiloides. 4
Conjuntamente, la patología plaquetaria (hiperactividad, propagación, aglutinación), la estructura anómala del fibrinógeno y la eriptosis de glóbulos rojos se detectaron e interpretaron como un reflejo de una inflamación sistémica.4
Las citocinas altamente dominantes reveladas se relacionaron con el cambio en la estructura de las plaquetas. Al mismo tiempo, se encontró que el fibrinógeno en coágulos se polimerizó en un mayor número de láminas β que reflejaban la formación de una estructura de proteína amiloide. Tales cambios en las proteínas podrían afectar la formación anómala de coágulos y enfatizar la naturaleza sistémica de la enfermedad.4
En un estudio indicaron que la inflamación sistémica causada por cualquier tipo de infección conduce a la producción de mediadores inflamatorios. Estos mediadores inflamatorios pueden provocar la activación de células microgliales. La activación de estas células microgliales inicia la cascada de neurodegeneración que conduce a diversas enfermedades neurodegenerativas. 22
El estudio de Willis y Gabaldon, sugiere que los trastornos neurológicos también se han asociado con el microbioma oral. Focalizándose en la infección por P. gingivalis y el Treponema a menudo forman placas amiloides, lo cual está directamente asociado con la neurodegeneración. 10
De igual manera, la neurodegeneración, según los autores Ranjan et al, es un proceso en el cual las neuronas pierden su estructura, función y seguidamente la muerte de estas. Adicionalmente indican que, hasta el momento, la beta amiloide (Aβ) y la maraña neurofibrilar son los dos biomarcadores más frecuentemente asociados a las enfermedades neurodegenerativas. 7
Además de eso, la inflamación neural está considerada como uno de los parámetros para el comienzo de la neurodegeneración. Indican que existe dos causas de inflamación: lesión del sistema nervioso central o infecciones periféricas. La alteración de la microbiota oral da la oportunidad de ingresar al cerebro a patógenos, especialmente por una infección periodontal. 7,24
Como efectos de la neurodegeneración, el estudio de Holmstrup et al, sugiere que, durante la progresión de la enfermedad de Parkinson, se produce una degeneración gradual de los compuestos nigroestriatales, lo que conduce a síntomas cognitivos, motores y psiquiátricos. Además, indica que todavía no hay pruebas sólidas de que la enfermedad periodontal influya en la patogenia de la enfermedad de Parkinson. Sin embargo, hay estudios que indican que la enfermedad periodontal es más común en pacientes con enfermedad de Parkinson. 12
En la investigación de Rodrigues et al, los autores indican que los síntomas motores pueden interferir con los pequeños movimientos automáticos de la mano, causando un deterioro en la capacidad de cepillarse los dientes, que se considera un factor de riesgo principal para el deterioro de la salud bucal de este tipo de pacientes. Conjuntamente a los síntomas cognitivos, como la demencia o apatía, la alteración del comportamiento motor y, de manera particular, las vacilaciones motoras pueden ser influyentes en la calidad y en la frecuencia de la higiene oral en la vida cotidiana de estos pacientes. 1
Varios estudios indican que los pacientes con Parkinson tienen alteraciones salivales como lo son la xerostomía y la sialorrea, si bien podría parecer contradictorio, un paciente podría presentar ambas afecciones. Esto va a depender de los medicamentos administrado para mejorar su salud neurológica. 40–42 . Se menciona que al administrarse los medicamentos antiparkinsonianos, los mismos son capaces de aumentar, reducir o alterar el flujo y la composición salival, probablemente porque copian la acción del sistema nervioso autónomo o porque actúan directamente sobre los procesos celulares de salivación. 55
Con mayor especificidad, la autora Llena indica que los fármacos como el Bipirideno y la Seligilina, son directamente asociados a xerostomía en pacientes con Parkinson. 56 Por otro lado el autor Aguilar, indica que los fármacos asociados a sialorrea en pacientes afectados por la enfermedad de Parkinson son los siguientes: agonistas de la dopa; Levodopa/Carbidopa, Amantadina y Parlodel. 57
Según varios estudios, la falta de higiene y la baja frecuencia de visitas al odontólogo, provoca con mayor prevalencia enfermedades periodontales, tales como la gingivitis y la periodontitis, en pacientes con enfermedad de Parkinson. Esto puede ser provocado adicionalmente por los medicamentos que estos pacientes consumen, los cuales provocan xerostomía. 49,50,58
Acorde a un estudio de Prete y Ouanounou, estos autores sugieren que las visitas dentales deben ser breves y programadas por la mañana. Además, coordinar las citas con el programa de medicación del paciente, si es posible, para evitar manifestaciones de síntomas motores durante los procedimientos dentales para evitar la aspiración y la posibilidad de daño iatrogénico. 48
De acuerdo con los autores, Martimbianco et al, 13 los cuidados odontológicos generales que deberían tener los pacientes con Parkinson:
· Durante las consultas neurológicas, el médico debe introducir el tema de las visitas al dentista. 13
· Si el paciente no tiene citas dentales regulares, el neurólogo debe derivar a esta persona a un centro de salud bucal. 13
· El cepillado de los dientes debe realizarse con regularidad y debe realizarse alternando las manos derecha e izquierda, ya que la rigidez y el temblor pueden ser más incapacitantes en una extremidad a medida que avanza la enfermedad. Consecuentemente, el paciente debe aprender a usar cualquiera de las manos para la higiene bucal. 13
· Las instrucciones individualizadas sobre la higiene bucal, junto con la masticación y los ejercicios para los labios, pueden mejorar la salud bucal. 13
Por otro lado, la autora Kortemeyer, indica de manera más especifica que, Los afectados por Parkinson presentan frecuentemente muchas limitaciones de movimiento. Además de, temblores lo que ocasione una mayor dificultad en el cuidado de los dientes. Recomienda, medios auxiliares: cepillo dental eléctrico y el cepillo dental de triple cabezal. Adicionalmente, menciona que muchas veces el paciente no puede mantener la boca abierta, para esto recomienda un abrebocas en forma de dedal. 59
El autor Gardner y la autora Wichmann, al igual que la autora Kortemeyer, aconsejan que para la limpieza dental es importante utilizar el cepillo eléctrico, adicionalmente, sugieren que es fundamental utilizar enjuagues bucales por lo menos dos veces al día, si el paciente presenta problemas de sialorrea, recomiendan evitar alimentos muy azucarados, porque estos favorecen la salivación. Un enfoque adicional es que indican que, para la realización de la limpieza oral, es mejor que le paciente este cómodamente sentado en una mesa, para poder facilitar la misa. 60
CONCLUSIONES
1. Las bacterias que se encuentra alteradas por la disbiosis oral, están estrechamente identificadas en pacientes con enfermedad de Parkinson, de manera exponencial la P. Gingivalis, y las del complejo rojo.
2. La disbiosis oral ocasiona el aumento de biomarcadores inflamatorios, los cuales provocan inflamación sistémica crónica. Los biomarcadores que se encuentran con mayor frecuencia son: IL-1, la IL-1β, IL-1RA, IL-6, el factor de necrosis tumoral, y la proteína C reactiva. Estos coinciden con los que se encuentran alterados durante las enfermedades periodontales.
3. Los biomarcadores inflamatorios aumentados, provocan como se mencionó anteriormente una inflamación sistema, la cual provocara a su vez neuroinflamación crónica, que conllevara a una neurodegeneración del paciente.
4. La neurodegeneración está ligada particularmente a patógenos orales, esta puede ocasionar en los pacientes con Parkinson afecciones motoras, cognitivas y adicionalmente psicológicas. Aunque esta enfermedad se ve afectada adicionalmente por factores genéticos y ambientales. Lo que sugiere que, si bien los patógenos aún no se los reconoce como iniciadores de la enfermedad, podrían estar involucrados en la progresión de la misma.
5. Los efectos de la enfermedad de Parkinson en el periodonto, son las enfermedades periodontales, estas tienen una mayor prevalencia, pues los pacientes a causa de la afección motora no tienen una buena higiene oral, tienen una baja frecuencia de visitas odontológicas, además presentan xerostomía, lo que conlleva a dichas enfermedades.
RECOMENDACIONES
Se
sugiere realizar nuevos estudios, pues la evidencia científica debería
proporcionar más información, datos completos de estudios de pacientes que se
vean afectados por ambas alteraciones y que corroboren una relación
bidireccional entre las dos. Al mismo
tiempo de datos de laboratorio, como toma de muestras, para poder corroborar la
vinculación de los patógenos orales en la Enfermedad de Parkinson.
Referencias
1. Giselle Rodrigues Ribeiro, Camila Heitor Campos, Renata Cunha Matheus, Rodrigues Garcia. O r a l H e a l t h i n E l d e r s with Parkinson’s Disease. Brazilian Dental Journal. 2016;3:340-4.
2. Fleurya Vanessa, Alkisti Zekeridouc, Vladimir Lazarevicd, Nadia Gaıad, Catherine Giannopoulouc, , Laurence Gentone, , Jose Cancela, , Myriam Girardd, Rachel Goldsteinb, Julien F. Ballyb, Andrea Mombellic, et al. Oral Dysbiosis and Inflammation in Parkinson’s Disease. PMID. 2021;11:619-31.
3. Tejaswani Kaur, Ashita Uppoor and Dilip Naik. Parkinson’s disease and periodontitis – the missing link? A review. Gerodontology. 2015;4:434-8.
4. Buin Adams, , J M. Nunes1, , Martin J. Page1, , Timothy Roberts2, 1, , Jonathan Carr1, et al. Parkinson’s disease: a systemic inflammatory disease accompanied by bacterial inflammagens. Frontiers in Aging Neuroscience. 2019;11.
5. Ingar Olsen, Douglas B. Kell2, Etheresia Pretorius. Is Porphyromonas gingivalis involved in Parkinson’s disease? European Journal of Clinical Microbiology & Infectious Diseases. 2020;2013-8.
6. Tingting PU1, , Min HUANG1, , Jing ZHONG1, , Greg MIRT2, , Xianwei ZOU3, , Jianping YU3, et al. Oral flora imbalance in Parkinson’s disease. Biomedical and Clinical Research. 2019;1:1-2.
7. Rajeev Ranjan1, , Gyanaseni Dhar2, , Swetapadma Sahu3, , Nibedita Nayak4, , Monalisa Mishra5. Periodontal Disease and Neurodegeneration: The Possible Pathway and Contribution from Periodontal Infections. 2018;12:01-5.
8. Margot Gosney*, Shuja Punekar, Jeremy R. Playfer, Patricia K. Bilsborrow, Michael V. Martin. The incidence of oral Gram-negative bacteria in patients with Parkinson’s disease. European Journal of Internal Medicine. 2003;14:484-7.
9. Pedro A.B. Pereira, MSc, Velma T.E. Aho, MSc, BA, Lars Paulin, MSc, Eero Pekkonen, MD, PhD, Petri Auvinen, PhD, Filip Scheperjans. Oral and nasal microbiota in Parkinson’s disease. Parkinsonism and Related Disorders. 2017;61-7.
10. Jesse R. Willis, Toni Gabaldón. The Human Oral Microbiome in Health and Disease: From Sequences to Ecosystems. Microorganisms. 2020;8:1-28.
11. João Botelho, Vanessa Machado, José João Mendes, Paulo Mascarenhas. Causal association between Periodontitis and Parkinson’s Disease: A bidirectional Mendelian Randomization study. MDPI. 2020;5:772.
12. Palle Holmstrup, Christian Damgaard, Ingar Olsen, Björn Klinge, Allan Flyvbjerg, Claus Henrik Nielsen, et al. Comorbidity of periodontal disease: two sides of the same coin? An introduction for the clinician. JOURNAL OF ORAL MICROBIOLOGY. 2017;9:1-13.
13. Martimbianco ALC, Prosdocimi FC, Anauate-Netto C, dos Santos EM, Mendes GD, Fragoso YD. Evidence-Based Recommendations for the Oral Health of Patients with Parkinson’s Disease. Neurol Ther. 2021;10:391-400.
14. Yoann Maitre, Pierre Micheneau, Alexis Delpierre, Rachid Mahalli, Marie Guerin, Gilles Amador, et al. Did the Brain and Oral Microbiota Talk to Each Other? A Review of the Literature. J Clin Med. 2020;9:1-20.
15. Narengaowa, Kong W, Lan F, Awan UF, Qing H, Ni J. The Oral-Gut-Brain AXIS: The Influence of Microbes in Alzheimer’s Disease. Front Cell Neurosci [Internet]. 2021 [citado 4 de agosto de 2021];0. Disponible en: https://www.frontiersin.org/articles/10.3389/fncel.2021.633735/full
16. Radaic A, Kapila YL. The oralome and its dysbiosis: New insights into oral microbiome-host interactions. Comput Struct Biotechnol J. 2021;19:1335-60.
17. Rajeev Ranjan, Arra Abhinay, Monalisa Mishra. Can oral microbial infections be a risk factor for neurodegeneration? A review of the literature. Neurology India. 2018;6:344-51.
18. Feng Y-K, Wu Q-L, Peng Y-W, Liang F-Y, You H-J, Feng Y-W, et al. Oral P. gingivalis impairs gut permeability and mediates immune responses associated with neurodegeneration in LRRK2 R1441G mice. J Neuroinflammation. 2020;17:347.
19. Raffaella Franciotti, Pamela Pignatelli, Claudia Carrarini, Federica Maria Romei, Martina Mastrippolito, Antonella Gentile, et al. Exploring the Connection between Porphyromonas gingivalis and Neurodegenerative Diseases: A Pilot Quantitative Study on the Bacterium Abundance in Oral Cavity and the Amount of Antibodies in Serum. Biomolecules. 2021;11:1-12.
20. Yago Leira, Álvaro Carballo, Marco Orlandi, José Manuel Aldrey, Laura Vázquez-Vázquez, Francesco D’Aiuto, JoséCastillo, et al. Periodontitis and Systemic Markers of Neurodegeneration. A case-control study. Original Article Clinical Periodontology. 2018;
21. Dioguardi M, Crincoli V, Laino L, Alovisi M, Sovereto D, Mastrangelo F, et al. The Role of Periodontitis and Periodontal Bacteria in the Onset and Progression of Alzheimer’s Disease: A Systematic Review. J Clin Med. 2020;9:495.
22. Alvarenga MOP, Frazão DR, de Matos IG, Bittencourt LO, Fagundes NCF, Rösing CK, et al. Is There Any Association Between Neurodegenerative Diseases and Periodontitis? A Systematic Review. Front Aging Neurosci. 2021;13:651437.
23. Bui FQ, Almeida-da-Silva CLC, Huynh B, Trinh A, Liu J, Woodward J, et al. Association between periodontal pathogens and systemic disease. Biomedical Journal. 2019;42:27-35.
24. Dragos Mihaila, Jordan Donegan, Sarah Barns, Daria LaRocca, Qian Du, Danny Zheng, et al. The oral microbiome of early stage Parkinson’s disease and its relationship with functional measures of motor and non-motor function. PLOS ONE. 2019;14.
25. Liang Shen. Gut, oral and nasal microbiota and Parkinson’s disease. Microbial Cell Factories. 2020;19-50.
26. Chen C-K, Huang J-Y, Wu Y-T, Chang Y-C. Dental Scaling Decreases the Risk of Parkinson’s Disease: A Nationwide Population-Based Nested Case-Control Study. Int J Environ Res Public Health. 2018;15:1587.
27. Jimenez-Ferrer I, Swanberg M. Immunogenetics of Parkinson’s Disease. En: Stoker TB, Greenland JC, editores. Parkinson’s Disease: Pathogenesis and Clinical Aspects [Internet]. Brisbane (AU): Codon Publications; 2018 [citado 5 de agosto de 2021]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK536717/
28. Woo HG, Chang Y, Lee JS, Song T-J. Association of Tooth Loss with New-Onset Parkinson’s Disease: A Nationwide Population-Based Cohort Study. Parkinson’s Disease. 2020;2020:e4760512.
29. Huang Y, Liao J, Liu X, Zhong Y, Cai X, Long L. Review: The Role of Intestinal Dysbiosis in Parkinson’s Disease. Front Cell Infect Microbiol [Internet]. 2021 [citado 5 de agosto de 2021];0. Disponible en: https://www.frontiersin.org/articles/10.3389/fcimb.2021.615075/full
30. Chang-Kai Chen, Yung-Tsan Wu, Yu-Chao Chang. Periodontal inflammatory disease is associated with the risk of Parkinson’s disease: a population based retrospective matched cohort study. PEERJ. 2017;1-14.
31. Aliye Özenoğlu. Effect of Microbiota on Neurodegenerative Diseases. EC NEUROLOGY. 2019;9:789-801.
32. T.Y. Renn, L.Y. Chen, H.-M. Chang. The potential impact of periodontitis on the pathogenesis of Parkinson’s disease and cognitive deficits. 2018;
33. Su C-M, Kung C-T, Chen F-C, Cheng H-H, Hsiao S-Y, Lai Y-R, et al. Manifestations and Outcomes of Patients with Parkinson’s Disease and Serious Infection in the Emergency Department. Biomed Res Int. 2018;2018:6014896.
34. Brodacki B, Staszewski J, Toczyłowska B, Kozłowska E, Drela N, Chalimoniuk M, et al. Serum interleukin (IL-2, IL-10, IL-6, IL-4), TNFα, and INFγ concentrations are elevated in patients with atypical and idiopathic parkinsonism. Neuroscience Letters. 2008;441:158-62.
35. João Botelho, Patrícia Lyra, Luís Proença, Catarina Godinho, José João Mendes, Vanessa Machado. Relationship between Blood and Standard Biochemistry Levels with Periodontitis in Parkinson’s Disease Patients: Data from the NHANES 2011–2012. J Pers Med. 2020;10:1-11.
36. Cicciù M. Neurodegenerative Disorders and Periodontal Disease: Is There a Logical Connection? Neuroepidemiology. 2016;47:94-5.
37. Yair Zlotnik, Yacov Balash, Amos D. Korczyn, Nir Giladi, Tanya Gurevich. Disorders of the Oral Cavity in Parkinson’s Disease and Parkinsonian Syndromes. Hindawi. 2015;20:1-6.
38. Pastor P, Tolosa E. La enfermedad de Parkinson: diagnóstico y avances en el conocimiento de la etiología y en el tratamiento. Med Integr. 2001;37:104-17.
39. Marjolein A. E. van Stiphout , 1 Johan Marinus,2 Jacobus J. van Hilten,2, Frank Lobbezoo ,, 3 and Cees de Baat 1. Oral Health of Parkinson’s Disease Patients: A Case-Control Study. Hindawi. 2018;8.
40. LEONARDO M. BATISTA, MILLENA TELES PORTELA DE OLIVEIRA, WILRAMA B. MAGALHAES, POLIANA LIMA BASTOS. Oral Hygiene in Patients with Parkinson’s Disease. RIMJ ARCHIVES. 2015;35-7.
41. Shazia Kaka, Helen Lane, Emily Sherwin. Dentistry and Parkinson’s disease: learnings from two case reports. BRITISH DENTAL JOURNAL. 2019;227:30-6.
42. Dibello V, Zupo R, Sardone R, Lozupone M, Castellana F, Dibello A, et al. Oral frailty and its determinants in older age: a systematic review. The Lancet Healthy Longevity. 2021;2:e507-20.
43. Cornélio FM, Esteban JCG, Urizar JMA. Alteraciones orales en los pacientes con enfermedad de Parkinson. Revisión sistemática. Ciencias Clínicas. 2015;16:12-7.
44. Harris Ricardo J, Fortich Mesa N, Díaz Caballero A. Fisiopatología y manifestaciones bucales de la enfermedad de Parkinson: Una revisión actualizada. Odontoestomatol. 2012;29:151-7.
45. Ribeiro GR, Campos CH, Garcia RCMR. Oral Health in Elders with Parkinson’s Disease. Braz Dent J. 2016;27:340-4.
46. Jeter CB, Rozas NS, Sadowsky JM, Jones DJ. Parkinson’s Disease Oral Health Module: Interprofessional Coordination of Care. MedEdPORTAL. 14:10699.
47. Nogueira A, Ferret-Sena V, Mendes JJ, Godinho C. Implications of Parkinson Disease in oral health. 2017;6:1.
48. Prete BRJ, Ouanounou A. Medical Management, Orofacial Findings, and Dental Care for the Patient with Parkinson’s Disease. J Can Dent Assoc. 2021;16.
49. Persson M, Sterberg TÖ, Granérus A-K, Karlsson S. Influence of Parkinson’s disease on oral health. Acta Odontologica Scandinavica. 1992;50:37-42.
50. Yoshimi Nakayama, Mitsuru Mori. Oral health conditions, behavior and swallowing in patients with Parkinson’s disease. J Natl Inst Public Health. 2016;65:175-182.
51. Bennett JPJ, Keeney PM, Brohawn DG. RNA Sequencing Reveals Small and Variable Contributions of Infectious Agents to Transcriptomes of Postmortem Nervous Tissues From Amyotrophic Lateral Sclerosis, Alzheimer’s Disease and Parkinson’s Disease Subjects, and Increased Expression of Genes From Disease-Activated Microglia. Front Neurosci. 2019;28:235.
52. Newadkar UR, Khairnar SJ, Dodamani AS, Newadkar RD. Oral Health Issues and Challenges in Parkinson’s Disease. International Journal of Nutrition, Pharmacology, Neurological Diseases. 2017;7:54.
53. Cabrera Escobar D, González Valdés L. Atención estomatológica integral a los pacientes con enfermedad de Parkinson. Medicentro Electrónica. 2018;22:152-4.
54. Herrera AJ, Castaño A, Venero JL, Cano J, Machado A. The Single Intranigral Injection of LPS as a New Model for Studying the Selective Effects of Inflammatory Reactions on Dopaminergic System. Neurobiology of Disease. 2000;7:429-47.
55. Valicena M, Escalona, LA. Manejo terapéutico del paciente con Xerostomía. Acta odontologica. 2001;39.
56. Llena Puy C. La saliva en el mantenimiento de la salud oral y como ayuda en el diagnóstico de algunas patologías. Medicina Oral, Patología Oral y Cirugía Bucal (Internet). 2006;11:449-55.
57. Rebolledo FA. Tratamiento de sialorrea en enfermedades neurológicas más frecuentes del adulto. 2006;5:6.
58. Auffret M, Meuric V, Boyer E, Bonnaure-Mallet M, Verin M. Oral cavity disorders in Parkinson’s disease: more than meets the eye. PMCID. 2019;11:1507-153.
59. Kortemeyer B. Higiene bucal en las personas mayores y enfermas. Quintessence (ed esp). 2012;25:256-62.
60. Joan Gardner, Rose Wichmann. Manejo de la Enfermedad de Parkinson en su Etapa Avanzada [Internet]. National Parkinson Foundation; 2018. Disponible en: https://secure3.convio.net/prkorg/site/DocServer/Manejo_de_la_enfermedad_de_Parkinson_en_su_etapa_avanzad.pdf?docID=201
Notas de autor
faith89@hotmail.it







