

Pancreatitis Aguda: Articulo de Revisión
Acute Pancreatitis: A Review Article
Revista Médico Científica, vol.. 33, núm. 1, 2020
Universidad de Panamá


Artículos de Revisión
Recepción: 20 Julio 2020
Aprobación: 18 Septiembre 2020

Resumen: La pancreatitis aguda es uno de los principales motivos de consulta por enfermedad gastrointestinal en los cuartos de urgencias, y es una causa importante de morbimortalidad a nivel mundial. Se caracteriza por la activación desmedida de la tripsina en las células acinares del páncreas, provocando la autodigestión enzimática del tejido pancreático. La primera descripción de esta entidad fue realizada en el año 1652 por el médico danés Nicholaes Tulp. Sus principales etiologías son la litiasis biliar y el consumo excesivo de alcohol. Para su diagnóstico se requiere al menos 2 de los 3 criterios a continuación: dolor intenso en abdomen superior, habitualmente irradiado a espalda “en cinturón”; niveles de amilasa y/o lipasa séricos superior a 3 veces el límite de lo normal y hallazgos típicos de pancreatitis aguda por imagenología de abdomen. La hidratación, nutrición temprana y el manejo del dolor son los pilares en el manejo de una pancreatitis aguda.
Palabras clave: pancreatitis, páncreas, lipasa, cálculos biliares.
Abstract: Acute pancreatitis is a main gastrointestinal causes for emergency room visits, and it´s a major cause of morbidity and mortality worldwide. It is characterized by the excessive activation of trypsin in pancreas acinar cells causing enzymatic self- digestion of pancreatic tissue. This entity was first described in 1652 by the danish physician Nicholaes Tulp. Main etiologies are gallstones and excessive alcohol consumption. To perform acute pancreatitis diagnosis it´s required 2 of the 3 diagnostic criteria: typical pancreatitis abdominal pain; serum elevation of amylase and/or lipase greater than 3 times the normal limit and typical acute pancreatitis findings in abdominal imaging. Hydration, early nutrition, and pain control are the management cornerstone in acute pancreatitis.
Keywords: pancreatitis, pancreas, lipase, gallstones.
INTRODUCCIÓN
a pancreatitis aguda es un proceso inflamatorio de inicio abrupto en el páncreas que puede afectar múltiples órganos[1]. Es la patología gastrointestinal más común por la cual se acude a los cuartos de urgencias en los Estados Unidos[2]. En los Estados Unidos, en el año 2009, fue la principal causa de egreso hospitalario de etiología gastrointestinal[3] y en el año 2012, fue la quinceava causa de muerte por enfermedad gastrointestinal, hepática y pancreática[2].
El páncreas es un órgano ubicado en el retroperitoneo, en la parte superior del abdomen[4]. Posee 4 partes anatómicas: cabeza, cuello, cuerpo y cola. Desde la cola hasta la cabeza del páncreas, el conducto pancreático principal atraviesa el parénquima y desemboca en el conducto biliar común. El páncreas se encuentra en relación anatómica con el bazo, duodeno, mesocolon transverso y estómago[5]. Tiene un peso aproximado entre 100 – 150 gramos, una longitud estimada de 15 – 25 cm y una secreción diaria de jugo pancreático con un pH >8 entre 1500 – 3000 mL[4], [6].
Fisiológicamente, el páncreas posee funciones tanto exocrinas como endocrinas[4]. E
EPIDEMIOLOGÍA
La pancreatitis aguda es una afección gastrointestinal común de carácter mundial asociado con una considerable morbilidad y aumento de costos en salud[6],[11]. Su incidencia, dependiendo del país, etiología y factores de riesgo, varía entre 5 hasta 45 casos por cada 100,000 personas, considerando que en la actualidad estas cifras han ido en aumento. Panamá no cuenta con datos ni estadísticas sobre la epidemiología de esta enfermedad[6],[11],[12].
Es la causa gastrointestinal más común de hospitalizaciones en Estados Unidos, resultando anualmente en >250,000 casos[6],[11],[12],[13]. El tiempo
promedio de hospitalización es de 4 días, representando un costo mayor a 6,000 dólares, los cuales representan gastos anuales de hasta 2.6 mil millones de dólares en Estados Unidos[6],[11],[12]. Las tasas de hospitalización son más comunes en personas de raza negra y en el sexo masculino[6]. La mortalidad estimada es de 1 a 4%; el 50% de los decesos ocurren en las primeras dos semanas[6],[11].
Grados de severidad
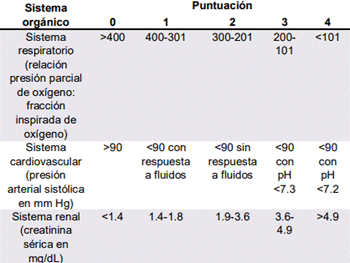
Los criterios revisados de Atlanta establecen tres grados de severidad en pancreatitis aguda: leve, moderadamente severa y severa. La pancreatitis aguda leve es aquella en la cual hay ausencia de falla orgánica, y de complicaciones locales o sistémicas. En la pancreatitis aguda moderadamente severa existe falla orgánica transitoria (< 48 horas) o complicaciones, ya sean locales o sistémicas sin persistencia de falla orgánica. La pancreatitis aguda severa está caracterizada por la presencia de falla orgánica persistente (> 48 horas). En las primeras 48 horas no se puede distinguir entre enfermedad moderada-severa la cual es temporal, y la enfermedad severa que puede estarse desarrollando. La falla orgánica se determina a partir de los criterios de Marshall (Ver Tabla #1). Un puntaje mayor a 2 en más de una ocasión, durante 3 días consecutivos es válido para falla orgánica persistente en el paciente con pancreatitis aguda[3],[14].
TIPOS DE PANCREATITIS AGUDA (CLASIFICACIÓN MORFOLÓGICA)
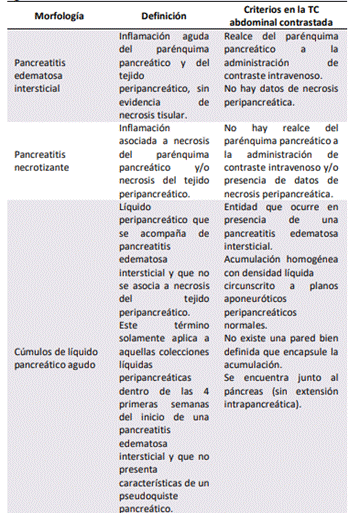
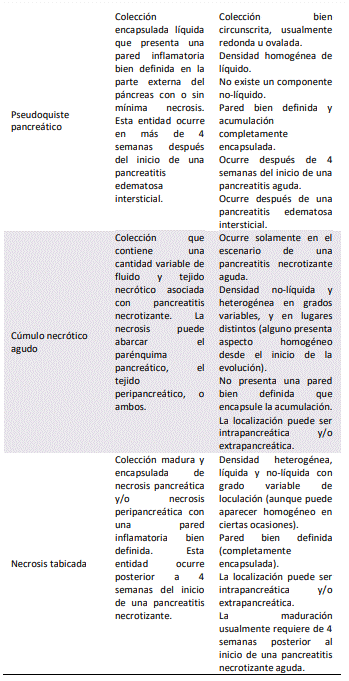
La pancreatitis edematosa intersticial, y la pancreatitis necrotizante son los dos tipos en los que se subdivide la pancreatitis aguda. La mayoría de los pacientes (80% – 90%) desarrollará una pancreatitis edematosa intersticial, caracterizada por un agrandamiento localizado o difuso del páncreas. Se presentarán cambios en el parénquima pancreático y en la grasa peripancreática en la tomografía computarizada (TC) abdominal contrastada. El parénquima pancreático presentará un reforzamiento homogéneo tras la administración de contraste intravenoso, mientras que la grasa peripancreática presentará cambios inflamatorios. Estos pacientes presentan recuperación clínica dentro de la primera semana del inicio de los síntomas. Los cúmulos de líquido pancreático agudo y el pseudoquiste pancreático son las complicaciones que pueden ocurrir en una pancreatitis edematosa intersticial.
La pancreatitis necrotizante, está presente en el 5%
– 10% de los pacientes con pancreatitis aguda. Esta se caracteriza por la presencia de necrosis que involucra el parénquima pancreático y el tejido peripancreático (más común), necrosis solamente del tejido peripancreático (menos común), o necrosis solamente del parénquima pancreático (excepcional). La necrosis se determina por un área del parénquima pancreático que no realza con la administración de contraste intravenoso en una TC abdominal después de la primera semana del inicio del episodio de pancreatitis aguda. Esto se debe a que la alteración de la perfusión pancreática no es evidente en los primeros días de la enfermedad, y la necrosis del parénquima pancreático y del tejido peripancreático tomará varios días en aparecer. Por esta razón, la realización de una TC abdominal contrastada tiene una utilidad limitada para determinar necrosis del parénquima pancreático y del tejido peripancreático en el inicio de la presentación de una pancreatitis aguda. La necrosis del tejido peripancreático, se determina por un
parénquima pancreático que realza de manera homogénea a la administración de contraste intravenoso en una TC abdominal, en comparación con el tejido peripancreático que no realza a la administración de contraste intravenoso. La evolución de una pancreatitis necrotizante es variable, el parénquima pancreático y el tejido peripancreático puede permanecer sólido o licuarse, permanecer estéril o infectarse, y perdurar o resolver en un periodo de tiempo. El cúmulo necrótico agudo, y la necrosis tabicada son las complicaciones que pueden ocurrir en una pancreatitis necrotizante[14]. En la Tabla #2 se describen las características morfológicas de la pancreatitis aguda.
ETIOLOGÍA
Las etiologías involucradas en la pancreatitis aguda pueden ser identificadas en un 75% – 85% de los casos[15]. Los cálculos biliares y el consumo de alcohol son las dos causas más frecuentes de pancreatitis aguda en el adulto[16]. Otras causas comunes son: la pancreatitis inducida por drogas[17], pancreatitis
Hipertrigliceridémica[18], pancreatitis post- colangiopancreatografía retrógrada endoscópica (CPRE)[19] y la pancreatitis idiopática[15]. En la edad pediátrica, las etiologías más comunes de pancreatitis aguda a nivel mundial son: cálculos biliares, traumatismo abdominal cerrado, y enfermedades multisistémicas[20]. En Panamá, la principal causa de pancreatitis aguda en edad pediátrica es de etiología parasitaria causada por Ascaris lumbricoides, seguida por traumatismo abdominal cerrado, y en tercer lugar se encuentran los cálculos biliares[21]. En la Tabla #3 se mencionan las causas comunes y poco comunes descritas en la literatura de pancreatitis aguda.
Cálculos biliares
Los cálculos biliares son la principal causa de pancreatitis aguda en los adultos, representando un 38% – 40% del total de los casos[16],[21]. Los cálculos al migrar de la vesícula biliar, pueden causar la obstrucción del conducto biliar común, del conducto pancreático, o de ambos. Esta migración calculosa ocurre más frecuentemente en mujeres que en hombres, y los cálculos que poseen un tamaño ≤ 5mm son los que tendrán la capacidad de migrar y desencadenar un cuadro de pancreatitis aguda biliar. La obstrucción impide el drenaje de la secreción pancreática a través de la ampolla duodenal, lo que ocasiona un incremento de la presión intraductal e inflamación del tejido pancreático[22],[23].
Consumo de alcohol
La pancreatitis alcohólica es la segunda causa más frecuente de pancreatitis aguda en el adulto, representando un 30% – 35% del total de los casos[16],[19]. Ocurre de manera más frecuente en hombres que en mujeres, y en aquellos adultos que abusan en el consumo de bebidas alcohólicas de manera crónica; el 10% presentará al menos un episodio de pancreatitis aguda[22]. El alcohol disminuye el umbral de activación del tripsinógeno inactivo a tripsina activa en las células acinares pancreáticas, y la exposición persistente causará
necrosis pancreática[24]. El consumo de alcohol mayor al recomendado por día, semana u ocasión incrementa las consecuencias perjudiciales para la salud. En hombres, el consumo de > 14 bebidas alcohólicas por semana o > 4 bebidas alcohólicas por ocasión; y en mujeres el consumo de > 7 bebidas alcohólicas por semana o > 3 bebidas alcohólicas por ocasión se considera consumo peligroso de alcohol[25]. En general, una bebida alcohólica corriente, contiene aproximadamente 10 gramos de alcohol (por ejemplo: una copa de vino o una lata de cerveza). Se considera un consumidor de bebidas alcohólicas estándar, aquel que consume entre 14- 15 gramos de alcohol por ocasión. El consumo de
>80 gramos de alcohol al día es considerado consumo excesivo de alcohol. El riesgo de desarrollar pancreatitis aguda incrementa con un consumo de alcohol >50 gramos por día, por al menos 5 años de duración en el consumo de alcohol[3],[26].
Hipertrigliceridemia
La hipertrigliceridemia, es la tercera causa más común de pancreatitis aguda, representando un 5%
– 10% de los casos en adultos, y en mujeres embarazadas puede llegar a representar hasta un 56% de las causas de pancreatitis aguda[19],[27]. Los niveles de triglicéridos se consideran normales por debajo de 150 mg/dL. La hipertrigliceridemia leve es aquella con niveles séricos entre 150 – 199 mg/dL; la moderada aquella con niveles séricos entre 200 – 999 mg/dL; la severa aquella con niveles séricos entre 1000 – 1999 mg/dL; y la muy severa aquella con niveles séricos ≥2000 mg/dL. La hipertrigliceridemia severa y muy severa se encuentran asociadas a un incremento en el riesgo de desarrollar pancreatitis aguda[28].
Drogas
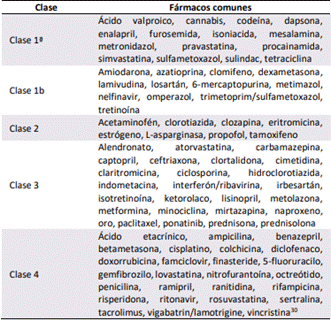
Un amplio listado de medicamentos frecuentemente prescritos se encuentran asociados a la aparición de pancreatitis aguda[17]. Al ser una lista extensa, se han dividido los casos de pancreatitis aguda inducida por drogas en tres clases, y se
incluye una cuarta clase de fármacos con evidencia limitada en la literatura. En la clase 1a, la droga asociada tiene al menos un caso reportado con reexposición positiva sin otra probable etiología. En la clase 1b, la droga asociada tiene al menos un caso reportado con reexposición positiva, en el escenario de otras probables etiologías. En la clase 2, el medicamento tiene al menos 4 casos reportados con una latencia consistente. En la clase 3, el medicamento tiene al menos 2 casos reportados sin latencia consistente. En la clase 4, el medicamento presenta un caso reportado sin evidencia de reexposición positiva[29]. Se debe realizar un diagnóstico de pancreatitis inducida por drogas al excluir en primera instancia el resto de las probables etiologías de pancreatitis aguda[30]. Una lista de los medicamentos asociados junto a su respectiva clase se describe en la Tabla #4.
Post – Colangiopancreatografía Retrógrada Endoscópica (CPRE)
La pancreatitis aguda biliar, la colangitis sobreagregada a la pancreatitis aguda biliar, y la coledocolitiasis son las principales condiciones clínicas para realizar una CPRE, y no representa beneficio alguno su realización en la ausencia de las mismas[22]. La pancreatitis aguda es la complicación más común posterior a una CPRE. La pancreatitis post-CPRE, se define como el síndrome clínico consistente con pancreatitis con niveles de amilasa superior a 3 veces el límite de lo normal por más de 24 horas posterior al procedimiento y que requiere de más de un día de hospitalización. Los pacientes con alto riesgo de desarrollar pancreatitis post-CPRE son aquellos que cumplen con al menos uno de los siguientes criterios: sospecha clínica de disfunción del esfínter de Oddi, antecedente personal patológico de pancreatitis post-CPRE, edad menor a 50 años, sexo femenino, y antecedente personal patológico de más de 2 episodios de pancreatitis. La incidencia general de pancreatitis post-CPRE es de 9,7% y en pacientes de alto riesgo su incidencia es del 17,7%[31].
Idiopática
En ocasiones la causa de la pancreatitis aguda no puede ser identificada, y cuando se han descartado todas las posibles causas se establece el diagnóstico de pancreatitis aguda idiopática, la cual puede estar presente en el 10% – 40% de los casos[15].


*Causas probables, evidencia limitada
FISIOPATOLOGÍA
La pancreatitis aguda es causada por la activación desregulada de tripsina en las células acinares[22]. Los
principales factores que desencadenan un episodio de pancreatitis aguda son la obstrucción del ducto pancreático y la lesión pancreática inducida por alcohol. Entre las causas destacadas que ocasionan una obstrucción del ducto pancreático se encuentran: litiasis biliar, obstrucción tumoral, causas parasitarias, entre otras[41]. La lesión pancreática inducida por alcohol obedece a la teoría de los tapones proteicos, la cual establece que el alcohol causa la precipitación de proteínas en los pequeños ductos pancreáticos, promoviendo la formación de litiasis. El contacto entre el cálculo y el conducto pancreático ocasionará ulceración y cicatrización empeorando la obstrucción inicial y cuyo resultado final será la atrofia de células acinares y la fibrosis del conducto pancreático[42].
La pancreatitis aguda surge cuando los mecanismos protectores intracelulares que previenen la activación del tripsinógeno a tripsina son suprimidos, causando autodigestión glandular e inflamación en las células acinares[22]. Los mecanismos autoprotectores del páncreas son: síntesis de tripsinógeno inactivo, autolisis de tripsina activada, mantenimiento de la homeostasis de calcio intracelular bajo, síntesis del inhibidor de la tripsina secretora pancreática (sintetizado por el gen inhibidor de serina proteasa tipo Kazal 1). Este último está encargado de la inactivación del 20% de la actividad de la tripsina[6],[22].
Al activarse el tripsinógeno en tripsina en las células acinares se activarán otras enzimas como la elastasa, y la fosfolipasa A2. A su vez se activa la vía del complemento y la vía de las cininas. La cascada inflamatoria inicia, con la producción local de IL-1, IL-6, IL-8, y factor de necrosis tumoral alfa[22],[41]. La activación de tripsinógeno en tripsina, también motiva la activación de células endoteliales, lo que lleva a la migración transendotelial de leucocitos, que intensificará la respuesta inflamatoria en el parénquima pancreático[43]. La activación de tripsinógeno en tripsina además promueve el daño pancreático al promover la producción de radicales libres de oxígeno[44]. Las complicaciones locales
(necrosis pancreática, pseudoquiste pancreático, y absceso pancreático) surgen por el daño causado a las células acinares secundario a la cascada inflamatoria y a la activación de células endoteliales. El resultado final de la activación de enzimas y liberación de mediadores inflamatorios en el páncreas podrá causar daño a órganos adyacentes (pulmón, hígado o riñón), llevando al paciente a una falla orgánica múltiple[22],[41].
CUADRO CLÍNICO
La documentación de una historia clínica en la que se describan los antecedentes del paciente y la realización de un examen físico apropiado, es necesario para determinar el origen del padecimiento. Las mujeres menores a 55 años presentan una incidencia más alta de pancreatitis aguda biliar en comparación a los varones del mismo grupo etario. En contraste, la pancreatitis aguda alcohólica es más frecuente en los varones, en todos los grupos de edad[45]. Otros antecedentes de importancia son la medicación habitual o de novo en el paciente, elevación de triglicéridos, traumatismos recientes, e historia familiar de pancreatitis aguda. Las características clínicas compatibles con un episodio de pancreatitis aguda son: la aparición de un dolor abdominal continúo de localización epigástrica o periumbilical; el cual puede irradiarse hacia la espalda, exacerbarse con el movimiento, y aliviarse al reclinarse hacia adelante. El dolor abdominal usualmente se encuentra asociado a sensación de distensión abdominal, anorexia, náuseas y vómitos[46]. Los pacientes se presentarán en el cuarto de urgencias en las primeras 12 – 24 horas desde el inicio del dolor abdominal[1], y el dolor abdominal estará presente en el 90% de los casos[30].Los pacientes con un episodio de pancreatitis aguda severa presentarán defensa y rebote a la palpación abdominal, en contraste con un episodio de pancreatitis aguda leve, en donde se presentarán con ligero dolor abdominal. En el examen general los pacientes parecen estar enfermos, y pueden
presentar fiebre, hipotensión, taquicardia, taquipnea y alteración del estado mental en casos severos, mientras que los casos leves no se presentan con estas alteraciones[47]. El signo de Cullen (equimosis periumbilical) y el signo de Gray- Turner (equimosis alrededor de los flancos), a pesar de presentar una baja sensibilidad y especificidad, se encuentran presente en aproximadamente 1% de los casos y su presencia está asociada a un 37% de mortalidad[48]. En el 39% – 86% de los casos de pancreatitis aguda se produce hipocalcemia, cuyo mecanismo exacto de desarrollo no es del todo conocido. Las manifestaciones clínicas de hipocalcemia dependen de la severidad de la misma. En casos leves se presentan parestesias periorales y calambres musculares. El signo de Chvostek (percusión del nervio facial que lleva al espasmo de músculos faciales), y el signo de Trousseau (espasmo carpopedal al inflar un manguito de presión arterial en el brazo) pueden encontrarse en casos severos[49].
DIAGNÓSTICO
Las guías de práctica clínica del Colegio Americano de Gastroenterología del año 2013, establecen los criterios diagnósticos para pancreatitis aguda. Se requieren 2 de los siguientes 3 criterios para realizar el diagnóstico:
1. Dolor abdominal característico de pancreatitis
2. Niveles de amilasa y/o lipasa séricas con elevación superior a 3 veces el límite de lo normal
3. Hallazgos típicos de pancreatitis aguda por imagenología del abdomen[3].
La presentación de una pancreatitis aguda severa en presencia de enzimas pancreáticas con mínima elevación es posible. Por lo cual, una elevación menor a 3 veces el límite de lo normal de amilasa y/o lipasa séricos al momento de la llegada del paciente al cuarto de urgencias, no deben ser utilizados para determinar la severidad de la enfermedad[41].
La Asociación Europea para el Estudio del Hígado establece que para realizar el diagnóstico de pancreatitis aguda biliar son necesarios presentar los siguientes criterios:
1. Dolor abdominal superior
2. Alteración de pruebas de función hepática y pancreática
3. Colelitiasis y/o coledocolitiasis[50].
DIAGNÓSTICO DIFERENCIAL
Cualquier causa de abdomen agudo o dolor abdominal forma parte del diagnóstico diferencial de pancreatitis aguda. El principal es la colecistitis aguda. Ambas comparten la etiología biliar. El cólico biliar se sitúa en el hipocondrio derecho, y por lo general es más severo[6],[51]. También debe diferenciarse de una colangitis aguda, complicación que se puede evidenciar en ambas patologías previamente mencionadas, pero que presenta fiebre e ictericia.[51] Para confirmar o descartar cualquiera de estas etiologías debe realizarse un ultrasonido biliar[6].
La obstrucción intestinal puede simular pancreatitis aguda, pero su dolor generalmente es crescendo- decrescendo. Sus hallazgos al examen físico incluyen: distensión a la palpación, timpanismo a la percusión y presencia de aumento o disminución de ruidos hidroaéreos a la auscultación. El panel de laboratorios puede demostrar leucocitosis, incremento de nitrógeno en urea, acidosis metabólica y datos de falla orgánica. Se puede confirmar la obstrucción mecánica mediante la realización de una TC de abdomen[6],[52].
La oclusión vascular mesentérica aguda debe sospecharse en pacientes ancianos con leucocitosis, distensión abdominal y diarrea sanguinolenta. Su inicio es generalmente súbito, sin pródromos. El dolor abdominal se caracteriza por ser desproporcionado, en comparación a los hallazgos del examen físico.[6],[53] Importante recalcar que la amilasa puede elevarse en esta patología. La revisión de Khan et al, encontró dos estudios en
donde hasta un 63,5% presentaron elevaciones de este marcador y el diagnostico de isquemia mesentérica aguda[54]. Su diagnóstico se realiza con Angio-TC[53].
Siempre debe indagarse en enfermedades previas, como la diabetes. La cetoacidosis diabética puede llegar a simular el dolor abdominal de la pancreatitis aguda, e incluso eleva los niveles séricos de amilasa, pero no de lipasa. Otros diagnósticos diferenciales incluyen: neumonía basal, perforación intestinal, aneurisma aórtico disecante, cólico renal, enfermedades reumatológicas como: el lupus eritematoso sistémico y la poliarteritis nodosa, entre otras.[6]
ESTUDIOS DE LABORATORIO
Los niveles séricos de lipasa y amilasa deben ser indicados como prueba inicial ante la sospecha de una pancreatitis aguda, debido a que sus concentraciones séricas se incrementan a las pocas horas de iniciado el cuadro clínico. La interpretación en la alteración de estas enzimas debe realizarse con un juicio clínico pertinente, ya que no se incrementan de manera exclusiva en pancreatitis aguda[55]. Los principales sitios en el ser humano en el cual se sintetiza la enzima amilasa son en las células acinares del páncreas, y en las glándulas salivares. Existen otros lugares donde se sintetiza, a una menor concentración, la amilasa: tejido adiposo, tejido muscular esquelético, intestino delgado, ovarios, y trompas de Falopio[56]. Los niveles séricos de amilasa se incrementan en una pancreatitis aguda en las primeras 6 – 24 horas, realiza su pico a las 48 horas y descienden a niveles normales o cerca de los mismos a los 3 – 5 días. La amilasa sérica elevada más de 3 veces del límite superior de lo normal presenta una sensibilidad estimada del 72% y una especificidad estimada del 93% para el diagnóstico de pancreatitis aguda[57]. Los niveles de amilasa sérica, pueden estar dentro de valores normales en casos de pancreatitis aguda de etiología crónica, alcohólica e hipertriglideridémica[3]. Existen algunas patologías
distintas a la pancreatitis aguda capaces de causar una elevación en los niveles séricos de amilasa, como por ejemplo: fibrosis quística, tumores malignos, traumatismos, trastornos de las glándulas salivares, trastornos gastrointestinales (apendicitis aguda, enfermedad ulcero péptica, isquemia intestinal) , trastornos ginecológicos (embarazo ectópico roto, infección pélvica, cistoadenoma seroso ovárico), colelitiasis, colecistitis, peritonitis, alcoholismo crónico, falla renal, embarazo, acidosis, osteomas múltiples y disección aórtica aguda[58] .
El principal sitio de producción de la enzima lipasa en seres humanos ocurre en las células acinares del páncreas. Las isoformas producidas en el páncreas son la lipasa pancreática, y la lipasa pancreática relacionada con la proteína 2. Ambas isoformas pancreáticas, presentan una concentración 100 veces mayor en comparación a otras isoformas conocidas de lipasa (lipasa hepática, lipasa endotelial, lipoproteina lipasa)[56],[58]. Los niveles
séricos de lipasa en una pancreatitis aguda empiezan a incrementarse a las 4 – 8 horas, presentan su pico a las 24 horas, y descienden a niveles normales o cerca de los mismos a los 8 – 14 días. La lipasa sérica elevada más de 3 veces del límite superior de lo normal presenta una sensibilidad estimada del 79% y una especificidad estimada del 89% para el diagnóstico de pancreatitis aguda[57]. Una diferencia importante entre ambas enzimas es la reabsorción de la lipasa a nivel de los túbulos renales, por lo cual es capaz de permanecer por mayor tiempo en la circulación sanguínea, y al persistir por más tiempo; es de mayor utilidad en comparación con la amilasa, en caso de una presentación tardía de pancreatitis aguda[59]. Existen causas distintas a la pancreatitis aguda que ocasionan una elevación importante de la lipasa sérica, las cuales se describen en la Tabla #5.

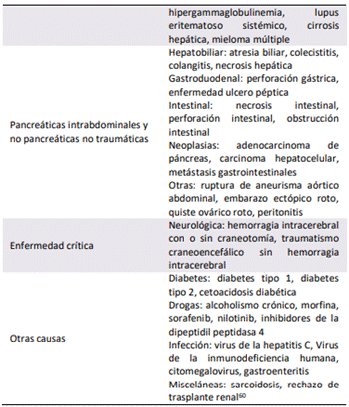
Al momento de realizar la admisión de un paciente
con pancreatitis aguda se debe indicar la toma de una serie de laboratorios junto a la toma de lipasa y amilasa sérica. Estos exámenes de laboratorio son: biometría hemática completa, glucosa, creatinina, nitrógeno de urea, electrolitos, albúmina, aspartato aminotransferasa, alanina aminotransferasa, fosfatasa alcalina y tiempos de coagulación. Si el paciente presenta taquipnea o una saturación de oxígeno menor a 95% es apropiada la toma de una gasometría arterial[41].
Para el diagnóstico de pancreatitis aguda se ha planteado la medición del tripsinógeno-2 en orina. El tripsinógeno, es producido por las células acinares del páncreas y sus principales isoformas son el tripsinógeno-1, y el tripsinógeno-2[58]. En la pancreatitis aguda, la inflamación y consecuente autodigestión enzimática del páncreas, provoca el escape del tripsinógeno-2 a la circulación sanguínea, con posterior incremento en su depuración urinaria[61]. En casos de pancreatitis aguda, el tripsinógeno-2 urinario se incrementa a las pocas horas de iniciado el cuadro clínico y desciende a
niveles normales en 3 a 5 días[58]. Un meta-análisis realizado en China por Jin et al, demuestra que los niveles de tripsinógeno-2 urinario > 50ng/mL asociado a dolor abdominal agudo sugieren pancreatitis aguda, con una sensibilidad del 80% y una especificidad del 92%[62]. Otro meta-análisis realizado por Rompanesi et al, en el 2017 publicado por Cochrane, demostró resultados similares al meta-análisis previamente descrito, en donde los niveles de tripsinógeno-2 urinario > 50 ng/mL presentan una sensibilidad estimada del 71% - 74% y una especificidad estimada del 89% para pancreatitis aguda[57].
ESTUDIOS DE IMAGEN
La principal etiología de pancreatitis aguda es la biliar. Debido a su alta prevalencia y frecuentes recurrencias, es razonable realizar un ultrasonido abdominal a todos los pacientes a su ingreso para descartar esta etiología y, de ser positivo, referir a una colecistectomía. Cabe destacar que esta herramienta es para determinar etiología, ya que su utilidad no es diagnóstica de pancreatitis[3]. De manera tardía, tiene utilidad para identificar características morfológicas de colecciones y como guía para intervenciones terapéuticas[63].
Las técnicas de imagen que se utilizan para diagnóstico y graduación de la severidad son típicamente: la TC abdominal contrastada y la Resonancia Magnética. A pesar de que la TC puede identificar de manera temprana cambios inflamatorios en el páncreas, su realización no aporta sensibilidad al diagnóstico clínico, y si es realizada muy temprano, puede dar resultados falsos negativos hasta en un 27%[13]. Por la razón anteriormente mencionada, no se recomienda realizar una TC de ingreso a los pacientes con pancreatitis aguda. La TC abdominal contrastada es considerada el Gold Estándar imagenológico para determinar el grado de severidad e identificar complicaciones pancreáticas y extra pancreáticas, así como colecciones, efusión pleural e infartos de órganos[41].
Las indicaciones para realizar una TC abdominal contrastada en pancreatitis aguda son: falta de certeza diagnóstica, confirmar la severidad basado en predictores clínicos, una pobre respuesta al tratamiento conservador o un deterioro clínico aún con el tratamiento óptimo[64]. Su realización complementa con los hallazgos morfológicos (ver tabla 2) la escala de severidad imagenológica de Balthazar, la cual combina las clasificaciones de las alteraciones pancreáticas y peripancreáticas con el puntaje de necrosis pancreática (ver tabla 6 y tabla 7). Cabe destacar, que esta escala no es beneficiosa ya que su valor predictivo es similar a las escalas clínicas[41],[65].
La resonancia magnética es la alternativa a la TC abdominal contrastada en caso de alergia u otra contraindicación. Su sensibilidad es similar, pero su especificidad es mayor. Es superior para evaluar tejidos blandos y la integridad del ducto pancreático. Sus desventajas incluyen su disponibilidad limitada, su largo tiempo de realización, necesidad de personal capacitado y altos costos[13],[64].


PRONÓSTICO DE LA PANCREATITIS
En primera instancia, debe evaluarse al paciente y determinar la severidad del cuadro clínico utilizando la revisión de los criterios de Atlanta del 2012, ya sea leve, moderadamente severa o severa; y con respecto a esta dar el manejo adecuado. Esto es vital para la reducción de la mortalidad por pancreatitis aguda[66],[67],[68]. Existen numerosos sistemas de graduación de severidad, muchos de estos utilizados de manera común en la práctica clínica. Sin embargo, muchas de estas herramientas resultan tediosas y poco convenientes, ya que son difíciles de calcular o requieren un tiempo aproximado de 48 a 72h para ser válidas[67].
En las practicas se ha demostrado que escalas como APACHE II (Acute Physiology and Chronic Health Evaluation II), Glasgow, RANSON y BISAP (Bedside Index of Severity in Acute Pancreatitis) tienen pobre valor predictivo positivo. La escala de APACHE II, también utilizada para determinar el pronóstico de los pacientes en Unidad de Cuidados Intensivos, era la herramienta más utilizada en contexto de pancreatitis aguda. Esta escala, posee una sensibilidad de 100% y una especificidad de aproximadamente 63.4%[69]. No obstante, la misma es complicada, ya que requiere parámetros de laboratorio no relevantes con el cuadro clínico y datos de la historia clínica, la cual puede llegar a ser difícil de conseguir[70].
La escala de Ranson posee una sensibilidad de aproximadamente 90% y una especificidad de 67%. La escala de Glasgow, una sensibilidad de 50% y una especificidad de 78.6%[61]. Ambas, tienen la desventaja de requerir 48 horas para ser calculadas y la obtención de parámetros no rutinarios en un caso de pancreatitis aguda[70].
La escala BISAP, predice de manera más precisa la falla orgánica temprana y la mortalidad intrahospitalaria. Es más sencilla de calcular al ingreso[68]. En un estudio retrospectivo, Park et al demuestran que la predicción en severidad, mortalidad y falla orgánica es similar a la de la escala APACHE II, y mejor que la escala de RANSON, el
índice de severidad por Tomografía Computada y marcadores individuales como el hematocrito, la proteína C reactiva y el índice de masa corporal[71].
La Escala Modificada de Marshall ha recibido mayor atención por su fácil aplicación en el estadiaje de pancreatitis aguda, dependiendo en las variables de duración y grado de la falla orgánica. La misma fue adoptada por la Revisión de Atlanta del 2012, y es actualmente la escala recomendada para graduar la severidad. Originalmente utilizada para calcular mortalidad en pacientes críticos, ha sido simplificada de seis sistemas a tres (cardiovascular, respiratorio y renal), en donde un puntaje mayor o igual a 2, refiere falla del órgano indicado[72].
Adicional a las escalas de severidad, se han estudiado numerosos biomarcadores y datos de laboratorios como factores predictores de severidad y mortalidad. Entre los más destacados está la PCR (Proteína C Reactiva), utilizada ampliamente en la práctica. No obstante, su valor es limitado pues es significativo a 72 horas de iniciado el cuadro clínico. Estudios han demostrado que, su sensibilidad es tan baja como un 37% en el momento de la admisión y puede llegar hasta 79% conforme pasan las horas. Se concluye que la PCR no es específica para esta enfermedad y, por tanto, no es de utilidad para predecir pronóstico, mortalidad ni desarrollo de necrosis pancreática; razón por la cual no se incluye en las guías de manejo de Pancreatitis Aguda[61].
La Procalcitonina es muy estudiada como posible marcador de severidad. Este resulta inconsistente, pero se ha demostrado que en valores >0.5ng/mL tiene una sensibilidad de 81% y especificidad de 86%, tornándose una herramienta útil en predecir severidad y el desarrollo de necrosis pancreática[61].
Valores de laboratorio como el hematocrito y el Nitrógeno de Urea (BUN), son utilizados por su mayor rapidez de obtención, menor costo y por representar el estado del volumen intravascular, brindándonos datos de desarrollo de falla orgánica y de respuesta al tratamiento[73]. Wu et al, en un estudio prospectivo entre Estados Unidos y Holanda
demuestran que, los niveles elevados del BUN tanto en la admisión como a las 24 horas de hospitalización son factores independientes de mortalidad en Pancreatitis. Un nivel mayor de 20 mg/dL o un aumento de este luego de 24 horas aumentan la mortalidad hasta 4 veces. El estudio también demuestra que, una disminución de 5 mg/dL cada 24 horas en valores mayores de 20 mg/dL genera reducción en la mortalidad intrahospitalaria[74].
Los datos correspondientes al hematocrito indican que su elevación, especialmente >44%, se relacionan a un curso más severo de la enfermedad, incluyendo estancias hospitalarias prolongadas y requerimiento de unidad de cuidados intensivos. Además de mayor desarrollo de falla multiorgánica y necrosis pancreática[73].
La mortalidad es aproximadamente de un 4%, la mayoría de los casos resuelve con el correcto tratamiento en un par de días. De estos casos, entre 15 a 20% presentarán complicaciones; dependiendo de cuál desarrolle el paciente, así mismo aumentará la mortalidad, que va de 25% por una necrosis pancreática infectada hasta un 36% - 50% secundario a una falla orgánica múltiple[75].
TRATAMIENTO
El tratamiento de la pancreatitis aguda ha ido evolucionando a lo largo de los años. Actualmente se compone de los siguientes pilares: hidratación intravenosa temprana, nutrición adecuada, analgesia e intervenciones necesarias[11].
Hidratación Intravenosa
La resucitación con líquidos intravenosos de manera temprana, es la piedra angular del tratamiento de pancreatitis aguda. Sin embargo, su evidencia es de pobre calidad. Su objetivo es prevenir hipovolemia, principalmente por la formación de terceros espacios, y la hipoperfusión de órganos[11]. Debido a esto, siempre se debe iniciar hidratación lo más pronto posible. Numerosos estudios han utilizado
cristaloides, coloides y más recientemente la terapia dirigida a metas. Esta última reduce la mortalidad en pacientes con sepsis, la cual tiene similitudes con la pancreatitis aguda[12].
La terapia dirigida a metas no ha demostrado mejoría en la mortalidad y en complicaciones; razón por la cual la AGA (Asociación Americana de Gastroenterología) la recomienda de manera condicional. No obstante, la hidratación agresiva, definida como 250 mL a 500 mL por hora, solo es beneficiosa en las primeras 24 horas y a largo plazo genera complicaciones respiratorias y abdominales[11],[3]. La IAP (Asociación Internacional de Pancreatología) recomienda que la tasa de infusión de la resucitación inicial sea de 5-10 mL/kg/h (Grado 1B), ya que una infusión total de 2.5 a 4 litros en las primeras 24 horas, es suficiente para alcanzar las metas esperadas. Estas metas son: una frecuencia cardiaca <120/min, presión arterial media entre 65 y 85 mm Hg, diuresis >1 mL/kg/h y un valor de hematocrito entre 35 y 44% (Grado 2B)[64].
Con respecto a la elección de la solución de resucitación optima, principalmente entre lactato Ringer y solución salina normal, la AGA no favorece una sobre la otra debido a que las dos resultan beneficiosas, basado en el pobre nivel de evidencia[11]. La IAP recomienda el uso de lactato Ringer sobre solución salina normal (Grado 1B) basado en un estudio aleatorizado, donde esta disminuía más el desarrollo de falla orgánica en comparación a la solución salina normal[64]. Otros beneficios teóricos del lactato Ringer incluyen: la inactivación del tripsinógeno y menos posibilidades de desarrollar acidosis metabólica hiperclorémica[3].
Nutrición
El dogma tradicional de mantener al paciente sin alimentación para evitar la sobreestimulación del páncreas inflamado debe ser olvidado. La AGA y la IAP recomiendan alimentación enteral de manera temprana, preferiblemente dentro de las primeras
24 horas, en casos de pancreatitis aguda leve, siempre y cuando el paciente pueda tolerarlo. De
esta manera, se protege la barrera de la mucosa intestinal, reduciendo la translocación bacteriana. Se disminuye el riesgo de desarrollar necrosis pancreática infectada y la estancia hospitalaria del paciente[11],[79].
Al presentarse un caso severo, se recomienda reiniciar alimentación enteral entre 3 a 5 días. Por lo general, estos pacientes no toleran vía oral; por lo cual se propone la utilización de sonda nasogástrica o nasoyeyunal o iniciar nutrición parenteral total[12],[79]. El metaanálisis de Yi et al, demuestra superioridad en la nutrición enteral, en comparación a la parenteral con respecto a reducción de complicaciones, mortalidad y costo[66]. La nutrición parenteral está indicada como terapia de segunda línea en caso de que no se toleren las otras vías (Grado 2C)[64]. Referente a la elección entre alimentación nasoenteral y nasoyeyunal, la AGA y la IAP indican que ambas pueden ser utilizadas por su eficacia similar (Grado 2A). No obstante, no se evidencia beneficio en la mortalidad en ninguna de las dos modalidades[11],[64].
El beneficio de la alimentación temprana ha sido demostrado con diversos tipos de dietas (baja en grasa, liquida, blanda y corriente); por esta razón ya no se considera necesario iniciar con dieta de líquidos claros[11].
Analgesia
El dolor asociado con pancreatitis aguda es el síntoma cardinal, y generalmente es severo. Por lo tanto, la analgesia adecuada toma parte fundamental del tratamiento. No hay un consenso definitivo acerca del analgésico de elección, y la eficacia de un tipo de medicamento sobre otro no está lo suficientemente clara[76]. Es aceptable iniciar tratamiento intravenoso con acetaminofén[13]. Gulen et al, en su estudio prospectivo compara acetaminofén, dexketoprofeno, y tramadol, demostrando que ninguno era superior a otro[83].
Si los agentes no opiodes no generan alivio, debe iniciarse el uso de medicamentos opioides
intravenosos como morfina, fontanal e hidromorfona, los cuales son efectivos y seguros[13]. Basurto Ona et al, en su artículo de revisión indica que los opioides son bastante seguros, y que su uso disminuye la necesidad de utilizar analgesia suplementaria[77].
Antibióticos
La profilaxis antibiótica para prevenir complicaciones infecciosas en pacientes con cualquier grado de severidad de pancreatitis aguda no es recomendada (Grado 1B)[11],[64]. Aun con el desarrollo de necrosis estéril, los estudios no han demostrado beneficios en esta práctica[3].
La necrosis pancreática infectada es una complicación que aumenta drásticamente la mortalidad, por esta razón varios autores buscan encontrar la utilidad de la profilaxis antibiótica en una necrosis estéril. Sin embargo, el diseño metodológico de múltiples estudios es una limitante[3].
El tratamiento antibiótico está indicado en infecciones extrapancreáticas como: colangitis, neumonía, bacteriemia, entre otras. Otra recomendación fuerte es la presencia de necrosis pancreática infectada, la cual debe sospecharse en pacientes con necrosis pancreática estéril confirmada y que no mejoran o deterioran en el periodo de una semana. Para iniciar antibioticoterapia, debe primero realizarse una aspiración con aguja fina guiada por TC y obtener material para cultivo y tinción Gram. Posterior a esto se puede iniciar el tratamiento empírico con carbapenémicos, quinolonas o metronidazol, cuyo perfil permite penetrar la necrosis pancreática, disminuyendo la mortalidad y la necesidad de intervenciones quirúrgicas[3],[79].
Colangiopancreatografía Retrograda (CPRE)
La CPRE está indicada en pancreatitis aguda de etiología biliar en el contexto de una colangitis (Grado 1B) o de una obstrucción del conducto biliar común (Grado 1C). Esta solo debe realizarse en
carácter de urgencia (<24 horas) en presencia de una colangitis aguda (Grado 2C). No debe ser realizada en una pancreatitis aguda leve o una pancreatitis aguda severa sin evidencias de colangitis[64].
La obstrucción biliar persistente sin colangitis es una indicación razonable. No obstante, no se ve una diferencia ni un beneficio en el tiempo de realización en <24 horas, <48 horas y <72 horas[12].
Aproximadamente un 2 a 4% de los pacientes desarrollan pancreatitis post-CPRE. Esto puede prevenirse con canalización guiada, colocación de stents en el ducto pancreático y utilización de anti- inflamatorios rectales (indometacina)[3],[32].
Manejo Quirúrgico: Colecistectomía
La etiología biliar es la causa más común de pancreatitis aguda. Se estima que aproximadamente un 18% de los pacientes serán readmitidos en un periodo de 6 semanas por eventos biliares recurrentes[12],[3],[64]. Todos los pacientes con pancreatitis aguda leve de etiología biliar deben someterse a una colecistectomía durante el curso de la actual hospitalización (Grado 1C), reduciendo complicaciones biliares y recurrencias[11],[64].
En caso de presentar un episodio moderadamente severo o severo, con colecciones peripancreáticas, este procedimiento debe retrasarse hasta que haya mejoría o estabilización a las 6 semanas. El retraso quirúrgico en estos casos, reduce morbimortalidad e infecciones relacionadas[12],[64].
Manejo quirúrgico de las complicaciones
La complicación más común de la pancreatitis aguda es la necrosis pancreática estéril. Anteriormente, se realizaba el drenaje abierto de las mismas, resultando en un aumento considerable en la mortalidad[3]. Actualmente, las indicaciones del drenaje quirúrgico y mínimamente invasivo son la sospecha o documentación de necrosis pancreática infectada ya sea por cultivo o clínica, en especial
cuando esta es encapsulada. Si no hay evidencia de necrosis infectada, la persistencia de falla orgánica luego de semanas de haber iniciado el cuadro de pancreatitis aguda puede ser sugestivo de esta (Grado 1C). Hay excepciones en donde se debe drenar una necrosis estéril, como: el caso de obstrucción del tracto de salida gástrico, de la vía biliar o del intestino secundario a un efecto de masa (Grado 2C)[64],[79].
Cabe destacar que el concepto de que toda necrosis pancreática o peripancreática infectada requiere drenaje y desbridamiento quirúrgico no es absoluto. Se ha comprobado que el uso de antibióticos retrasa y hasta evita la realización de procedimientos invasivo[64]. En el reporte de casos de Freeman et al, la tasa de mortalidad en el manejo conservador y quirúrgico resultó similar[78].
La aspiración con aguja fina por vía percutánea para la detección de bacterias no está indicada de manera rutinaria, ya que existe alta probabilidad de un falso negativo. Muchas veces la clínica y los signos imagenológicos nos dan los datos necesarios para sospechar esta complicación[64].
El drenaje percutáneo guiado por TC de la necrosis pancreática se realiza en casos de sobreinfección y/o de presentar sintomatología. Se recomienda realizar de manera temprana, por ejemplo, en las dos primeras semanas del cuadro clínico. También es utilizada como adyuvante al tratamiento endoscópico o quirúrgico de las necrosis encapsuladas[79].
En la actualidad, el abordaje mínimamente invasivo es de elección siempre que esté disponible. Esto se debe a que genera mejor respuesta clínica y menos complicaciones con respecto a las cirugías abiertas [79],[80]. Al contrario del drenaje percutáneo, el abordaje endoscópico (drenaje transmural, necrosectomía, cistenterostomía) se beneficia de retrasar el momento de la intervención. También su éxito depende de características de la colección, como el tamaño y su adhesión a una estructura luminal (Estomago o duodeno)[79].
El drenaje transmural endoscópico previamente se basaba en una punción ciega a protrusiones en la submucosa. Actualmente, ha sido complementado con el ultrasonido endoscópico, el cual, mediante su guía de imagen, hace este procedimiento más efectivo y con menor porcentaje de complicaciones[80],[81]. Por consenso de especialistas se considera que, este procedimiento debe ser el procedimiento standard en estos pacientes[82]. Inicialmente, se utilizaban los stents plásticos para el drenaje transmural. Los stents metálicos, como los LAMS (lumen-apposing metal stents) han demostrado evidentes ventajas sobre sus predecesores, haciendo los procedimientos más rápidos, seguros y efectivos; razón por la cual muchos endoscopistas consideran que debe ser la herramienta de elección, sobre todo en casos de necrosis encapsuladas (Grado 2B)[79],[81],[82].
La necrosectomía endoscópica directa también necesita apoyo del ultrasonido endoscópico y muchas veces de fluoroscopia. Es reservado para pacientes con grandes colecciones necróticas o en respuesta inadecuada al drenaje transmural[79],[80]. El abordaje abierto para drenaje y desbridamiento de colecciones va en desuso, por su alto perfil de complicaciones y aumento de mortalidad. Su utilidad radica luego de que las técnicas menos invasivas hayan fallado o no se encuentren disponibles[79],[80].
específicas para su diagnóstico, es contraproducente utilizarlas en todos los casos por su alto costo y pobre impacto sobre el manejo y pronóstico. Esta entidad posee una compleja fisiopatología que es similar a la sepsis o la falla orgánica múltiple, por lo cual se recomienda graduar su severidad con escalas que sean rápidas y fáciles de implementar, como el Score de Marshall Modificado.
Una correcta resucitación intravenosa, vigilando parámetros fisiológicos, junto con una alimentación temprana y un manejo del dolor adecuado permite la mejoría de la mayoría de los pacientes; y de presentar complicaciones, su manejo ha evolucionado a ser lo menos invasivo posible, con buenos resultados y pocas complicaciones. Es de vital importancia que todo personal de salud este actualizado en un tema tan común como lo es la pancreatitis aguda, en su correcto manejo y en las técnicas novedosas que se han desarrollado para su tratamiento.
CONCLUSIONES
La pancreatitis aguda continúa siendo una de las patologías gastrointestinales más comunes, produciendo una enorme carga económica en el sistema de salud. Su incidencia ha ido en aumento, pero su mortalidad en decremento. Los cálculos biliares y el consumo del alcohol siguen liderando como agentes etiológicos.
El diagnóstico debe ser clínico y mediante la obtención de lipasa. Mientras que las técnicas imagenológicas, como la TC contrastada y la Resonancia Magnética, son altamente sensibles y
Referencias
1. Johnson C, Besselink M, Carter R. Acute Pancreatitis. BMJ [INTERNET] 2014 Aug 12 [consultado el 14 de mayo de 2020]. 349:g4859. Disponible en: https://www.bmj.com/content/349/bmj.g4859.long
2. Peery A, Crockett S, Barritt A,Dellon E,Eluri S,Gangarosa L et al. Burden of Gastrointestinal, Liver, and Pancreatic Diseases in the United States. Gastroenterology [INTERNET] 2015 Dec [consultado el 14 de mayo de 2020]. 149(7):1731‐1741. Disponible en: https://www.gastrojournal.org/article/S0016- 5085(15)01242-1/
Tenner S, Baillie J, De Witt J, Swaroop S. American College of Gastroenterology Guideline: Management of Acute Pancreatitis. Am J Gastroenterol [INTERNET] 2013 Feb [Consultado el 14 de mayo de 2020]. 108(9):1400-1416. Disponible en: https:journals.lww.com/ajg/fulltext/2013/09000/American_College_of_Gastroenterology_Guideline_.6.aspx
4. Sing P. Overview of the pancreas. In: The renin-angiotensin system: current research progress in the pancreas. AdvExpMedBiol [INTERNET] 2010 [consultado el 14 de mayo de 2020]. 690:3‐12. Disponible en: https://link.springer.com/chapter/10.1007%2F978-90-481- 9060-7_1
5. Dalley A, Agur A, Moore K. Moore Fundamentos de anatomía con orientación clínica. 6ta ed. Filadelfia: Wolters Kluwer; 2020 [consultado el 14 de mayo de 2020].
6. Jameson J, Fauci A, Kasper D, Hauser S, Longo D, Loscalzo J. Harrison Principios de Medicina Interna. 20va ed. Ciudad de Mexico: McGrawHilleducation; 2018 [consultado el 14 de mayo de 2020].
7. Sastre J, Sabater L, Aparisi L. Fisiología de la secreción pancreática. GastroenterolHepatol [INTERNET] 2006 [consultado el 14 de mayo de 2020]. 28(supl 2):3-9. Disponible en: https://www.elsevier.es/es-revista-gastroenterologia- hepatologia-14-articulo-fisiologia-secrecion-pancreatica- 13071380
8. Hall J. Guyton y Hall Tratado de Fisiología Médica. 13va ed. Barcelona: Elsevier España; 2016 [consultado el 14 de mayo de 2020].
9. Graus-Nunes F, Souza-Mello V. The renin-angiotensin system as a target to solve the riddle of pancreas homeostasis. BiomedPharmacother [INTERNET] 2019 Jan [consultado el 14 de mayo de 2020]. 109:639-645. Disponible en: https://www.sciencedirect.com/science/article/pii/S07533322 1832821X?via%3Dihub
10. Pannala R, Kidd M, Modlin I. Acute Pancreatitis A Historical Perspective. Pancreas [INTERNET] 2009 May [consultado el 14 de mayo de 2020]. 38(4):355‐366. Disponible en: https://journals.lww.com/pancreasjournal/Abstract/2009/050 00/Acute_Pancreatitis A_Historical_Perspective.1.aspx
11. Crockett SD, Wani S, Gardner T, Falck-Ytter, Y, Barkun A, Crockett S et al. American Gastroenterological Association Institute Guideline on Initial Management of Acute Pancreatitis. Gastroenterology [Internet] 2018 [consultado el 30 de mayo de 2020]; 154(4):096–1101. Disponible en: https://www.gastrojournal.org/article/S0016-5085(18)30076- 3
12. Vege SS, DiMagno MJ, Forsmark CE, Martel M, Barkun AN. Initial Medical Treatment of Acute Pancreatitis: American Gastroenterological Association Institute Technical Review. Gastroenterology [Internet] 2018 [consultado el 30 de mayo 2020];154(4):1103‐1139. Disponible en: https://www.gastrojournal.org/article/S0016-5085(18)30075- 1/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.go v%2F29421596%2F
13. Waller A, Long B, Koyfman A, Gottlieb M. Acute Pancreatitis: Updates for Emergency Clinicians. J EmergMed [Internet] 2018 [consultado el 30 de mayo de 2020];55(6):769‐ 779. Disponible en: https://www.jem- journal.com/article/S0736-4679(18)30836-9/fulltext
14. Banks P, Bollen T, Dervenis C, Gooszen H, Johnson C, Sarr M. Classification of acute pancreatitis – 2012: revision of the Atlanta classification an definitions by international consensus. Gut [INTERNET] 2013 Jan [consultado el 14 de mayo de 2020]. 62(1):102-11. Disponible en: https://gut.bmj.com/content/62/1/102.long
15. Chatila A, Bilal M, Guturu P. Evaluation and management of acute pancreatitis. World J Clin Cases [INTERNET] 2019 May 6 [consultado el 17 de mayo de 2020]. 7(9):1006-1020. Disponible en: https://www.ncbi.nih.gov/pmc/articles/PMC6511926/
16. Quinlan J. Acute Pancreatitis. Am FamPhysician [INTERNET] 2014 Nov 1 [consultado el 17 de mayo de 2020]. 90(9):632-9. Disponible en: https://www.aafp.org/afp/2014/1101/p632.html
17. Trivedi C, Pitchumoni C. Drug-Induced Pancreatitis An Update. J Clin Gastroenterol [INTERNET] 2005 Sep [consultado el 17 de mayo de 2020]. 39(8):709-16. Disponible en: https://journals.lww.com/jcge/Abstract/2005/09000/Drug_In duced_Pancreatitis An_Update.12.aspx
18. Murphy M, Sheng X, MacDonald T, Wei L. Hypertriglyceridemia and Acute Pancreatitis. JAMA InternMed [INTERNET] 2013 Jan 28 [consultado el 17 de mayo de 202]. 173(2):162-4. Disponible en: https://jamanetwork.com/journals/jamainternalmedicine/full article/1399846
19. Forsmark C, Vege S, Wilcox C. Acute Pancreatitis. N Engl J Med [INTERNET] 2016 Nov 17 [consultado el 17 de mayo de 2020]. 375(20):1972-1981. Disponible en: https://www.nejm.org/doi/full/10.1056/NEJMra1505202
20. Bai H, Lowe M, Husain S. What have we learned about acute pancreatitis in children?.J PediatrGastroenterolNutr [INTERNET] 2011 [consultado el 17 de mayo de 2020]. 52(3):262-70. Disponible en: https://journals.lww.com/jpgn/Fulltext/2011/03000/What_Ha ve_We_Learned_About_Acute_Pancreatitis_in.3.aspx
21. Chanis R, McCalla R, Flores R, Osorio M. Pancreatitis aguda: Casos reportados en 10 años Hospital del Niño (2001 -2011). Pediátr Panamá [INTERNET] 2012 [consultado el 17 de mayo de 2020]. 41(3):6-11. Disponible en: https://www.spp.com.pa/revista/revista_pediatrica_vol41_n3
22. Frossard J, Steer M, Pastor C. Acute Pancreatitis. Lancet [INTERNET] 2008 Jan 12 [consultado el 16 de mayo de 2020]. 371(9607):143-52. Disponible en: https://www.thelancet.com/journals/lancet/article/PIIS0140- 6736(08)60107-5/fulltext
23. Tejedor M, Albillos A. Enfermedad litiásica biliar. Medicine [INTERNET] 2012 [consultado el 17 de mayo de 2020]. 11(8):481-8. Disponible en: https://www.sciencedirect.com/science/article/pii/S03045412 12703347
24. Portelli M, Jones C. Severeacute pancreatitis: pathogenesis, diagnosis and surgicalmanagement. HepatobiliaryPancreatDisInt [INTERNET] 2017 Apr [consultado el 17 de mayo de 2020]. 16(2):155-159. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1499 387216601637?via%3Dihub
25. Moyer V. Screening and behavioral counseling interventions in primary care to reduce alcohol misuse: U.S. preventive services task force recommendation statement. Ann InternMed [INTERNET] 2013Aug 6 [consultado el 17 de mayo de 2020]. 159(3):210-8. Disponible en: https://www.acpjournals.org/doi/10.7326/0003-4819-159-3- 201308060-00652
26. Herreros-Villanueva M, Hijona E, Bañales J, Cosme A, Bujanda L. Alcohol consumptiononpancreaticdiseases. World J Gastroenterol [INTERNET] 2013 [consultado el 17 de mayo de 2020]. 19(5):638-647. Disponible en: https://www.wjgnet.com/1007-9327/full/v19/i5/638.htm
27. Ewald N. Hypertriglyceridemia-induced acute pancreatitis. Clinicallipidology [INTERNET] 2017 Jan 18 [consultado el 18 de mayo de 2020]. 8(5):587-94. Disponible en: https://www.tandfonline.com/action/showCitFormats?doi=10 .2217%2Fclp.13.44
28. Berglund L, Brunzell J, Goldberg A, Goldberg I, Sacks F, Murad M et al. Evaluation and Treatment of Hypertriglyceridemia: An Endocrine Society Clinical Practice Guideline. J Clin EndocrinolMetab [INTERNET] 2012 Sep [consultado el 18 de mayo de 2020]. 97(9):2969-89. Disponible en: https://academic.oup.com/jcem/article/97/9/2969/2536709
29. Badalov N, Baradarian R, Iswara K, Li J, Steinberg W, Tenner S. Drug-Induced Acute Pancreatitis: An Evidence-Based Review. Clin GastroenterolHepatol [INTERNET] 2007 Jun [consultado el 19 de mayo de 2020]. 5(6):648-61. Disponible en: https://www.cghjournal.org/article/S1542-3565(06)01201- 8/fulltext
30. Olson E, Perelman, Birk J. Acute management of pancreatitis: the key to best outcomes. PostgradMed J [INTERNET] 2019 Jun [consultado el 19 de mayo de 202]. 95(1124):328-333. Disponible en: https://pmj.bmj.com/content/95/1124/328.long
31. Kochar B, Akshintala V, Afghani E, Elmunzer B, Kim K, Lennon A et al. Incidence, Severity, and Mortality of post-ERCP Pancreatitis: A Systematic Review by Using Randomized, Controlled Trials. GastrointestEndosc [INTERNET] 2015 Jan [consultado el 19 de mayo de 2020]. 81(1):143-149. Disponible en: https://www.giejournal.org/article/S0016-5107(14)01936- 1/fulltext
32. Elmunzer B, Scheiman J, Lehman G, Chak A, Mosler P, Higgins P et al. A Randomized Trial of Rectal Indomethacin to Prevent Post-ERCP Pancreatitis. N Engl J Med [INTERNET] 2012 [consultado el 19 de mayo de 2020]. 366:1414-22. Disponible en: https://www.nejm.org/doi/pdf/10.1056/NEJMoa1111103?arti cleTools=true
33. Mazaki T, Mado K, Masuda H, Shiono M. Prophylactic pancreatic stent placement and post-ERCP pancreatitis: an updated meta-analysis. J Gastroenterol [INTERNET] 2014 Feb [consultado el 19 de mayo de 2020]. 49(2):343-55. Disponible en: https://link.springer.com/article/10.1007/s00535-013- 0806-1
34. Forsmark C, Baillie J. AGA Institute Technical Review on Acute Pancreatitis. Gastroenterology [INTERNET] 2007 [consultado el 19 de mayo de 202]. 132:2022–2044. Disponible en: https://www.gastrojournal.org/article/S0016- 5085(07)00591-4/pdf
35. Malkarnekar S, Naveen L. A rare case of acute pancreatitis following snake envenomation with fatal outcome. Trop J Med Res [INTERNET] 2014 [consultado el 19 de mayo de 2020].17:137-9. Disponible en: http://www.tjmrjournal.org/downloadpdf.asp?issn=1119- 0388;year=2014;volume=17;issue=2;spage=137;epage=139;au last=Malkarnekar;type=2
36. Puentes A, Prieto J. Pancreatitis Aguda Artículo de Revisión. IntraMed J [INTERNET] 2014 [consultado el 19 de mayo de 2020]. 3(2):1-14. Disponible en: http://journal.intramed.net/index.php/Intramed_Journal/artic le/download/332/133/
37. Parniczky A, Abu-El-Haija M, Husain S, Lowe M, Oracz G, Sahin-Toth M et al. EPC/HPSG evidence-based guidelines for the management of pediatric pancreatitis. Pancreatology [INTERNET] 2018 Mar [consultado el 19 de mayo de 2020]. 18(2):146-160. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1424 390318300012
38. Rawla P, Bandaru S, Vellipuram A. Review of Infectious Etiology of Acute Pancreatitis. Gastroenterology Res [INTERNET] 2017 Jun [consultado el 19 de mayo de 2020]. 10(3): 153–158. Disponible en: https://www.gastrores.org/index.php/Gastrores/article/view/ 858
39. Uc A, Husain S. Pancreatitis in Children. Gastroenterology [INTERNET] 2019 May [consultado el 19 de mayo de 2020] 156(7):1969-1978. Disponible en: https://www.gastrojournal.org/article/S0016-5085(19)30352- X/pdf
40. Shimosegawa T, Chari S, Frulloni L, Kamisawa T, Kawa S, Mino-Kenudson M et al. International ConsensusDiagnosticCriteriaforAutoimmune Pancreatitis. Pancreas [INTERNET] 2011 Apr [consultado el 19 de mayo de 2020]. 40(3):352-8. Disponible en: https://journals.lww.com/pancreasjournal/Fulltext/2011/0400 0/International_Consensus_Diagnostic_Criteria_for.3.aspx
42. Apte M, Pirola R, Wilson J. Mechanisms of alcoholic pancreatitis. J GastroenterolHepatol [INTERNET] 2010 Dec [consultado el 16 de mayo de 2020]. 25(12):1816-26. Disponible en: https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1440- 1746.2010.06445.x
43. Alvarez-Aguilar P, Dobles-Ramirez C. Pancreatitis aguda: fisiopatología y manejo inicial. Acta Médica Costarricense [INTERNET] 2019 [consultado el 16 de mayo de 2020]. 61(1):13- 21. Disponible en: http://docs.bvsalud.org/biblioref/2019/03/983714/v61n1art1 3.pdf
44. Jha R, Ma Q, Sha H, Pallkhe M. Acute pancreatitis: A literature review. MedSciMonit [INTERNET] 2009 [consultado el 16 de mayo de 2020]. 15(7):147-156. Disponible en: https://www.medscimonit.com/download/index/idArt/86969 9
45. Roberts S, Akbari A, Thorne K, Atkinson M, Evans P. The incidence of acute pancreatitis: impact of social deprivation, alcohol consumption, seasonal and demographic factors. AlimentPharmacolTher [INTERNET] 2013 Sep [consultado el 27 de mayo de 2020]. 38(5):539-48. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1111/apt.12408
46. Goodchild G, Chouhan M, Johnson g. Practical guide to the management of acute pancreatitis. FrontlineGastroenterol [INTERNET] 2019 Jul [consultado el 27 de mayo de 2020]. 10(3):292-299. Disponible en: https://fg.bmj.com/content/10/3/292
47. Dupuis C, Baptista V, Whalen G, Adib K, Singh A, Wassef W et al. Diagnosis and management of acute pancreatitis and its complications. GastrointestInterv [INTERNET] 2013 Jun [consultado el 27 de mayo de 2020]. 2(1): 36-46. Disponible en: https://www.sciencedirect.com/science/article/pii/S22131795 13000072
48. Wright W. Cullen Sign and Grey Turner Sign Revisited. J Am OsteopathAssoc [INTERNET] 2016 Jun 1 [consultado el 27 de mayo de 2020]. 116(6):398-401. Disponible en: https://jaoa.org/article.aspx?articleid=2525753
49. Ahmed A, Azim A, Gurjar M, Baronia A. Hypocalcemia in acute pancreatitis revisited. Indian J CritCareMed [INTERNET] 2016 Mar [consultado el 27 de mayo de 2020]. 20(3): 173–177. Disponible en: https://www.ijccm.org/doi/pdf/10.4103/0972- 5229.178182
41. Lankisch P, Apte M, Banks P. Acute Pancreatitis. Lancet [INTERNET] 2015 Jul 4 [consultado el 16 de mayo de 2020]. 386(9988):85-96. Disponible en: https://www.thelancet.com/journals/lancet/article/PIIS0140- 6736(14)60649-8/fulltext
50. Lammert F, Acalovschi M, Ercolani G, Van Erpecum K, Gurusamy K, Van Laarhoven C et al. EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones. J Hepatol [INTERNET] 2016 Jul [consultado el 28 de mayo de 2020]. 65(1):141-181. Disponible en: https://www.journal-of- hepatology.eu/action/showPdf?pii=S0168- 8278%2816%2930032-0
51. Halpin V. Acute cholecystitis. BMJ Clin Evid [Internet]. 2014 [Consultado el 30 de mayo de 2020];2014:0411. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4140413/
52. Jackson PG, Raiji MT. Evaluation and management of intestinal obstruction. Am FamPhysician [Internet]. 2011 [Consultado el 30 de mayo de 2020];83(2):159‐165. Disponible en: https://www.aafp.org/afp/2011/0115/p159.html
53. Savlania A, Tripathi RK. Acute mesenteric ischemia: current multidisciplinary approach. J CardiovascSurg (Torino) [Internet]. 2017 [Consultado el 30 de mayo 2020];58(2):339‐ 350. Disponible en: https://www.minervamedica.it/en/journals/cardiovascular- surgery/article.php?cod=R37Y2017N02A0339
54. Khan SM, Emile SH, Wang Z, Agha MA. Diagnostic accuracy of hematological parameters in Acute mesenteric ischemia-A systematic review. Int J Surg [Internet]. 2019 [Consultado el 30 de mayo de 2020];66:18‐27. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1743 919119300883?via%3Dihub
55. Basnayake C, Ratnam D. Blood Tests for Acute Pancreatitis. AustPrescr [INTERNET] 2015 Aug [consultado el 30 de mayo de 2020]. 38(4):128-30. Disponible en: https://www.nps.org.au/australian-prescriber/articles/blood- tests-for-acute-pancreatitis
56. Ismail O, Bhayana V. Lipase or amylase for the diagnosis of acute pancreatitis?Clin Biochem [INTERNET] 2017 Dec [consultado el 30 de mayo de 2020]. 50(18):1275-1280. Disponible en: https://www.sciencedirect.com/science/article/pii/S00099120 17303569
57. Rompianesi G, Hann A, Komolafe O, Pereira S, Davidson B, Gurusamy K. Serum Amylase and Lipase and Urinary Trypsinogen and Amylase for Diagnosis of Acute Pancreatitis. Cochrane DatabaseSystRev [INTERNET] 2017 Apr 21 [consultado el 30 de mayo de 2020]. 4(4):CD012010. Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/1465185 8.CD012010.pub2/full
58. Lippi G, Valenttino M, Cervellin G. Laboratory diagnosis of acute pancreatitis: in search of the Holy Grail. CritRev Clin LabSci [INTERNET] Feb 2012 [consultado el 30 de mayo de 2020]. 49(1):18-31. Disponible en: https://www.tandfonline.com/doi/full/10.3109/10408363.201 2.658354
59. Shah A, Eddi R, Kothari S, Maksoud C, DiGiacomo W, Baddoura W. Acute Pancreatitis With Normal Serum Lipase: A Case Series. JOP [INTERNET] 2010 Jul 5 [consultado el 30 de mayo de 2020]. 11(4):369-72. Disponible en: http://www.serena.unina.it/index.php/jop/article/view/3623/ 3962
60. Hameed A, Lam V, Pleass H. Significant elevations of serum lipase not caused by pancreatitis: a systematic review. HPB [INTERNET] 2015 Feb [consultado el 30 de mayo de 2020]. 17(2):99-112. Disponible en: https://www.hpbonline.org/article/S1365-182X(15)31176- X/fulltext
61. Staubli S, Oertli D, Nebiker C. Laboratory markers predicting severity of acute pancreatitis. CritRev Clin LabSci [INTERNET] 2015 [consultado el 30 de mayo de 2020]. 52(6):273-83. Disponible en: https://www.tandfonline.com/doi/full/10.3109/10408363.201 5.1051659
62. Jin T, Huang W, Jiang K, Xiong J, Xue P, Javed M et al. Urinary trypsinogen-2 for Diagnosing Acute Pancreatitis: A Meta- Analysis. HepatobiliaryPancreatDisInt [INTERNET] 2013 Aug [consultado el 30 de mayo de 2020]. 12(4):355-62. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S1499 387213600569
63. Bollen TL. Acute pancreatitis: international classification and nomenclature. Clin Radiol [Internet] 2016 [consultado el 2 de junio de 2020]. 71(2):121‐133. Disponible: https://www.clinicalradiologyonline.net/article/S0009- 9260(15)00388-8/fulltext
64. Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology[Internet] 2013 [consultado el 2 de junio de 2020];13(4 Suppl 2): e1‐e15. Disponible en: https://www.sciencedirect.com/science/article/pii/S14243903 13005255
65. Mancilla C, Sanhueza A. Clasificación Balthazar Ranson. GastroenterolLatinoam 2010 21(3):415-417. Disponible en: https://gastrolat.org/clasificacion-de-balthazar-ranson/
66. Lee PJ, Papachristou GI. New insights into acute pancreatitis. Nat Rev Gastroenterol Hepatol [Internet]. 2019 [consultado el 2 de junio de 2020].;16(8):479‐496. Disponible: https://www.nature.com/articles/s41575-019-0158-2
67. James, Theodore W.; Crockett, Seth D. Management of acute pancreatitis in the first 72 hours, Current Opinion in Gastroenterology[Internet]. September 2018 [consultado el 2 de junio de 2020]. Volume 34 - Issue 5 - p 330-335. Disponible: https://journals.lww.com/cogastroenterology/Abstract/2018/ 09000/Management_of_acute_pancreatitis_in_the_first_72.1 1.aspx
68. Zhou, H., Mei, X., He, X., Lan, T., & Guo, S. Severity stratification and prognostic prediction of patients with acute pancreatitis at early phase. Medicine [Internet]. 2019 [consultado el 2 de junio de 2020]. 98(16), e15275. Disponible: https://journals.lww.com/mdjournal/Fulltext/2019/04190/Sev erity_stratification_and_prognostic_prediction.52.aspx
69. Di MY, Liu H, Yang ZY, Bonis PA, Tang JL, Lau J. Prediction Models of Mortality in Acute Pancreatitis in Adults: A Systematic Review. Ann Intern Med [Internet]. 2016 [consultado el 2 de junio de 2020];165(7):482‐490. Disponible: https://www.acpjournals.org/doi/full/10.7326/M16- 0650?url_ver=Z39.88- 2003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub++0pu bmed&
70. Hagjer, S., & Kumar, N. Evaluation of the BISAP scoring system in prognostication of acute pancreatitis – A prospective observational study. International Journal of Surgery [Internet], 2018 [consultado el 2 de junio de 2020] 54, 76–81. Disponible: https://www.sciencedirect.com/science/article/abs/pii/S1743 91911830712X?via%3Dihub
71 Park, J. Y., Jeon, T. J., Ha, T. H., Hwang, J. T., Sinn, D. H., Oh, T.-H., … Choi, W.-C. Bedside index for severity in acute pancreatitis: comparison with other scoring systems in predicting severity and organ failure. Hepatobiliary & Pancreatic Diseases International [Internet]. 2013 [consultado el 2 de junio de 2020]; 12(6), 645–650. Disponible: https://www.sciencedirect.com/science/article/abs/pii/S1499 387213601010?via%3Dihub
72 Abu Omar Y, Attar BM, Agrawal R, et al. Revised Marshall Score: A New Approach to Stratifying the Severity of Acute Pancreatitis. Dig Dis Sci [Internet]. 2019 [consultado el 2 de junio de 2020];64(12):3610‐3615. Disponible: https://link.springer.com/article/10.1007%2Fs10620-019- 05719-y
73 Koutroumpakis E, Wu BU, Bakker OJ, et al. Admission Hematocrit and Rise in Blood Urea Nitrogen at 24 h Outperform other Laboratory Markers in Predicting Persistent Organ Failure and Pancreatic Necrosis in Acute Pancreatitis: A Post Hoc Analysis of Three Large Prospective Databases [published correction appears in Am J Gastroenterol [Internet]. 2016 [consultado el 2 de junio de 2020];111(8):1216. Mounzer, Rawad [added]]. Am J Gastroenterol. 2015;110(12):1707‐1716. Disponible: https://insights.ovid.com/pubmed?pmid=26553208
74. Wu BU, Bakker OJ, Papachristou GI, et al. Blood urea nitrogen in the early assessment of acute pancreatitis: an international validation study. Arch Intern Med [Internet]. 2011 [consultado el 2 de junio de 2020];171(7):669‐676. Disponible: https://jamanetwork.com/journals/jamainternalmedicine/full article/227077
75. Petrov, M. S., Shanbhag, S., Chakraborty, M., Phillips, A. R. J., & Windsor, J. A. Organ Failure and Infection of Pancreatic Necrosis as Determinants of Mortality in Patients With Acute Pancreatitis. Gastroenterology [Internet]. 2010 [consultado el 2 de junio de 2020]; 139(3), 813–820. Disponible: https://www.gastrojournal.org/article/S0016-5085(10)00864- 4/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.go v%2F20540942%2F66. Yi F, Ge L, Zhao J, et al. Meta-analysis: total parenteral nutrition versus total enteral nutrition in predicted severe acute pancreatitis. InternMed [Internet] 2012 [consultado el 2 de junio de 2020]. 51:523–530. Disponible en: https://www.jstage.jst.go.jp/article/internalmedicine/51/6/51 _6_523/_article
76. Stigliano S, Sternby H, de Madaria E, Capurso G, Petrov M. Early management of acute pancreatitis: A review of the best evidence. DigLiverDis [Internet] 2017 [consultado el 2 de junio de2020]. 49(6):585‐594. Disponible en: https://www.dldjournalonline.com/article/S1590- 8658(17)30196-2/fulltext
77. BasurtoOna X, Rigau Comas D, Urrútia G. Opioids for acute pancreatitis pain. Cochrane Database of Systematic Reviews 2013, Issue 7. Art. No.: CD009179. Disponible en: https://www.cochranelibrary.com/cdsr/doi/10.1002/1465185 8.CD009179.pub2/full
78. Freeman ML, Werner J, van Santvoort HC, et al. Interventions for necrotizing pancreatitis: summary of a multidisciplinary consensus conference. Pancreas [Internet] 2012 [consultado el 2 de junio de 2020]. 41(8):1176‐1194. Disponible en: https://insights.ovid.com/article/00006676- 201211000-00004
79. Baron TH, DiMaio CJ, Wang AY, Morgan KA. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology [Internet] 2020 [consultado el 2 de junio de 2020]. 158(1):67‐ 75.e1. Disponible en: https://www.gastrojournal.org/article/S0016-5085(19)41293- 6/pdf
80. Dalsania R, Willingham F. Treatment of walled-off pancreatic necrosis. CurrOpinGastroenterol [Internet] 2019 [consultado el 2 de junio de 2020]. 35(5):478‐482. Disponible en: https://journals.lww.com/co- gastroenterology/Abstract/2019/09000/Treatment_of_walled _off_pancreatic_necrosis.13.aspx
81. Rana S, Shah J, Kang M, Gupta R. Complications of endoscopic ultrasound-guided transmural drainage of pancreatic fluid collections and their management. Ann Gastroenterol [Internet] 2019 [consultado el 2 de junio de 2020]. 32(5):441‐450. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6686089/pdf /AnnGastroenterol-32-441.pdf
82. Guo J, Saftoiu A, Vilmann P, et al. A multi-institutional consensus on how to perform endoscopic ultrasound-guided peri-pancreatic fluid collection drainage and endoscopic necrosectomy. EndoscUltrasound [Internet] 2017 [consultado el 2 de junio de 2020]. 6:285-291. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5664848/pdf /EUS-6-285.pdf
83. Gulen B, Dur A, Serinken M, Karcioglu O, Sonmez E. Pain treatment in patients with acute pancreatitis: a randomized controlled trial. Turk J Gastroenterol [Internet] 2016 [consultado el 2 de junio de 2020]. 27:192-6. Disponible en: https://europepmc.org/article/med/27015624

