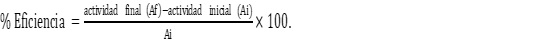Introducción
La intensificación de las actividades agrícolas, ganaderas e industriales ha provocado el aumento y acumulación de residuos (Yusuf, 2017). Se estima que tan solo los residuos agrícolas derivados de la producción de trigo y de arroz fueron de entre 673.3 y 709.2 millones de toneladas métricas (t) en la década de los 90, sin contar las aproximadamente 147.2 millones t de otros residuos industriales (Sadh, Duhan & Duhan, 2018).
Los residuos agroindustriales son muy variables en su composición, ya que contienen polisacáridos complejos, proteínas, carbohidratos y componentes polifenólicos, por lo que deberían considerarse como materia prima para otros procesos industriales en lugar de ser considerados como desechos (Sadh et al., 2018), y ser utilizados como sustrato para el crecimiento de microorganismos para la producción de bioetanol, enzimas, saborizantes, azucares reductores y sus derivados (Nguyen et al., 2010; Sadh et al., 2018).
Actualmente las agroindustrias no solo son valoradas por su desempeño productivo y económico sino también por su relación con el medio ambiente, de manera que la protección de éste ya no solo es una exigencia sujeta a multas o sanciones, puesto que representa una amenaza u oportunidad y hasta condiciona su permanencia o salida del mercado. La utilización eficaz, de bajo costo y ecológica racional de los residuos que producen estas industrias es cada vez más importante, sobre todo por las restricciones legales que ya empiezan a surtir efecto en muchos países (Wadhwa & Bakshi, 2013).
Además, la agroindustria debe ser sensible a los temas ambientales y procurar el desarrollo de la conciencia social, que obliga a producir de una manera sostenible; y a considerar los subproductos agroindustriales generados desde la siembra, manejo y comercialización como parte de sistemas cíclicos donde no se produzca la acumulación de residuos (Yepes, Montoya, & Orozco, 2008). Por ello, surge la necesidad de conversión de los residuos agroindustriales en un producto útil y con valor agregado, que además de solucionar un problema genere incentivos económicos; de ahí la importancia del estudio de alternativas tecnológicas para el aprovechamiento de los residuos agroindustriales (Mirabella, Castellani, & Sala, 2014; Yepes et al., 2008).
Entre los usos alternos que puede darse a los residuos agroindustriales está la producción de α-amilasas. Dichas enzimas tienen aplicaciones en muchos sectores, como en la química clínica, medicinal y analítica, en las industrias de panadería, elaboración de cerveza, detergentes, textiles, papel, así como en las destilerías (Pandey, Selvakumar, Soccol, & Nigam, 1999). A pesar de las aplicaciones, el costo de producción de las α-amilasas por métodos sintéticos es alto, por lo que la fermentación en estado sólido de los residuos agrícolas podría reducirlos significativamente (Castilho, Polato, Baruque, Sant’Anna, & Freire, 2000; Castro, Carvalho, Freire, Castilho, 2010) y convertirlos en una técnica económicamente atractiva para el sector industrial (Pandey et al., 1999). Por otro lado, la inmovilización de enzimas puede favorecer la estabilidad de las α-amilasas y permite que sean recuperadas y reutilizadas, lo que reduciría aún más su costo (Cowan & Fernández-Lafuente, 2011; Liese & Hilterhaus, 2013).
Múltiples especies de hongos anamorfos han sido reportadas como productoras de amilasas a partir de desechos agrícolas. Por ejemplo Singh, Singh, Bali, Sharma y Mangla (2014) reportaron que las α-amilasas de Aspergillus fumigatus producidas a partir de la fermentación en estado sólido del salvado de trigo, paja de arroz, bagazo de caña de azúcar, cáscara de granada, plátano y piña tienen potencial aplicación en el procesamiento húmedo de textiles. Y en otros estudios como el de Melnichuk, Braia, Anselmi, Meini y Romanini (2020) reportan que la producción de enzimas de Aspergillus oryzae a partir de los residuos de cascara de soja y de la industria de harinas podría evitar que se quemen estos abundantes deshechos agrícolas.
En este trabajo se evaluó la producción de amilasas a partir de residuos agrícolas, utilizando 20 cepas nativas de hongos anamorfo provenientes del cepario de hongos del Departamento de Microbiología, Facultad de Ciencias Químicas y Farmacia de la USAC, dichas cepas se inocularon en cascarilla de arroz para producir las enzimas por medio de fermentación en estado sólido (FES) y posteriormente, se evaluó el efecto de la inmovilización de las amilasas en esferas de alginato de sodio. La importancia de esta investigación radica en dar a conocer el potencial biotecnológico de los hongos anamorfos nativos para la utilización de residuos agroindustriales, a través de la producción de amilasas para la generación de azúcares reductores que puedan ser utilizados en la producción de etanol y biocombustibles así como en la manufactura de otros productos.
Materiales y métodos
Origen y reactivación de cepas
Las cepas de hongos anamorfos se obtuvieron de la colección de hongos saprobios y micorrícicos del Departamento de Microbiología de la Facultad de Ciencias Químicas y Farmacia de la USAC, y provienen del Astillero Municipal de Tecpan-Guatemala, Chimaltenango y del Parque Ecológico Senderos de Alux, Sacatepéquez, Guatemala. Las cepas se reactivaron en los medios agar papa dextrosa (PDA) y agar extracto de restos del bosque (AERB). Se incubaron durante 15 días a 25 °C y posteriormente se tomaron círculos de 0.5 cm de diámetro de cada una de las cepas fúngicas y se transfirieron en condiciones de esterilidad a agar almidón, para su adaptación y propagación para los ensayos posteriores (Lagunes et al., 2015).
Fermentación en estado sólido para la producción enzimática
A partir de la biomasa de las cepas fúngicas desarrolladas en agar almidón, se preparó una solución madre de las esporas de cada una de las cepas en Tween 80 al 0.1 %, de la cual se preparó una solución de 1x106 esporas/ml en solución de cloruro de sodio al 0.9% p/v. Se agregó 1.0 ml de la solución anterior en Erlenmeyers con 5.0 g de salvado de arroz y 5.0 ml de agua destilada, dicha solución fue incubada a 28 ºC durante 20 días. Todo en condiciones asépticas (Pandey, Soccol, & Mitchell, 2000).
Extracción de las amilasas
Una vez completado el periodo de incubación, se agregaron 50.0 ml de NaCl al 1.0 % a los Erlenmeyer del paso anterior, posteriormente se agitaron en una incubadora de rotación orbital durante 30 min y luego se filtró el extracto enzimático con membranas de 8.0 µm, 0.80 µm y 0.45 µm (Lonsane & Ramesh, 1990).
Evaluación de la actividad amilolítica
La actividad amilolítica de las enzimas extraídas en el paso anterior fue evaluada adicionando 10.0 µl del extracto enzimático a 0.5 ml de una solución de almidón soluble. La desaparición del sustrato fue medida por espectrofotometría luego de la reacción del yodo y yoduro con el almidón a 640 nm (de Castro, de Andréa, Castilho, & Freire, 2010). La cuantificación se realizó en unidades amilolíticas por decilitro (UA/dl), las unidades amilolíticas son la cantidad de enzima contenida en 100.0 ml de muestra, que puede hidrolizar 10.0 mg de almidón en 30 min.
Inmovilización de las amilasas
Las enzimas del extracto enzimático obtenidas en el filtrado fueron inmovilizadas con alginato de sodio. Para realizar la inmovilización se agregaron 10.0 ml del extracto enzimático a 100.0 ml de alginato de sodio al 1.0 %, esta solución fue homogenizada, a partir de ella se agregaron gotas de 20.0 µl con una micropipeta en una solución de CaCl2 0.2 M. Las esferas formadas se dejaron estabilizar durante una hora en la solución de CaCl2 0.2 M, posteriormente fueron lavadas con buffer de acetato de sodio 0.1 M (Ertan, Yagar, & Balkan, 2007).
Evaluación de la actividad amilolítica de las enzimas inmovilizadas
Se transfirieron 10.0 g de las esferas con las enzimas fúngicas inmovilizadas de cada una de las cepas en 100.0 ml del medio líquido con almidón soluble en Erlenmeyers de 250.0 ml y se incubaron a 37 ºC con agitación constante durante 20 min. Se realizaron cinco repeticiones por cada cepa. La actividad enzimática fue evaluada a través de la determinación de la actividad amilolítica cada 5 min con la toma de muestras de 1.0 ml durante los 20 min que duró la incubación. La desaparición del sustrato fue evaluada por un método espectrofotométrico basado en la reacción del yodo y yoduro con el almidón a 640 nm (Ertan et al., 2007) La cuantificación se realizó en unidades amilolíticas por decilitro (UA/ml).
Análisis estadístico
El análisis se llevó a cabo por medio de un diseño de bloques aleatorios completos de las 20 cepas nativas a evaluar, con cinco repeticiones sucesivas; las actividades enzimáticas se midieron en unidades internacionales por decilitro (UI/dl). Se calculó la media y la desviación estándar para cada cepa fúngica. Para evidenciar si existía o no diferencia de la actividad amilolítica entre las 20 cepas, se realizó un análisis de varianza (anova) y una prueba posterior de comparación de medias de Duncan, con el .05 de significancia. Los resultados fueron procesados en Excel 2013 y el programa R® (Zaferanloo, Bhattacharjee, Ghorbani, Mahon, & Palombo, 2014).
Para evaluar el efecto de la inmovilización en las amilasas se determinó el porcentaje de eficiencia de las enzimas inmovilizadas en alginato de sodio frente a las producidas directamente en salvado de arroz utilizando la siguiente ecuación:
Resultados
Al evaluar la actividad amilolítica de
las 20 cepas de hongos anamorfos se determinó que todas las cepas produjeron
amilasas. Sin embargo, las amilasas de Aspergillus sp. SL15319
mostraron la mayor actividad media (desviación estándar), tanto libres, 930.26 (1.56) UA/dl, como inmovilizadas, 900.34 (3.21) UA/dl, seguido
por las de Beltrania rhombica, 905.02 (10.72) y 879.07 (3.87) UA/dl y Aspergillus sp. SL15119, 907.46 (5.17)
y 875.95 (9.39) UA/dl, respectivamente. Las que mostraron menor
actividad fueron Chaetopsina splendida
SL10519, 39.44 (28.02) y 46.44 (6.87) UA/dl y Brachysporiella sp. SL10319, 44.29 (37.48) y 32.33 (26.55) UA/dl (p < .05), respectivamente (Tabla 1).
Tabla 1
Capacidad amilolítica de las enzimas fúngicas libres e
inmovilizadas en alginato de calcio sobre cascarilla de arroz
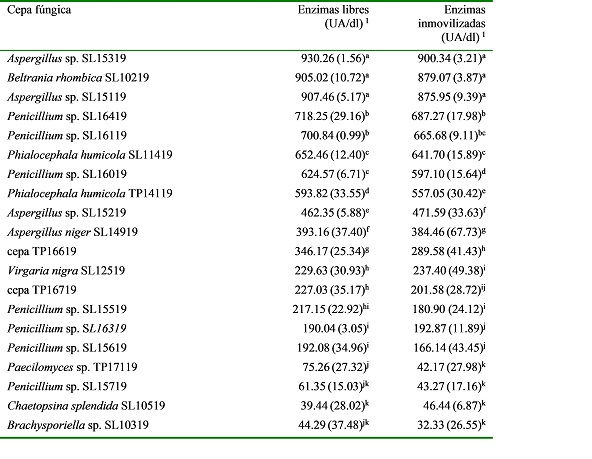 1Unidades amilolíticas por decilitro, Media (desviación
estándar); Letras distintas en la misma columna indican diferencia
estadísticamente significativa, de acuerdo con la prueba de comparaciones
múltiples de Duncan (p < .05).
1Unidades amilolíticas por decilitro, Media (desviación
estándar); Letras distintas en la misma columna indican diferencia
estadísticamente significativa, de acuerdo con la prueba de comparaciones
múltiples de Duncan (p < .05).
No se
observó diferencia significativa entre la actividad amilolítica de las enzimas
libres e inmovilizadas de la mayoría de las cepas (80 %). Se estableció que mostraron
diferencia significativa entre las actividades de las amilasas libres e
inmovilizadas de Penicillium sp. SL16119, P.
humicola TP14119, Penicillium sp. SL15619 y la cepa TP16619 (Figura
1).
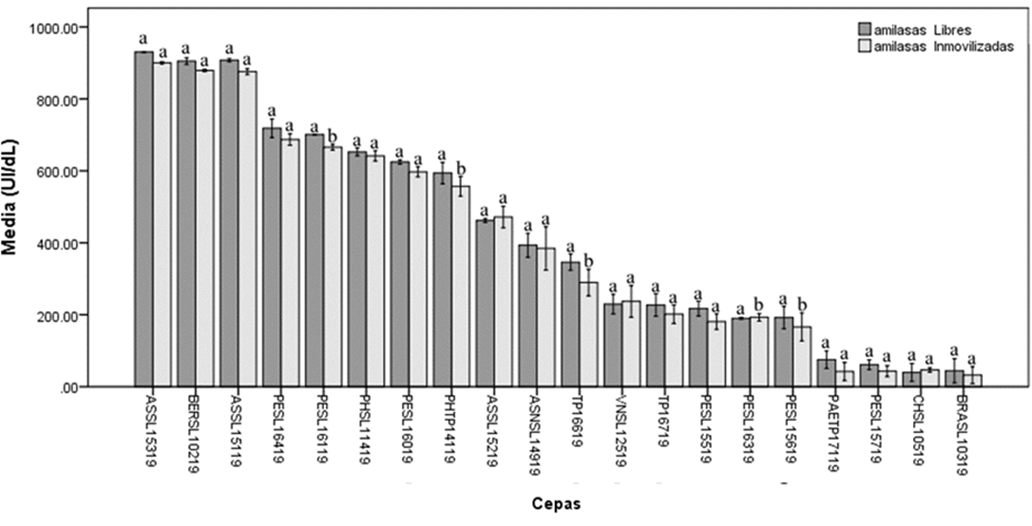 Figura1. Actividad
amilolítica de las amilasas fúngicas libres e inmovilizadas sobre cascarilla de
arroz. Letras iguales entre la actividad de la enzima libre e inmovilizada
obtenida por cada cepa, indican ausencia de diferencia significativa de acuerdo
con la prueba de comparaciones múltiples
de Duncan (p < .05).
Figura1. Actividad
amilolítica de las amilasas fúngicas libres e inmovilizadas sobre cascarilla de
arroz. Letras iguales entre la actividad de la enzima libre e inmovilizada
obtenida por cada cepa, indican ausencia de diferencia significativa de acuerdo
con la prueba de comparaciones múltiples
de Duncan (p < .05).
Discusión
Todas las cepas estudiadas produjeron amilasas utilizando como sustrato cascarilla de arroz. Aliyah, Alamsyah, Ramadhani y Hermansyah (2017) usando el mismo sustrato, encontraron actividades de 659.5 UA/dl para una cepa de A. niger, cantidad mayor a la obtenida por la misma especie nativa de A. niger SL14919; sin embargo, otras cepas de Aspergillus (Aspergillus sp. SL15319, Aspergillus sp. SL15119) mostraron actividades mayores, así como también Beltrania rhombica SL10219, Penicillium sp. SL16419 y Penicillium sp. SL16119. Estos resultados las hacen promisorias para ser utilizadas como productoras de amilasas para fines industriales y en la degradación de desechos agrícolas. Se recomienda probar otros sustratos que sean desechos agrícolas abundantes en Guatemala para la producción de alfa amilasas fúngicas, como el bagazo de caña o el raquis del maíz.
Con relación a la inmovilización de las enzimas en alginato de calcio no se observó diferencia significativa entre la actividad amilolítica de las enzimas libres e inmovilizadas en la mayoría de las cepas, lo que es importante, tomando en consideración que en la inmovilización se busca que la actividad de la enzima se mantenga (cambios de temperatura, pH y otros factores de su entorno) y que incluso pueda reutilizarse, sin un proceso de purificación posterior (Santos, Sarrouh, Rivaldi, Converti, & Silva, 2008). Por ejemplo, He y colaboradores (2017) utilizando otra técnica de inmovilización lograron mantener la estabilidad de α-amilasas respecto a cambios de temperatura y pH. Por lo anterior se recomienda efectuar estudios de los factores que afectan la actividad de la enzima.
La disminución en la actividad amilolítica de algunas cepas evaluadas en este estudio puede deberse al atrapamiento en el alginato de calcio el cual es un proceso físico donde el sitio activo de la enzima inmovilizada puede estar bloqueado por la matriz o la esfera de alginato, lo que ocasionaría la reducción de la actividad de la enzima (Sethi, Jana, Nanda, & Dasmohapatra, 2016). Aunque la actividad puede reducirse, al inmovilizar amilasas de Fusarium solani en esferas de alginato de calcio Kumar, Muthukumar y Garg (2012) encontraron una actividad menor al de las enzimas libres (81%), sin embargo, determinaron que las enzimas inmovilizadas funcionaban mejor que las libres a 40 ºC y su actividad se mantenía hasta por 180 min, mientras que la actividad de las enzimas libres se vio disminuida en un 80% en 60 min.
Aunque la inmovilización no modifica o en algunos casos disminuye la actividad es recomendable realizarla, debido a la estabilidad que brinda frente a las fluctuaciones de temperatura, pH y otros factores. Además, ayuda a mantener la actividad durante mayor tiempo que las enzimas libres (Ertan, et al., 2007).
Esta investigación no solo contribuye a la búsqueda de alternativas para el aprovechamiento de los residuos agrícolas para la obtención de compuestos de interés industrial a través de la producción de amilasas, para la obtención de bienes y servicios de índole económico, sino que además resulta de beneficio para resaltar el valor agregado que poseen los hongos anamorfos de Guatemala como productores de enzimas a nivel local, por lo que se hace necesario continuar haciendo estudios de este tipo que contribuyan al desarrollo de la biotecnología en Guatemala.
Agradecimientos
Los autores expresan su agradecimiento a la Dirección General de Investigación
(DIGI) de la Universidad de San Carlos de Guatemala por el cofinanciamiento del
presente estudio (DIGI-USAC-4.8.63.6.71-2019), a la Facultad de Ciencias
Químicas y Farmacia y a la Facultad de Agronomía de la Universidad de San
Carlos de Guatemala por el apoyo y aval otorgado.
Referencias
Aliyah, A., Almsyah, G., Ramadhani, R., & Hermansyah, H. (2017). Production of α-Amylase and β-Glucosidase from Aspergillus niger by solid state fermentation method on biomass waste substrates from rice husk, bagasse and corn cob. Energy Procedia, 136, 418-423. doi: 10.1016/j.egypro.2017.10.269
Castilho, L. R., Polato, C. M. S., Baruque, E. A., Sant’Anna, G. L., & Freire, D. M. G. (2000). Economic analysis of lipase production by Penicillium restrictum in solid-state and submerged fermentations. Biochemical Engineering Journal, 4(3), 239-247. doi: 10.1016/S1369-703X(99)00052-2
de Castro, A. M., de Andréa, T. V., Castilho, L., & Freire, D. M. G. (2010). Use of mesophilic fungal amylases produced by solid-state fermentation in the cold hydrolysis of raw babassu cake starch. Applied biochemistry and biotechnology, 162(6), 1612-1625.
Castro, A. M., Carvalho, D. F., Freire, D. M. G., & Castilho, L. R. (2010). Economic analysis of the production of amylases and other hydrolases by Aspergillus awamori in solid-state fermentation of babassu cake. Enzyme Research, 576872, 1-9. doi: 10.4061/2010/576872
Cowan, D. A., & Fernandez-Lafuente, R. (2011). Enhancing the functional properties of thermophilic enzymes by chemical modification and immobilization. Enzyme and Microbial Technology, 49(4), 326-346. doi: 10.1016/j.enzmictec.2011.06.023
Ertan, F., Yagar, H., & Balkan, B. (2007). Optimization of α-amylase immobilization in calcium alginate beads. Preparative Biochemistry and Biotechnology, 37(3), 195-204. doi: 10.1080/10826060701386679.
He, L., Mao, Y., Zhang, L., Wang, H., Alias, S. A., Gao, B., & Wei, D. (2017). Functional expression of a novel α -amylase from Antarctic psychrotolerant fungus for baking industry and its magnetic immobilization. Biotechnology, 17(22), 1-13. doi: 10.1186/s12896-017-0343-8
Kumar, D., Muthukumar, M., & Garg, N. (2012). Kinetics of fungal extracellular D -amylase from Fusarium solani immobilized in calcium alginate beads. Journal of Environmental Biology, 33(6), 1021-1025.
Lagunes, M., López, A., Ramos, A., Trigos, A., Salinas, A., & Espinoza, C. (2015). Actividad antibacteriana de extractos metanol:cloroformo de hongos fitopatógenos. Revista Mexicana de Fitopatología, 33(1), 87-94.
Liese, A., & Hilterhaus, L. (2013) Evaluation of immobilized enzymes for industrial applications. Chemical Society Reviews, 42(15), 6236-6249. doi: 10.1039/C3CS35511J
Lonsane, B.K., & Ramesh, M.V. (1990). Production of Bacterial Thermostable α-Amylase by Solid-State Fermentation: A Potential Tool for Achieving Economy in Enzyme Production and Starch Hydrolysis. Advances in Applied Microbiology, 35, 1-56. doi: 10.1016/S0065-2164(08)70242-9
Melnichuk, N., Braia, M. J., Anselmi, P. A., Meini, M. R., & Romanini, D. (2020). Valorization of two agroindustrial wastes to produce alpha-amylase enzyme from Aspergillusoryzae by solid-state fermentation. Waste Management, 106, 155-161. doi: 10.1016/j.wasman.2020.03.025
Mirabella, N., Castellani, V., & Sala, S. (2014). Current options for the valorization of food manufacturing waste: a review. Journal of Cleaner Production, 65, 28-41. doi: 10.1016/j.jclepro.2013.10.051
Nguyen, T., Kim, K., Han, S., Cho, H., Kim, J., Park, S., ... Sim, S. (2010). Pretreatment of rice straw with ammonia and ionic liquid for lignocellulose conversion to fermentable sugars. Bioresource Technology, 101(19), 7432-7438. doi:10.1016/j.biortech.2010.04.053.
Pandey, A., Selvakumar, P., Soccol C. R., & Nigam P. (1999). Solid state fermentation for production of industrial enzymes. Current Science, 77, 149-162.
Pandey, A., Soccol, C., & Mitchell, D. (2000). New developments in solid state fermentation: I-bioprocesses and products. Process Biochemistry, 35(10), 1153-1169. doi: 10.1016/S0032-9592(00)00152-7.
Sadh, P., Duhan, S., & Duhan, J. (2018). Agro-industrial wastes and their utilization using solid state fermentation: a review. Bioresources and Bioprocessing, 5(1), 1-15. doi: 10.1186/s40643-017-0187-z.
Santos, D. T., Sarrouh, B. F., Rivaldi, J. D., Converti, A., & Silva, S. S. (2008). Use of sugarcane bagasse as biomaterial for cell immobilization for xylitol production. Journal of Food Engineering, 86(4), 542-548. doi: 10.1016/j.jfoodeng.2007.11.004
Sethi, B. K., Jana, A., Nanda, P. K., & Dasmohapatra, P. K. (2016). Production of α -Amylase by Aspergillus terreus NCFT 4269.10 Using Pearl Millet and Its Structural Characterization. Frontiers in Plant Science, 7(639), 1-13. doi: 10.3389/fpls.2016.00639
Singh, S., Singh, S., Bali, V., Sharma, L., & Mangla, J. (2014). Production of fungal amylases using cheap, readily available agriresidues, for potential application in textile industry. BioMed Research International, 48, 1-9. doi: 10.1155/2014/215748
Wadhwa, M., & Bakshi, M. (2013). Utilization of fruit and vegetable wastes as livestock feed and as substrates for generation of other value added products. Bangkok, Tailandia: RAP publication.
Yepes, S., Montoya, L., & Orozco, F. (2008). Valorización de residuos agroindustriales -frutas- en Medellín y el Sur del Valle del Aburrá, Colombia. Revista de la Facultad Nacional de Agronomía Medellín, 61(1), 4422-4431.
Yusuf, M. (2017). Agro-industrial wastes materials and their recycled value-added applications: Revision. En L. Martínez, O. Kharissova & B. Kharisov (Eds). Handbook of Ecomaterials (pp. 1-9). Cham: Springer.
Zaferanloo, B., Bhattacharjee, S., Ghorbani, M., Mahon, P., & Palombo, E. (2014). Amylase production by Preussia minima, a fungus of endophytic origin: optimization of fermentation conditions and analysis of fungal secretome by LC-MS. BMC Microbiology, 14(55), 1-12. doi: 10.1186/1471-2180-14-55.