Introducción
Las tortugas marinas son un grupo de vertebrados con una serie de adaptaciones para el hábitat marino, como la forma hidrodinámica de su cuerpo; extremidades planas en forma de remo para una mayor eficiencia y rapidez de nado; caparazón de queratina y pocos elementos óseos que les permite defenderse de los depredadores; un sistema interno que le permite bucear y permanecer sumergido por largos lapsos de tiempo (Chacón, Sánchez, Calvo, & Ash, 2007; Frazier, 1999; Meylan & Meylan, 1999). Otra característica distintiva de las tortugas marinas es que regresan a las playas para depositar sus huevos, en donde se lleva a cabo el proceso de incubación para el surgimiento de sus crías (Frazier, 1999; Hendrickson, 1980).
La parlama (Lepidochelys olivacea) es la tortuga marina más pequeña dentro de las siete especies de tortugas marinas que existen en el mundo, presentando una relativamente alta frecuencia de anidación a nivel mundial (Gulko & Eckert, 2004; Pritchard & Mortimer, 2000). Esta especie anida a lo largo de la costa del Pacífico de Guatemala, durante los meses de julio a noviembre (Consejo Nacional de Áreas Protegidas [CONAP], 2009). Desafortunadamente, se presume que esta especie se encuentra afectada negativamente por actividades humanas como la sobreexplotación de los huevos (Ga-Young & Eckert, 2009), la alteración de las áreas de anidación (Hu, Hu, & Huang, 2018; Vega & Robles, 2005) o la captura incidental (Vega & Robles, 2005), las cuales posicionan a la parlama en estado vulnerable ante la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN) (Hinestroza & Páez, 2000; Viejobueno & Arauz, 2014).
A lo largo de la costa del Pacífico guatemalteco no existen nidos naturales debido a la depredación por humanos, resultando en la relocalización de los huevos en los tortugarios (Morales-Mérida, 2013). En Guatemala, debido a la alta comercialización de los huevos de parlama, se instituyó Resolución No. 01-21-2012 por el Consejo nacional de áreas protegidas [CONAP], en el que se aclara que los recolectores de huevos de parlama deben donar el 20% del nido hacia el tortugario local autorizado legalmente (CONAP, 2015).
En este sentido, la obtención de información no solo de las poblaciones de parlama en el país, sino también respecto a la biología de anidación, es de gran importancia para monitorear la efectividad de los programas de conservación.
Existe una serie de parámetros que son fundamentales para tener un mejor entendimiento de la demografía de las poblaciones, tales como el tamaño, edad, tasa de crecimiento y el potencial reproductivo de los individuos (Broderick, Glen, Godley, & Hays, 2003). El número de huevos depositados durante la anidación es un indicador del potencial reproductivo (Brown & Shine, 2009).
Se han realizado múltiples estudios que establecen una relación entre el tamaño de la tortuga y la cantidad de huevos depositados. Sin embargo, la relación no está clara para el caso de la parlama en el país (Bjorndal & Carr, 1989; Broderick, et.al., 2003; Frazer & Richardson, 1986; Pinckney, 1990). Estudios acerca de una posible relación entre el momento de anidación y la cantidad de huevos depositados han sido mucho más escasos (Carr & Hirth, 1962; Broderick, et.al., 2003).
En este estudio se buscó: 1) determinar si existía una relación entre el tamaño de la parlama (ancho curvo de caparazón) y el número de huevos; y 2) de explorar el tipo de relación existente entre el tamaño de la parlama (ancho curvo de caparazón) y el número de huevos con el momento (día dentro de la temporada) donde los huevos fueron puestos. Por cada nido se generó información básica acerca de la especie, así como datos que pueden ser utilizados para implementar acciones de conservación en futuro cercano.
Materiales y métodos
Área de estudio
Este estudio prospectivo observacional se realizó en los meses de junio a octubre del año 2017, a lo largo de 6 km de playa dentro del Área Protegida de Usos Múltiples Hawaii, en el departamento de Santa Rosa, Guatemala. Esta es un área protegida que busca proteger y conservar el ecosistema del manglar, áreas de humedales y zona marino costera que cuentan con una amplia y rica variedad de biodiversidad (Asociación de Rescate y Conservación de Vida Silvestre [ARCAS] & CONAP, 2010).
Se encuentra ubicada en la Aldea Hawaii, en el municipio de Chiquimulilla, Santa Rosa; latitud 13° 51’ 58.50” y longitud 90° 24’ 40.87” y con un área aproximada de 8 km2 (Zelaya, 2016). El clima característico de la región es cálido húmedo, con una época lluviosa que abarca desde mayo hasta principios de octubre. La temperatura media mensual oscila entre 23.9 ° y 30 °C, con una temperatura máxima anual de 27 °C aproximadamente. La humedad media oscila entre el 68 y 85 %, con un promedio de 76 %. El alto contenido de humedad y las temperaturas altas son comunes en Hawaii y su variación es mínima (ARCAS & CONAP, 2010).
Toma de datos
En Guatemala aún no hay datos poblacionales de las tortugas que anidan en las playas por lo que los trabajos se basan en esfuerzo de muestreo más que en número de muestra. Debido a esto, la muestra consistió en dos patrullajes diarios de 2 a 3 h cada uno, a lo largo de 6 km de playa dentro del área protegida, durante 20 noches.
Durante 20 noches se realizaron patrullajes nocturnos y se recolectó información respecto al largo y ancho curvo del caparazón (LCC y ACC respectivamente) de 74 hembras anidadoras, el número de huevos puestos, el momento de anidación (asociada con la fecha de oviposición durante la temporada de anidación de la tortuga).
Análisis de datos
A partir de los datos colectados, se realizó una serie de modelos lineales generalizados con el programa estadístico de R, versión 3.5.2. Estos modelos compararon la posibilidad de una relación entre el ancho curvo del caparazón de las tortugas anidadoras y el momento en la temporada en que anidó la tortuga, como un efecto directo del tamaño de la nidada (número de huevos puestos). Con base en el estadístico de criterio de evaluación de Akaike (p = .05) utilizado en R, se determinó el modelo más adecuado de la comparación entre 4 modelos generados. De todos los modelos obtenidos, el modelo que más se adecuó fue la comparación entre el ancho (ACC), junto con el momento de oviposición durante la temporada y la interacción de este momento elevado al cuadrado (AIC: 617.14). Después de la comparación entre modelos se utilizó una correlación de Spearman y el paquete estadístico effects para analizar el tipo de relación que se presentaba entre el ancho curvo del caparazón y el momento de anidación (fecha) con el número de huevos puestos.
Resultados
El promedio de tamaño del ancho curvo del caparazón (ACC) fue de 70.7cm (Desviación Estándar: 2.60) cm con un IC 95 % [63.5 a 77cm] y del número de huevos puestos por nido de 92 (D.E: 15.67), IC 95 % [59 a 120 huevos]. De los modelos lineales generalizados, se analizaron múltiples modelos, consistiendo cada uno en diferentes combinaciones de las variables utilizadas para el estudio y transformaciones de las mismas. Se seleccionó el modelo que mejor explicara la relación con la variable de respuesta, presentando el valor mínimo del estimador del criterio de información de Akaike (AIC) (Takane & Bozdogan, 1987). El mejor modelo obtuvo un valor de AICc=617.14 para las variables de ancho, momento de oviposición y la elevación del momento de oviposición al cuadrado (3.715e+00x + 1.670e-04 -4.932e-06; p= 1.12e-3).
Se obtuvo una relación directa leve entre el ancho curvo del caparazón con el número de huevos, con un coeficiente de correlación de 0.409 (p=2.942e-4) (Figura 1 y Tabla 1). Esta relación se observó también en el análisis del paquete effects (Tabla 2), en el que los datos presentaron un efecto polinomial de segundo orden, el cual llevó a un incremento en el número de huevos conforme la temporada de anidación progresaba, resultando en un pico a mitad de la temporada de anidación con un patrón de descenso hacia el final de la misma.
Tabla 1.
Ancho curvo del caparazón (ACC) y tamaño de la nidada analizada por el paquete effects.
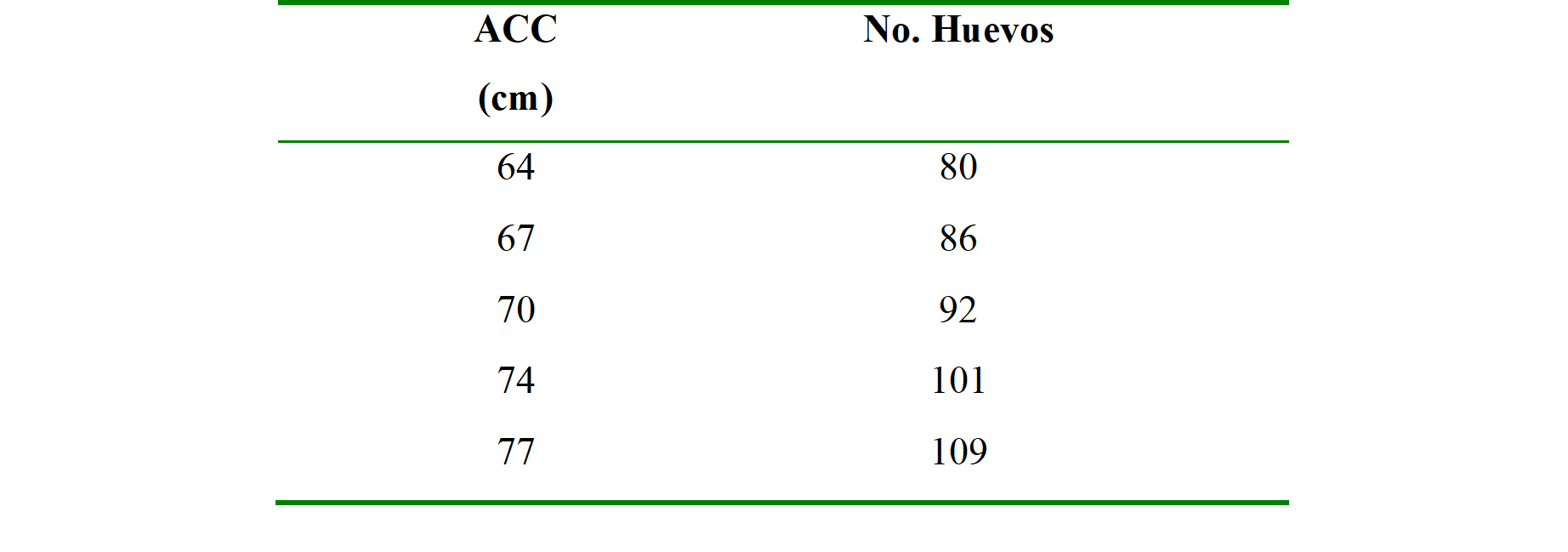
Tabla 2.
Momento de anidación y el tamaño de la nidada analizada por el paquete effects.

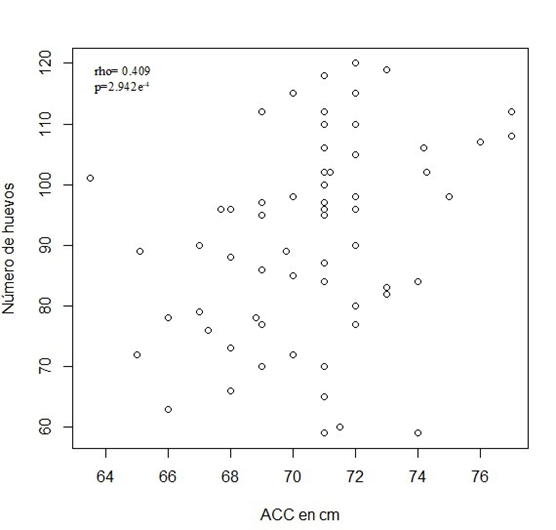 Figura 1. Relación entre el ancho curvo del
caparazón de la hembra anidadora y el número de
huevos puestos
Figura 1. Relación entre el ancho curvo del
caparazón de la hembra anidadora y el número de
huevos puestos
Durante la temporada de anidación se
observó un pico a mitad de la temporada de anidación con un patrón de descenso
hacia el final de esta (Tabla 2). Este cuadro sintetiza el patrón observado en
el conjunto de datos ejemplificando mejor la relación, describiendo al momento
de anidación como las fechas de oviposición a lo largo de la temporada de
anidación, tomando en cuenta el 1 de Julio como número 1 y así sucesivamente
hasta el 31 de diciembre, el cual es considerado número 184.
Discusión
Los hallazgos de este estudio sugieren una relación directa entre el ancho curvo del caparazón de la tortuga anidadora y el número de huevos puestos por nido por la tortuga (Figura 1, Tabla 1), concordando con lo descrito en estudios previos tanto para la especie (Hinestrosa & Páez, 2000; Barrientos, Ramírez, & Páez, 2014), como para otras tortugas marinas. Estudios realizados con Caretta caretta, por Frazer y Richardson (1986), en Isla Little Cumberland; Bjorndal y Carr (1989), en Costa Rica; Hays y Speakman (1991), en Greek Island; y Pinckney (1990), en Isla Kiawah; reportaron una relación directa entre el número de huevos puestos y el ancho curvo del caparazón de las tortugas. Tanto Bjorndal y Carr (1989), con Chelonia mydas, en Costa Rica, y Broderick, et al., (2003), con hembras anidadoras de Chelonia mydas y Caretta caretta en Cyprus, obtuvieron que el tamaño de la nidada incrementaba con el tamaño de la tortuga para ambas especies. Para las tortugas Dermochelys coriacea en Costa Rica, Ros (2013), también reportó una relación directa entre el tamaño del carapacho, tanto en largo como en ancho, y el tamaño de la nidada.
El promedio del ancho de caparazón
para esta especie de tortuga marina reportado en este estudio (70.7cm)
concuerda con lo reportado para la especie (70.4 cm) (Brenes Arias, Bonilla Bonilla, Bonilla Salazar, & Vega Delgado, 2015). El promedio de tamaño de la nidada reportado en este estudio (92
huevos) es menor a lo reportado para esta especie en otras localidades, como
Costa Rica con un aproximado de 98 huevos por nidada y en Cuthbert
Bay, India, con un rango entre 110 a 121 huevos (Brenes Arias et al., 2015; Fatima, Andrews, John y Shanker, 2011). Sin embargo, continúa siendo un número alto
de huevos puestos por nidada. Un tamaño de nidada grande se considera de beneficio
energético para las hembras, minimizando el tiempo y energía invertida en la
playa por huevo puesto durante cada reanidación (Hays & Speakman, 1991).
Las parlamas, como el resto de las tortugas marinas, colocan varias nidadas a lo largo de una sola temporada de anidación, tomando de 2 a 4 años para su siguiente temporada de anidación (Miller, 1997). El número de nidadas por temporada permite separar el éxito reproductivo total en pequeños grupos, en un contexto en el que se presentan varios riesgos, como la depredación, erosión, duración de la temporada y la energía requerida para la reproducción (Le Gouvello, Nel, & Cloete, 2020; Ekanayake, Kapurusinghe, Saman, Rathnakumara, Samaraweera, & Rajakaruna, 2016). El momento de anidación durante la temporada, demostró que las parlamas ponen una menor cantidad de huevos al inicio de temporada de anidación, incrementando gradualmente y presentando su punto más alto a mitad de la temporada y posteriormente disminuyendo hasta llegar al final de la temporada (Tabla 2).
Carr y Hirth (1962), reportaron la presencia de una tendencia en la que nidadas iniciales presentan un mayor número de huevos que nidadas tardías en la temporada de anidación de Chelonia mydas en la Isla Ascensión. El incremento en el número de huevos a la mitad de la temporada, durante los meses de septiembre y octubre, podría relacionarse con el aumento de eficiencia o capacidad en el proceso relacionado con la vitelogénesis (Broderick, et al., 2003). Esto permite a la tortuga tener más espacio en la cavidad celómica para almacenar más cantidad de huevos, como sucede con las tortugas verdes (Chelonia mydas) y tortugas cabezonas (Caretta caretta) en el norte de Chipre (Broderick, et al., 2003); las cuales muestran una disminución en el número de huevos puestos conforme progresa la temporada de anidación.
Este estudio provee información morfológica sobre las poblaciones de parlama, al igual que aclara aspectos de su biología de anidación en el país. Se observa que las tortugas con un mayor ancho curvo de caparazón depositaron un mayor número de huevos. Asimismo, se describe un incremento progresivo en el número de huevos depositados mientras avanza la temporada de anidación, llegando a su máximo durante la mitad de esta. La información poblacional permitirá diseñar estrategias de conservación más eficaces al ejecutarse alrededor de los parámetros poblacionales de la parlama en el país, y concentrando los esfuerzos durante ventanas temporales específicas.
Agradecimientos
Se agradece el apoyo brindado a lo
largo de esta investigación, a los guardarecursos y a
todo el personal de la Asociación de Rescate y Conservación de Vida Silvestre
(ARCAS) Hawaii. y al Dr. Marc Girondot por los análisis y la guía
Referencias
Asociación de Rescate y Conservación de Vida Silvestre, & Consejo Nacional de Áreas Protegidas. (2010). Plan maestro area de uso múltiple Hawaii, 2010-2015. Guatemala: Autor
Barrientos, K., Ramírez, C., & Páez, V. (2014). Nesting Biology of the Olive Ridley Sea Turtle (Lepidochelys olivacea) (CHELONIIDAE) at El Valle Beach, Northern Pacific, Colombia. Acta Biológica Colombiana, 19(3), 437-445.
Bjorndal, K. & Carr, A. (1989). Variation in clutch size and egg size un the green turtle nesting population at tortuguero, Cost Rica. Herpetologica, 45(2), 181-189.
Brenes Arias, O., Bonilla Bonilla, L., Bonilla Salazar, A., & Vega Delgado, A. (2015). Características de la Anidación de Lepidochelys olivacea (Testudinata: Cheloniidae) entre el 2010 y 2012 en Playa Tortuga Ojochal de Osa, Puntarenas, Costa Rica. Revista de Biología Tropical, 63, 339-349.
Broderick, A., Glen, F., Godley, B., & Hays, G. (2003). Variation in reproductive output of marine turtles. Journal of Experimental Marine Biology and Ecology, 288(1), 95-109.
Brown, G. P., & Shine, R. (2009). Beyond size-number trade-offs: clutch size as a maternal effect. Philosophical Transactions of The Royal Society B: Biological Sciences, 364(1520), 1097–1106.
Carr, A. & Hirth, H. (1962). The Ecology and Migrations of Sea Turtles, 5 Comparative features od Isolates Green Turtle Colonies. American Museum Novitates. 2091, 1-42.
Consejo nacional de áreas protegidas (2009). Manual for conservation of sea turtles in Guatemala, with emphasis on the hatchery management. Guatemala: Wildlife Rescue and Conservation Asociation y Consejo Nacional de Áreas Protegidas
Consejo nacional de áreas protegidas (2015). Estrategia Nacional de Manejo y Conservación de Tortugas Marinas de Guatemala. Documento técnico No. 02-2015. Guatemala: Autor.
Chacón, D., Sánchez, J., Calvo, J., & Ash, J. (2007). Manual para el manejo y la conservación de las tortugas marinas en Costa Rica; con énfasis en la operación de proyectos en playa y viveros. San José, Costa Rica: Sistema Nacional de Áreas de Conservación y Ministerio de Ambiente y Energía.
Ekanayake, E., Kapurusinghe, T., Saman, M., Rathnakumara, D., Samaraweera, P., & Rajakaruna, R. (2016). Reproductive Output and Morphometrics of Green Turtle, Chelonia mydas Nesting at the Kosgoda Rookery in Sri Lanka. Ceylon Journal of Science,45(3), 103-116
Fatima, E., Andrews, H., John, S., & Shanker, K. (2011). Status of Marine Turtles in Cuthbert Bay, Middle Andaman Islands. Marine Turtles Newsletter.130, 6-9.
Ga-Young, C., & Eckert, K. (2009). Manual of best practices for safeguarding sea turtle nesting beaches (technical report no. 9). Ballwin, Missouri: Wider caribbean sea turtle conservation network.
Frazer, N., & Richardson, J. (1986). The relationship of clutch size and frequency to body size in loggerhead turtles, Caretta caretta. Journal of Herpetology, 20(1), 81-84
Frazier, J. (1999). Generalidades de la historia de vida de las tortugas marinas. Conservación de tortugas marinas en la región del gran caribe–un diálogo para el manejo regional efectivo. Reunión llevada a cabo en Santo Domingo, República Dominicana,
Gulko, D., & Eckert, K. (2004). Sea turtles: an ecological guide. Honolulu: Mutual Publications.
Hays, G. C., & Speakman, J. R. (1991). Reproductive investment and optimum clutch size of loggerhead sea turtles (Caretta caretta). The Journal of Animal Ecology, 60 (2),455-462.
Hendrickson, J. R. (1980). The ecological strategies of sea turtles. American Zoologist, 20(3), 597-608.
Hinestroza, L., & Páez, V. (2000). Anidación
y Manejo de la tortuga golfina (Lepidochelys olivacea) en la playa La cuevita, bahía Solano, Chocó,
Colombia, Cuadernos de Herpetología, 14(2), 131-144.
Hu, Z., Hu, H., & Huang, Y. (2018). Association between nighttime artificial light pollution and sea turtle nest density along Florida coast: A geospatial study using VIIRS remote sensing data. Environmental Pollution, 239, 30-42.
Le Gouvello, D., Nel, R., & Cloete, A. (2020). The influence of individual size on clutch size and hatchling fitness traits in sea turtles. Journal of experimental marine biology and ecology, 527, 151372.
Meylan, A. B., & Meylan, P. A. (1999). Introduction to the evolution, life history, and biology of sea turtles. Research and management techniques for the conservation of sea turtles. Washington DC: IUCN/SSC Marine Turtle Specialist Group Publication,
Miller, J. (1997). Reproduction in sea turtles. En: Lutz, P.L., Musick, J.A. (Eds.), The Biology of Sea Turtles. Boca Raton, Florida: CRC Marine science series.
Morales-Mérida, B. A. (2013). Relación entre la duración del período de incubación y la proporción de sexos de tortuga marina Lepidochelys olivacea en la Reserva Natural de Usos Múltiples Monterrico (RNUMM) (Tesis de licenciatura). Facultad de Ciencias Químicas y Farmacia. USAC, Guatemala.
Pinckney, J. (1990). Correlation Analysis of Adult Female, Egg and Hatchling Size in the Loggerhead Turtle, Caretta caretta (L.), Nesting at Kiawah Island, South Carolina, USA. Bulletin of Marine Science, 47(3), 670-679.
Pritchard, P. C., & Mortimer, J.A. (2000). Taxonomía, morfología externa e identificación de las especies (Trad. R. Briseño-Dueñas & A. Abreu-Grobois). En K. Eckert, A. Borndal, F. A. Abreu-Grobois, & M. Donnelly (Eds.). Técnicas de investigación y manejo para la conservación de las tortugas marinas (Publicación No. 4, pp. 23-41). Blanchard, Pensylvania: Consolidated Graphic Communications.
Ros, E. (2013). Size, clutch size and nesting distribution in leatherbacks on Playa Norte, Costa Rica. Publicaciones y Recursos. Costa Rica: Caño Palma, Estación Biológica. Canadian Organization for Tropical Education and Rainforest Conservation (COTERC).
Takane, Y. & Bozdogan, H. (1987). Akaike Information Criterion (AIC): Introduction. Psychometrika. 52(3),315.
Vega, A. J., & Robles, Y. (2005). Descripción del proceso de anidación y biometría de hembras, huevos y nidos en tortuga golfina Lepidochelys olivacea (Eschscholtz, 1829) en Isla de Cañas, Pacífico panameño. Tecnociencia, 7(2), 43-55.
Viejobueno, S., & Arauz, R. (2014). Conservación y actividad reproductiva de tortuga lora (Lepidochelys olivacea) en la playa de anidación solitaria Punta Banco, Pacífico Sur de Costa Rica. Recomendaciones de manejo a través de dieciséis años de monitoreo. Revista de Biología Tropical, 63(1), 383-394.
Zelaya, L. (2016). Influencia de la densidad de siembra en el éxito de eclosión y duración del período de incubación, en huevos de tortuga marina Lepidochelys olivacea, en viveros de incubación del Parque Nacional Hawaii, Chiquimulilla, Santa Rosa (Tesis de licenciatura). Facultad de Ciencias Químicas y Farmacia. USAC, Guatemala.








