Introducción
Las amilasas son un grupo de hidrolasas que pueden romper específicamente el enlace α-glicosídico del almidón y están ampliamente distribuidas en la naturaleza. Se encuentran en plantas, animales y microorganismos donde cumplen una función nutricional ya que permiten la digestión de los hidratos de carbono. Esta enzima se divide en tres clases importantes, la α-amilasa (1,4-α-D-glucano-glucanohidrolasa), la ß-amilasa (1,4-α-D-glucano-maltohidrolasa) y la γ-amilasa (1,4-α-D-glucano-glucohidrolasa) (Ramachandran et al., 2004). Los hongos producen principalmente α-amilasas, las cuales rompen aleatoriamente el enlace 1,4-α-D-glucosídico entre unidades de glucosa adyacentes dentro de la cadena de amilosa lineal (Saleem & Ebrahim, 2013). Las α-amilasas fúngicas constituyen un 25 % del mercado mundial de enzimas y son ampliamente utilizadas en procesos biotecnológicos ya que tienen la ventaja de que son rentables y facilitan la modificación y optimización de los procesos de producción (Karnwal & Nigam, 2013), por lo que son de utilidad tanto en la industria de producción de alimentos, cerveza, enzimas pancreáticas, textiles y de los detergentes (Gudynaite–Savitch & White, 2016).
Las amilasas fúngicas para uso industrial se producen a partir de hongos como Aspergillus, Penicillium y Rhizopus aislados de sustratos ricos en almidón (Pandey, Soccol & Mitchell, 2000). Sin embargo, los hongos anamorfos también son un grupo de interés, debido a que tienen la capacidad de degradar sustratos complejos como la hojarasca que está compuesta principalmente de celulosa, lignina y almidón. Dicha capacidad se debe al potencial que tienen para producir enzimas tales como celulasas, lacasas y amilasas (Gamboa & García, 2008; Rubbo & Kiesecker, 2004).
A pesar del potencial biotecnológico que tienen los hongos anamorfos para la producción de enzimas, en Guatemala no existen estudios al respecto, por lo que el objetivo de esta investigación fue analizar la capacidad de 40 cepas de hongos anamorfos saprobios nativos para la producción de α-amilasas. La capacidad productora de dichas enzimas se midió cualitativamente a través del índice de actividad enzimática, evidenciado por la detección de halos de degradación en agar almidón, y se cuantifico espectrofotométricamente con la medición de la actividad amilolítica de los extractos enzimáticos obtenidos a partir de salvado de trigo. Cabe resaltar que la producción de enzimas a nivel local es de suma importancia principalmente para la industria productora de alimentos, cerveza, textiles y detergentes ya que eliminaría los costos de importación de dichas enzimas. Asimismo, esté estudio muestra la capacidad que tienen los hongos anamorfos nativos para la producción de α-amilasas.
Materiales y métodos
Procedencia de las cepas
Se utilizaron 40 cepas nativas de hongos anamorfos aisladas a partir de hojarasca de Querqus sp del Astillero Municipal de Tecpán-Guatemala, Chimaltenango (N 14º 46' 48.81", O 91º 0' 27.42") y del Parque Ecológico Senderos de Alux, San Lucas Sacatepéquez, Sacatepéquez (N 14º 36' 43.41", O 90º 38' 15.92"), las cuales están almacenadas en el cepario de hongos saprobios y micorrícicos del Departamento de Microbiología de la Facultad de Ciencias Químicas y Farmacia de la Universidad de San Carlos de Guatemala. Se realizaron cultivos axénicos de las cepas en agar papa dextrosa (PDA), los cuales fueron incubados durante 15 días a 25 °C. Posteriormente se tomaron círculos de 0.5 cm de diámetro del micelio de cada una de las cepas y se transfirieron en condiciones de esterilidad a agar almidón al 1.0 % (AAL), para su adaptación y producción de biomasa para los ensayos posteriores (Lagunes et al., 2015).
Producción de amilasas en agar almidón (AAL)
Las cepas fúngicas fueron inoculadas nuevamente en el medio AAL y se incubaron a 25 °C durante 18 días. La producción de amilasas se detectó por la formación de un halo de hidrólisis alrededor de las colonias, mediante la adición de yodo en yoduro de potasio (0.026 % I2 + 0.26 % KI) como revelador. El índice de actividad enzimática se calculó por medio de la fórmula . Se realizaron cinco repeticiones por cada cepa fúngica (Pandey et al., 2000).
Producción de amilasas por fermentación en fase sólida y extracción de enzimas
A partir de las cepas fúngicas desarrolladas en cajas de Petri con agar almidón, se realizó una suspensión de esporas o micelio en Tween 80 al 0.01 %. Cada suspensión fue inoculada en frascos de 100 ml con tapa de rosca que contenían salvado de trigo (Preparados con 10 g de salvado de trigo adicionado con 5 ml de agua destilada y esterilizados durante 15 min a 121 ºC y 1 atm), y se incubaron a 28 °C durante siete días para la producción de amilasas. Las enzimas se extrajeron agregando 50 ml de una solución acuosa de NaCl al 1.0 % a los frascos con salvado de trigo, con posterior agitación en una incubadora de rotación orbital durante 30 min. Los extractos obtenidos se filtraron y fueron almacenados a 5 ºC (Pandey et al., 2000).
Evaluación de la actividad amilolítica de los extractos
La actividad amilolítica de los extractos se evaluó con la adición de 0.5 ml de una solución de almidón soluble 0.2 M en acetato de sodio 0.1 M y 10.0 µl del extracto acuoso, con posterior incubación a 37 ºC por 30 min. Transcurrido este lapso, se agregó una solución de yodo en yoduro de potasio (0.006 % I2 + 0.06 % KI) en HCl 0.2 M, la cual reaccionó con el almidón residual y se determinó por medio de absorbancia por espectrofotometría en un equipo VWR V-1200 a 640 nm (Queen, Rajalakshmi, & Komathi, 2017). La absorbancia basal se midió posterior a la preparación de los reactivos y se utilizó almidón soluble como control positivo. La cuantificación se expresó en unidades amilolíticas por decilitro (UA/dl) a través de la formula . Se realizaron 5 repeticiones por cepa. Las unidades amilolíticas determinan la cantidad de enzima contenida en 100.0 ml de muestra, que puede hidrolizar 10.0 mg de almidón en 30 min (Sarmiento, Vargas, Pedroza, Matiz, & Poutou, 2003).
Análisis estadístico
Se calculó la media y la desviación estándar para el índice de actividad y la actividad enzimática de cada cepa fúngica. La normalidad de los datos se evaluó con una prueba de Shapiro-Wilk. Para evidenciar si existía o no diferencias entre los índices de actividad y las actividades enzimáticas de las 40 cepas, se realizó un análisis de varianza y la prueba de comparaciones múltiples de Duncan (.05 de significancia). Los resultados fueron procesados en el programa R® (Zaferanloo, Bhattacharjee, Ghorbani, Mahon, & Palombo, 2014).
Resultados
De las 40 cepas de hongos anamorfos saprobios aislados de la hojarasca de Quercus sp, 37 produjeron amilasas, de éstas Virgarianigra SL12517 mostró la mayor actividad enzimática (625.13 UA/dl), seguido por Aspergillus niger SL14917 (621.63 UA/dl) y Aspergillus sp SL15317 (558.57 UA/dl). La menor actividad la mostró Mariannaeaelegans TP13819 (1.52 UA/dl) y la cepa TP16919 (1.52 UA/dl). Chloridium sp SL10619, TP13019 y Helicosporium sp SL10819 no mostraron actividad amilolítica. De las cepas que produjeron amilasas 20 mostraron índices de actividad mayores a 100, en tanto que los extractos acuosos correspondientes mostraron actividades enzimáticas mayores a 50 UA/dl (Tabla 1).
Tabla 1
Índices de actividad y actividad amilolítica
de los extractos de las cepas que mostraron actividades mayores a 100 y
actividad enzimática mayor a 50 UA/dl.
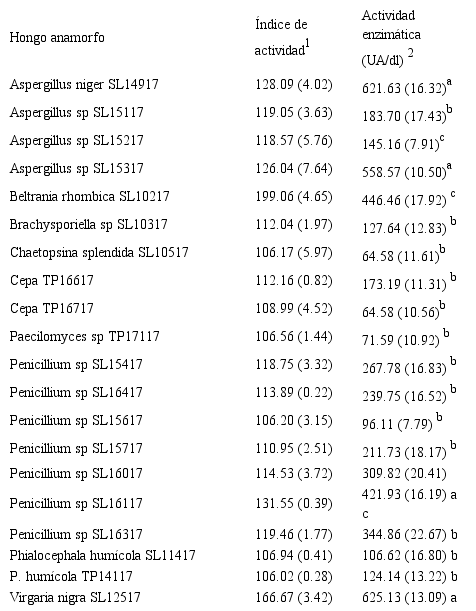 1 La relación halo/colonia
fue medida en milímetros a los 18 días de incubación, media (desviación
estándar). 2Unidades amilolíticas por decilitro. a,
b, c Letras distintas indican diferencia significativa, de acuerdo con la
prueba de comparaciones múltiples de Duncan (p < .05), media (desviación
estándar).
1 La relación halo/colonia
fue medida en milímetros a los 18 días de incubación, media (desviación
estándar). 2Unidades amilolíticas por decilitro. a,
b, c Letras distintas indican diferencia significativa, de acuerdo con la
prueba de comparaciones múltiples de Duncan (p < .05), media (desviación
estándar).
|
Hongo anamorfo
|
Índice de actividad1
|
Actividad enzimática
(UA/dl) 2
|
|
Aspergillus niger
SL14917
|
128.09 (4.02)
|
621.63 (16.32)a
|
|
Aspergillus sp SL15117
|
119.05 (3.63)
|
183.70 (17.43)b
|
|
Aspergillus sp SL15217
|
118.57 (5.76)
|
145.16 (7.91)c
|
|
Aspergillus sp SL15317
|
126.04 (7.64)
|
558.57 (10.50)a
|
|
Beltrania
rhombica SL10217
|
199.06 (4.65)
|
446.46 (17.92) c
|
|
Brachysporiella sp SL10317
|
112.04 (1.97)
|
127.64 (12.83) b
|
|
Chaetopsina
splendida SL10517
|
106.17 (5.97)
|
64.58 (11.61)b
|
|
Cepa TP16617
|
112.16 (0.82)
|
173.19 (11.31) b
|
|
Cepa TP16717
|
108.99 (4.52)
|
64.58 (10.56)b
|
|
Paecilomyces sp TP17117
|
106.56 (1.44)
|
71.59 (10.92) b
|
|
Penicillium sp SL15417
|
118.75 (3.32)
|
267.78 (16.83) b
|
|
Penicillium sp SL16417
|
113.89 (0.22)
|
239.75 (16.52) b
|
|
Penicillium sp SL15617
|
106.20 (3.15)
|
96.11 (7.79) b
|
|
Penicillium sp SL15717
|
110.95 (2.51)
|
211.73 (18.17) b
|
|
Penicillium sp SL16017
|
114.53 (3.72)
|
309.82 (20.41)
|
|
Penicillium sp SL16117
|
131.55 (0.39)
|
421.93 (16.19) a c
|
|
Penicillium sp SL16317
|
119.46 (1.77)
|
344.86 (22.67) b
|
|
Phialocephala
humícola SL11417
|
106.94 (0.41)
|
106.62 (16.80) b
|
|
P. humícola TP14117
|
106.02 (0.28)
|
124.14 (13.22) b
|
|
Virgaria nigra SL12517
|
166.67 (3.42)
|
625.13 (13.09) a
|
Las cepas Aspergillus sp SL15019, Beltrania querna SL10119 y TP12819, Cladosporium sp TP16519, Mariannaea elegans TP13919, Paecilomyces sp TP17019 y TP17219, Penicillium sp SL15819, SL15919 y SL16219, Stachybotryna sp SL12019 y TP14619, Thozetella cubensis SL12219, Thozetella nivea SL12319 y TP14719, así como las cepas TP16819 y TP16919 mostraron índices de actividad menores a 100 y sus extractos acuosos correspondientes mostraron actividades enzimáticas menores a 50 UA/dl (Tabla 2).
Tabla 2
ndices de actividad y actividad amilolítica
de los extractos de las cepas que mostraron actividades menores a 100 y actividad
enzimática menor a 50 UA/dl.
 1 La relación halo/colonia fue medida en milímetros a los 18 días de incubación, media (desviación estándar). 2Unidades amilolíticas por decilitro. a, b, c Letras distintas indican diferencia significativa, de acuerdo con la prueba de comparaciones múltiples de Duncan (p < .05), media (desviación estándar).
1 La relación halo/colonia fue medida en milímetros a los 18 días de incubación, media (desviación estándar). 2Unidades amilolíticas por decilitro. a, b, c Letras distintas indican diferencia significativa, de acuerdo con la prueba de comparaciones múltiples de Duncan (p < .05), media (desviación estándar).
|
Hongo anamorfo
|
Índice de actividad1
|
Actividad enzimática
(UA/dl) 2
|
|
Aspergillus sp SL15019
|
99.26 (1.84)
|
36.55 (4.00) ab
|
|
Beltrania querna SL10119
|
94.52 (23.42)
|
23.42 (1.61) b
|
|
Beltrania querna TP12819
|
98.88 (12.08)
|
32.18 (1.21) ab
|
|
Cladosporium sp TP16519
|
99.03 (26.04)
|
26.04 (6.58) ab
|
|
Mariannaeaelegans TP13819
|
99.32 (1.49)
|
1.52 (4.35) c
|
|
Paecilomyces sp TP17019
|
97.59 (12.66)
|
43.56 (1.59) a
|
|
Paecilomyces sp TP17219
|
96.00 (16.74)
|
15.53 (3.40) b
|
|
Penicillium sp SL15819
|
99.38 (5.10)
|
43.56 (5.56) a
|
|
Penicillium sp SL15919
|
98.77 (3.56)
|
40.06 (1.63) a
|
|
Penicillium sp SL16219
|
99.44 (6.17)
|
47.07 (1.87) a
|
|
Stachybotrina sp SL12019
|
98.33 (12.36)
|
5.02 (2.95) c
|
|
Stachybotrina sp TP14619
|
96.92 (11.67)
|
29.55 (1.84) a
|
|
Thozetellacubensis
SL12219
|
97.59 (47.07)
|
47.07 (7.21) a
|
|
Thozetella nívea SL12319
|
99.17 (5.41)
|
43.56 (4.58) a
|
|
Thozetella nívea TP14719
|
97.71 (9.75)
|
26.04 (8.75) a
|
|
Cepa TP16819
|
98.08 (10.77)
|
29.55 (8.12) a
|
|
Cepa TP16919
|
97.41 (8.40)
|
1.52 (1.71) c
|
Discusión
El índice de actividad amilolítica mostró que el 92.5 % de las cepas de hongos anamorfos produjeron amilasas. Dichas cepas fueron colectadas a partir de hojarasca de Querqus sp la cual posee glucanos como celulosa y almidones como parte de su composición, y constituye la principal fuente de carbono para los microorganismos descomponedores en las primeras etapas, por lo tanto se esperaba un alto potencial amilolítico por parte de los hongos anamorfos estudiados (Leitner et al., 2012).
De las cepas evaluadas en este estudio V. nigra SL12517 presentó la actividad amilolítica más elevada (625 UA/dl), la cual sobrepasa a las encontradas por Puri y Loveleen (2013), que produjeron α-amilasas también a partir de salvado de trigo y obtuvieron valores de entre 272 UA/dl y 411 UA/dl. De modo similar, A. niger SL14917 presentó la segunda actividad más alta (621.63 UA/dl) que es comparable con la misma especie reportada por Tester, Qi y Karkalas (2006), para la degradación de residuos agroindustriales, en donde demostraron su efectividad en la descomposición de almidones crudos bajo diferentes condiciones de pH y temperatura. Aspergillus ha sido ampliamente utilizado para la producción de α-amilasas debido a su capacidad de utilización de diferentes fuentes de carbono, peptonas y a sus bajos requerimientos nutricionales (Mathew, Vezhacharickal, Sajeshkumar & Ashokan, 2016).
Spier, Woiciechowski, Vandenberghe y Soccol (2006) y Villalba, Bula, Juan y Ávila (2008) encontraron que A. niger tiene un alto potencial para la producción de amilasas en residuos agroindustriales como el almidón de yuca, bagazo de caña y salvado de trigo. Respecto a las otras especies de Aspergillus, mostraron actividades amilolíticas de entre 183.60–558.57 UA/dl, se ha reportado que dicho género muestra la capacidad para degradar almidón mediante la inducción en sustratos como el salvado de trigo o de maíz, así como potencial aplicación en la industria de producción de alimentos y elaboración de textiles (Alva et al., 2007; Mojsov, 2012; Mojsov et al., 2018).
Respecto a Aspergillus sp SL15217, SL15317, B. rhombica SL10217, Brachysporiella sp SL10317, Chaetopsinasplendida SL10517, las cepas TP16819, TP16919, Paecilomyces sp TP17117 y Penicillium sp SL15417, SL16417, SL15717, SL16017, SL16117, SL16317, mostraron actividades enzimáticas de entre 100 y 400, valores que son similares a los reportados por Castro y colaboradores (2011), acerca de la capacidad de los hongos de los géneros Penicillium, Rhizopus y Aspergillus como productores de enzimas amilasas, celulasas y xilanasas para aplicaciones industriales. Asimismo, se observó una baja actividad enzimática con C. splendida SL10517 y Phialocephalahumícola SL11417 y TP14117.
Por otra parte, Vanegas–Zamora, Méndez y Murillo (2015) utilizaron cepas de Aspergillus sp, Rhizopus oryzae y Penicillium sp en subproductos del arroz para la producción de α-amilasas y obtuvieron resultados de entre 1000–4000 UA/dl y Mazumdar y Maumdar (2018) que a partir de Aspergillus oryzae en cáscaras de plátano, obtuvieron actividades de hasta 645 UA/dl, dichas actividades amilolíticas son mayores a los obtenidos en este estudio debido a que optimizaron variables tales como el periodo de fermentación, la temperatura de incubación, el pH inicial del medio y la concentración del sustrato.
Cabe resaltar que el potencial de los hongos anamorfos nativos asociados a la hojarasca de Quercus sp para la producción de α-amilasas es promisorio para su uso a nivel industrial a través de su producción a gran escala utilizando el salvado de trigo y otros residuos agroindustriales, ya que dichos hongos tienen la capacidad de desarrollarse en sustratos con pocos nutrientes y presentan actividades comparables a las cepas que se utilizan en la actualidad para la producción de α-amilasas.
Agradecimientos
Los autores expresan su agradecimiento a la Dirección
General de Investigación de la Universidad de San Carlos de Guatemala por el
cofinanciamiento del presente estudio DIGI-USAC-4.8.63.6.10-2018, a la Facultad
de Ciencias Químicas y Farmacia por el apoyo y aval otorgado y a la Inga. Liuba
Cabrera, Coordinadora del Programa Universitario de Investigación en
Alimentación y Nutrición, por la asistencia técnica y administrativa.
Referencias
Alva, S., Anupama, J., Savla, J., Chiu, Y., Vyshali, P., Shruti, M., & Ruchi, K. (2007). Production and characterization of fungual amylase enzyme isolated from Aspergillus sp. JGI 12 in solid state culture. African journal of biotechnology, 6(5), 576-581.
Castro, A., Andréa, T., Carvalho, D., Teixeira, M., Reis-Castilho, L., & Freire, D. (2011). Valorization of residual agroindustrial cakes by fungal production of multienzyme complexes and their use in cold hydrolysis of raw starch. Waste and biomass valorization, 2(3), 291-302. doi:10.1007/s12649-011-9075-5
Gamboa, M., & García, S. (2008). Potencial biológico y creatividad química de hongos microscópicos del trópico americano. En G. Heredia. Tópicos sobre diversidad, ecología y biotecnología de los hongos microscópicos (pp. 253-272). Veracruz: Prograf.
Gudynaite–Savitch, L., & White, T.C. (2016). Fungal biotechnology for industrial enzyme production: focus on (Hemi)cellulase production strategies, advances and challenges. En M. Schmoll & C. Dattenböck (Eds.). Gene expression systems in fungi: advancements and applications (pp. 395-439). Cham, Switzerland: Springer International Publishing.
Karnwal, A., & Nigam, V. (2013). Production of amylase enzyme by isolated microorganisms and it's application. International journal of pharma and bio sciences, 3(4), 354-360.
Lagunes, M., López, A., Ramos, A., Trigos, A., Salinas, A., & Espinoza, C. (2015). Actividad antibacteriana de extractos metanol:cloroformo de hongos fitopatógenos. Revista mexicana de fitopatología, 33(1), 87-94.
Leitner, S., Wanek, W., Wild, B., Haemmerle, I., Kohl, L., Keiblinger, K., ... Richter, A. (2012). Influence of litter chemistry and stoichimetry on glucan depolymerization during decomposition of beech (Fagus sylvatica L.) litter. Soil biology & biochemistry, 50(2012), 174-187.
Mathew, J., Vezhacharickal, P., Sajeshkumar, N., & Ashokan, A. (2016). Amylase production by Aspergillus niger through submerged fermentation using starchy food byproducts as substrate. Internation journal of herbal medicine, 4(6), 34-40.
Mazumdar, A., & Maumdar, H. (2018). Bio-processing of banana peel for alpha amylase production by Aspergillus oryzae employing solid state fermentation. The clarion, 7(1), 36-42.
Mojsov, K. (2012). Microbial alpha-amylases and their industrial applications: a review. International journal of management, it and engineering, 2(10), 583-609.
Mojsov, K., Andronikov, D., Janevski, A., Jordeva, S., Kertakova, M., Golomeova, S., ... Ignjatov, I. (2018). Production and application of a-amylase enzyme in textile industry. Tekstilna industrija, 1, 23-28.
Pandey, A., Soccol, C., & Mitchell, D. (2000). New developments in solid state fermentation: I bioprocesses and products. Process biochemistry, 35(10), 1153-1169. doi:10.1016/S0032-9592(00)00152-7
Puri, S., & Loveleen, A. (2013). Production and optimization of amylase and glucoamylase using Aspergillus oryzae under solid state fermentation. International journal of research in pure and applied microbiology, 3(3), 83-88.
Queen, J., Rajalakshmi, G., & Komathi, S. (2017). Screening of amylase producing microbes from rhizosphere soil and its potential application in baking bread. European journal of biotechnology and bioscience, 5(5), 63-72.
Ramachandran, S., Patel, A., Nampoothiri, K., Chandran, S., Szakacs, G., Soccol, C., & Pandey, A. (2004). Alpha amylase from a fungal culture grown on oil cakes and its properties. Brazilian archives of biology and technology, 47(2), 309-317. doi: 10.1590/S1516-89132004000200019
Rubbo, M. & Kiesecker, M. (2004). Leaf litter composition and community structure: translating regional species changes into local dynamics. Ecology, 85(9), 2519-2525.
Saleem, A., & Ebrahim, M. (2013). Production of amylase by fungi isolated from legume seeds collected in Almadinah Almunawwarah, Saudi Arabia. Journal of taibah university for science, 8, 90-97. doi: 10.1016/j.jtusci.2013.09.002
Sarmiento, V., Vargas, D., Pedroza, A., Matiz, A., & Poutou, R. (2003). Producción de alfa–amilasa con células libres e inmovilizadas de Thermus sp. Revista MVZ Córdoba, 8(2), 310-317.
Spier, M., Woiciechowski, A., Vandenberghe, L., & Soccol, C. (2006). Production and Characterization of Amylases by Aspergillus niger under solid state fermentation using agro industrial products. International journal of food engineering, 2(3), 1-19. doi:10.2202/1556-3758.1116
Tester, R., Qi, X., & Karkalas, J. (2006). Hydrolysis of native starches with amylases. Animal feed science and technology, 130(1), 39-54. doi: 10.1016/j.anifeedsci.2006.01.016
Vanegas–Zamora, R., Méndez, J., & Murillo, W. (2015). Potencial amilolítico de microorganismos asociados al arroz cultivados a partir de almidón extraído de subproductos del grano. Revista de la academia colombiana de ciencias exactas, físicas y naturales, 39(153), 514-519.
Villalba, P., Bula, A., Juan, H., & Ávila, A. (2008). Yucca (Manihot esculenta Crantz) starch polysaccharide dextrination through biological procedures. Interciencia, 33(4), 314-316.
Zaferanloo, B., Bhattacharjee, S., Ghorbani, M., Mahon, P., & Palombo, E. (2014). Amylase production by Preussia minima, a fungus of endophytic origin: optimization of fermentation conditions and analysis of fungal secretome by LC-MS. BMC Microbiology, 14(55), 1-12. doi:10.1186/1471-2180-14-55






