Introducción
Aedes aegypti ha sido el principal vector de arbovirosis en América, tales como la fiebre amarilla (Jentes et al., 2011), chikungunya (Leparc-Goffart, Nougairede, Cassadou, Prat, & Lamballerie, 2014) y dengue (Simons, Farrar, Chau, & Wills, 2012). A pesar de los programas de erradicación del mosquito en la mayor parte de América en 1970, (Gubler, 2014; Organización Panamericana de la Salud & Organización Mundial de la Salud, 1959), en la actualidad se reporta presencia del vector en regiones de 21 de los 22 departamentos de Guatemala (Lepe et al., 2016). Sin embargo el conocimiento de dicha distribución es restringida, abordada a través de encuestas entomológicas que realiza el Ministerio de Salud Pública y Asistencia Social (MSPAS) y los factores que dictaminan dicha distribución en la región de Guatemala es escaso (Lepe et al., 2016).
Estos mosquitos probablemente originarios de África, transportados a América en los barcos de las primeras exploraciones y colonizaciones europeas en el siglo 15, se encuentra en sitios con isotermas comprendidas entre los 10 °C y los 45 °C (Nelson, 1986). Temperatura por debajo de estas genera dificultades en el desarrollo de los mosquitos, en la densidad poblacional y en la fertilidad de las hembras (Patz, Martens, Focks, & Jetten, 1998). Es debido a esto que generalmente se encuentra en regiones por debajo de los 1,000 m.s.n.m. (Nelson, 1986). Esta variable restringe los límites geográficos de la actual distribución de A. aegypti, en Guatemala.
El mosquito es el vector principal del virus del dengue, arbovirus más extendido en el planeta, presentando casos en países de todo el mundo (Simons, et al., 2012). Se estima que se producen alrededor de 390 millones de casos de dengue al año, de los cuales únicamente 96 millones son identificados por medio de sistemas de vigilancia de los centros de salud de cada país (Bhatt et al., 2013). La enfermedad se encuentra muy extendida en los trópicos y la variación en cuanto al riesgo de contagio se deben en gran medida a la precipitación, temperatura y urbanización (Simons, et al., 2012). En el año 2016 el virus de dengue fue transmitido en el continente americano a más de dos millones de habitantes. En Guatemala desde el año 2010 hasta abril de 2017 se reportaron alrededor de 50,000 casos (Sistema de Información Gerencial de Salud [SIGSA] 2017).
Existen diversas condiciones necesarias para la transmisión del virus es necesario reunir una serie de condiciones del vector como la temperatura, humedad relativa, radiación solar o la sobrevivencia del insecto, y una combinación de factores intrínsecos del virus, como las características genéticas del virus, y factores extrínsecos al virus como el periodo de incubación extrínseca, el cual depende de la temperatura externa al mosquito (Hardy, Houk, Kramer, & Reeves, 1983; Samuel, Adelman, & Myles, 2016). Existen contradicciones en cuanto a la temperatura ideal para que el virus pueda replicarse, así como para su diseminación en el tracto digestivo del imago. En el caso de A. aegypti fluctuaciones muy grandes en temperatura disminuyen la transmisión del virus, mientras que la temperatura ideal para la transmisión es de 30°C (Lambrechts et al., 2011; Watts, Burke, Harrison, Whitmire, & Nisalak, 1987).
En 1995 el mosquito Aedes albopictus Skuse 1895 (Díptera: Culicidae) es encontrado en la región caribeña del país (Ogata & Samavoa, 1996; Tabaru et al., 1998). Actualmente se conoce que está presente en alguna localidad de al menos once departamentos a lo largo del norte del país (Lepe et al., 2016). Así pues este mosquito puede estar desempeñando un papel importante en la dinámica de transmisión de las arbovirosis en regiones del país donde A. aegypti se encuentre ausente. Ha sido reportado como vector competente de múltiples enfermedades virales como dengue (Simmons et al., 2012; Villatoro, 2006), chikungunya (Thiberville et al., 2013), y zika (Grard et al., 2014). Se asume que tiene un origen asiático (sureste asiático). En la actualidad se encuentra distribuido mundialmente, circundando comunidades humanas y sirviendo de transmisor principal de enfermedades como dengue en sitios rurales donde A. aegypti se encuentra ausente (Gratz, 2004). El vector presenta ventajas sobre otros vectores debido a la capacidad que tiene para sobrevivir en ambientes con recursos limitados y densidades combinadas altas (Juliano, 1998).
A partir de la metodología propuesta por Barbosa (2015), se formularon dos modelos lineales generalizados con el fin de 1) establecer el área potencial de distribución de A. aegypti en Guatemala con base en datos climáticos de WorldClim- Global Climate Data (Hijmans, Cameron, Parra, Jones, & Jarvis, 2005), 2) definir el área potencial de casos de dengue con base en la presencia A. aegypti datos provenientes de Global Biodiversity Information Facility (GBIF) entre los años 1990 y 2016, por último 3) determinar los puntos de mayor riesgo de transmisión potencial de dengue en Guatemala. El alcance de este estudio se encuentra limitado en los siguientes puntos: escala de resolución de la base de datos extraída de WorldClim- Global Climate Data (Hijmans et al., 2005) 2.5 km, los datos de ocurrencia del mosquito que se extiende a un área geográfica mayor a la reportada en las bases de datos de GBIF (GBIF, 2017), ausencia de datos para el país del estudio, así como a la falta de información antropogénica como densidad de población, urbanización, acceso al agua o sistemas de drenaje. Este estudio permitirá tener un acercamiento sobre la distribución actual del vector en la región, definir su distribución potencial, para luego poder indicar regiones priorizadas para el control del vector en Guatemala, así como definir regiones que deberían ser priorizadas por el riesgo de presentar brotes de dengue.
Materiales y métodos
Área de estudio:
Debido a la falta de datos para Guatemala, el primer modelado se llevó a cabo con datos de ocurrencias de A. aegypti en México, Belice, Honduras, Nicaragua, Costa Rica, El Salvador y Panamá, georreferenciadas en la base de datos de Global Biodiversity Information Facility (GBIF, 2017). Iniciativa intergubernamental conformada por 97 participantes, entre ellos países y organizaciones internacionales, que colaboran para promover acceso libre y abierto a datos de biodiversidad. Se descargó las coordenadas geográficas de ocurrencias con el paquete rgbif, utilizando como filtros "Aedes aegypti" como Scientific Name, países de búsqueda "México, Guatemala, Belice, El Salvador, Honduras, Nicaragua, Costa Rica y Panamá" (Real, Barbosa, & Vargas, 2006), de la consola del software estadístico R (R Core team, 2017).
Para depurar los datos erróneos en cuanto a falta de información en las coordenadas geográficas, se procedió a sobreponer los datos en el mapa del área muestreada, con el paquete maps (Becker & Wilks 2018). Se estableció como erróneos los datos que se encontraron fuera del área de interés. Dichos valores se eliminaron directamente en la consola de R. Con la búsqueda se logró obtener 13,840 puntos de ocurrencia georreferenciados.
El área de estudio fue elegida con base en el reporte de constante infestación de culícidos además de la accesibilidad de estos datos. Los datos climáticos corresponden a 19 variables (Tabla 1) extraídos de WorldClim- Global Climate Data (Hijmans et al., 2005).
Tabla 1.
Variables ambientales evaluadas para la realización de los modelos
 WorldClim- Global
Climate Data (Hijmans et
al., 2005).
WorldClim- Global
Climate Data (Hijmans et
al., 2005).
|
Variables evaluadas
|
Modelo 1
|
Modelo 2
|
|
Temperatura
Media anual
|
Rango
diurno medio
|
Temperatura
estacional
|
|
Rango
diurno medio
|
Temperatura
media de cuarto más frío
|
Temperatura
media del cuarto más húmedo
|
|
Isotermia
|
Precipitación
del mes más húmedo
|
Precipitación
por estacionalidad
|
|
Temperatura
estacional
|
Precipitación
del cuarto más frío
| |
|
Temperatura máxima del mes más
cálido
| | |
|
Temperatura mínima del mes más
frío
| | |
|
Rango anual de temperatura
| | |
|
Temperatura media de cuarto más
húmedo
| | |
|
Temperatura media de cuarto más
cálido
| | |
|
Temperatura media de cuarto más
seco
| | |
|
Temperatura media de cuarto más
frío
| | |
|
Precipitación anual
| | |
|
Precipitación del mes más
húmedo
| | |
|
Precipitación del mes más seco
| | |
|
Precipitación por
estacionalidad
| | |
|
Precipitación del cuarto más
frío
| | |
|
Precipitación del cuarto más
caliente
| | |
|
Precipitación del cuarto más
húmedo
| | |
|
Precipitación del cuarto más
seco
| | |
Selección de logaritmo de modelado:
La distribución potencial de los vectores puede ser abordado a partir de modelos de nicho ecológico (Escobar et al., 2016; Peterson et al., 2011). Estos permiten caracterizar las condiciones ambientales favorables para la presencia de una especie en cierto territorio sin necesidad de inmigración (Peterson et al., 2011). Se han llevado a cabo modelos de distribución potencial, los cuales muestran que el área a la cual se circunscriben A. aegypti en América es desde el norte de Estados Unidos (Hahn et al., 2016), hasta el norte de Argentina, para los cuales hay mapas generales, y en cuyos trabajos dejan la inquietud de realizar mapas con la distribución autóctona de A. aegypti de cada país (Kraemer et al., 2015).
En Guatemala ha sido abordado únicamente por Lepe y colaboradores (2016). En el caso de dengue existen mapas a nivel global para demarcar las zonas con incidencia de dengue y en cuyos resultados se ha mostrado evidencia de que los casos muestran relación con variables medioambientales y la presencia del vector (Brady et al., 2012; Van, Bambrick, & Hales, 2017; Lover et al., 2014).
La generación del modelo puede llevarse a cabo mediante múltiples algoritmos para predecir la probabilidad de ocurrencia/ausencia de una especie en determinado sitio con base en múltiples variables (Van et al., 2017), por ejemplo el modelo flexible para graficar la distribución potencial de especies (DOMAIN) (Elith et al., 2006), Máxima entropía (Carpenter, Gillison, & Winter, 1993), Sistema de modelado del algoritmo genético para la producción de un conjunto de reglas (GARP) (Stockwell & Peters, 1999) o modelos machine-learning (BRT) (Van et al., 2017).
La comparación entre regiones mediante la presencia y ausencia de individuos de especies suele presentar varios errores intrínsecos a la metodología utilizada. Entre estos se puede mencionar que no se toman en cuenta la proximidad ambiental o espacial entre sitios de ocurrencia, lo que incrementa las falsas ausencias dando como resultado que dos sitios cercanos similares sean totalmente distintos al igual que dos sitios en zonas geográficas opuestas (Barbosa & Real, 2012).
Las bases de datos poseen errores inevitables, falsas ausencias, error al ingresar datos o falsos positivos (Rocchini et al., 2011). Debido a esto Rocchini y colaboradores (2011) y Barbosa (2015), recomiendan utilizar la distribución de especies como “borrosas o difusas”, zonas con cierto grado de incertidumbre de presencia o ausencia en lugar de supuestas presencias y ausencias. Debido a esto se utilizó el método propuesto por Barbosa (2015), incluido dentro del paquete fuzzySim en el software estadístico R (Barbosa, 2014), que permite convertir datos de presencia/ausencia de especies en superficies continuas y difusas a partir de un modelo lineal generalizado, además de convertir la probabilidad a valores favorables (favorabilidad), independientes de la prevalencia, que han demostrado ser apropiados para su uso dentro de un marco de lógica difusa (Barbosa 2015; Stockwell & Peters, 1999).
Sin embargo existen limitaciones de los modelos en cuanto la información obtenida de las bases de datos. Se puede mencionar: reportes heterogéneos en todo el país de origen, vacíos de información, incongruencia en las coordenadas geográficas, falta de información acerca de ausencias estrictas, registros dobles, error en la nomenclatura, sistemas de coordenadas distintos, entre otros. Sin embargo estas limitantes son solventadas a través de la extrapolación de las condiciones en donde existe registro, por medio de los modelados.
Análisis de datos:
Los datos para el presente estudio consisten en dos variables de respuesta binomial: presencia/ausencia de A. aegypti, presencia/ausencia de casos de dengue (GBIF, 2017) y una serie de variables continuas ambientales de acceso público WorldClim- Global Climate Data (Hijmans et al., 2005). (Tabla 1). Los casos de dengue se solicitaron al Sistema de Información Gerencial de Salud (SIGSA) de Guatemala, información comprendida entre enero de 2010 a abril de 2017. Estos casos fueron georreferenciados en el Sistema de Información Geográfico Quantum Gis versión 2.18 (QGIS Development Team, 2017). Un modelo linear generalizado binomial (Barbosa 2014; Barbosa, 2017), fue utilizado para determinar la distribución del vector con base en las variables de temperatura y precipitación.
El resultado de las probabilidades de la grilla, obtenidos del modelo en R fueron importados a Quantum Gis, donde se convirtieron en formato raster y se graficó con el complemento de diseño, propio del sistema de información geográfico. El modelo 1 que contenía los países de México, Guatemala, Belice, Honduras, Nicaragua, El Salvador, Costa Rica y Panamá (Figura 1), fue recortado en los límites de Guatemala y graficado nuevamente (Figura 2). Los valores de probabilidad de la grilla de este país fueron importados a R para la realización del segundo modelo.
A continuación se realizó un segundo modelo linear generalizado para determinar la distribución actual de casos de dengue con relación a la distribución potencial del vector y las variables ambientales. Fueron utilizadas las 19 variables que presenta la base de datos de WorldClim- Global Climate Data (Hijmans et al., 2005), a priori, posteriormente evaluadas y filtradas (Tabla 1), para realizar los siguientes modelos:
Modelo 1: A. aegypti ~ Intercepto + 4 variables ambientales
Modelo 2: Dengue ~ Intercepto + Probabilidad de presencia/ausencia A. aegypti + 3 variables ambientales
Los modelos lineales generalizados (modelos 1 y 2) se ajustaron utilizando la función MultGLM del paquete fuzzySim (Barbosa, 2014), en R, por medio del script desarrollado por Barbosa (2017). La evaluación de ambos modelos se llevó a cabo por medio del paquete modEvA (Barbosa, Brown, Jiménez-Valverde, & Real, 2016). Se determinó la capacidad de discriminación y clasificación (Tabla 2), independiente de umbral, lo que significa que no se utiliza un umbral de corte para clasificar los valores de presencia/ausencia, sino directamente sobre los valores continuos del mapa (Legendre & Legendre, 2012), por medio del área bajo la curva Característica Operativa del Receptor (ROC), con la función “AUC” del paquete modEVA, estadística de habilidad verdadera (TTS) (Allouche, Tsoar, & Kadmon, 2006), y la tasa de clasificación correcta (CCR) con la función optiTresh del paquete modEVA en R. La bondad de ajuste o calibración de ambos modelos, se llevó a cabo mediante la recta de calibración de Miller (Pliscoff & Fuentes-Castillo, 2011), con la función MillerCalib del paquete modEVA.
Para ambos modelos (modelos 1 y 2) se utilizó el 15% de los datos como datos de validación. Se eliminaron las variables que presentaban falsos negativos a través del False Disdicovery Rate (Benjamini & Hochberg, 1995), con la función FDR, colinealidad con la función multicol, y correlación entre variables mayor a .75 (Marquardt, 1970), con la función cor, en el paquete fuzzySim. El proceso de selección de variables fue por pasos, seleccionándolas a partir del modelo saturado, en ambas direcciones (Tabla 1).
Resultados
Modelos predictivos
Aedes aegypti
Se puede observar en la figura 1 que México, Guatemala, Belice, Honduras, Nicaragua y Costa Rica, presentan alta probabilidad para la presencia de A. aegypti en alguna región, con excepción de Panamá. La mayor probabilidad (entre .75 y 1.00) se presenta, en las costas del océano pacífico, comenzando con la zona oeste de la sierra madre occidental de México, pasando por la depresión del Balsas, continuando por las zona comprendida entre la cadena volcánica de Guatemala y la costa del Pacífico, El Salvador, tierras bajas de Nicaragua (la depresión de los lagos de Nicaragua) y tierras bajas de Costa Rica; por otro lado existe una alta probabilidad en la Sierra Madre Oriental de México y Yucatán en dirección noreste (.5 - .75), seguida de las costas del océano atlántico (.25 - .75). Las zonas con menor probabilidad (0 - .25), se presentan en tierras altas como las comprendidas por las Sierra Madre Oriental y Occidental de México, La cadena Volcánica, altiplano, Cordillera de los Cuchumatanes, Sierra de las Minas de Guatemala, y Tierras altas de Belice (Sierra Maya); la costa del Atlántico de Centroamérica y el territorio de Panamá.
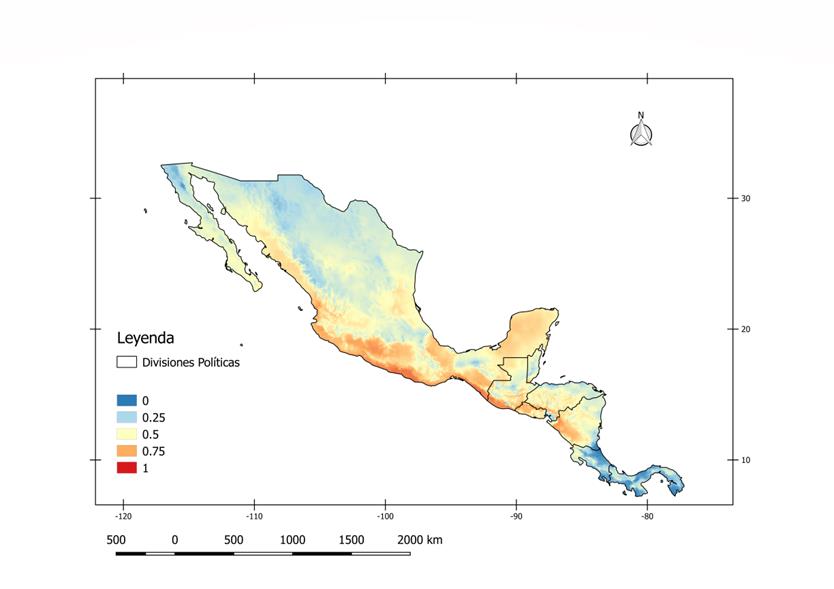 Figura 1.
Mapa de probabilidad
de presencia de A. aegypti
en México y Centroamérica: Mapa generado en Quantum GIS. Fecha: Junio 2017. El
mapa muestra las condiciones favorables para la ocurrencia del mosquito desde 0
(azul) hasta 1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017.
Figura 1.
Mapa de probabilidad
de presencia de A. aegypti
en México y Centroamérica: Mapa generado en Quantum GIS. Fecha: Junio 2017. El
mapa muestra las condiciones favorables para la ocurrencia del mosquito desde 0
(azul) hasta 1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017.
En
Guatemala (Figura 2), se observa que existe una alta probabilidad de presencia
(.75 - 1), en todas las tierras bajas del sur del país hasta la cordillera
volcánica, en el oriente del país se observa una probabilidad de presencia del
vector entre .5 y .7 comprendiendo los territorios de los departamentos de
Guatemala, El Progreso, Jalapa, Jutiapa, Zacapa y Chiquimula. En el occidente
del país se observa una probabilidad de .75 en la región noroeste del
departamento de Huehuetenango. Al norte del país en el departamento de Petén se
observa probabilidades de encontrar al vector entre .75 en la zona norte hasta
una probabilidad de cero en la zona suroriental. Los departamentos con
territorios con mayor probabilidad para la presencia de A. aegypti (> .75), son Escuintla,
Santa Rosa, Suchitepéquez, Retalhuleu, San Marcos, Quetzaltenango y Jutiapa.
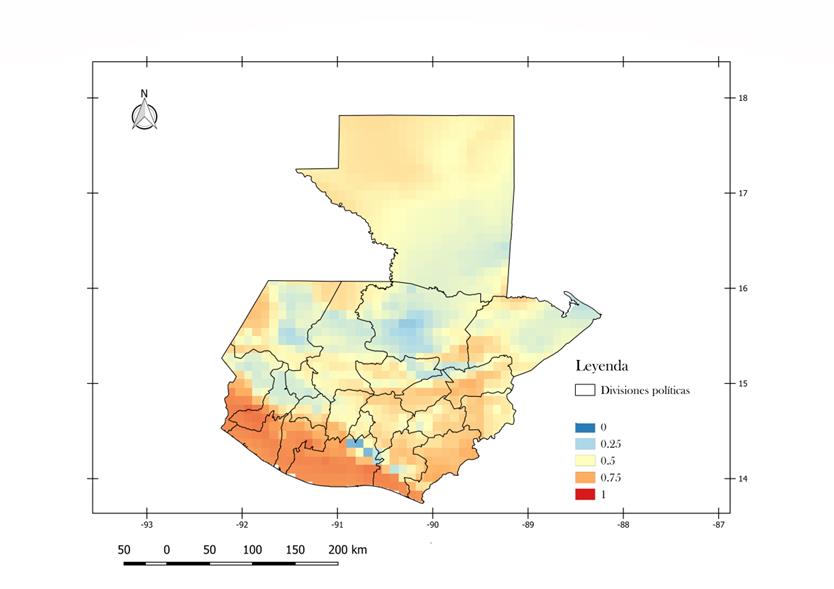 Figura 2.
Mapa de probabilidad
de presencia de A. aegypti
en Guatemala: Mapa generado en Quantum GIS. Fecha: Junio 2017. El mapa muestra
las condiciones favorables para la ocurrencia del mosquito desde 0 (azul) hasta
1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017
Figura 2.
Mapa de probabilidad
de presencia de A. aegypti
en Guatemala: Mapa generado en Quantum GIS. Fecha: Junio 2017. El mapa muestra
las condiciones favorables para la ocurrencia del mosquito desde 0 (azul) hasta
1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017
Dengue
De acuerdo a la figura 3 la zona costera que colinda con el Océano Pacífico presenta una alta probabilidad (.75 - 1) a diferencia de las costas que tiene contacto con el Océano Atlántico las cuales presentan una probabilidad baja (0 - .25). Los puntos con mayor probabilidad de presentar incidencia de casos de dengue se encuentran en la zona noroeste de Huehuetenango, la zona comprendida entre Ciudad Tecún Umán y la costa del pacífico en San Marcos, Las comunidades que rodean el lago de Atitlán en Sololá, La región Noreste de Escuintla y la zona montañosa entre Pueblo Nuevo Viñas, volcán Tecuamburro, Volcán Cruz Quemada y Volcán Moyuta en Santa Rosa. La mayor probabilidad para la incidencia de casos de dengue en Guatemala se observa 19 de los 22 departamentos.
En los sistemas montañosos, las áreas con mayor probabilidad de presentar casos se encuentran entre el sistema de Montañas de la Sierra madre. Las montañas de San Juan, Sierra de Chuacus y Sierra de las Minas cuentan con la mayor probabilidad (.75 - 1). Otra zona con alta probabilidad es la que se encuentra en la zona Oeste de Huehuetenango, en la zona baja de la cordillera de los Cuchumatanes (.75 - 1). Se puede resaltar que las tierras bajas del sur del país cuentan con áreas con la mayor probabilidad de incidencia de casos, mientras que las tierras bajas del Petén no presentan probabilidad de incidencia de casos.
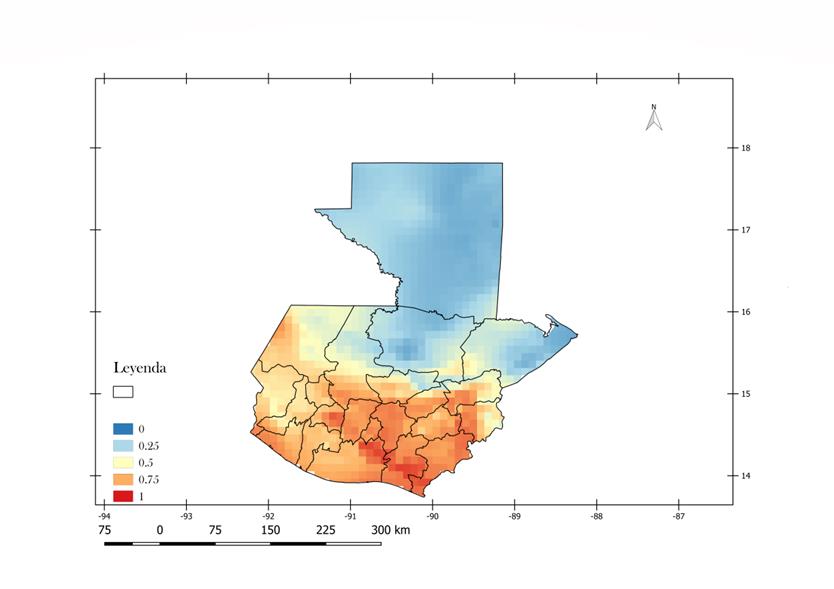 Figura 3.
Mapa de probabilidad
de incidencia de dengue en Guatemala.
Mapa generado en Quantum GIS. Fecha: Junio 2017. El mapa muestra las
condiciones favorables para la ocurrencia de casos de dengue desde 0 (azul)
hasta 1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017.
Figura 3.
Mapa de probabilidad
de incidencia de dengue en Guatemala.
Mapa generado en Quantum GIS. Fecha: Junio 2017. El mapa muestra las
condiciones favorables para la ocurrencia de casos de dengue desde 0 (azul)
hasta 1 (rojo), en una resolución de 10 km X 10 km
Mapa generado en Quantum GIS. Fecha: Junio 2017.
De acuerdo a la figura 4 la incidencia de casos de dengue coincide en su gran mayoría con los datos obtenidos por el modelo y la predicción realizada. Se observa en las Figuras 4 y 5 que precisamente los departamentos con baja probabilidad de incidencia de casos de dengue cuentan con un porcentaje bajo de casos. Petén cuenta únicamente con el 3.7 % de los casos reportados, Izabal reporta únicamente el 1.42% de casos y Alta Verapaz 6.41% sumando un total del 11.53% de casos. Las condiciones para la incidencia de casos se centra en departamentos como Guatemala (27.45% de casos), Quetzaltenango (8.76% de casos) y Santa Rosa (8.61% de casos) y Escuintla (7.4% de casos) departamentos que en conjunto suman el 52.2% de los casos. Departamentos con alta probabilidad, pero con un porcentaje bajo de casos reportados como Chimaltenango (0.32%), Totonicapán (0.02%) y Jalapa (1.11%).
Cabe mencionar que el número de casos que se presentan en época seca (noviembre-abril) es mayor al número de sitios que presentan casos en época lluviosa (mayo-octubre). Al observar los casos por época (Figura 4), se puede ver que departamentos como Petén, Izabal, Huehuetenango, Retalhuleu, Totonicapán y Zacapa muestran casos de dengue únicamente en época seca, mientras que los 16 departamentos restantes muestran casos de dengue en ambas épocas.
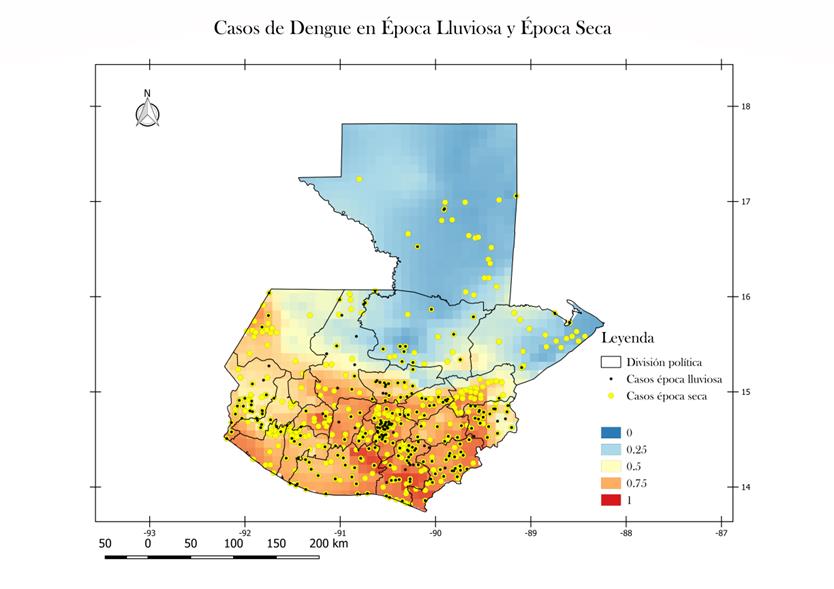 Figura 4.
Sitios en los
cuales se presentan casos de dengue en época lluviosa y época seca, sobre el
mapa de probabilidad de incidencia de dengue en Guatemala. Época seca: Mayo,
Junio, Julio, Agosto, Septiembre, Octubre. Época lluviosa: Noviembre,
Diciembre, Enero, Febrero, Marzo, Abril. Mapa generado en Quantum GIS.Fecha: Junio 2017. El mapa muestra las condiciones
favorables para la ocurrencia de casos de dengue desde 0 (azul) hasta 1 (rojo),
en una resolución de 10 km X 10 km.
Mapa generado en Quantum GIS.Fecha: Junio 2017.
Figura 4.
Sitios en los
cuales se presentan casos de dengue en época lluviosa y época seca, sobre el
mapa de probabilidad de incidencia de dengue en Guatemala. Época seca: Mayo,
Junio, Julio, Agosto, Septiembre, Octubre. Época lluviosa: Noviembre,
Diciembre, Enero, Febrero, Marzo, Abril. Mapa generado en Quantum GIS.Fecha: Junio 2017. El mapa muestra las condiciones
favorables para la ocurrencia de casos de dengue desde 0 (azul) hasta 1 (rojo),
en una resolución de 10 km X 10 km.
Mapa generado en Quantum GIS.Fecha: Junio 2017.
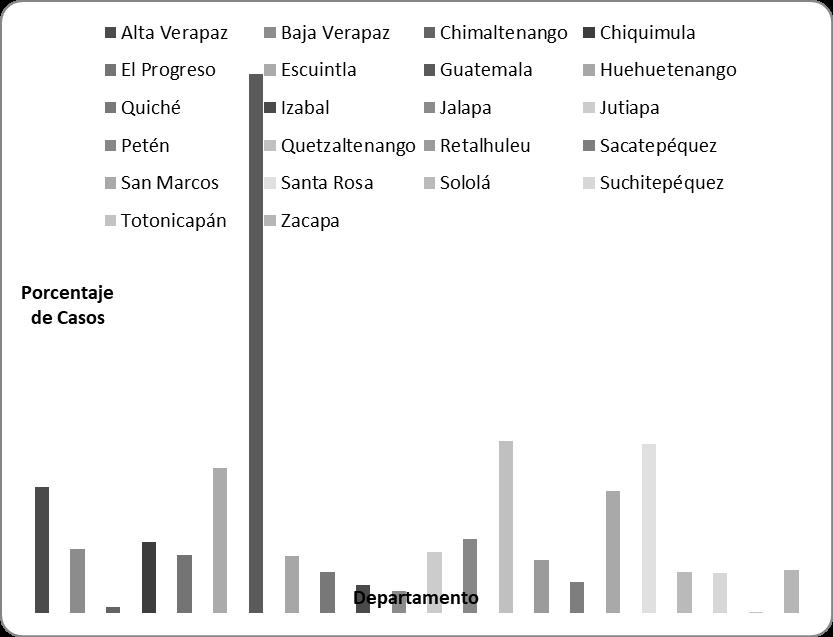 Figura 5.
Porcentaje de
casos de dengue, por departamento del año 2010-2017 hasta la semana
epidemiológica 16 (22 de abril de 2017). Fuente: Unidad de Difusión de
Estadísticas de Salud, Sistema de Información Gerencial en Salud (SIGSA),
Ministerio de Salud Pública y Asistencia Social. Fecha:
Junio 2017
Unidad de Difusión de
Estadísticas de Salud, Sistema de Información Gerencial en Salud (SIGSA),
Ministerio de Salud Pública y Asistencia Social. Fecha:
Junio 2017.
Figura 5.
Porcentaje de
casos de dengue, por departamento del año 2010-2017 hasta la semana
epidemiológica 16 (22 de abril de 2017). Fuente: Unidad de Difusión de
Estadísticas de Salud, Sistema de Información Gerencial en Salud (SIGSA),
Ministerio de Salud Pública y Asistencia Social. Fecha:
Junio 2017
Unidad de Difusión de
Estadísticas de Salud, Sistema de Información Gerencial en Salud (SIGSA),
Ministerio de Salud Pública y Asistencia Social. Fecha:
Junio 2017.
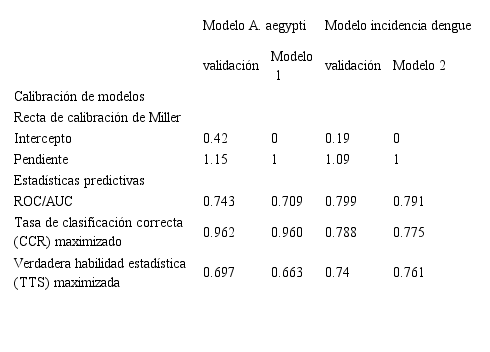
La
recta de calibración de Miller mostró que los modelos generados se ajustaban a
los datos con valores de intercepto cercanos a 0 y pendientes cercanas a 1. La
capacidad discriminativa y de clasificación de ambos modelos, de acuerdo al
área bajo la curva presenta valores por arriba de 0.7 (Tabla 2). Para la
transformación de los resultados obtenidos a un mapa de presencia/ausencia, los
valores de la tasa de clasificación correcta de los dos modelos y la verdadera
habilidad estadística de ambos son presentados en la misma tabla.
Tabla 2.
Calibración de modelos A. aegyptiy y dengue.
|
Modelo A. aegypti
|
Modelo
incidencia dengue
|
|
validación
|
Modelo 1
|
validación
|
Modelo 2
|
|
Calibración de modelos
| | | | |
|
Recta
de calibración de Miller
| | | | |
|
Intercepto
|
0.42
|
0
|
0.19
|
0
|
|
Pendiente
|
1.15
|
1
|
1.09
|
1
|
|
Estadísticas predictivas
| | | | |
|
ROC/AUC
|
0.743
|
0.709
|
0.799
|
0.791
|
|
Tasa de
clasificación correcta (CCR) maximizado
|
0.962
|
0.960
|
0.788
|
0.775
|
|
Verdadera
habilidad estadística (TTS) maximizada
|
0.697
|
0.663
|
0.74
|
0.761
|
Discusión
Los resultados muestran una alta probabilidad de condiciones para la presencia de A. aegypti en 21 de los 22 departamentos de Guatemala en al menos una región (probabilidad entre .5 y 1). Estos resultados apoyan los reportados por Lepe y colaboradores (2016), quienes obtienen la misma distribución en cuanto a departamentos se refiere. Climas muy fríos son limitantes para el desarrollo de organismos ectotermos que requieren de una fuente de calor externa a la producida por ellos mismos. Es por esto que el departamento de Totonicapán, debido a la temperatura que registra a través del año, no ha reportado presencia de vectores de dengue ni de Chagas (Tabaru et al., 1998), en comparación a departamentos con climas más cálidos como Escuintla y Santa Rosa.
La ausencia de datos georreferenciados provenientes del Programa de Enfermedades Transmitidas por Vectores oscurece en gran medida la presentación y generación de mapas que puedan generar información de alerta para brotes de casos febriles.
Las variables que determinan la probabilidad de presencia de A. aegypti de acuerdo a los modelos coinciden con las principales variables predictoras de Kraemer et al. (2015). Tal como se reporta con anterioridad, las condiciones climáticas que afectan directamente la presencia del vector son la temperatura y máxima precipitación, variables que intervienen directamente en el ciclo gonotrófico y la sobrevivencia de los adultos (Brady et al., 2012). Existe por lo tanto siempre una menor probabilidad de encontrar el vector en sitios rurales que presentan condiciones de precipitación altas o temperaturas muy bajas. Este resultado puede explicar el aumento de casos de dengue en la época seca (Figura 4). El modelo propuesto para la distribución actual del vector está basado únicamente en variables ambientales. Es por esto que los resultados mostrados deben tomarse con precaución ya que no se tomaron variables antropogénicas como la conducta de los habitantes en las distintas regiones con respecto al mosquito, la presencia de recipientes útiles para la crianza de los estadios larvales del vector, la disponibilidad de agua en las comunidades y el manejo de desechos sólidos que han mostrado ser esenciales para la presencia de estos organismos (Organización Mundial de la Salud [OMS] & Programa Especial para la Investigación y Capacitación de Enfermedades Tropicales, 2010).
Los procedimientos que lleva a cabo el MSPAS para el control y vigilancia vectorial no toman en cuenta aspectos ecológicos. Aunque dichas campañas y posterior vigilancia se realiza a partir de índices entomológicos o reportes de casos, el resultado no tiene el alcance que se esperaría debido a que este problema debe de abordarse basándose en aspectos ecológicos relacionados al vector, al virus y factores de riesgo antropogénicos tales como acceso a agua, servicio de extracción de basura o alcantarillado (Hahn, et al., 2016).
La incidencia de casos de dengue se ve altamente influenciada por la presencia del vector en el sur del territorio a lo largo de la costa del Pacífico, a pesar de que la presencia del vector no es sinónimo de presencia de enfermedad, ya que puede no estar circulando el virus ni en la población humana ni en la del mosquito transmisor.
El alto número de pacientes detectados en Petén (Figura 2 y 3), muestra que la presencia del vector en el departamento no implica causalidad con la enfermedad. Los casos reportados pueden deberse a la presencia de un segundo vector que se encuentre inmerso en la dinámica de la enfermedad, a migración de casos, a la presencia de variables no tomadas en cuenta en este estudio. Este problema puede ser abordado mediante estrategias que integren redes de información que faciliten el acceso a la historia clínica de los pacientes entre los profesionales de salud.
La distribución potencial del vector no coincide con la distribución potencial de la enfermedad en la región norte del país de acuerdo al modelo 2 (Figura 2 y 3), hecho que pone de manifiesto la sospecha de un segundo actor en la transmisión del virus. Estas zonas pueden deber sus altas probabilidades de incidencia, a la distribución de A. albopictus (Lepe et al., 2016), vector que compite por los mismos recursos que utiliza el primero A. aegypti. De hecho se ha observado un desplazamiento de A. aegypti, en ambientes rurales por parte de A. albopictus debido a la alta capacidad de sobrevivencia que este último tiene bajo condiciones que no favorecen a otros vectores, condiciones como hacinamiento, temperaturas por debajo de los 20° C o criaderos con características más selváticas presentes en comunidades antropogénicas presentes en regiones rurales (Black, Rai, Turco, & Arroyo, 1989).
Otro factor que podría explicar la distribución más extensa de incidencia de casos con relación a la distribución del vector observada en todo el país, es la existencia de sub-registro debido a que la falta de asistencia de los pacientes a los centros de salud, o bien el personal de estas entidades públicas no posean las herramientas adecuadas para distinguir casos de dengue a las de otras arbovirosis con sintomatologías similares como la fiebre de chikungunya o zika.
Para poder abordar la enfermedad de manera adecuada debe contarse con personal capacitado para dicha tarea, además de personal capaz de realizar las intervenciones de control vectorial necesarias para evitar la diseminación del virus. En Guatemala el monitoreo de los criaderos de mosquitos a través de índices larvales y pupales por vivienda en cada comunidad es la medida más común utilizada para determinar el riesgo de brotes de dengue (MSPAS, OPS, & Organización Mundial de la Salud [OMS], 2015). El personal del Ministerio de Salud encargado del control vectorial es insuficiente para cubrir las exigencias de la metodología utilizada por lo que se muestrea los mismos sitios (MSPAS, OPS & OMS, 2015). Debido a esto la vigilancia vectorial debe abordarse a través de modalidades distintas como sitios centinela o el uso de ovitrampas, en lugares como: a) La Unión, Nentón, Huehuetenango, b) Ciudad Tecún Umán San Marcos y c) Palín, Escuintla. Los sitios centinela definidos como los sitios donde los casos de dengue y las poblaciones del vector son recurrentemente altos, deben ser seleccionados con base en diversas fuentes de información.
La información obtenida por este estudio acerca de las zonas con alto riesgo de transmisión probable de dengue pueden ser utilizada para la selección de sitios centinela en el país siendo estos: 1) la región noroeste de Huehuetenango, 2) la región comprendida entre Ciudad Tecún Umán y la costa del pacífico en San Marcos, 3) las comunidades que rodean el lago de Atitlán en Sololá, 4) la región noreste de Escuintla y 5) la zona montañosa entre Pueblo Nuevo Viñas, volcán Tecuamburro, Volcán Cruz Quemada y Volcán Moyuta en Santa Rosa (Figura 3). Se sugiere realizar los estudios de campo necesarios para establecer la utilidad de las regiones obtenidas, debido a que el estudio presente muestra datos ecológicos a escalas muy amplias, es necesario la investigación en relación a elementos que se ven implicados a escala de microclima (Jansen & Beebe, 2010), comprender los aspectos culturales en la población humana en estas zonas con relación a la enfermedad (Bastos & Camus, 2004) e índices entomológicos.
En conclusión, la incidencia de casos de dengue en el territorio guatemalteco se ve altamente influenciada por la presencia del vector A. aegytpi, sin embargo los casos de dengue no presentan una relación de causalidad con la distribución espacial del vector. Por lo que se sugiere 1. Realizar una indagación más profunda sobre la relación entre el vector A. albopictus y su papel en la transmisión de dengue en la región norte del país, 2. Definir sitios centinelas para la vigilancia de los vectores los cuales podrían ser a) la región noroeste de Huehuetenango, b) la región comprendida entre Ciudad Tecún Umán y la costa del pacífico en San Marcos y c) la región noreste de Escuintla 3. Evaluar los proceso de control vectorial utilizados por las autoridades y el impacto que tienen en la salud de la población.
Referencias
Allouche, O., Tsoar, A., & Kadmon, R. (2006). Assessing the accuracy of species distribution models: prevalence, kappa and the true skill statistic (TSS). Journal of Applied Ecology, 43(6), 1223-1232. doi:10.1111/j.1365-2664.2006.01214.x
Barbosa, A. M. (Project Admin.) (2014). fuzzySim: Fuzzy Similarity in Species Distributions. R package version 1.7.9/r96. Recuperado de https://r-forge.r-project.org/projects/fuzzysim.
Barbosa, A. M. (2015). fuzzySim: applying fuzzy logic to binary similarity indices in ecology. Methods in Ecology and Evolution, 6, 853-858. doi:10.1111/2041-210X.12372
Barbosa, A. M. (2017). R script del seminario/hangout: Selección de variables, construcción y evaluación de modelos de distribución de especies con los paquetes R 'fuzzySim' y 'modEvA'. Recuperado de https://github.com/AMBarbosa/scripts/blob/master/hangout_fuzzySim_modEvA.
Barbosa, A. M., Brown, J. A., Jimenez-Valverde, A., & Real, R. (2016). modEvA: Model evaluation and analysis. R package version 1.3.2. Recuperado de https://CRAN.R-project.org/package=modEvA
Barbosa, A. M., & Real, R. (2012). Applying fuzzy logic to comparative distribution modelling: a case study with two sympatric amphibians. The Scientific World Journal, 2012. doi:10.1100/2012/428206
Bastos, S., & Camus, M. (2004). Multiculturalismo y pueblos indígenas: reflexiones a partir del caso de Guatemala. Revista Centroamericana de Ciencias Sociales, 1(1), 87-112.
Becker R. B & Wilks A. R. (2018). maps: Draw Geographical Maps. R package version 3.3.0. Recuperado de https://CRAN.R-project.org/package=maps
Benjamini, Y., & Hochberg, Y. (1995). Controlling the false discovery rate: A practical and powerful approach to multiple testing. Journal of the Royal Statistical Society, 57 (1), 289-300.
Bhatt, S., Gething, P. W., Brady, O. J., Messina, J. P., Farlow, A. W., Moyes, C. L., … Hay, S. I. (2013). The global distribution and burden of dengue. Nature, 496(7446), 504-507.
Black, W. C., Rai, K. S., Turco, B. J., & Arroyo, D. C. (1989). Laboratory study of competition between United States strains of Aedes albopictus and Aedes aegypti. Journal of Medical Entomology, 26(4), 260-271.
Brady, O., Gething, P., Bhatt, S., Messina, J., Brownstein, J., Hoen, A., … Hay S. I. (2012). Refining the global spatial limits of dengue virus transmission by evidence-based consensus. Neglected Tropical Diseases, 6(8), e1760.
Carpenter, G., Gillison, A., & Winter, J. (1993). DOMAIN: A flexible modeling procedure for mapping potential distributions of animals and plants. Biodiversity and Conservation, 2(6), 667-680.
Elith, J., Graham, C., Anderson, R., Dudik, M., Ferrier, S., Guisan, A., … Zimmermann, N. E. (2006). Novel methods improve prediction of species distributions from occurrence data. Ecogeography, 29(2),129-151. doi:10.1111/j.2006.0906-7590.04596.x
Escobar, L. E., Romero-Álvarez, D., Leon, R., Lepe-López, M. A., Craft, M. E., Borbor-Córdova, M. J., … Svening J. C. (2016). Declining prevalence of disease vectors under climate change. Scientific Reports, 6, 39150. doi: 10.1038/srep39150
Global Biodiversity Information Facility -GBIF-. (2017). Acceso libre y gratuito a los datos de biodiversidad. Recuperado de http://www.gbif.org/
Grard, G., Caron, M., Mombo, I. M., Nkoghe, D., Ondo, S. M., Jiolle, D., … Leroy, E. (2014). Zika virus in Gabon (Central Africa) - 2007: A new threat from Aedesalbopictus?. PLoS Neglected Tropical Diseases, 8(2), e2681. doi:10.1371/journal.pntd.0002681
Gratz, N. (2004). Critical review of the vector status of Aedes albopictus. Medical and Veterinary Entomology, 18(3), 215-227.
Gubler, D. (2014). Dengue viruses: Their evolution, history and emergence as a global public health problem. In D. Gubler, E. Ooi, & S. Farrar. Dengue and dengue hemorrhagic fever (pp. 480-496). London: CAB International.
Hahn, M. B., Eisen, R. J., Eisen, L., Boegler, K. A., Moore, C. G., McAllister, J., … Mutebi, J. P. (2016). Reported Distribution of Aedes (Stegomyia) aegypti and Aedes (Stegomyia) albopictus in the United States, 1995-2016 (Diptera: Culicidae). Journal of Medical Entomology, 53(5), 1169-1175.
Hardy, J. L., Houk, E. J., Kramer, L. D., & Reeves, W. C. (1983). Intrinsic factors affecting vector competence of mosquitoes for arboviruses. Annual Review of Entomology, 28(1), 229-262.
Hijmans, R. J., Cameron, S. E., Parra, J. L., Jones, P. G., & Jarvis, A. (2005). Very high resolution interpolated climate surfaces for global land areas. International journal of climatology, 25(15), 1965-1978.
Jansen, C. C., & Beebe, N. W. (2010). The dengue vector Aedes aegypti: what comes next. Microbes and Infection, 12(4), 272-279.
Jentes, E., Poumerol, G., Gershman, M. D, Hill, D. R., Lemarchand, J., Lewis, R. F., … Monath, T. P. (2011). The revised global yellow fever risk map and recommendations for vaccination, 2010: consensus of the Informal WHO Working group on geographic risk for yellow fever. The Lancet Infectious Diseases, 11(8), 622-632.
Juliano, S. A. (1998). Species introduction and replacement among mosquitoes: interspecific resource competition or apparent competition. Ecology, 79(1), 255-268
Kraemer, M. U., Sinka, M. E., Duda, K. A., Mylne, A. Q., Shearer, F. M., Barker, C. M., … Hay S. I. (2015). The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus. eLife,4, e08347. doi: 10.7554/eLife.08347.
Lambrechts, L., Paaijmans, K. P., Fansiri, T., Carrington, L. B., Kramer, L. D., Thomas, M. B., & Scott, T. W. (2011). Impacto de las fluctuaciones diarias de temperatura en la transmisión del virus del dengue por Aedes aegypti. Proceedings of the National Academy of Sciences of the United States of America, 108(18), 7460 - 7465.
Legendre, P., & Legendre, L. (2012). Numerical ecology (3rd ed.). Amsterdam: Elsevier.
Leparc-Goffart,I., Nougairede, A., Cassadou, S., Prat, C., & Lamballerie, X. (2014). Chikungunya in the Americas. The Lanccet, 383(9916), 514.
Lepe, M., Dávila, A., Canet M., López Y., Flores E., Dávila A., & Escobar L. (2016). Distribución de Aedes aegypti y Aedes albopictus en Guatemala. Ciencia, Tecnología y Salud, 4(1), 21-31.
Lover, A. A., Buchy, P., Rachline, A., Moniboth, D., Huy, R., Meng, C. Y., …Cavailler P. (2014). Spatial epidemiology and climatic predictors of pediatric dengue infections captured via sentinel site surveillance, Phnom Penh Cambodia 2011–2012. BMC Public Health, 14(1), 658. doi: 10.1186/1471-2458-14-658.
Marquardt, D. W. (1970). Generalized inverses, ridge regression, biased linear estimation, and nonlinear estimation. Technometrics,13(3), 591-612.
Ministerio de Salud Pública y Asistencia Social, Organización Panamericana de la Salud, & Organización Mundial de la Salud. (2015). Manual operativo de vigilancia y control entomológico de Aedes aegyptivector del dengue y chikungunya en Guatemala. Guatemala: Autor.
Nelson, M. J. (1986). Aedes aegypti: Biología y Ecología. Washington: Organización Panamericana de la Salud.
Ogata, K., & Samavoa, L. (1996) Discovery of Aedes albopictus in Guatemala. Journal of the American Mosquito Control Association, 12(3 Pt 1), 503-506.
Organización Mundial de la Salud, & Programa Especial para la Investigación y Capacitación de Enfermedades Tropicales. (2010). Dengue: Guías para el diagnóstico, tratamiento, prevención y control. La Paz: Organización Panamericana de la Salud, Organización Mundial de la Salud.
Organización Panamericana de la Salud, & Organización Mundial de la Salud. (1959). Resolución CD11.R13. Estado de la Erradicación de Aedes aegypti en las Américas. Recuperado de http://iris.paho.org/xmlui/bitstream/handle/123456789/1979/CD11.R13sp.pdf?sequence=2&isAllowed=y
Patz, J., Martens, W., Focks, D., & Jetten, T. (1998). Dengue fever epidemic potential as projected by general circulation models of global climate change. Environ Health Perspect, 106(3), 147-153.
Peterson, A. T., Soberón, J., Pearson, R. G., Anderson, R. P., Martínez-Meyer, E., Nakamura, M., …. Araújo, M. B. (2011). Ecological Niches and Geographic Distributions. New Jersey: Princeton University Press.
Pliscoff, P., & Fuentes-Castillo, T. (2011). Modelación de la distribución de especies y ecosistemas en el tiempo y en el espacio: una revisión de las nuevas herramientas y enfoques disponibles. Revista de Geografía Norte Grande, 48, 61-79.
QGIS Development team (2017). QGIS Geographic information system. Open source geospatial foundation project. Recuperado de http://qgis.osgeo.org
R Core team (2017). R: A language and environment for statistical computing. R Foundation for statistical computing. Vienna, Austria. Recuperado de https://www.R-project.org/
Real, R., Barbosa, A., & Vargas, J. M. (2006). Obtaining environmental favorability functions from logistic regression. Environmental Ecology Statistics, 13(2), 237-245.
Rocchini, D., Hortal, J., Lengyel, S., Lobo, J.M., Jimenez-Valverde, A., Ricotta, C., … Chiarucci, A. (2011). Accounting for uncertainty when mapping species distributions: the need for maps of ignorance. Progress in Physical Geography, 35(2), 211–226
Samuel, G. H., Adelman, Z. N., & Myles, K. M. (2016). Temperature-dependent effects on the replication and transmission of arthropod-borne viruses in their insect hosts. Current Opinion in Insect Science, 16, 108-113. doi:10.1016/j.cois.2016.06.005.
Simmons, C. P., Farrar, J. J., Chau, N. V., & Wills, B. (2012).Dengue. The New England Journal of Medicine, 366(15), 1423-1432.
Stockwell, D. R., & Peters, D. P. (1999). The GARP modelling system: problems and solutions to automated spatial prediction. International Journal of Geographic Information Systems, 13(2), 143-158. doi: 10.1080/136588199241391
Tabaru Y, Monroy, C, Rodas A, Mejia M, Pichilla R, Mauricio H, and Pérez M. 1998. Distribution of Aedes albopictus (Diptera Culicidae) in Guatemala, following colonization in 1995. Medical Entomology and Zoology,. 49 (4), 331-336.
Thiberville, S. D., Moyen, N., Dupuis-Maguiraga, L., Antoine, N., Gould, E. A., Roques, P., … de Lamballerie, X. (2013). Chikungunya fever: Epidemiology, clinical syndrome, pathogenesis and therapy. Antiviral Research, 99(3), 345-370.
Sistema de Información Gerencial en Salud. (2017). Casos de dengue por centro de salud. Guatemala, Ministerio de salud pública y asistencia social. Recuperado de http://sigsa.mspas.gob.gt/component/jdownloads/category/14-sigsa-web?Itemid=-1
Van K. E., Bambrick
H., & Hales, S. (2017). La
distribución geográfica de la fiebre del dengue y la influencia potencial del
cambio climático global. TropIKA.net.
Recuperado de http://journal.tropika.net/scielo.php?script=sci_arttext&pid=S2078-86062010005000001&lng=en.
Villatoro, G. R. (2006). Historia del Dengue en Guatemala. Guatemala: Editorial Universidad
de San Carlos de Guatemala.
Watts, D. M., Burke, D. S., Harrison, B. A., Whitmire, R. E., & Nisalak, A. (1987). Efecto de la temperatura en la eficiencia del vector de Aedes aegypti para virus dengue. The American Journal of Tropical Medicine Hygiene, 36 (1), 143-152.












