Introducción
El ensayo clínico controlado (ECC) es una investigación experimental planificada, controlada y prospectiva. En él, una o más intervenciones son asignadas a participantes humanos para evaluar sus efectos sobre condiciones de salud, en términos de eficacia (cuando los efectos son evaluados en condiciones ideales) y seguridad de tratamientos e intervenciones para diversas enfermedades.(1)
De esta manera ha llegado a convertirse en el estándar de oro de la investigación clínica. Se han desarrollado métodos de evaluación más objetivos, generalizado el empleo de la aleatorización, el enmascaramiento y el correcto análisis estadístico. Esos son pilares sobre los que descansa la calidad de un ensayo clínico y los que garantizan la fiabilidad de los resultados obtenidos.(2)
Durante los últimos 70 años, los ensayos clínicos se han perfeccionado, constituyéndose en la metodología fundamental de las agencias reguladoras de medicamentos para autorizar la comercialización de estos productos.(3)
En este sentido durante las últimas décadas del siglo pasado hubo un incremento significativo de las investigaciones clínicas en Cuba, lo que trajo consigo el desarrollo científico en el diseño, coordinación, conducción, monitorización,
inspección y auditoría de los estudios en seres humanos. Además de la protección de los derechos de los sujetos incluidos en este tipo de investigación.(4,5)
Aunque hubo algunos logros durante la década de 1980 a 1990, el sector biotecnológico cubano continuaba realizando avances científicos relevantes, los centros de investigación que desarrollaban los nuevos tratamientos trabajaban directamente con los hospitales en la realización de los ensayos clínicos. En su conjunto este enfoque presentó problemas en relación con el diseño y la implementación de los ensayos clínicos, unido a largos intervalos de demora entre el descubrimiento científico y la disponibilidad de los nuevos tratamientos para los pacientes.(6)
En este contexto surge el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) en 1991. A partir de su creación, un propósito importante fue la instauración de una red que contara con múltiples instituciones en el país para la ejecución de los ensayos clínicos y así aumentar la eficiencia, alcanzar los resultados con mayor velocidad y con estándares de calidad requeridos.(4)
Así en el año 1998 el Hospital General Dr. Juan Bruno Zayas Alfonso de Santiago de Cuba se inserta en esta red nacional y desde entonces ha participado activamente en la ejecución de ensayos clínicos multicéntricos, a partir de una estrategia de apertura para la realización de ensayos clínicos en el año 2005/2006. Institución certificada en Buenas Prácticas Clínicas desde el 2011 ha contribuido a proporcionar evidencias científicas que sustentan intervenciones y determinadas acciones de salud, al igual que el registro sanitario de nuevos productos y su posterior comercialización dentro y fuera del país.
Es por ello, que los autores se propusieron como objetivo describir la experiencia adquirida y el desarrollo alcanzado por el Hospital General “Dr. Juan Bruno Zayas Alfonso” en la ejecución de protocolos de ensayo clínico multicéntricos.
Métodos
Se realizó un estudio descriptivo sobre la ejecución de ensayos clínicos realizados en el Hospital General “Dr. Juan Bruno Zayas Alfonso” de Santiago de Cuba desde
el año 2005 hasta diciembre de 2020. Se empleó la técnica de revisión documental.
Se revisó la documentación de cada uno de los ensayos clínicos, carpeta del investigador y carpeta del farmacéutico. También registros relacionados con la conducción de estas investigaciones por el coordinador de la investigación clínica, documentos institucionales e informes no publicados. Igualmente informes de las visitas evaluadoras del CENCEC para la preparación del sitio a la re certificación en Buenas Prácticas Clínicas y los informes de inspecciones realizadas por el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED), que incluyeron las de certificación y recertificación en Buenas Prácticas Clínicas realizadas.
Se analizaron las variables: centro promotor, producto evaluado, fase del ensayo clínico, especialidades médicas, principales indicaciones, pacientes incluidos e investigadores.
Los datos se procesaron en una base de datos en Excel. Los resultados se presentan en tablas mediante números absolutos y porcientos.
Resultados
Desde
1998 hasta 2005 se tiene conocimiento que se realizaron en la institución ocho ensayos clínicos
multicéntricos que se listan a continuación:
-
- Uso de la coriodermina en pacientes con psoriasis.
- Melagenina cálcica en pacientes diagnosticados con vitiligo. Fase III.
- Eficacia de la Jalea Liposómica de Clobetazol en pacientes con psoriasis.
- LeukoCIM en pacientes oncohematológicos.
- Aplicación del Interferón alfa 2B recombinante humano en el tratamiento de la Esquizofrenia Paranoide.+
- Empleo del Interferón Alfa 2B recombinante en el tratamiento de la leucemia mieloide crónica.
- Empleo del Interferón Alfa en el tratamiento de la fase de mantenimiento del mieloma múltiple.
- CEA – C5 en tumores colorectales
En el período comprendido de 2005 hasta diciembre de 2020 se han ejecutado 39 ensayos clínicos multicéntricos, lo cual permitió la evaluación clínica de 22 productos farmacéuticos en 21 indicaciones médicas. De los productos estudiados 10 han sido en enfermedades oncológicas con la realización de 23 ensayos clínicos (58,9 %), en localizaciones como riñón, pulmón, mamas, esófago, próstata, cabeza y cuello, piel, ovario, cuello uterino y sistema hematológico.
Por otra parte se han desarrollado 16 investigaciones (41 %) en diversas indicaciones no oncológicas en enfermedades como hepatitis por virus B, infección por el virus de inmunodeficiencia adquirida, enfermedad hemorroidal aguda, infarto cerebral agudo, hiperplasia prostática benigna, asma bronquial persistente, en el síndrome de distrés respiratorio del adulto e infarto agudo del miocardio.
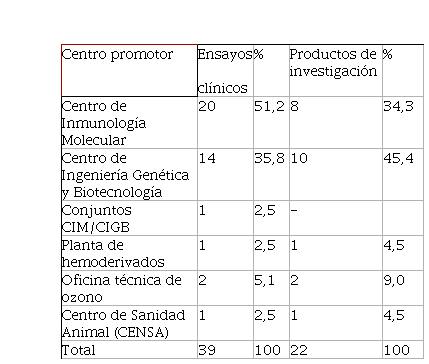
Dentro de los centros promotores que han ejecutado ensayos clínicos en el hospital se destacó el Centro de Inmunología Molecular (CIM) con 20 ensayos y el Centro de Ingeniería Genética y Biotecnología (CIGB) con 14 para un 87 % y 51,2
% respectivamente (Tabla 1). A medida que se desarrolló el sector biotecnológico y el trabajo con los hospitales, el CIGB fue el primer promotor que comenzó a realizar ensayos clínicos en este centro. A partir de 2005 aumentó la participación institucional en estas investigaciones.
Tabla 1
Ensayos clínicos y productos evaluados por promotor
|
Centro promotor
|
Ensayos clínicos
|
%
|
Productos de investigación
|
%
|
|
Centro de Inmunología Molecular
|
20
|
51,2
|
8
|
34,3
|
|
Centro de Ingeniería Genética y Biotecnología
|
14
|
35,8
|
10
|
45,4
|
|
Conjuntos CIM/CIGB
|
1
|
2,5
|
-
| |
|
Planta de hemoderivados
|
1
|
2,5
|
1
|
4,5
|
|
Oficina técnica
de ozono
|
2
|
5,1
|
2
|
9,0
|
|
Centro de Sanidad
Animal (CENSA)
|
1
|
2,5
|
1
|
4,5
|
|
Total
|
39
|
100
|
22
|
100
|
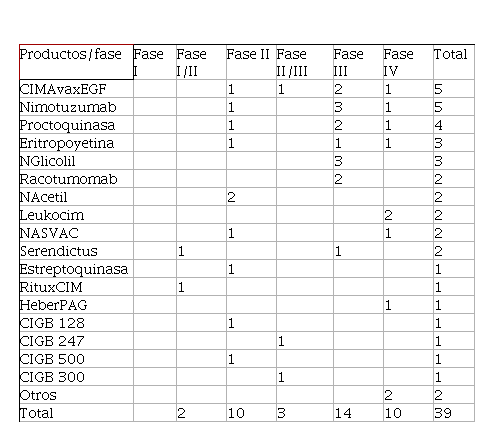
Con
relación a los productos de investigación los más utilizados han sido el CIMAvaxEGF, nimotuzumab, los supositorios
de estreptoquinasa (proctoquinasa), eritropoyetina
y NGlicolil. La mayor cantidad de ensayos ejecutados fueron en fase II, III y IV
de desarrollo de medicamentos (Tabla 2).
Tabla 2
Principales productos de investigación y fases del ensayo clínico
|
Productos/fase
|
Fase I
|
Fase I/II
|
Fase II
|
Fase II/III
|
Fase III
|
Fase IV
|
Total
|
|
CIMAvaxEGF
| | |
1
|
1
|
2
|
1
|
5
|
|
Nimotuzumab
| | |
1
| |
3
|
1
|
5
|
|
Proctoquinasa
| | |
1
| |
2
|
1
|
4
|
|
Eritropoyetina
| | |
1
| |
1
|
1
|
3
|
|
NGlicolil
| | | | |
3
| |
3
|
|
Racotumomab
| | | | |
2
| |
2
|
|
NAcetil
| | |
2
| | | |
2
|
|
Leukocim
| | | | | |
2
|
2
|
|
NASVAC
| | |
1
| | |
1
|
2
|
|
Serendictus
| |
1
| | |
1
| |
2
|
|
Estreptoquinasa
| | |
1
| | | |
1
|
|
RituxCIM
| |
1
| | | | |
1
|
|
HeberPAG
| | | | | |
1
|
1
|
|
CIGB 128
| | |
1
| | | |
1
|
|
CIGB 247
| | | |
1
| | |
1
|
|
CIGB 500
| | |
1
| | | |
1
|
|
CIGB 300
| | | |
1
| | |
1
|
|
Otros
| | | | | |
2
|
2
|
|
Total
| |
2
|
10
|
3
|
14
|
10
|
39
|
Respecto a las especialidades médicas han sido varias las participantes en los ensayos clínicos. Se destacó oncología y neumología con la ejecución de 10 (25,6
%) y 5 (12,8 %) ensayos respectivamente. También gastroenterología, dermatología y hematología.
Con relación a los equipos de investigación, estuvieron constituidos por médicos, licenciadas en enfermería, tecnólogos de la salud en los perfiles de imagenología, laboratorio clínico, citohistopatología y gestión de información en salud. Además, de licenciados en psicología y técnicos de archivo. En el hospital suman más de cien profesionales que han participado en los ensayos clínicos. De ahí, el carácter interdisciplinario de estas investigaciones.
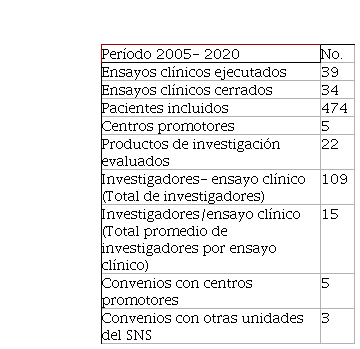
En el período analizado se han incluido 474 pacientes y evaluado 22 productos de investigación de 5 centros promotores. Se han ejecutado 39 protocolos de ensayo
clínico y concluido 34 con la participación de 109 investigadores. La institución tiene convenios con otras instituciones del Sistema Nacional de Salud (SNS) y con centros promotores como se muestra en tabla resumen (Tabla 3).
Tabla 3
Resumen de la actividad de ensayos clínicos
|
Período 2005-
2020
|
No.
|
|
Ensayos clínicos ejecutados
|
39
|
|
Ensayos clínicos cerrados
|
34
|
|
Pacientes incluidos
|
474
|
|
Centros promotores
|
5
|
|
Productos de investigación evaluados
|
22
|
|
Investigadores- ensayo clínico (Total de investigadores)
|
109
|
|
Investigadores/ensayo
clínico (Total promedio de investigadores por ensayo
clínico)
|
15
|
|
Convenios con centros promotores
|
5
|
|
Convenios con
otras unidades del
SNS
|
3
|
Otro
resultado alcanzado por el Hospital General Dr. Juan Bruno Zayas fue en el año 2011 la certificación en Buenas
Prácticas Clínicas. Se certificaron tres sitios clínicos y cinco servicios al igual que el Comité de Ética para
la investigación. Fueron re
certificados en 2015 y luego de prórroga
de la condición, en la actualidad en proceso de recertificación nuevamente.
Discusión
A través de la red nacional de ensayos clínicos de la cual forma parte la provincia de Santiago de Cuba y dentro de esta el Hospital General Dr. Juan Bruno Zayas Alfonso, donde se han desarrollado ensayos clínicos en su mayoría conducidos a través del CENCEC pero otros directamente por el promotor.
A partir del año 2006 se comienzan a realizar ensayos clínicos con varios centros promotores pertenecientes al entonces polo científico del oeste, ahora centros que pertenecen al Grupo de las Industrias Biotecnológica y Farmacéutica (BioCubaFarma). Surge la figura del coordinador de la investigación clínica (CIC), profesional que junto con el investigador se encarga de gestionar todos los aspectos técnicos, logísticos y organizativos en el sitio clínico donde se desarrolla el ensayo clínico.
Los ensayos clínicos ejecutados en la institución han sido fundamentalmente con productos indicados para el tratamiento de enfermedades oncológicas de diversas localizaciones y diferentes etapas clínicas. De manera similar ha sido el comportamiento en otras provincias del país.(7,8,9)
La evaluación de nuevos productos para el tratamiento del cáncer influye en que la provincia tenga una decisiva participación no solo en la evaluación de nuevos productos para el registro sanitario, sino también para facilitar su extensión a la población a través de los estudios fase IV. Estos ensayos clínicos corresponden a los estudios que se realizan con fármacos comercializados. Se llevan a cabo para efectuar la fármacovigilancia del producto, que incluye la detección de efectos secundarios a largo plazo, así como posibles efectos del fármaco sobre la enfermedad en sí misma o estudios de morbilidad y mortalidad.(10,11)
En la actualidad el cáncer es uno de los principales problemas de salud de la sociedad. Situación que se deteriorará a nivel mundial a medida que la población crece y envejece. Estudios prevén que la mortalidad por dicha enfermedad se incremente en un 30 % para el 2030.(12) De ahí que el desarrollo de nuevas líneas de tratamiento en el mundo, a partir de la comprensión de sus mecanismos moleculares conduzca a la realización de ensayos clínicos que se traducen en terapias y diagnósticos que benefician a los pacientes.(13,14,15)
Por otra parte los resultados de los ensayos clínicos son el principal determinante para la autorización y posterior comercialización del fármaco. El mundo desarrollado con su creciente competitividad en este campo impone mayores exigencias en el cumplimiento de los estándares para el registro de los productos médicos y comenzó la certificación de los sitios clínicos para la realización de ensayos clínicos. Esto brinda mayor credibilidad a los resultados obtenidos de las investigaciones realizadas y da mayor prestigio y competitividad al producto.(16,17) En Cuba es necesario obtener esta certificación. Es por ello que el Hospital General Dr. Juan Bruno Zayas Alfonso de Santiago de Cuba basado en la experiencia de trabajo en la planificación y ejecución de ensayos clínicos, así como los avances tecnológicos y estructurales con que cuenta, se propuso por parte del CENCEC iniciar el proceso de certificación en Buenas Prácticas Clínicas
(BPC) que culminaría con la certificación del sitio en octubre de 2011, condición ratificada en 2015 y mantenida hasta la actualidad.
El principal impacto que ha tenido la ejecución de los ensayos clínicos a lo largo de todos estos años ha sido, la contribución al registro sanitario de varios productos y su incorporación al cuadro básico de medicamentos, entre los cuales se encuentran: los interferones y sus disímiles usos en la medicina, la estreptoquinasa recombinante y su uso en cardiología y, de manera local, en la crisis hemorroidal, lo que ha evitado considerablemente las intervenciones quirúrgicas, sus complicaciones y recuperación prolongada además del costo.(2) En este sentido, al registro de anticuerpos monoclonales como el nimotuzumab para el cáncer en las localizaciones de cabeza y cuello, esófago y su incorporación al cuadro básico de medicamentos para estas enfermedades. Igualmente, el registro de la vacuna CIMAvaxEGF y racotumomab para el cáncer de pulmón de alta incidencia en la población.
Con relación al carcinoma basocelular de piel se han disminuido las intervenciones quirúrgicas y la afectación estética de los pacientes con la consecuente mejora en la calidad de vida.
Por otra parte la ejecución de los ensayos clínicos, con la implementación de medidas sistematizadas, con una norma internacional de calidad científica y ética que es la BPC, favorece la ejecución y eleva la calidad de diferentes procesos hospitalarios, lo que deviene en una mejor atención a la población.
De esta manera este centro ha tenido una influencia positiva en el Sistema Nacional de Salud. Por una parte porque para la aceptación del protocolo de ensayo clínico se exigen los mejores estándares de diagnóstico, evaluación y tratamiento. Por otro lado la superación creciente de los recursos humanos que participan en el estudio, que exige mayor rigor científico en su especialidad y en otras áreas relacionadas con la investigación clínica, la metodología de los ensayos clínicos, las BPC y la ética de la investigación, lo cual deviene en una mejor atención a los afectados.
Desde la incorporación de Santiago de Cuba a la red Nacional de Ensayos Clínicos y dentro de esta el Hospital General Dr. Juan Bruno Zayas Alfonso, ha mantenido un trabajo sistemático en la ejecución de ensayos clínicos multicéntricos y con
ello ha contribuido al registro sanitario de varios productos farmacéuticos de centros promotores nacionales fundamentalmente del Centro de Inmunología Molecular y del Centro de Ingeniería Genética y Biotecnología.
Fundamentalmente estos productos constituyen novedosas terapias que se incluyen en el tratamiento del cáncer en disímiles localizaciones y en otras enfermedades que afectan la calidad de vida de los pacientes que las padecen. Al estar la institución certificada en BPC supone mantener la calidad alcanzada en la ejecución de los ensayos clínicos.
Referencias bibliográficas
1. Hincapié Tabares D, Pérez Carrillo V, Donado Gómez JH.
Clasificación de los desenlaces de ensayos clínicos. Medicina U.P.B. 2019;38(2):147-57. DOI: https://doi.org/10.18566/medupb.v38n2.a07
2. Marañón Cardonne T, Landazuri Llago S, Clapé Laffita O, Vaillant Lora Ll, Mastrapa Cantillo K. Desarrollo y principales resultados en la ejecución de los ensayos clínicos en el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso". MEDISAN. 2016 [acceso 29/12/2020];20(5):718-24. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029- 30192016000500018&lng=es
3. Estrada S, Arancibia M, Stojanova J, Papuzinski C. Conceptos
generales en bioestadística y
epidemiología clínica: estudios experimentales con diseño de ensayo clínico aleatorizado. Medwave. 2020;20(2):e7869. DOI: https://doi.org/10.5867/medwave.2020.02.7869
4. Pascual López MA, Jiménez Rivero G, Torres Pombert A, Fors López MM, López Zayas I. Surgimiento, evolución y principales resultados del Centro Nacional Coordinador de Ensayos Clínicos. Rev Cubana Farm. 2011 [acceso 29/12/2020];45(1):4-18. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034- 75152011000100002&lng=es
5. Rodríguez Feria Z, Madrazo Carnero A, Mariño Cruz D. Los ensayos clínicos en Oncología, necesidad terapéutica actual. Correo Científico Medico. 2017 [acceso
29/12/2020];21(4):953-4. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1560- 43812017000400001&lng=es
6. Gorry C. El ABC de los ensayos clínicos en Cuba. MEDICC
Review. 2016 [acceso 29/12/2020];18(3). Disponible en: https://www.scielosp.org/article/medicc/2016.v18n3/9-14/en/
7. Cuevas Pérez O, Fernández Ruíz D, Escandón López G, Quirós Enrique M, García Rodríguez Y. Experiencia en la conducción de ensayos clínicos en Cienfuegos. MEDISUR. 2018 [acceso 28/12/2020];16(1):55-62. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727- 897X2018000100009&lng=es
8. Negret Hernández M, Naranjo Rodríguez S, Cárdenas Garabito D, Ramos Castro
G.
Experiencia en la conducción de ensayos clínicos en la provincia de Matanzas. 2005-2012. Rev. Med. Electrón. 2014 [acceso 29/12/2020];36(4):417-24. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684- 18242014000400004&lng=es
9. Silva Valido D, Soler Cano D, Elías Oquendo L, Sayoux
Thaureaux L, Franco Bonal D.
Experiencia en la ejecución de ensayos clínicos multicéntricos en la provincia de Guantánamo. Rev Inf Cient. 2014 [acceso 28/12/2020];83(1):[aprox.
10 p.]. Disponible en: http://www.revinfcientifica.sld.cu/index.php/ric/article/view/986
10. Cuevas Pérez O, Molina Gómez A, Fernández Ruiz D. Los ensayos
clínicos y su impacto en la sociedad. Medisur. 2016 [acceso 28/12/2020];14(1):13-21. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727- 897X2016000100005&lng=es
11. Chiara R. Proceso de investigación y desarrollo de un nuevo medicamento. Google académico. 2019 [acceso 28/12/2020]. Disponible en: http://dicyt.uto.edu.bo/observatorio/wp-content/uploads/2020/05/PROCESO- DE-INVESTIGACION-Y-DESARROLLO-DE-UN-NUEVO-MEDICAMENTO-Dr-Chiara.pdf
12. Celis Julio E, Pavalkis D. A mission‐oriented approach to cancer in
Europe: a joint mission/vision 2030. Molecular oncology. 2017;11(12):1661-72. DOI: https://doi.org/10.1002/1878-0261.12143
13. Ning Li, Huang Hui Yao, Wu Da Wei, Yang Zhi Min, Wang Jun, Wang Jian Sheng, et al. Changes in clinical trials of cancer drugs in mainland China over the decade 2009–18: a systematic review. The Lancet. 2019;20(11):619-26. DOI: https://doi.org/10.1016/S1470-2045(19)30491-7
14. Burris Howard A. Correcting the ASCO position on phase I
clinical trials in cancer. Nat Rev
Clin Oncol. 2020;17(125). DOI: https://doi.org/10.1038/s41571- 019-0311-4
15. Mierzynska J, Piccinin C, Pe M, Martinelli F, Gotay C, Coens C,
et.al. Prognostic value of
patient-reported outcomes from international randomised clinical trials on cancer: a systematic review. The Lancet.
2019;20(12):685-98. DOI: https://doi.org/10.1016/S1470-2045(19)30656-4
16. Marañón Cardonne T, Herrera Buch A, Calás Rosales M, Griñán Semanat Dianne Y, Vaillant Lora Ll.
Certificación en Buenas Prácticas Clínicas de un sitio clínico. Rev Cubana Salud Pública. 2014 [acceso
29/12/2020];40(4):392-402. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864- 34662014000400013&lng=es.17
17. Salgado Selema G, Santana Paneque AM, Sánchez Sola S, Periche Cuadrado S, Ríos Gutiérrez N. Valoración de las
buenas prácticas clínicas en el desarrollo de los ensayos clínicos, marzo 2015 a marzo 2018. Revista Multimed. 2018
[acceso 29/12/2020];22(5):[aprox. 0 p.]. Disponible en: http://www.revmultimed.sld.cu/index.php/mtm/article/view/998
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Contribuciones de los autores
Tatiana Marañón Cardonne: Conceptualización. Análisis formal. Investigación. Metodología. Administración del proyecto. Visualización. Redacción – borrador original. Redacción – revisión y edición.
Dianne Yurien Griñan Semanat: Curación de datos. Investigación. Redacción – revisión y edición.
Sanlia Landazuri Llago: Curación de datos. Metodología. Redacción – revisión y edición.
Llilian Dangelis Vaillant Lora: Visualización.
Tania Margarita Poulut Durades: Visualización. Redacción – revisión y edición.







