Introducción
La yuca es un cultivo originario de América Tropical e introducido en África y Asia por los conquistadores europeos en los siglos XVII y XVIII (Domínguez et al., 1983). Es considerada la cuarta fuente de calorías después del arroz, la caña de azúcar y el maíz (Ceballos, 2002). Este cultivo se ha convertido en un elemento clave para la lucha contra el hambre y la pobreza (FAO, 2019) y constituye el alimento básico para más de 1000 millones de personas en el mundo aproximadamente (FAO, 2016). En Cuba, la yuca forma parte del grupo de raíces y tubérculos tropicales que la población consume como fuente energética básica para su dieta y es componente esencial de la comida tradicional. Se destinan para la plantación de este cultivo más de 100 mil hectáreas con rendimientos que oscilan entre 4 y 20 t.ha-1. En los últimos años se trabaja por lograr la plantación de 13,42 ha por cada mil habitantes. La superficie cultivada a nivel nacional promedia de 125000 ha, con una producción de 585 000 t de raíces frescas y un rendimiento de 4,7 t.ha-1 (Medero et al., 2015), el cual está muy por debajo del rendimiento promedio mundial (10,9 t.ha-1).
La falta de tecnologías para la producción de material de siembra, en cantidad suficiente y en condiciones fitosanitarias óptimas, se ha convertido en un obstáculo para el desarrollo a escala comercial del cultivo de la yuca (Medero et al., 2015). La propagación vegetativa convencional facilita la diseminación de plagas y enfermedades, lo cual afecta la calidad y cantidad del material de plantación y, por ende, el rendimiento del cultivo. Por todo lo anterior, resulta necesario el empleo de la biotecnología como técnica auxiliar, además del método tradicional, para el mejoramiento genético y la propagación masiva de plantas.
Materiales y métodos
Ubicación del experimento para la toma de datos
El experimento se realizó durante el período comprendido entre enero de 2010 y enero de 2015, en áreas experimentales del Instituto de Investigaciones en Viandas Tropicales (INIVIT), ubicado en el municipio de Santo Domingo, provincia Villa Clara.
Descripción de los clones estudiados
Se utilizaron dos genotipos procedentes del banco de germoplasma cubano de yuca: Clon 'CMC-76': Genotipo promisorio para la agricultura cubana que fue introducido del Centro Internacional de Agricultura Tropical (CIAT), ubicado en Colombia. Posee tallos de color castaño claro y raíces de color externo castaño claro. La planta es medianamente ramificada y su ciclo de cosecha es a partir de los 10 meses. Posee buena calidad culinaria (Medero, 2006).
2. Clon 'CEMSA 74-725': genotipo comercial que forma parte de la estrategia clonal cubana para producir yuca los 12 meses del año. Híbrido obtenido por el programa de mejoramiento genético del INIVIT. Presenta tallos con color externo cenizo o gris y raíces de color externo blanco o crema. La planta es de porte poco ramificado y con ciclo de cosecha a partir de los 10 meses. Su calidad culinaria es buena (MINAG, 2012).
Diseño experimental y plantación en campo
Se utilizaron, como variantes experimentales, plantas propagadas por el método tradicional (estacas), plantas producidas in vitro por organogénesis y procedentes de embriones somáticos, según metodología propuesta por Medero, (2006).
Las plántulas procedentes de ambos métodos de regeneración de los clones CMC-76 y CEMSA 74-725 con una altura promedio entre 6-12 cm, se trasplantaron a condiciones de campo con el auxilio de una paletilla preparada para ese fin y se colocaron sobre la parte alta del cantero. Para las plantas del método tradicional se utilizaron, como material de plantación, estacas de 20 cm de longitud, con siete o nueve yemas, obtenidas de tallos primarios. En las plantas procedentes de los métodos biotecnológicos a partir del segundo ciclo de cultivo, se procedió de igual forma que en el método tradicional.
La plantación se realizó en un diseño de Bloques al Azar y con tres repeticiones, sobre un suelo Pardo Sialítico Cálcico Carbonatado (Hernández et al., 2015); las parcelas quedaron formadas por cinco surcos de 10 metros de largo, donde se evaluaron plantas al azar, de los tres surcos centrales. La distancia de plantación para el clon CMC-76 fue de 0,90 m x 1,10 m y para el clon CEMSA 74-725 de 0,90 m x 0,90 m. Las labores de cultivo y el control de plagas y enfermedades se realizaron según las recomendaciones del Instructivo Técnico de la Yuca (MINAG, 2012). Las evaluaciones se realizaron a los 12 meses de la plantación, durante cinco ciclos de cultivo en campo.
De los dos genotipos de yuca:CMC-76 y CEMSA 74-725, las cuales se siembran bajo tres métodos diferentes: el método tradicional, por Organogénesis y por Embriogénesis Somática, se quiere comparar sus rendimientos promedio.
Resultados y Discusión
Resultados de la evaluación del rendimiento por planta
(kg.pta-1):
Tabla 1:
Ciclos de cultivo en campo y método de propagación por Genotipo
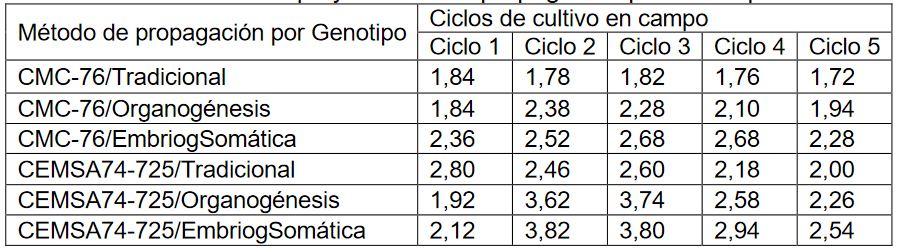 Fuente: Elaboración propia
Fuente: Elaboración propia
Se tomó una colección de 30 unidades experimentales (Tabla 2) y se estudió el rendimiento del cultivo en campo en seis relaciones diferentes de Métodos de Propagación por Genotipo. Es decir, es de interés contrastar el efecto de un solo factor, que se presenta con seis niveles, sobre la variable respuesta. Los rendimientos en los 5 ciclos de cultivo en campo a analizar son iguales en las seis relaciones de Métodos de Propagación por Genotipo, para ello se plantea el siguiente contraste de hipótesis:
H0 = μ1= μ2= μ3= μ4= μ5= μ6= μ y H1 = μi= μj para algún i≠j
En este modelo, que estudia el efecto que produce un solo factor en la variable respuesta, la asignación de las unidades experimentales a los distintos niveles del factor se debe realizar de forma completamente al azar. Este modelo, junto con este procedimiento de asignación recibe el nombre de Diseño Completamente Aleatorizado y está basado en el modelo estadístico de Análisis de la Varianza de un Factor o una Vía. Esta técnica estadística se utiliza cuando se tienen que comparar más de dos grupos y la variable respuesta es una variable numérica. Para aplicar este diseño adecuadamente las unidades experimentales deben ser lo más homogéneas posible.
El problema planteado se modeliza a través de un diseño unifactorial totalmente aleatorizado de efectos fijos equilibrado mediante el paquete estadístico SPSS 21.
Tabla 2:
Colección de 30 unidades experimentales
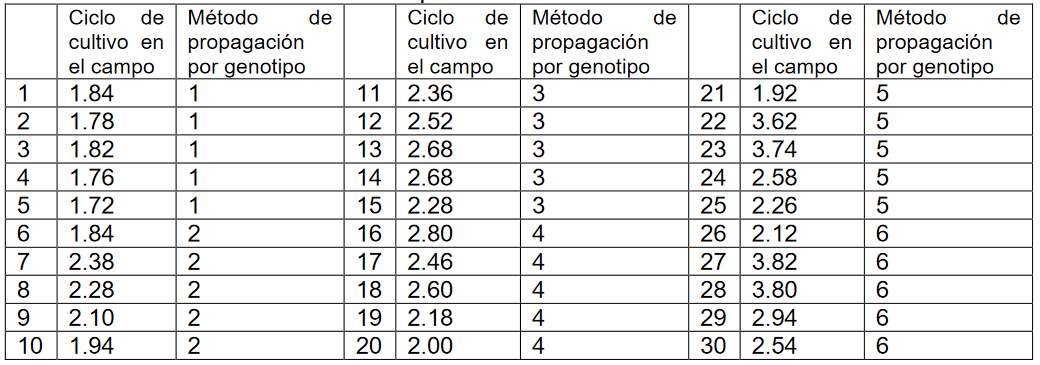 Fuente: Elaboración propia
Fuente: Elaboración propia
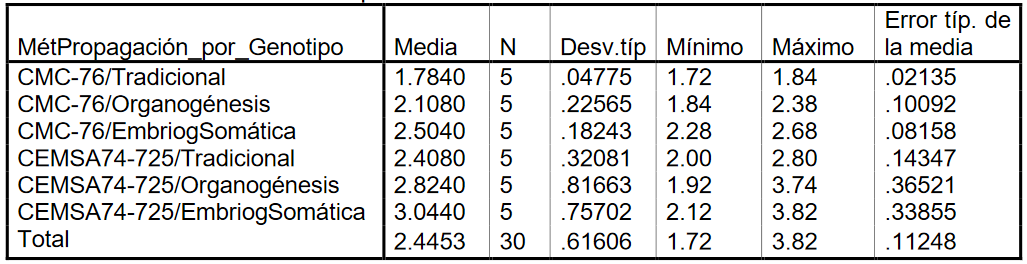
Se comienza realizando un análisis descriptivo (Tabla 3):
Tabla 3:
Ciclo de Cultivo en Campo
 Fuente: SPSS
21
Fuente: SPSS
21
Se
observa que el valor medio de estos grupos es numéricamente distinto, la media
del CEMSA74-725/EmbriogSomática
tiene un valor medio casi equivalente al doble de la media del CMC-76/Tradicional. Por tanto, la hipótesis se centra en comprobar si el ciclo de cultivo en campo es
significativamente distinto en los seis grupos de análisis. Para responder a
esta hipótesis se recurre al Análisis
de la Varianza de un factor; obteniéndose la siguiente Tabla ANOVA:
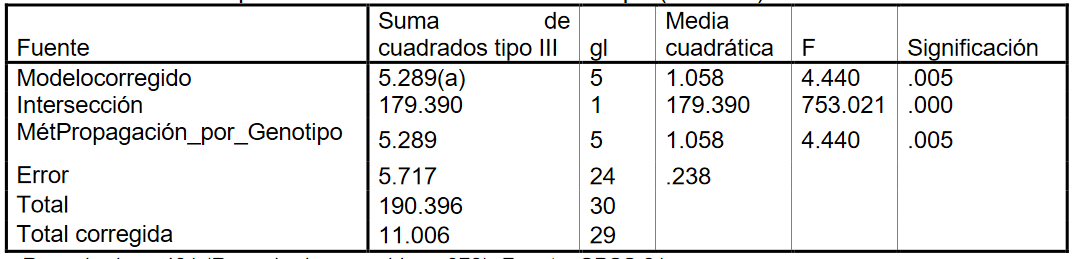
Tabla 4:
Variable dependiente: ciclo de cultivo en campo (ANOVA)
a R cuadrado = .481 (R cuadrado corregida = .372)
Fuente: SPSS 21
En
la ANOVA obtenida (Tabla 4), el valor del estadístico de contraste de igualdad de medias, F =4.440 deja a su derecha un p -valor de
0.005, menor que el nivel de significación del 5%, por lo que se rechaza la Hipótesis nula de igualdad de medias.
Es decir, existen diferencias significativas
en ciclos de cultivo en campo entre los seis métodos de propagación por genotipo. También se muestra que R cuadrado vale 0.481, indicándonos que el modelo explica el 48.1% de la
variabilidad de los datos. El modelo propuesto hay que validarlo, para ello hay que comprobar si se verifican las
hipótesis básicas del modelo, es decir, si las perturbaciones son variables aleatorias independientes con distribución normal de media 0 y varianza constante.
Tabla 5:
Pruebas de normalidad
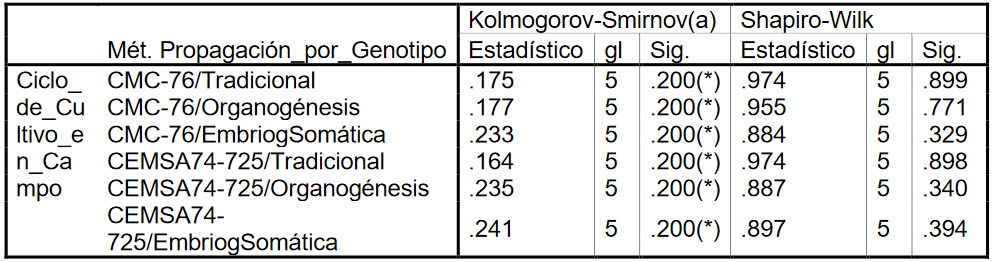 Fuente: SPSS
21* Este es un límite inferior de la significación verdadera. a Corrección de la significación de Lilliefors
Fuente: SPSS
21* Este es un límite inferior de la significación verdadera. a Corrección de la significación de Lilliefors
Todos los p -valores (Sig.) son mayores que el nivel de significación 0.05. Concluyendo que las muestras de los ciclos de cultivo en campo se distribuyen de forma normal en los seis métodos de propagación por genotipo objetos de análisis.
Para analizar la hipótesis de normalidad de los residuos, salvan los residuos no tipificados y se crea una nueva variable RES-1 que contiene los residuos del modelo.
Tabla 6:
Variable RES-1
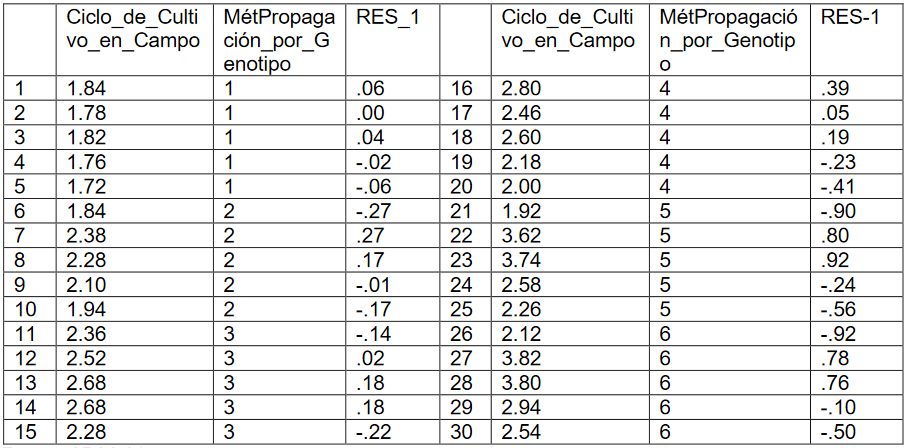 Fuente: SPSS
21
Fuente: SPSS
21
Para
el estudio de la Normalidad de los Residuos, se realizaron los procedimientos
gráficos siguientes: Histograma y Gráfico Probabilístico Normal y el Contraste de Kolmogorov-Smirnov como procedimiento analítico.
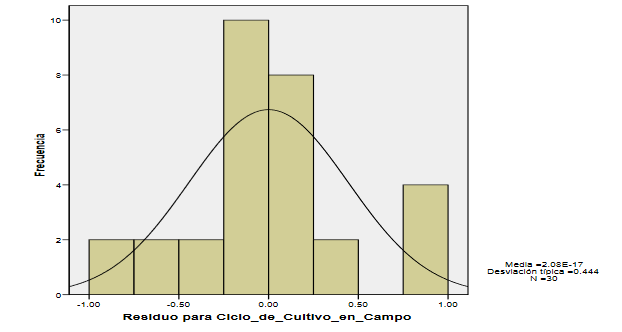 Figura 1:
Histograma resultante algunas desviaciones de la normalidad(SPSS 21)
Figura 1:
Histograma resultante algunas desviaciones de la normalidad(SPSS 21)
Se observa en el histograma resultante algunas desviaciones
de la normalidad, las cuales no implican necesariamente la ausencia de normalidad de los residuos.
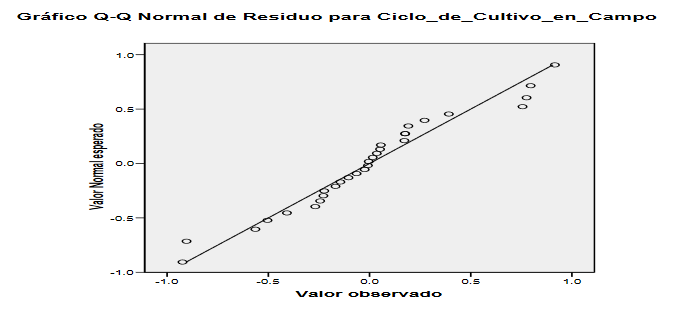 Figura 2:
Gráfico Q-Q normal de residuo para ciclo de cultivo en campo (SPSS 21)
Figura 2:
Gráfico Q-Q normal de residuo para ciclo de cultivo en campo (SPSS 21)
Se
aprecia en este gráfico que los puntos aparecen próximos a la línea diagonal.
Esta gráfica no muestra una
desviación marcada de la normalidad por lo que se puede concluir que se sigue una
distribución normal.
Tabla 7:
Prueba de Kolmogorov-Smirnov para una muestra.
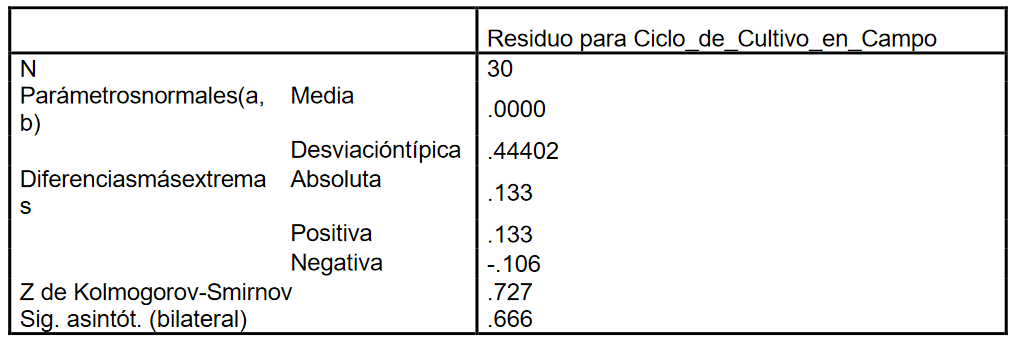
a La
distribución de contraste es la Normal. b Se han calculado a partir de los datos.
Fuente: SPSS
21
Para
esta prueba el p-valor (0.727) es mayor que el nivel de significación 0.05, por
lo que no se rechaza la hipótesis de
normalidad. Para comprobar que se satisface el supuesto de independencia entre los residuos se
analiza el gráfico de los residuos frente a los valores pronosticados o predichos (Figura 3 y 4) por el modelo. El empleo de este gráfico es útil puesto que la presencia de alguna tendencia en el mismo puede ser indicio de una violación de dicha hipótesis.
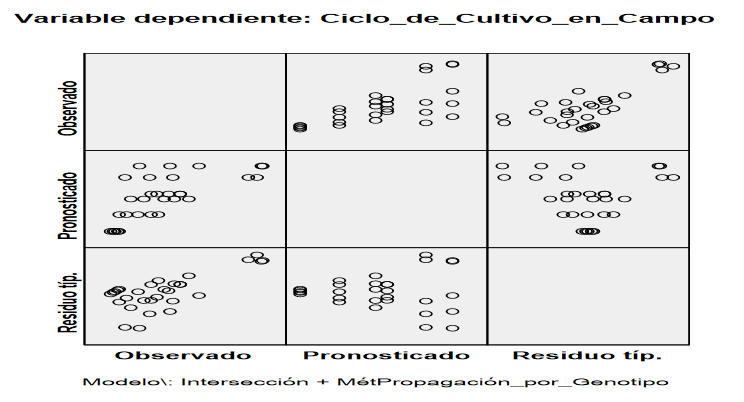 Figura 3:
Residuo pronosticado observado (SPSS 21)
Figura 3:
Residuo pronosticado observado (SPSS 21)
Al
interpretar el gráfico que representa los residuos en el eje de ordenadas y los
valores pronosticados en el eje de abscisas se observa que no hay ninguna tendencia sistemática que haga sospechar del incumplimiento de la
suposición de independencia. También, se puede realizar un gráfico de dispersión de los residuos y las predicciones,
para ello, tenemos que guardar los
valores predichos obteniéndose así una nueva variable PRE_1 en la ventana de datos que
contiene los valores pronosticados por el modelo.
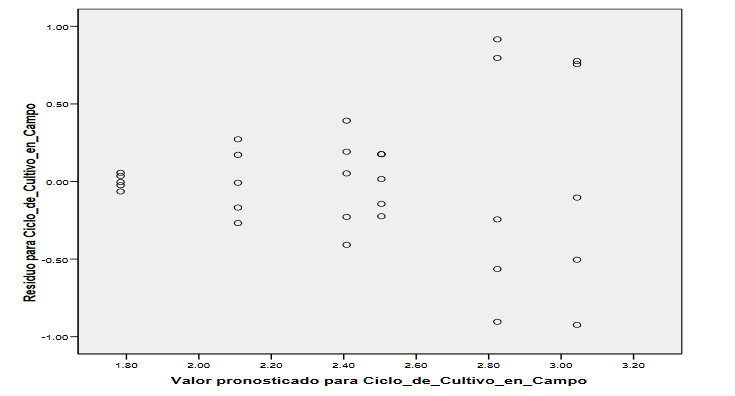 Figura 4:
Valor pronosticado para ciclo de cultivo
en campo (SPSS 21)
Figura 4:
Valor pronosticado para ciclo de cultivo
en campo (SPSS 21)
Para verificar la Hipótesis de homocedasticidad, primeramente, se comprueba la homocedasticidad gráficamente
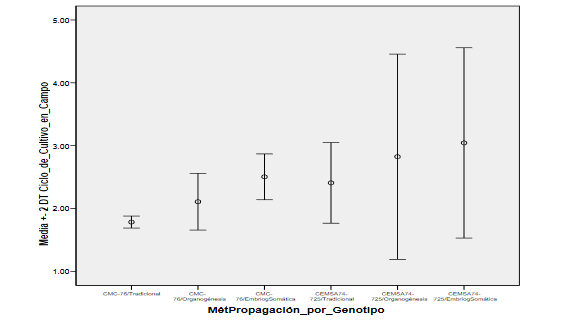 Figura 5:
Media para ciclo de cultivo en campo
(SPSS 21)
Figura 5:
Media para ciclo de cultivo en campo
(SPSS 21)
Cada
grupo tiene su promedio y dos desviaciones típicas a la izquierda y dos
desviaciones típicas a la derecha del
promedio. Se observa que en el CEMSA74-725/Organogénesis y en el CEMSA74-725/EmbriogSomática
hay mucha más dispersión que el resto de los grupos y donde hay menos dispersión es en el CMC-76/Tradicional, la
dispersión en el resto de los grupos es muy similares. Del gráfico no se deduce directamente si hay homogeneidad en estas varianzas, por lo que se recurre a
analizarlo analíticamente mediante la prueba: el test de Levene.
Tabla 8:
Prueba de homogeneidad de varianzas
 Fuente: SPSS
21
Fuente: SPSS
21
El p -valor de 0.000, menor que el nivel de significación del 5%, por lo que se rechaza la Hipótesis de homogeneidad de las varianzas por lo que hay que realizar una prueba alternativa: contrastes Post-hoc.
Esta salida muestra los intervalos de confianza simultáneos construidos por el método de Tukey (Tabla 10). En la tabla se muestra un resumen de las comparaciones de cada tratamiento con los restantes. Es decir, aparecen comparadas dos a dos las seis medias de los tratamientos. La tabla se interpreta observando los valores de Significación menores que el 5%.
Concluimos que se detectan diferencias significativas en los ciclos de cultivos en campo entre CMC-76/Tradicional y CEMSA74-725/Organogénesis; CMC-76/Tradicional y CEMSA74- 725/EmbriogSomática.
Tabla 9:
Tabla de Comparaciones múltiples
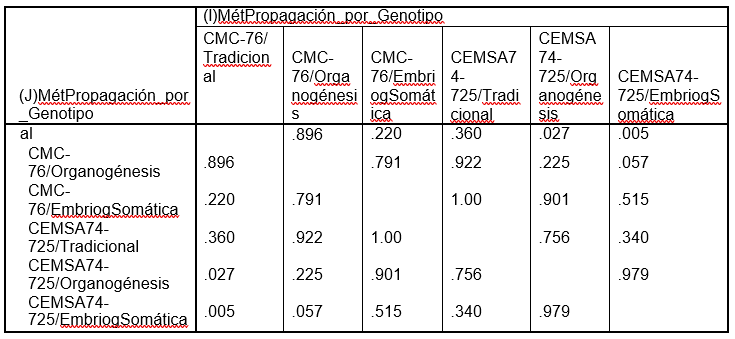
La diferencia de medias es significativa al nivel .05
Fuente: SPSS 21
Tabla 10:
Tabla de subconjuntos homogéneos (HSD de Tukey)
 Fuente: SPSS 21
Fuente: SPSS 21
Se muestran las medias para los grupos en los subconjuntos homogéneos. El tamaño muestral de la media armónica = 5.000.La tabla de subconjuntos homogéneos muestra por columnas los subgrupos de medias iguales, formados al utilizar el método de Tukey. Se llama Prueba de subgrupos homogéneos porque se agrupan en columnas aquellos grupos que no difieren significativamente. Se observa que la prueba de Tukey ha agrupado el primero con el segundo, tercero y cuarto en una misma columna y desde el segundo grupo hasta el sexto en otra columna. De esta forma gráfica se puede deducirlos subgrupos homogéneos y cuales difieren significativamente. Al analizar los subgrupos formados se observa que el p-valor (Sig.) es de 0.220 y 0.057, ambos mayores que el nivel de significación 0.05 deduciendo que no hay diferencias significativas en la media de los ciclos de cultivo en campo en ambos subgrupos. También se deduce que subconjuntos difieren significativamente entre sí. Estas diferencias se pueden ver de una forma gráfica, en un diagrama de cajas (figura 6), que se muestra a continuación:
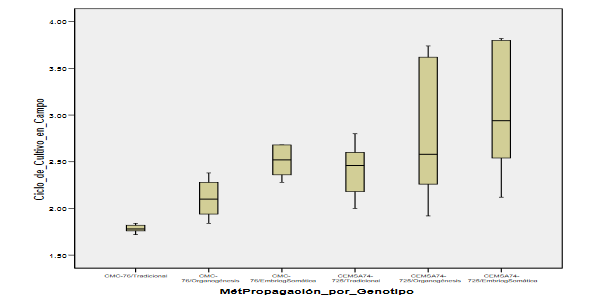 Figura 6:
Diagrama de cajas
Figura 6:
Diagrama de cajas
Se observa que las cajas correspondientes a los métodos de propagación por genotipo: CMC- 76/EmbriogSomática, CEMSA74-725/Tradicional y CEMSA74-725/Organogénesis están prácticamente
superpuestas, este criterio se utiliza para comparar grupos y en este caso nos indica que hay homogeneidad o que no hay diferencias significativas en ese grupo de medias. Se puede concluir que el Método de Propagación por Genotipo: CEMSA74- 725/EmbriogSomática tiene una distribución superior a los demás, por lo que se puede afirmar que es mucho más productivo sembrar cultivos de yuca genotipo CEMSA 74-725, utilizando el método de Embriogénesis
Somática.
Conclusiones
Como
resultado se obtuvo que la embriogénesis somática, es de gran importancia y su utilización provee plantas de CEMSA 74-725
de gran calidad, procedentes de embriones somáticos presentaron un comportamiento significativamente superior respecto a las obtenidas por organogénesis o por el método tradicional.
Referencias Bibliográficas
Ceballos, H. (2002). La yuca en Colombia y el mundo: nuevas perspectivas para un cultivo milenario. In: OSPINA, B.C.H. (ed.) La yuca en el tercer milenio: sistemas modernos de producción, procesamiento, utilización y comercialización Cali, Colombia: Centro Internacional de Agricultura Tropical (CIAT).
Delgado, L. S. (2019). Quantity and quality food losses across the value chain: a comparative analysis. Documento de antecedentes elaborado para El estado mundial de la agricultura y la alimentación 2019. Progresos en la reducción de la pérdida y el desperdicio de alimentos. Washington D.C., IFPRI: No publicado.
Domínguez, C. C. (1983). Morfología de la planta de yuca. Cali, Colombia: PND/CIAT, Centro Internacional de Agronomía Tropical.
FAO. ( 2016). Los datos de FAOSTAT. Disponible: http://www.fao.org.
FAO. (2018). Género y pérdida de alimentos en cadenas de valor alimentarias sostenibles, Guía de orientación. Roma. Obtenido de http://www.fao.org/3/I8620ES/i8620es.pdf)
FAO. (2019). El estado mundial de la agricultura y la alimentación. Progresos en la lucha contra la pérdida y el desperdicio de alimentos. Roma. Licencia: CC BY-NC-SA 3.0 IGO.
FAOSTAT. (2015). Organización de las Naciones Unidas para la Alimentación y la Agricultura.
Dirección de estadística. En: _HYPERLINK http://faostat3.fao.org/browse/Q/QC/S.
MEDERO, V. (2006). Embriogénesis somática en yuca (Manihot esculenta, Crantz). Tesis de doctorado en Ciencias Agrícolas, Universidad de Ciego de Ávila.
MEDERO, V., ESCOBAR, R., GALLEGO, G., TOHME, J., BEOVIDEZ, Y., & GÓMEZ, S. R.
(2002). Determinación por AFLP de la estabilidad genética de plantas de yuca obtenidas por embriogénesis somática y organogénesis. Biotecnología Vegetal, 4(2):245-24.
MEDERO, V., FILIPIA, R., RODRÍGUEZ, S., BASAIL, M., SANTOS, A., RAYAS, A., . . . PONS,
Y. B. (2015). Producción de material de plantación de alta calidad genética y fitosanitaria en yuca. Agricultura Tropical, 1(1): 22-32.
MINAG, M. d. (2012). Instructivo Técnico para la producción de semillas de viandas. La Habana: INIVIT-FAO, pp.11-30.
MURILLO, F. Y.-G. (2002). Capítulo 4. Análisis de varianza.p. 52-57.
SPSS 21, I. (2019). SPSS 21 17. Documentation [Online]. Disponible http://support.SPSS 21comProductsExtSPSS21DocumentationSPSS21forWindowsindex.html.





















