Introducción
Una de las limitantes más severas que afronta la producción de tomate es la problemática fitosanitaria. En Nicaragua, los problemas fitosanitarios han sido históricamente manejados utilizando plaguicidas, los cuales han demostrado ser costosos, poco eficientes y altamente contaminantes, teniendo un alto efecto perjudicial sobre el ambiente y la salud pública (Antón et al,2014;Al-Deghairi, M. 2008; Alves, S. B. 1986). Ante la necesidad de contrarrestar los efectos de este sistema de control fitosanitario, surgen alternativas de manejo económicamente viables y capaces de garantizar la inocuidad de los productos agrícolas, proteger y preservar la biodiversidad y el ambiente en que se desarrollan los cultivos (Jiménez, E; Rodriguez, O. 2014; Jussieu, A. 1830)
Una de las alternativas, que destacan es la utilización de bioinsumos, las cuales han tenido un impacto positivo sobre el manejo de los agroecosistemas productivos; según Reyes (2011), Cuando hablamos de bioinsumos nos referimos a los productos, elaborados a partir de organismos benéficos como insectos, hongos, bacterias y virus, o bien a extractos de plantas; la ventaja de estos productos es que no dejan residuos en el agua, el aire, el suelo o en los productos alimenticios y tampoco ponen en peligro la salud de los agricultores y consumidores (CAB INTERNATIONAL, 2000; Cardona, C.; Rodríguez. A.; Prad, P. 1993;Carmona, D. 2000;Cave, R. 1994; Chavarria, S. 2004) .
Navarrete et al, (2016), quienes evaluaron el efecto de algunos derivados de Azadiracta indica sobre las poblaciones de Bemisia tabaco (GEN) y sus controladores biológicos y Arriola (2011): Evaluación de tres insecticidas a base de nim Azadiracta indica sobre adultos de mosca blanca (Bemisia tabaci); ponen de manifiesto el exorbitante potencial de estos mecanismos de control y resaltan la sostenibilidad como un objetivo que se podría lograr haciendo uso de estos elementos(INTA, 2002; Godonou, I., Green, K.
R., Oduro, K. A., Lomer, C. J., Afreh-Nuamah, A. 2000; GoetteL, M. 1992, Gutiérrez,
W. y Gonzales, C. 2009; Hall, R. 1993, Hernández, V., Berlanga, A. 1995; Humber,
R. 1996; Inbar, M; Doostdar, G; Leibee Y Mayer, R; 1999; Jiménez Martínez,
Edgardo 2007; Jiménez-Martínez; Varela G. 2013; Junqueira, C; Nunez, L &
Luz, C. 2006; Jussieu, A 1789).
De igual manera, muchos son los investigadores (Arias, M. 1995;Balladares, J. 2016;Bethke, J. Y Parrella, M. 1985) que han puesto bajo observación el modo de acción y desarrollo de un amplio espectro de controladores biológicos con el objetivo de determinar, sustentar y validar estas tecnologías como una alternativa al método de control ponderante en la región de Guatemala, tales son los casos de: Alas (2000), quien evaluó la efectividad de cuatro insecticidas biológicos [Mycotrol y Naturalis (Beauveria bassiana), Ago Biocontrol (Verticillium lecanii) y PFR-97 (Paecilomyces p1)] versus un testigo convencional (químico) sobre las poblaciones de ninfas de moscas blancas en el cultivo del melón (Cucumis melo, L), los resultados de esta investigación indicaron que Mycotrol fue el insecticida biológico, que ejerció un control similar al del testigo convencional. También se determinó que fue el insecticida que obtuvo la mayor relación beneficio/costo, constituyéndola como una alternativa altamente rentable para el agricultor.
La presente investigación se focalizo en la evaluación de bioinsumos y su efecto en la dinámica poblacional de mosca blanca (Bemisia tabaci, Genn) y mosca minadora (Liriomyza spp) en la producción de tomate. Las primicias que conllevó a realzar dicho estudio, están fundamentadas en la demanda actual que atraviesa la población mundial ligada al suministro de productos inocuos y con altos estándares de calidad, así como la contaminación ambiental (de suelo y agua); provocada por el uso indiscriminado de plaguicidas utilizados en la agricultura convencional y los costos elevados en los que debe incurrir el agricultor para implementarlos(Lanuza Rodríguez, EH; Rizo
González, EJ. 2012; Laurenti, N. 1768; Lessing,
C. 1832; Linnae, C. 1753; Link, H. 1833;MAG, 2007; Mau, R y Martín, J. 1991; Monzón,
A. 2001; Morales, F; Cardona, C; Bueno, J Y Rodríguez. 2006; Murguido, C. y
Vera, R. 1999; Núñez, E. 1995; Osborne, L & Landa, Z. 1992; Pacheco, M.F. 1985)..
Finalmente, los resultados obtenidos pueden ser de provecho para investigadores del sector agrícola que aborden la problemática fitosanitaria en futuras investigaciones, extensionistas, agricultores y todo aquel cuya incidencia tenga impacto sobre el desarrollo de la agricultura en la región.
Materiales y métodos
Diseño metodológico
Tipo de
estudio
Es un estudio de carácter
experimental en el que se evaluó la efectividad de cinco alternativas de manejo
para el control de Mosca blanca (Bemisia
tabaci, Genn) y Minador (Liriomyza
spp) en la producción de tomate y de corte transversal porque se llevó a
cabo en el período comprendido entre noviembre 2017 y mayo 2018, en el Centro
de Desarrollo Tecnológico Hugo Rafael Chávez Frías del Instituto Nicaragüense
de Tecnología Agropecuaria (INTA) San Isidro (Comisión nacional de la mosca
blanca, 1992;Espinel, C; Torrez, L; Grijalba, E; Villamizar, L Y Cotes, A. 2008;
Evans, G. y Serra, C. 2002; Fabricius, J. 1787; Fagoonee, I. Y Toory, V. 1983; Falcon,
L. 1985; Faust, R. 1992; Flores, G.; Hilje,
L.; Mora, G. Y Carballo, M. 2008; García,
C; Chairez, I Y Hernández. 2010).
Lo cinco tratamientos estuvieron dispuestos en un diseño completamente aleatorio (DCA), efectuándose tres repeticiones y complementándose con un testigo convencional que reflejase el manejo que comúnmente realizan los agricultores de la región sobre el manejo de mosca blanca (B. tabaci) y la mosca minadora (Liriomyza spp) en un área experimental de 1380 m2.
Población de estudio
La
siembra se realizó en un área de 1134 m2 con las siguientes
distancias: 70cm entre planta y 80cm entre surco; este marco de siembra
constituyó una población de 1,296 plantas, que fueron dispuestas en 18 unidades
experimentales, cada unidad experimental contó con 72 plantas.
Área de estudio
La parcela experimental se
estableció durante el ciclo agrícola 2017, en terrenos del Centro de Desarrollo
Tecnológico Hugo Rafael Chávez Frías San Isidro. Según la localización donde se
realizó este ensayo; es un Bosque Seco Tropical (bs-T) (Holdrige, 1947; Link, H. 1833; Pouey, F;
Chirinos, D; Y Riveros, G. 1997; Sclar, C. 1994;Sorokin, K. 1883; SPENCER, K. 1973, Sponagel, K.
1999; Sponagel, K; Fúnez, M. 1994; Tanada, Y., Kaya, H. 1993; Urbina, E. 2001; Vega,
P. 2003; Vicentini, S., Faria, M., Oliveira, R. M. 2001; Vilas Boas, G; Franca.
F; De Avila, A.; Becerra, l. 1997; Walpers, G. 1842; Wraight, S., Carruthers,
et.al., 1998; Zoebisch, T Y Schuter, D. 1987,
INTA, 2014; Reyes, M. 2011), y zona
apta para el cultivo de tomate y el desarrollo poblacional de las plagas en
estudio, con coordenadas (12°54'25.39"N y 86°11'3.46"O).
Período de
estudio
El estudio se llevó a cabo en el período comprendido entre noviembre
2017 y mayo 2018.
Muestra
Para realizar el muestreo Se tomaron 180
plantas de un universo de 1296 plantas.
Fuente de
información
Primaria
Tablas de recolección de datos y
bitácora.
Secundaria
Sitio web,
Libros, revistas indexada, artículos científicos, guías de manejo del cultivo,
tesis.
Instrumento
de recolección de datos
Los
instrumentos utilizados durante el estudio fueron hojas de muestreo para determinar la incidencia y
severidad de mosca blanca (Bemisia tabaco GEN) y mosca minadora (Liriomyza
spp). Tomando en cuenta la escala, porcentaje de daño, descripción de la escala
y grado y categoría de infestación.
Procedimiento
de recolección de información
Los
datos fueron registrados en formatos de muestreo de incidencia y severidad, las
primeras observaciones se realizaron el 17 de diciembre del 2017, a partir de
entonces la frecuencia de muestreo fue de 1 vez por semana. Las observaciones
fueron anotadas en una bitácora.
Plan de
análisis
Para analizar los resultados obtenidos, utilizamos el programa “Statistical Program for Social Sciences” (IBM SPSS, 22), donde se efectuó el análisis de varianza (ANDEVA) y la separación de medias según Duncan a un nivel de significancia de 0.05 para determinar la existencia de diferencias significativas entre los tratamientos.
Para realizar el análisis económico, procedimos a utilizar la metodología propuesta por el Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT, 1998).
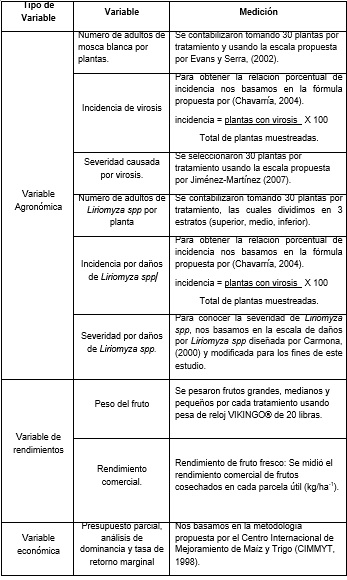
Operacionalización de variables(Ver anexos Tabla 1)
Resultados y
discusión
Bemisia tabaci
Se comparó la fluctuación poblacional de la mosca blanca en parcelas de tomate cuyos semilleros estuvieron protegidos física y químicamente durante la etapa de semillero, encontrándose incidencia de Bemisia tabaci en todos los recuentos realizados a partir de diciembre 2017 hasta febrero 2018, antes del primer corte productivo; la población más alta se presentó en el segundo recuento (3 moscas/planta), correspondiendo a las unidades experimentales tratadas con Confidor® (Imidacloprid), en recuentos ulteriores las poblaciones se mantuvieron constantes para todos los tratamientos (1-2 moscas/planta) (gráfico 1).
Según Vásquez et al, 2007; un agente de control biológico que reduzca los niveles poblacionales del vector, integrado en un sistema que incluya variedades con alguna resistencia o tolerancia al virus reducirá significativamente la incidencia de la enfermedad (Vuillemin, P. 1912).
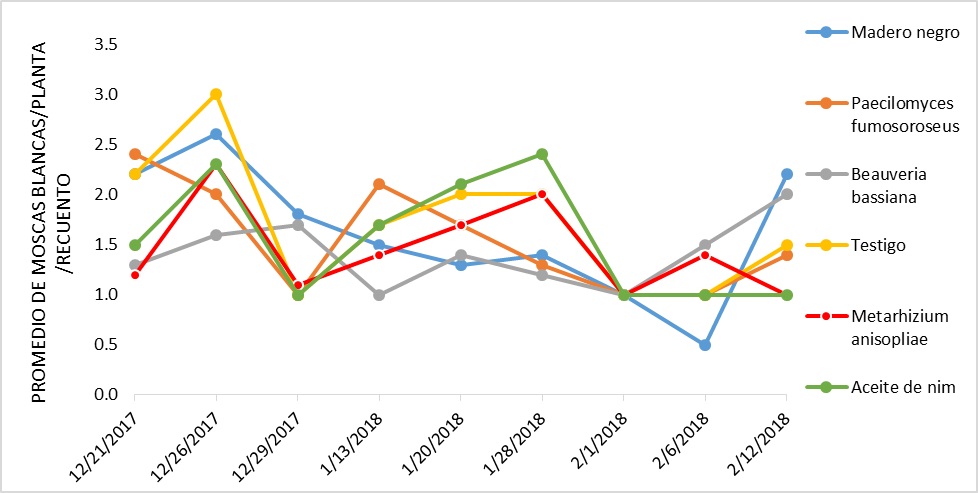 Gráfico 1
Fluctuación
poblacional de Bemisia tabaci
Gráfico 1
Fluctuación
poblacional de Bemisia tabaci
Número de
moscas blancas por planta
Según los análisis estadísticos realizados para esta variable no existen diferencias significativas, valores de F, (p˃ 0.05), (Tabla 2 y 3). En el Gráfico 2 se puede observar que los índices promedios (1.4 -1.7) de la mosca blanca para todos los tratamientos son semejantes.
Los resultados son relativamente inferiores a los obtenidos por: Alas,
(2000); quien registro 14 y 21 moscas por planta en las unidades experimentales
tratadas con Naturalis® (Beauveria
bassiana), Mycotrol® (Beauveria
bassiana) y PFR – 97® (Paecilomyces);
Navarrete, 2006; quien registro 27 y 32 moscas por planta para los
tratamientos INBIO – 75® (aceite formulado de nim), extracto acuoso
de semillas de nim y Confidor® a diferentes dosis; Rodríguez y Morales,
(2007); quienes registraron 2.75 y 2.9 moscas por planta para los tratamientos
Gaucho® (Imidacloprid – confidor®
(Imidacloprid) y aceite de nim respectivamente y la investigación
de Trujillo y Martínez, (2016); que
refleja 38.19 y 43.19 moscas por planta para los tratamientos madero negro y Metarhizium anisopliae respectivamente.
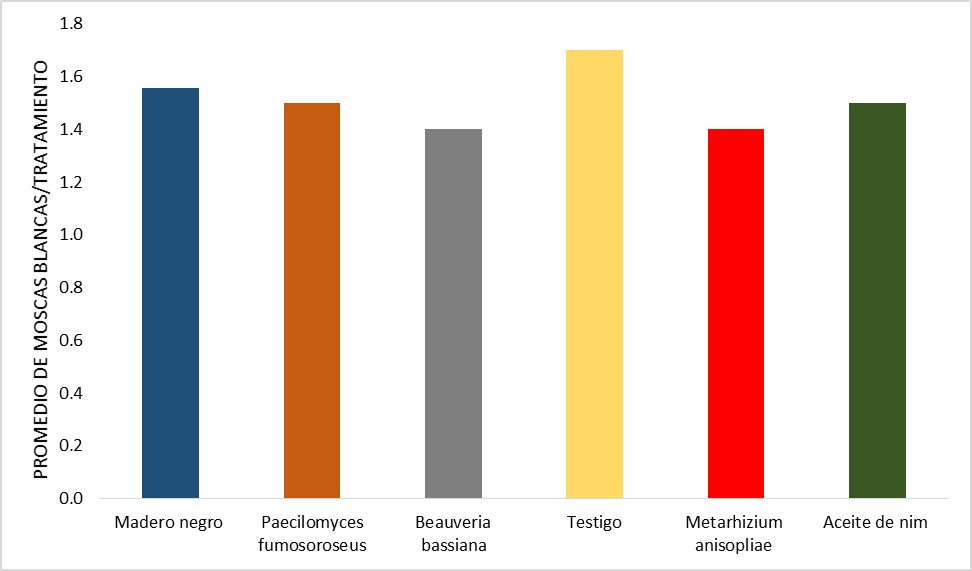 Gráfico 2 .
Promedio de moscas blancas por tratamiento
Gráfico 2 .
Promedio de moscas blancas por tratamiento
Incidencia de virosis a los 45 y 60 días después del trasplante (DDT)
Se comparó el porcentaje de incidencia de virosis ocasionada por mosca blanca; los datos se registraron a los 45 y 60 días posteriores al trasplante (Gráfico 3).
Se puede observar que los menores porcentajes de incidencia de virosis a los 45 DDT los presentó el testigo (Confidor® 20, LS Imidacloprid) con un valor de 26.7 % y aceite de nim (Azadiractina) con un 30%, pese a que las unidades experimentales correspondientes al testigo presentaren los mayores promedios poblacionales, lo que significa que había un mayor número de moscas en menos plantas infectadas, en contraste con los tratamientos evaluados; según lo señalado por Vázquez et al, (2007); a menudo basta un solo individuo para infectar el 100% de la plantación.
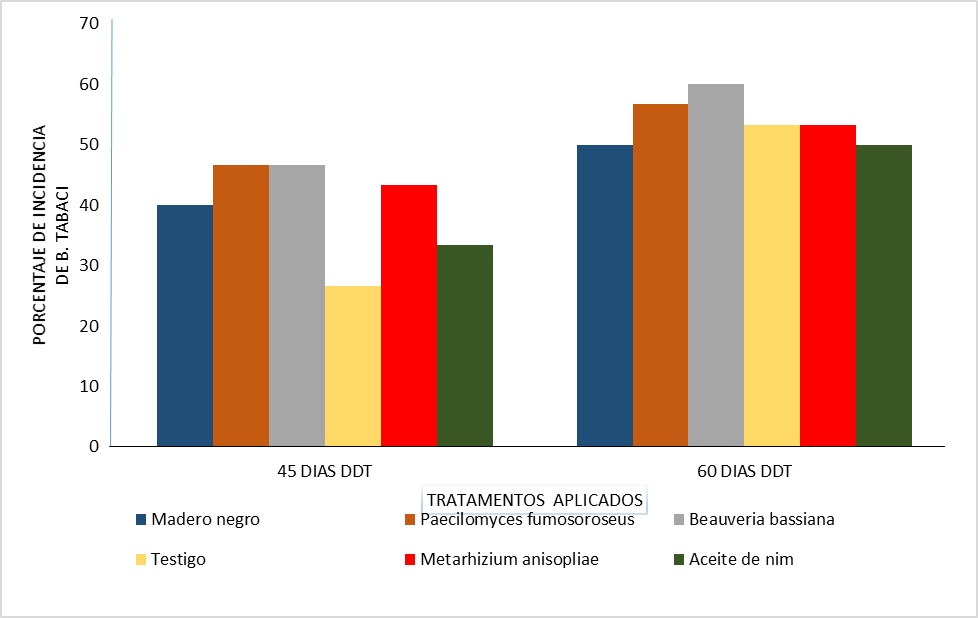 Gráfico 3
Porcentaje de incidencia de virosis por B. tabaci a los 45 y 60 DDT
Gráfico 3
Porcentaje de incidencia de virosis por B. tabaci a los 45 y 60 DDT
Los resultados obtenidos para el análisis
de esta variable no demuestran diferencias estadísticas significativas a los 45
DDT, valores de F, (p>0.05) , sin embargo, se observó que el menor porcentaje de incidencia de
26.7 % corresponde al testigo y el mayor de 46.7 % a Paecilomyces fumosoroseus y Beauveria bassiana.
A los 60 DDT (después del trasplante) no se
presentan diferencias estadísticas significativas para ninguno de los
tratamientos, valores de F, (p> 0.05) . Los porcentajes se mantuvieron entre 50 – 60.
Porcentajes de severidad de virosis de B, tabaci a los 60 DDT
Se comparó los niveles de severidad de virosis por mosca blanca alcanzados a los 60 DDT (después del trasplante) en los tratamientos evaluados (Gráfico 4).
El estudio realizado por Trujillo y Martínez, (2016), quienes también
compararon Metarhizium anisopliae y
madero negro (dos de los evaluados en el presente estudio), reflejan valores de
severidad similares (1 y 2 respectivamente) a los obtenidos en nuestra
investigación.
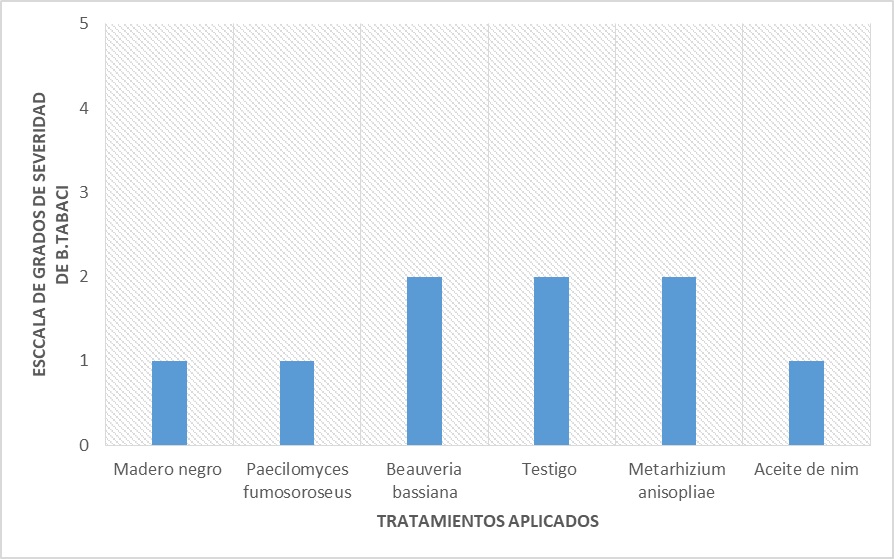 Gráfico 4
Grados
de severidad de virosis causado por B. tabaci a los 60 DDT
Gráfico 4
Grados
de severidad de virosis causado por B. tabaci a los 60 DDT
3.2 Fluctuación poblacional de mosca minadora (Liriomyza spp).
De manera análoga a los muestreos realizados
para mosca blanca, se hicieron recuentos a partir de noviembre 2017 - marzo
2018, para observar el comportamiento poblacional de la mosca minadora (Liriomyza spp). Encontrándose incidencia
del insecto en todos los muestreos realizados en las fechas mencionadas. Si
observamos el gráfico 5 notaran que los índices más altos del insecto se presentaron
el 1ro de febrero del 2018, correspondiente a las parcelas tratadas con Metarhizium anisopliae; para los demás
tratamientos; los índices poblacionales se muestran similares con una línea de
tendencia descendente en las fechas culminantes del experimento.
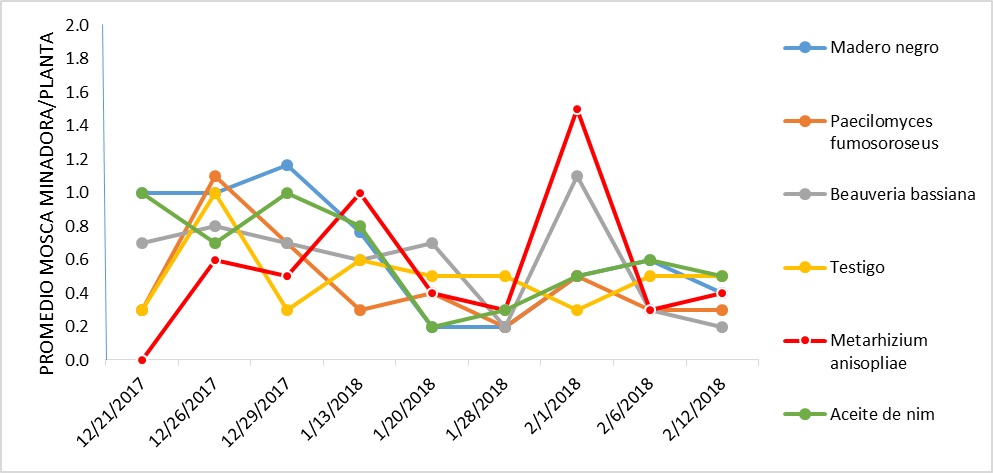 Gráfico 5 .
Fluctuación poblacional de Liriomyza spp.
Gráfico 5 .
Fluctuación poblacional de Liriomyza spp.
Número de moscas minadoras por planta
Según los análisis estadísticos realizados para esta variable no
existen diferencias estadísticas significativas, valores de F, (p> 0.05). En el gráfico 6 se puede observar que los índices promedios (0.5
-0.6) de la mosca minadora para todos los tratamientos son semejantes.
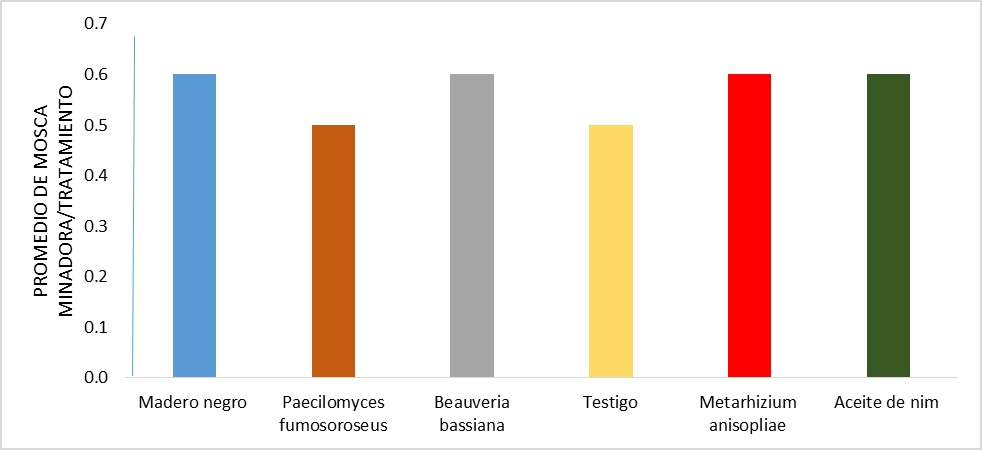 Gráfico 6 .
Promedio de moscas minadoras por tratamiento.
Gráfico 6 .
Promedio de moscas minadoras por tratamiento.
Incidencia de daño por mosca minadora
Se comparó
el porcentaje de incidencia por daños ocasionada por mosca minadora; los datos
se registraron a los 15 y 60 días posteriores al trasplante.
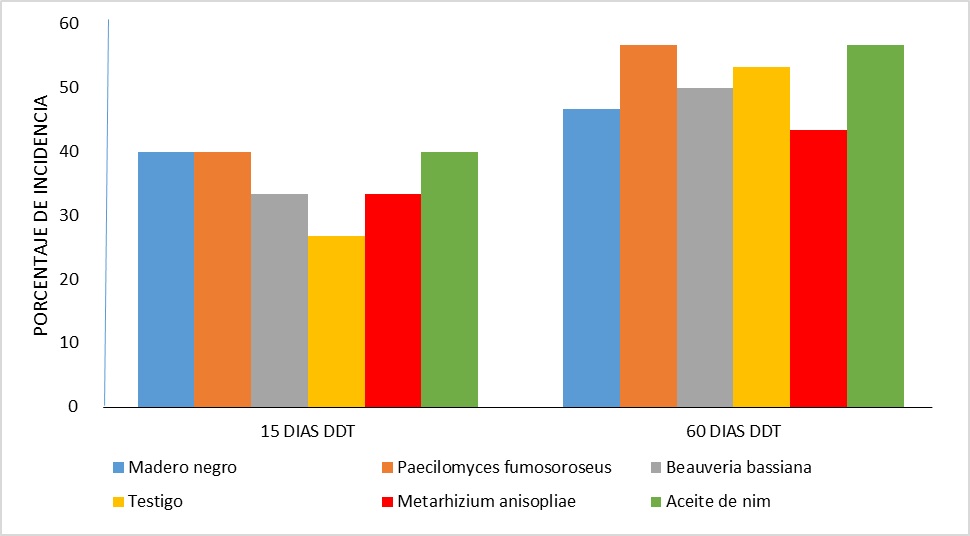 Gráfico 7
Incidencia
de daño por mosca minadora a los 15 y 60 DDT.
Gráfico 7
Incidencia
de daño por mosca minadora a los 15 y 60 DDT.
Los
resultados obtenidos en el análisis de esta variable no registran diferencias
estadísticas a los 15 DDT y tampoco a los 60 DDT, valores de F, (p> 0.05); sin embargo, en el gráfico 7 se puede apreciar a
simple vista que el testigo a los 15 DDT presenta niveles de incidencia
significativamente inferiores comparado con los tratamientos: Aceite de nim (Azadiractina), madero negro y Paecilomyces fumosoroseus.
Grados de severidad por daños de mosca minadora.
Se comparó los niveles de severidad de
virosis alcanzados a los 60 DDT en los tratamientos evaluados (Gráfico 8).
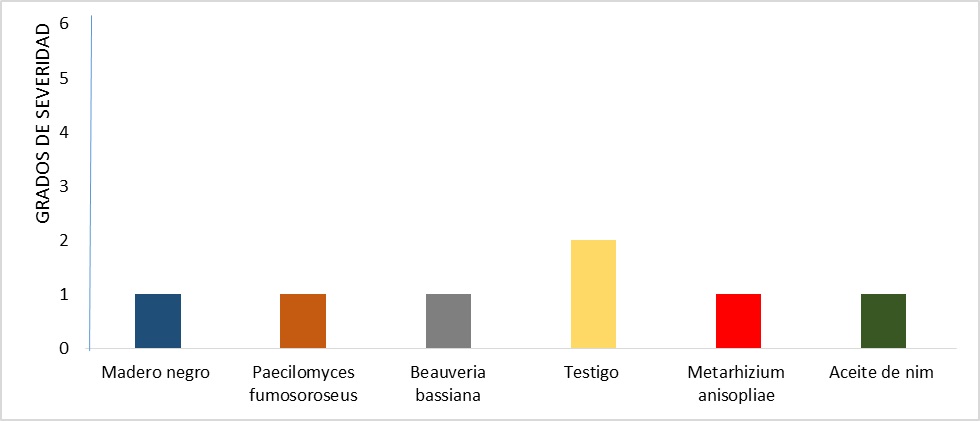 Gráfico 8
Grados
de severidad por daños de mosca minadora.
Gráfico 8
Grados
de severidad por daños de mosca minadora.
Comparación del
rendimiento total (kg/ha-1) de los tratamientos.
Se comparó el rendimiento total (kg/ha-1) en los
tratamientos evaluados, los mayores rendimientos los obtuvieron el testigo
confidor® 20 LS (Imidacloprid) con 1,385 cajillas- 22.72 Kg/ha-1, Beauveria bassiana (1,344 cajillas-22.72
Kg/ha-1) y Metarhizium anisopliae (1,328
cajillas-22.72 Kg/ha-1), respectivamente. Además, los menores
rendimientos los presentaron los tratamientos aceite de nim (1,277
cajillas-22.72 g/ha-1), Paecilomyces fumosoroseus (1,212 cajillas-22.72 Kg/ha-1) y
madero negro (1,187 cajillas-22.72 Kg/ha1) (gráfico 9).
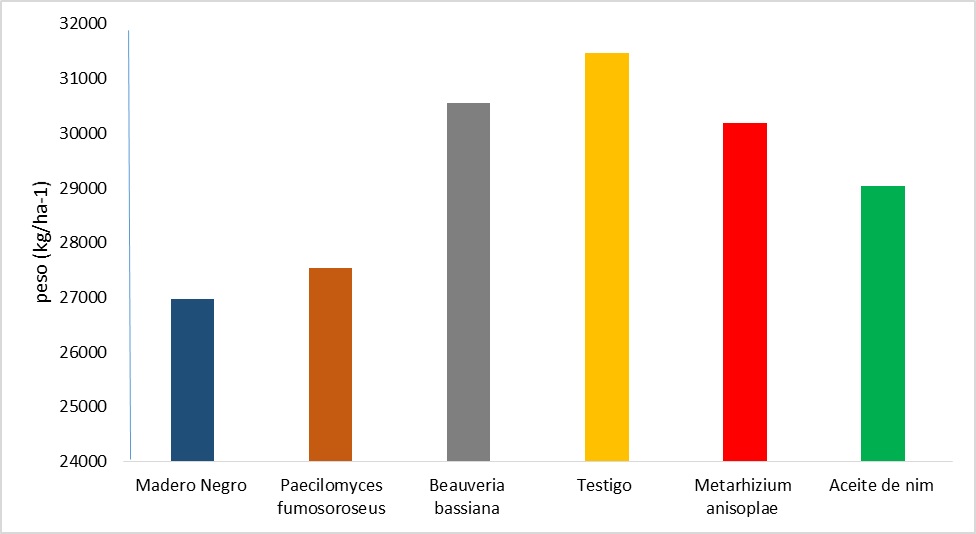 Gráfico 9 .
Rendimientos
(kg/ha-1) de los tratamientos evaluados.
Gráfico 9 .
Rendimientos
(kg/ha-1) de los tratamientos evaluados.
Comparación económica US$/ha-1 de
los tratamientos evaluados.
Se comparó el beneficio neto expresado en US$/ha-1 de
los tratamientos evaluados (tablas 2, 3 y 4), donde se observó que los mayores beneficios los
obtuvieron el testigo (Confidor® 20 LS, Imidacloprid), Beauveria bassiana y Metarhizium
anisopliae en contraste con los tratamientos aceite de nim (Azadiractina), Paecilomyces fumosoroseus y madero negro que obtuvieron los beneficios más bajos
(gráfico 10).
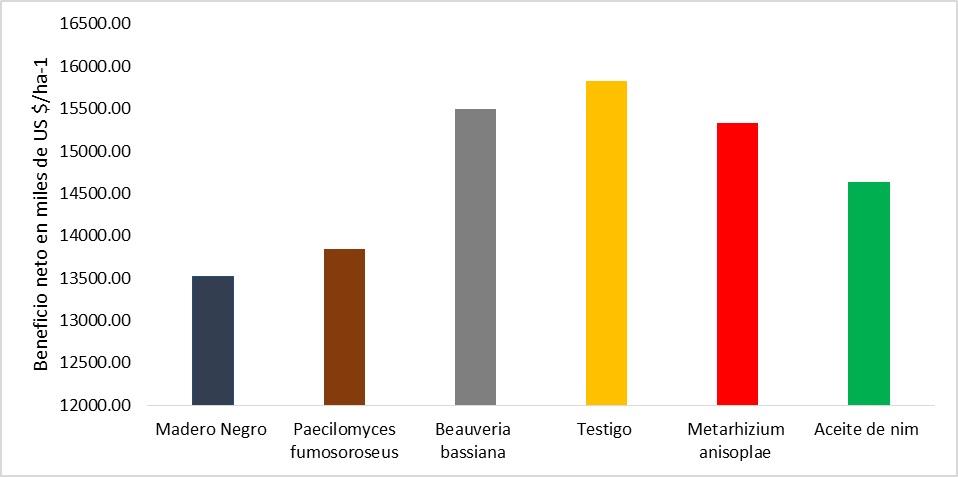 Gráfico 10
Beneficios
netos en miles de US$/ha-1.
Gráfico 10
Beneficios
netos en miles de US$/ha-1.
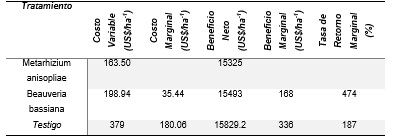
Tabla 2
Presupuesto parcial para cada uno de los tratamientos
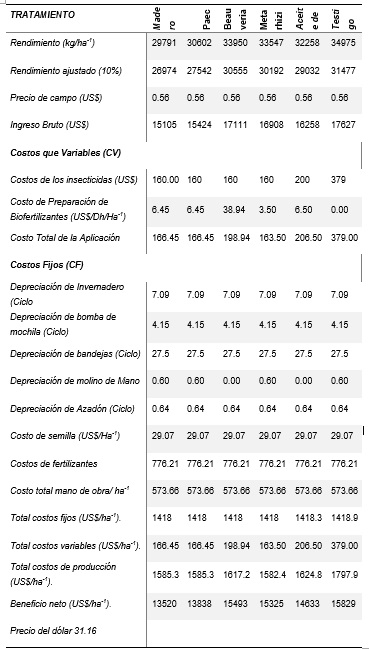 Fuente: Elaboración propia
Fuente: Elaboración propia
Tabla 3
Análisis de
dominancia par los tratamientos evaluados
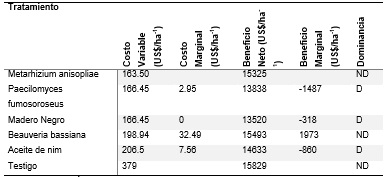 Fuente: Elaboración propia
Fuente: Elaboración propia
La tasa de
retorno marginal demuestra que el tratamiento de mayor rentabilidad es Beauveria
bassiana con un porcentaje de 474,
lo que significa que, por cada dólar invertido, el productor recupera su dólar
y obtiene US$4.74 de ganancia.
Tabla 4
Tasa
de retorno marginal de los tratamientos.
 Fuente: Elaboración propia
Fuente: Elaboración propia
La tasa de
retorno marginal demuestra que el tratamiento de mayor rentabilidad es Beauveria
bassiana con un porcentaje de 474,
lo que significa que, por cada dólar invertido, el productor recupera su dólar
y obtiene US$4.74 de ganancia.
De acuerdo al análisis de dominancia, los tratamientos dominados (D) fueron Paecilomyces fumosoroseus, madero negro y aceite de nim (Azadiractina), ya que tuvieron los beneficios marginales más bajos (ver tabla 3 y 4).
Conclusiones
Beauveria bassiana y Metarhizium anisopliae presentaron los menores porcentajes de adultos de Bemisia tabaci por planta (1.4 adultos/planta), aunque el valor no fue estadísticamente significativo en comparación con los demás tratamientos, por lo que todos fueron igualmente efectivos en el control de esta plaga.
Paecilomyces fumosoroseus, presentó los menores niveles poblacionales de Liriomyza spp (0.5 adultos/planta), aunque el valor no fue estadísticamente significativo en comparación con los demás tratamientos, por lo que todos fueron igualmente efectivos en el control de esta plaga.
A los 45 días después del trasplante, el testigo (Confidor® 20 LS, Imidacloprid), presentó los menores porcentajes de niveles de incidencia de virosis con 26.7%, seguido por el tratamiento aceite de nim con 33.3%.
Beauveria bassiana y Metarhizium anisopliae
El testigo
(Confidor® 20 LS, Imidacloprid), obtuvo el mayor rendimiento comercial de 31,477
kg/ha-1, seguido de los tratamientos Beauveria bassiana con 30,555 kg/ha-1 y Metarhizium
anisopliae con 30,192 kg/ha-1.
El tratamiento Beauveria bassiana, obtuvo el mayor porcentaje de retorno marginal de 474%, seguido del testigo (Confidor® 20 LS, Imidacloprid), de 87%.
Literatura citadas
Alas, G. (2000). Evaluación de la efectividad de cuatro insecticidas biológicos para el control de ninfas de mosca blanca (Bemisia tabaci) en el cultivo de melón (Cucumis melo), finca de los yajes, del municipio de Estanzuela, departamento de Zacapa, Universidad de San Carlos de Guatemala. Centro Universitario de Agronomia Oriente.
Al-Deghairi, M. (2008). Bioassay evaluation of the entomopathogenic fungi, Beauveria bassiana vuill against eggs and nymphs of Bemisia tabaci Gennadius (Homoptera: aleyrodidae). Pakistan Journal of Biological Science. 11:1551-1560.
Alves, S. B. (1986). Fungos
entomopatogenicos. En: Controle microbiano de insectos. Rostista Alves, S
(coordinador). Manole. P 73-126.
Antón, S; Narvaez, E; y Hernandez, A.
(2014). Control biológico de enfermedades en Nicaragua. Bettiol. W, y Rivera,
M. control biológico de enfermedades de plantas en america latina y el caribe
(p. 287). Nicaragua.
Arias, M. (1995). Mosca blanca,
descripción, ecología, danos y estrategias de manejo. Guayaquil, Ecuador, INIAP
(Instituto Nacional de Investigaciones Agropecuarias). 16 p. (Boletín
Divulgativo No. 253).
Arriola, J. (2011). Evaluación de tres
insecticidas a base de neem sobre el manejo de adultos de mosca blanca (Bemisia
tabaci; aleyrodidae) en pepino; aldea las tunas, salamá. Tesis de grado.
Universidad Rafael Landívar. Guatemala.
Balladares, J. (2016).Evaluación de
insecticidas químicos alternados con botánicos como opciones de manejo de mosca
blanca (Bemisia tabaci Gennadius) y otros insectos plagas en tomate (Solanum
lycopersicum L.), en Tisma, Masaya. (Tesis para optar al título de ingeniero
agrónomo). Universidad Nacional Agraria (UNA). Nicaragua.
Bethke, J. Y
Parrella, M. (1985). Leaf puncturing, feeding and oviposition behavior of
Liriomyza trifolii. Entomol. exp. appl., 39: 149-154.
https://doi.org/10.1111/j.1570-7458.1985.tb03556.x
CAB INTERNATIONAL
(Centre for Agricultural Bioscience International. (2000). Crop Protection
Compendium. Wallingford, UK, CAB INTERNATIONAL. 1
disco compacto, 8 m.
Cardona, C.; Rodríguez. A.; Prad, P.
(1993).Umbral de acción para el control de la mosca blanca de los invernaderos,
Trlaleurodea vaporariorum (Westwood) (Homoptera: Aleyrodidae) en habichuela.
Revista Colombiana de Entomología 49 (1): 27-33.
Carmona, D. (2000) Bioecología y Manejo
Integrado de la "mosca minadora de la hoja", Lyriomiza huidobrensis
Blanchard (Díptera: Agromyzidae), en cultivos de papa del sudeste de Buenos
Aires recuperado el 12 de dic del 2017
www.papaslatinas.org/wp-content/uploads/2017/08/Carmona-PLAGAS.pdf.
Cave, R. (1994). ¿Es viable el control
biológico de un vector de geminlvirus, corno Bemisia tabaci? Manejo Integrado
de Plagas no. 34: 16-22.
Chavarria, S. (2004). Evaluación de
cinco variedades de tomate (Lycopersicum esculentu_Mill) en relación al
complejo mosca blanca- Geminivirus bajo infecciones naturales en la zona del
pacifico de Nicaragua. Tesis previa a la obtención del título de ingeniero
agrónomo. Managua, Nicaragua. Universidad Nacional Agraria (UNA). P. 3-4
CIMMYT (Centro Internacional para el
Mejoramiento del Maíz y el Trigo). (1998). La formulación de recomendaciones a
partir de datos Económicos. Un manual metodológico de evaluación económica.
Edición completamente revisada. ME. D.F. CIMMYT. P. 79.
Comisión nacional de la mosca blanca.
(1992). Las moscas blancas en Nicaragua. Hilje, L; Arboleda, O. las moscas
blancas en america central y el caribe (p. 54). Costa Rica: CATIE.
Espinel, C; Torrez, L; Grijalba, E;
Villamizar, L Y Cotes, A. (2008). Preformulados para el control de la mosca
blanca Bemisia tabaci (Hemiptera Aleyrodidae) en condiciones de laboratorio.
Colombia. Revista Colombiana de Entomología. 34:22-27.
Evans, G. y Serra, C. (2002):
Parasitoids Associated with Whiteflies (Hemiptera, Aleyrodidae) in Hispaniola
and Descriptions of two New Species of Encarsia Forster (Hymenoptera:
Aphelinidae). Journal of
Hymenoptera Research, 11 (2): 197-212.
Fabricius, J.
(1787). Mantissa insectorum sistens species nuper detectas adiectis synonymis,
observationibus, descriptionibus, emendationibus, 2, p. 260-275.
Fagoonee, I. Y
Toory, V. (1983). Preliminary investigations of host selection mechanisms by
the leafminer Liriomyza trifolii. Insect. Sci. Application, 4: 337 341.
https://doi.org/10.1017/S1742758400002356
Falcon, L.
(1985). Development and Use of Microbial Insecticides in Biological Control in
Agricultural IPM Systems, Academic Press, Londres, pp229-242.
https://doi.org/10.1016/B978-0-12-357030-7.50019-3
Faust, R.
(1992). Conference report and 5 year national research and action plan for
development of management and control methodology for sweetpotato whitefly.
(1992, Houston, US). Houston, US, USDA. p. 4-5.
Flores, G.;
Hilje, L.; Mora, G. Y Carballo, M. (2008). Antifeedant activity of
botanical crude extracts and their fractions on Bemisia tabaci Genn (Homoptera:
Aleyrodidae) adults Sechiumpittieri (cucurbitaceae). Department of Agriculture
and Agroforestry. Tropical Agricultural Research and Higher Education Center
(CATIE). Turrialba, CR In: Rev. Biol. Trop. 56(4):2115-2129.
https://doi.org/10.15517/rbt.v56i4.5782
PMid:19419104
García, C; Chairez, I Y Hernández.
(2010). Efecto de la temperatura en la viabilidad de esporas y toxicidad de
Beauveria bassiana y Metarhizium anisopliae sobre Pieris rapae (L.)
(Lepidopetora: Pieridae). Folia Entomología. P. 1-7. México.
Godonou, I., Green, K. R., Oduro, K. A.,
Lomer, C. J., Afreh-Nuamah, A. (2000). Field Evaluation of
Selected Formulation of Beuveria bassiana for the Management of the Banana
Weevil (Cosmopolites sordidus) on Plantain (Musa spp.) Biocontrol Science and
Technology 10:779- 788.
https://doi.org/10.1080/09583150020011726
GoetteL, M.
(1992). Fungal Agents for Biocontrol, Biological Control of Locust and
Grasshoppers. U.K. CAB International Ascot. pp
122-132.
Gutiérrez, W. y Gonzales, C. (2009).
Evaluación De Cuatro Variedades De Tomate Industrial (Lycopersicum Esculentum,
Mill) En El Rendimiento Y Tolerancia Al Complejo Mosca Blanca (Bemisia Tabaci
Gennadius) - Geminivirus. Tesis para optar al título de ingeniería en
agronomía. UNA (Universidad Nacional Agraria). Managua. Nicaragua.
Hall, R. (1993).
The use of pathogens to control whiteflies in Europe and the tropics
Possibilities for integrated control. In: Memoria II Taller Latinoamericano y del Caribe sobre moscas blancas
y geminivirus. Managua, Nicaragua. 20-22 Octubre. p 35-48
Hernández, V., Berlanga, A. (1995).
Selección de aislamientos de Paecilomyces spp y su interacción con otros
agentes de control de Bemisia spp. In: Memorias XVIII Congreso Nacional de
Control Biológico. México. p 68-69.
Holdrige, R. (1996). Ecología basada en
zonas de Vida. Quinta reimpresión. San Jose, C.R. IICA (instituto
interamericano de cooperación para la agricultura), p 216.
Humber, R.
(1996). Fungi: Identification, Manual of Techniques in Insect Pathology,
Academic Press, New York, pp. 153-185.
https://doi.org/10.1016/B978-012432555-5/50011-7
IBM corp.
Released (2014). IBM SPSS Statistics for Windows, Version 22.0. Armonk, NY: IBM
corp.
Inbar, M;
Doostdar, G; Leibee Y Mayer, R; (1999). The role of rapidly plant induced
reponses in asymetric interspecific interactions among insect herbivores. J. Chem. Ecol., 25: 1961-1979.
https://doi.org/10.1023/A:1020998219928
INTA (Instituto Nicaragüense de
Tecnología Agropecuaria). (2002). Cultivando tomate con menos riegos.
Recuperado de: http://es.scribd.com/document/73793591/TOMATE-INTA.
Jiménez Martínez, Edgardo (2007). Guia
de manejo integrado de mosca blanca y virus en Nicaragua. Recuperado de: http://repositorio
una.edu.ni/id/eprint/2445
Jiménez, E; Rodriguez, O. (2014). Mosca
minadora (Liriomyza spp). Insectos plagas de cultivos en Nicaragua (p. 51).
Jiménez-Martínez; Varela G. (2013).
Módulo práctico: Manejo integrado de plagas. Managua, NI, Universidad Nacional
Agraria. 61p.
Junqueira, C; Nunez, L & Luz, C.
(2006). Impact of
moisture on in vitro germination of Metarhizium anisopliae and Beauveria
bassiana and their activity on Triatoma infestan. Mycological research. P.
485-492.
https://doi.org/10.1016/j.mycres.2005.12.001
PMid:16546363
Jussieu, A.
(1830). Mémoires du Museum di Histoire Naturelle. Paris. 19: 221.
Jussieu, A. (1789). Genera Plantarum,
secundum ordines naturales disposita juxta methodum in Horto Regio Parisiensi.
Francia.
https://doi.org/10.5962/bhl.title.7762
Lanuza Rodríguez, EH; Rizo González, EJ.
(2012). Evaluación de productos botánicos y químicos sobre el complejo mosca
blanca (Bemisia tabaci Gennadius)- Geminivirus en el cultivo de tomate (Solanum
esculentum, Mill.), en Tisma-Masaya. Tesis Ing. ISPAF. Universidad Nacional
Agraria, Facultad de Agronomía. Managua, NI. 59p.
Laurenti, N. (1768). Flora indica: cui
accedit series zoophytorum indicorum nec non prodromus florae capensis.
Lessing, C. (1832). Synopsis generum
Compositarum Earumque Dispositionis Novae Tentamen Monographis Mutarum
Capensium Interjectis. Alemania.
https://doi.org/10.5962/bhl.title.51470
Linnae, C. (1753). Species plantarum,
exhibentes plantas rite cognitas, ad genera relatas, cum differentiis
specifics, nominibus trivialibus, synonymis selectis, locis natalibus, secundum
sistema sexuale digestas. Tomo I.
https://doi.org/10.5962/bhl.title.669
Link, H. (1833).
Hortius regius botanicus Berolinensis. Tomo II. Alemania
MAG (Ministerio de Agricultura y
Ganadería). (2007) Agrocadena del tomate. Recuperado de: www.mag.go.cr/biblioteca_virtual/bibliotecavirtual/a00075.pdf
Mau, R y Martín, J. (1991). Liriomyza
sativae (Blanchard) Vegetable Leafminer. Department of Entomology. Honolulu, Hawaii. 4 p.
Monzón, A. (2001). Producción uso y
control de calidad de hongos entomopatógenos en Nicaragua. Manejo Integrado de
Plagas 63: 95-103.
Morales, F; Cardona, C; Bueno, J Y
Rodríguez. (2006). Manejo integrado de enfermedades causadas por virus
trssmitidas por mosca blanca. Proyecto manejo integrado sostenible de moscas
blancas como plagas y vectores de virus en los trópicos, p. 19. Colombia.
Murguido, C. y Vera, R. (1999).
Influencia de algunos factores del ambiente sobre la población de la mosca
blanca (Semis/a spp) en tomate de crecimiento indeterminado. Fitosanidad 1 (1):
7-10.
Navarrete, B; Valarezo, O; Cañarte, E; y
Solorzano, R. (2006). Efecto del nim (azadirachta indica juss.) Sobre bemisia
tabaci gennadius (hemiptera: aleyrodidae) y controladores biológicos en el
cultivo del melón cucumis melo l. Instituto Nacional de Investigaciones
Agropecuarias. Departamento Nacional de Protección Vegetal-Entomología.
Núñez, E. (1995). Reporte de Perú. In:
memoria IV Taller latinoamericano sobre moscas blancas y geminivirus.
Caballero, R., Patty, A (eds) Zamorano, Honduras. CEIBA 36: 157-162.
Osborne, L & Landa, Z. (1992). Biological
control of whiteflies with entomopathogenic fungi. Fl. Entomologist 75, 456-471.
https://doi.org/10.2307/3496127
Pacheco, M.F. (1985). Plagas de los
Cultivos Agrícolas en Sonora y Baja California. 1ª Ed. Edit. CIANO.SARH.INIA.
Campo Agrícola Experimental Valle del Yaqui. Cd. Obregón, Sonora, México. p.
222-223.
Pouey, F; Chirinos, D; Y Riveros, G.
(1997). Dinámica poblacional de pasadores de la hoja, Liriomyza spp, Díptera: Agromyzidae,
en tomate en la región noroccidental del estado Zulia, Venezuela. Reyes, M.
(2011). El economista. Bioinsumos, alternativa sostenible. Recuperado de: http://eleconomista.com.mx/columnas/agronegocios/2011/01/19/bioinsumos-alternativa-sostenible
Rodríguez, V y Morales, J. (2007).
Evaluación de alternativas de protección química y física de semilleros de
tomate (Lycopersicum esculentum, Mill) contra el ataque del complejo mosca
blanca (Bemisia tabaci, Gennadius) - Geminivirus y su efecto en el rendimiento,
en el municipio de Tisma, Masaya (Tesis para optar al título de ingeniero
agrónomo). Universidad
Nacional Agraria (UNA). Nicaragua.
Sclar, C.
(1994). Neem: mode of action of compounds present in extracte and formulations
of Azadlrachta indica seeds and their efficacy to pest of ornamental plants and
no target species (en linea). Consultado
el 2 de abril del 2004 .Disponible en:
www.colostate.edu/Depts/Entomology/courses/en570/papers_ 1994/sclar.html.
Sorokin, K.
(1883). Plant parasites of man and animals as causes of infectious diseases. J
Military Mead 2 (Suppl. 1), 268-291.
SPENCER, K.
(1973). Agromyzidae (Diptera) of economic importance. Series Entomological.
Vol. 9. Junk Ed., The Hague, 418 pág.
https://doi.org/10.1007/978-94-017-0683-4
Sponagel, K.
(1999). Presencia, estatus de peste y manejo de
la mosca blanca del algodón (Bemisia tabaci) y de la mosca blanca del
invernadero (Trlaleurodes vaporariorum). Quito, Ecuador. 51 p .Párrafo 10
Sponagel, K; Fúnez, M. (1994).
Estrategias probadas de manejo del complejo fitosanitario mosca - blanca virus
gemini en la producción de tomate: Manual de recomendaciones. La lima.
Fundación Hondureña de Investigación Agrícola. p. 1-6.
Tanada, Y.,
Kaya, H. (1993). Insect Pathology. Academic Press. New York, EE.UU.
Trujillo, M y Martinez, M. (2016).
Alternativas botánicas, biológica y química para el manejo del piojo del tomate
(Halticus sp) (Hemiptera: Miridae) y mosca blanca (Bemisia tabaci, Gen)
(Hemiptera: Aleyroridae) en el cultivo de tomate (Solanum lycopersicum L), bajo
condiciones de casa malla (Doctoral dissertation, Universidad Nacional
Agraria).
Urbina, E. (2001). El minador de la hoja
Liriomyza spp y su manejo en la Planicie Huasteca. INIFAP-CIRNE (Instituto
Nacional De Investigaciones Forestales, Agrícolas Y Pecuarias - Centro De
Investigación Regional Del Noreste Campo Experimental Ébano). Campo
Experimental Ébano. Folleto Técnico Núm. 5. San Luis Potosí, México. 14 p.
Vázquez, L; Murguido, C; Elizondo, A;
Elósegu, O y Morales, F. (2007). Control biológico de la mosca blanca Bemisia
tabaci. Proyecto manejo integrado sostenible de moscas blancas como plagas y
vectores de virus en los trópicos, p. 11. Colombia.
Vega, P. (2003). Dípteros de interés
agronómico. Agromícidos plaga de cultivos hortícolas intensivos. Bol. SEA,
2003, vol. 33, no 1, p. 293-307.
Vicentini, S., Faria, M., Oliveira, R.
M. (2001). Screening of
Beauveria bassiana (Deutomycotina: Hyphomycetes) Isolates Against Bemisia
tabaci (Genn.) Biotype B. (Hemiptera: Aleyrodidae) with a Description of a New
Bioassay Method. Brasil
Neotropical Entomology 30:97-103.
https://doi.org/10.1590/S1519-566X2001000100015
Vilas Boas, G; Franca. F; De Avila, A.;
Becerra, l. (1997). Manejo integrado de mosca branca Bemisia argentifoli.
Brasil, EMPRAPA. 11 p. (Circular Técnica no. 9).
Vuillemin, P. (1912). Beauveria, nouveau
genre de verticilliacées. Bulletin de la societé botanique de france. 59:34-40.
https://doi.org/10.1080/00378941.1912.10832379
Walpers, G.
(1842). Repertorium botanices systematicae. Tomo I, p.679.
Wraight, S.,
Carruthers, R., Bradley, C., Jaronski, S., lacey, L., Wood, P., Galini -
Whaight, S. (1998). Pathogenicity of the Entomopathogenic Fungi Paecilomyces
spp. and Beauveria bassiana against the silverleaf whitefly Bemisia
argentifolli. Journal of Invertebrate Pathology 71: 217- 226.
https://doi.org/10.1006/jipa.1997.4734
PMid:9538026
Zoebisch, T Y
Schuter, D. (1987). Suitability of foliage of tomatoes and three weed host for
oviposition and development of Liriomyza trifolii (Diptera: Agromyzidae). J. Econ. Entomol., 80:758-762.
https://doi.org/10.1093/jee/80.4.758
INTA (Instituto Nicaragüense de
Tecnologías Agropecuarias). (2014). Guia para el manejo integrado de plagas y
enfermedades del tomate.
Reyes, M.
(2011). El economista. Bioinsumos, alternativa sostenible. Recuperado de: http://eleconomista.com.mx/columnas/agronegocios/2011/01/19/bioinsumos-alternativa-sostenible
Anexo
Tabla 1
Operacionalización de variables
 Fuente: Elaboración propia
Fuente: Elaboración propia
Notas de autor
david.estrada@curj.unanleon.edu.ni


















