INTRODUCCIÓN
El tomate (Solanum lycopersicum L. = Lycopersicon esculentum Mill.) es una planta dicotiledónea perteneciente a la familia de las solanáceas (Peralta et al., 2005). Es una de las hortalizas más consumidas y distribuidas en todas las regiones del mundo. Es la hortaliza más importante por su consumo, superficie cultivada y por la tecnología desarrollada en torno a ella. La producción mundial de tomate fresco es de 177.042.056 t (FAOSTAT, 2016); se encuentra dentro de los diez alimentos de mayor producción a nivel mundial. En Argentina se cultivan 17.800 ha de tomate (INTA & CMCBA, 2009), de las cuales 10.500 ha se destinan a mercado fresco y 6.500 ha para industria. Es la hortaliza que ocupa la mayor superficie cultivada bajo cubierta del país, representando el 40% del total (Corvo Dolcet, 2005), concentrada principalmente en las provincias de Buenos Aires y Corrientes. Se producen en el país aproximadamente 1.000.000 de t de las cuales 650.000 son comercializadas para tomate en fresco (Del Pino, 2020). El Cinturón Hortícola Platense (CHP), que comprende las zonas productivas de los partidos de La Plata, Berazategui y Florencio Varela, no sólo es la región más importante de la provincia de Buenos Aires, sino que además es una de las zonas productivas más capitalizadas de Argentina. En los últimos 20 años la continua incorporación de invernaderos ha permitido su crecimiento en producción a nivel regional, provincial y nacional (García, 2011). Tiene más de 4.000 ha bajo cubierta y produce el 67% del tomate bajo invernadero de toda la provincia (CHFBA, 2005; MDA, 2018).
El tomate platense es una variedad botánica caracterizada por su sabor intenso, su forma irregular, achatada, acostillada o fuertemente lobulada (Garat, 2002). Es un producto típico de esta región (CHP) construido desde hace más de 70 años a través de una relación muy fuerte entre actores y territorio, dando por resultado un producto reconocido por su sabor, aroma y rusticidad. Como tal ha dominado por décadas la producción de tomate fresco en la región rioplatense, pero desde la década del 80, ha sido paulatinamente desplazado por materiales genéticos modernos, hasta tener una presencia menor tanto en las quintas como en el mercado. No obstante, en los últimos años se han desarrollado experiencias en el ámbito internacional y nacional, vinculadas a la revalorización y conservación de los materiales genéticos locales. Esto permitió trazar la existencia de un buen número de variedades de tomate platense de la región (Garat, 2002), las cuales, como llevan algunos años de producción continua en la zona, están adaptadas a las condiciones de suelo y clima. Esta característica y la experiencia reciente permiten inferir que la incorporación de variedades de tomate platense a las rotaciones sería beneficioso para disminuir la dependencia de insumos externos, respecto a las variedades comerciales, especialmente en el uso de agroquímicos (Otero et al., 2014).
El marchitamiento y cancro bacteriano del tomate es producido por la bacteria Clavibacter michiganensis subsp. michiganensis (Cmm) (Davis et al.,1984; Smith, 1910). Se encuentra presente en prácticamente todas las zonas productoras de tomate del mundo (EPPO/CABI, 1998; De León et al., 2011; CABI, 2015). Esta enfermedad ha causado grandes pérdidas en los cultivos de tomate tanto a campo como en invernadero. El síntoma más relevante es el marchitamiento y muerte de las plantas, lo que ocasiona grandes pérdidas económicas (Tancos
et al., 2013; CABI, 2015; Chalupowicz et al., 2016). Cuando se presenta puede enfermar a todas las plantas en parcelas o invernaderos en poco tiempo (Kawaguchi
et al., 2010; EPPO, 2013). Es de muy difícil control y las prácticas de manejo empleadas se han enfocado principalmente a medidas preventivas y al uso de productos de síntesis químicas (cúpricos y antibióticos), sin embargo, estos no han sido las prácticas más eficientes. Al contrario, no sólo aumentan los costos de producción, sino que causan daños al hombre, animales y al ambiente.
Impulsada por una creciente conciencia con su entorno, día a día la sociedad se vuelve más exigente con lo que consume, por lo que demanda una oferta mayor de alimentos con atributos de calidad específicos, más sanos y obtenidos de forma ambientalmente sustentable. Actualmente, el control de cualquier enfermedad implica buscar alternativas que permitan disminuir el uso de agroquímicos y de esta manera contribuir al cuidado del hombre y el ambiente.
Existen otras prácticas para el manejo de las enfermedades de los cultivos que actúan de manera más amigable con el hombre y su ambiente, como lo es el control biológico. Éste se basa en la incorporación de microorganismos benéficos que pueden establecer interacciones antagónicas con los patógenos, o bien estimular los mecanismos de defensa del hospedante (Montesinos & Bardají, 2008). En este sentido, se han reportado resultados positivos del uso de Trichoderma spp. sobre el crecimiento y productividad en diversas especies hortícolas (Grondona
et al., 1997; Brunner et al., 2005; Vinale et al., 2008; Kariuki et al., 2020). Trichoderma harzianum Rifai es un hongo de vida libre que vive en el suelo y coloniza las raíces de muchas plantas como un simbionte oportunista no virulento (Harman et al., 2004). Se ha utilizado en aplicaciones biotecnológicas como biofungicida y como promotor de crecimiento ya que proporciona beneficios importantes para la agricultura en condiciones de campo (Yedidia
et al., 2001; Bal & Altintas, 2006; Lorito et al., 2010). Existen reportes sobre la incorporación de este hongo en tomate, durante la etapa de almácigo, donde promovió el crecimiento, tanto de la parte aérea como radical, redundando en la obtención de plantines de mejor calidad al trasplante (Moo-Koh et al., 2017). En este sentido, González et al. (2013) y Jiménez et al. (2011) reportaron incrementos en el rendimiento al aplicarlo luego de la siembra. Mientras que Galeano et al. (2002) observaron que al incorporar T. harzianum previo al trasplante en plantas de tomate, pimiento y pepino, presentaban mayor altura respecto a las plantas no inoculadas.
Guerrero et al. (2017a; 2017b) y Utkhede & Koch (2004) señalaron una reducción del cancro bacteriano del tomate en ensayos en invernáculo mediante la incorporación de T. harzianum tanto al sustrato como a la parte aérea de plantas de tomate. Adicionalmente, dada su versatilidad al momento de actuar frente a los patógenos Trichoderma sp. ofrece un mayor rango de acción que no ha sido superado fácilmente por otros agentes de control biológico (Harman et al., 2004; Samuels, 2006).
El objetivo del presente trabajo fue evaluar la posibilidad del uso de Trichoderma harzianum, bajo dos modalidades de aplicación, sólida y líquida, sobre la manifestación del marchitamiento y cancro bacteriano y el rendimiento en plantas de tomate platense cultivadas bajo cubierta.
MATERIALES Y MÉTODOS
Aplicación de los antagonistas
Se utilizaron dos cepas de T. harzianum
(Th118 y Th5cc) como antagonistas. La cepa Th118 fue aislada del filoplano de
hojas de tomate y probada previamente en ensayos de invernáculo donde redujo la
incidencia de la enfermedad ocasionada por Botrytis cinerea (Dal Bello et al., 2011). Por
otra parte, la cepa Th5cc fue aislada del filoplano de trigo y usada previamente
como antagonista de Zymoseptoria
tritici (Cordo et al., 2007). Además, en trabajos previos se
determinó que la cepa Th5cc aplicada como formulación líquida y como
recubrimiento en semillas, resultó ser la más efectiva en mantener una alta
población de T. harzianum en el suelo con un
potencial efecto biocontrolador (Stocco et al., 2019). Ambas cepas se
identificaron molecularmente siguiendo la técnica descripta por Stocco et al.
(2016) y fueron depositadas en la base de datos del European Molecular Biology
Laboratory (EMBL) bajo los números de acceso LN869400 (T. harzianum
Th118) y LN869401 (T. harzianum Th5cc).
A su vez, estas cepas se encuentran depositadas en el cepario perteneciente al
Centro de Investigaciones de Fitopatología (CIDEFI).
La incorporación de este hongo se realizó al sustrato de los plantines de dos maneras diferentes, como preparación sólida y como preparación líquida. Para incorporar cada uno de los antagonistas de forma sólida, 1 ml de una suspensión de esporas de cada cepa de T. harzianum (108 esporas/ml) se sembró en 100 g de una mezcla de arena, salvado de trigo y agua en partes iguales, previamente esterilizada durante dos días consecutivos. Se incubó a temperatura ambiente (25 +/- 2ºC) durante 10 días. Posteriormente, la mezcla colonizada por el antagonista se secó en bolsas de papel dobles en estufa a 40 °C durante 24 h. El inóculo fúngico se desmenuzó manualmente y se incorporó al sustrato de los plantines en una proporción de 1:100 (por cada 2 kg de sustrato se utilizaron 20 g de inóculo). Por último, se sembraron las semillas de tomate en speedlings, una por cada celda.
El tratamiento testigo consistió en sembrar semillas de tomate sobre sustrato sin inóculo de T. harzianum. Para la incorporación del antagonista en forma líquida, se preparó una suspensión de esporas de cada cepa de T. harzianum desarrolladas en medio PDA (papa dextrosa agar) durante 8 días de crecimiento. La suspensión se realizó agregando agua estéril sobre la caja de Petri colonizada y raspando con un ansa estéril. Luego se ajustó a 1x108 esporas/ml y se agregó Tween 20 (0,01%). El inóculo fúngico se aplicó por única vez en el momento de la siembra en forma de riego utilizando 10 ml de suspensión por cada cavidad de la bandeja de siembra. Por último, se sembró una semilla de tomate en cada celda. En el momento de la siembra este tratamiento se regó con 10ml de agua destilada estéril.
Preparación
del inóculo de Clavibacter michiganiensis
subsp. michiganiensis
Para este trabajo se utilizó la cepa de la bacteria patógena Cmm (LPAb158), que se encuentra depositada en el cepario del Centro de Investigaciones de Fitopatología (CIDEFI). La misma fue identificada por técnicas microbiológicas y moleculares usando cebadores específicos que amplifican la región intergénica 16S-23S del ARNr (Patrik
& Rainey, 1999; Schaad et al., 2001; EPPO, 2013), descripto por Rolleri (2015).
Para la inoculación se partió de una suspensión bacteriana conservada en caldo nutritivo y glicerol (20%) y almacenada a -20°C. La cepa bacteriana, se cultivó en cajas de Petri, en medio Agar Nutritivo (AN), se sembró en estrías por agotamiento y se incubó a 27°C (+/- 2°C) entre 48 a 72 h. Luego, se realizó una suspensión de las colonias en agua destilada estéril, ajustándose a una lectura en el espectrofotómetro de OD600 = 0,3 (~5,5 x 108 UFC/ml) diluyéndose 1:10 para alcanzar la concentración final de uso de 107 ufc/ml.
Ensayos en Invernáculo
Los ensayos
se llevaron a cabo en un invernáculo (de 6m x 20m, con mampostería de madera y
polietileno de 180µ de espesor) situado en la Chacra Experimental Gorina, del
Ministerio de Desarrollo Agrario de la provincia de Buenos Aires (34° 54´ 56,4´´S
58° 02´ 21,5´´W), perteneciente al Cinturón Hortícola Platense. Los plantines
se sembraron en bandejas de siembra con los tratamientos respectivos descriptos
anteriormente y se trasplantaron al invernáculo cuando tenían entre 10 y 15 cm de altura y al menos 4–6 hojas verdaderas desplegadas.
Se realizó una sola inoculación con la bacteria patógena Cmm en el momento del primer desbrote cuando las plantas tenían entre 12-14 hojas. La misma consistió en sumergir la cuchilla de desbrote en la suspensión bacteriana con una concentración de 108 UFC/ml realizando un pequeño tajo en el tallo principal de la planta entre la quinta y sexta hoja.
Se realizó un ensayo durante la campaña 2015-2016 (ensayo 1) el cual se repitió en 2016-2017 (ensayo 2) en el mismo invernáculo.
Diseño experimental y Análisis Estadístico
El diseño experimental consistió en 3 bloques con 5 tratamientos al azar y 10 repeticiones de cada uno. Los tratamientos fueron:
-Tratamiento 1: Aplicación de la cepa Th118 en forma líquida (aplicada como riego) a la siembra y posterior inoculación con la suspensión bacteriana de Cmm en las plantas de tomate en el invernáculo (Th118 L).
-Tratamiento 2: Incorporación de la cepa Th118 en forma sólida (aplicada al sustrato) a la siembra y posterior inoculación con la suspensión bacteriana de Cmm en las plantas de tomate en el invernáculo (Th118 S).
-Tratamiento 3: Aplicación de la cepa Th5 cc en forma líquida a la siembra y posterior inoculación con una suspensión bacteriana de Cmm en las plantas de tomate en el invernáculo (Th5 cc L).
-Tratamiento 4: Incorporación de la cepa Th5 cc en forma sólida a la siembra y posterior inoculación con una suspensión bacteriana de Cmm en plantas de tomate en el invernáculo (Th5 cc S).
-Tratamiento 5: (Testigo) Tomate más inoculación de suspensión bacteriana Cmm sin aplicación de antagonista.
Para cada tratamiento se evaluaron parámetros relacionados con la sanidad y el rendimiento de los frutos. Con respecto a la sanidad de las plantas se evaluó a los 30 días posteriores a la inoculación, el número de hojas con síntomas sobre el total de hojas por planta. Respecto al rendimiento de frutos se evaluó peso y número de frutos por planta al momento de la maduración de la primera corona.
El número de hojas se analizó mediante análisis de la varianza (ANOVA), el peso y número de frutos se analizó mediante prueba no paramétrico de Friedman, debido a que los datos no cumplían con los supuestos de normalidad y varianzas homogéneas. Para los análisis estadísticos se utilizó el programa Infostat® (Di Rienzo et al., 2015).
RESULTADOS
Ensayos en invernáculo
No se
observaron diferencias significativas en el número de hojas con síntoma de
marchitamiento y cancro bacteriano entre los tratamientos tanto para el ensayo
1 (F: 0,55; p-valor =0,7) como para el ensayo 2 (F: 1,74; p-valor= 0,15). Para
el primer año en los tratamientos 1, 3 y 4 (Th118 L, Th5 cc L y Th5cc S) la
enfermedad respecto al testigo fue menor. En el segundo año todos los
tratamientos con T. harzianum
presentaron menos hojas afectadas que el testigo, siendo el tratamiento Th118 L
el que presentó menor cantidad de hojas afectadas por la enfermedad (Figura 1).
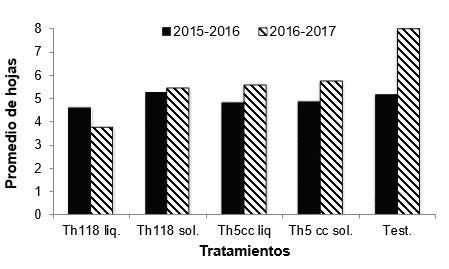 Figura 1
Promedio del número de hojas afectadas por cancro bacteriano en cada
tratamiento con T. harzianum y testigo para cada
ensayo. No se indican letras ya que no existen diferencias significativas entre
tratamientos para cada ensayo según el análisis de ANOVA.
Figura 1
Promedio del número de hojas afectadas por cancro bacteriano en cada
tratamiento con T. harzianum y testigo para cada
ensayo. No se indican letras ya que no existen diferencias significativas entre
tratamientos para cada ensayo según el análisis de ANOVA.
Con respecto al peso de los frutos, no hubo diferencias significativas entre el testigo y los tratamientos con T. harzianum en los dos ensayos. En el ensayo 1, si bien el análisis estadístico no mostró diferencias significativas entre los tratamientos (T: 2,20; p-valor =0,07) el tratamiento Th5cc L y el testigo fueron los que presentaron menores valores de peso (promedio 315 y 480 g respectivamente). El tratamiento Th 118 L fue el que se destacó presentando mayores valores de peso de frutos (promedio 580 g). Para el ensayo 2 tampoco se registraron diferencias significativas entre todos los tratamientos (T: 1,49; p-valor= 0,21) aunque el testigo registró los menores valores de peso de frutos (promedio 470 g). El tratamiento Th 5cc L y Th 118 L revelaron los valores más altos de peso de frutos cosechados (promedio 1000 y 900 g respectivamente) (Figura 2).
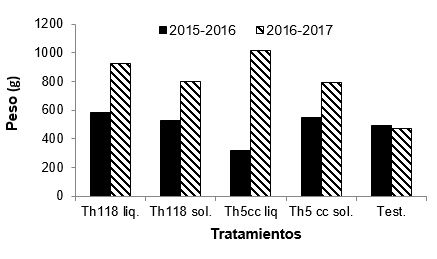 Figura 2
Promedio del peso de frutos en cada tratamiento con T. harzianum
y testigo para cada ensayo. No se indican letras ya que
no existen diferencias significativas entre tratamientos para cada ensayo de
acuerdo a la prueba de Friedman.
Figura 2
Promedio del peso de frutos en cada tratamiento con T. harzianum
y testigo para cada ensayo. No se indican letras ya que
no existen diferencias significativas entre tratamientos para cada ensayo de
acuerdo a la prueba de Friedman.
En cuanto al
número de frutos hubo diferencias para esta variable en los dos ensayos. Para
el ensayo 1 el análisis estadístico muestra diferencias significativas entre
los tratamientos (T: 3,42; p-valor= 0,01). El testigo y el tratamiento Th 5 cc L
registraron la menor cantidad de frutos. Los tratamientos Th118 L y Th118 S
fueron los que presentaron mayor cantidad de frutos (Figura 3).
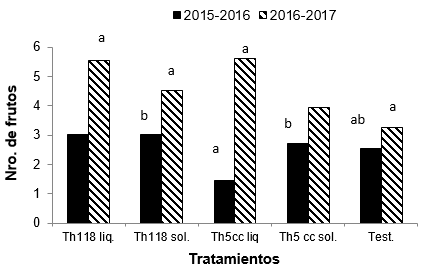 Figura 3
Promedio del número de frutos en cada tratamiento con T. harzianum
y testigo para cada ensayo. Letras iguales indican que no existen diferencias
significativas para el mismo ensayo según la prueba de (Friedman-dms) (p ≤
0,05).
Figura 3
Promedio del número de frutos en cada tratamiento con T. harzianum
y testigo para cada ensayo. Letras iguales indican que no existen diferencias
significativas para el mismo ensayo según la prueba de (Friedman-dms) (p ≤
0,05).
En el ensayo 2, los tratamientos no presentaron diferencias significativas para la variable número de frutos (T: 1,74; p-valor= 0,15) aunque el testigo fue el que registró menor cantidad de frutos cosechados. Los tratamientos Th118 L y Th5cc L fueron los que produjeron mayor cantidad de frutos (Figura 3).
Según lo observado en los resultados, hubo una tendencia favorable del tratamiento Th118 L a mejorar tanto los parámetros de sanidad de las plantas de tomate como de rendimiento. Este tratamiento fue el que presentó menor cantidad de hojas afectadas, así como también mayores valores de peso y número de frutos cosechados.
DISCUSIÓN
En los últimos años, en el mundo ha aumentado
el interés en el control biológico de patógenos vegetales, especialmente de
bacterias fitopatógenas (Volksch
& May 2001; Wilson et al., 2002; Nguyen & Ranamukhaarachchi, 2010; Valdez
Morales, 2016; Zahir et al., 2018; Abo-Elyousr et al., 2019). Dentro de este contexto, y de acuerdo con los resultados de estas
investigaciones, el uso de T. harzianum es una
buena alternativa para controlar el marchitamiento y cancro bacteriano del
tomate, y así reducir las consecuencias ambientales de las aplicaciones de
productos tóxicos.
En este trabajo se observó que el promedio de hojas afectadas por la bacteria patógena disminuyó al ser tratadas con el antagonista, esto coincide con los resultados de Anwar & Iqbal (2017). Estos autores estudiaron la actividad antimicrobiana de T. harzianum contra las bacterias Xanthomonas campestris y Clavibacter michiganensis y encontraron que el hongo produce metabolitos antibacterianos que en condiciones de laboratorio disminuyen el crecimiento de las bacterias fitopatógenas y que esto depende de las condiciones del medio (temperatura, pH, medio de cultivo y humedad). Además, Noshad et al. (2019) estudiaron la actividad antibacteriana del hongo antagonista sobre Clavibacter michiganensis, Agrobacterium tumefaciens y Xanthomonas campestris y observaron que utilizando nanoparticulas de plata a partir de una suspensión de esporas de T. harzianum se inhibía el crecimiento de las bacterias fitopatógenas.
Además de sus capacidades antimicrobianas como agente de biocontrol, este hongo tiene otros efectos directos en las plantas de tomate. Estos incluyen el aumento en el rendimiento y el efecto duradero de esta protección ya que el antagonista se incorporó en los plantines y su efecto duró hasta la cosecha.
En pruebas realizadas en plantines de tomate Guerrero et al. (2017b) señalan una reducción de hasta un 50% en la severidad del marchitamiento y cancro bacteriano del tomate en plantas infestadas con T. harzianum, en invernadero. Estos autores observaron también un aumento en el peso seco y fresco (entre 11 y 13 g) de las raíces de las plantas tratadas con este antagonista demostrando así, la capacidad de T. harzianum para mejorar la sanidad de las plantas.
La incorporación del agente de biocontrol al sustrato en el momento de la siembra, tiene como objetivo permitir que los conidios de T. harzianum colonicen el plantín, y al momento del trasplante, ya se haya puesto en contacto con la planta. Este hecho queda demostrado por los resultados promisorios que se observaron al inocular las plantas con Th 118 L. En este sentido, y como observaron Cordo et al., (2007) y Stocco et al., (2015), las plantas tratadas previamente con T. harzianum además de provocar menos severidad de la enfermedad demostraron un mayor desarrollo radicular. Esta afirmación y en concordancia con Bailey et al., (2011), podría deberse a que un mayor desarrollo de las raíces tiene el beneficio adicional de elevar la capacidad de soportar condiciones de estrés en las plantas colonizadas. Al respecto, Brotman et al., (2013) y Hermosa et al., (2012) coinciden en que las cepas de Trichoderma sp. pueden interactuar directamente con las raíces colonizando el apoplasto, incrementando el potencial de crecimiento, la resistencia a enfermedades y la tolerancia a estreses abióticos. Asimismo, Recinos Cabrera, (2015) observó que los mecanismos de acción de T. harzianum como promotor del crecimiento vegetal se manifiestan desde las primeras fases de la plántula, favoreciendo una mayor capacidad exploratoria del sistema radicular que le confiere ventajas al plantín en el momento del trasplante.
Teniendo en cuenta que el antagonista se incorporó al sustrato y Cmm se inoculó en la parte aérea de la planta, la disminución de los síntomas de la enfermedad también podría deberse a que los aislamientos de T. harzianum inducen diferentes tipos de señales que dan como resultado la activación de genes, la producción de enzimas involucradas en la supresión del patógeno y el incremento de barreras bioquímicas y estructurales en la planta (Hermosa et al., 2012; Hoitink et al., 2006; Nawrocka & Malolepsza, 2013). Este efecto sumado al mejoramiento del vigor de las plantas tiene un papel importante al momento de desarrollarse la infección y la posterior manifestación de los síntomas.
Con respecto al comportamiento diferencial de la cepa T. harzianum (Th 5cc) en los distintos años y, habida cuenta que el tomate platense no es un híbrido, y por lo tanto cada planta tiene una respuesta distinta ante una misma cepa, podemos sugerir que esta cepa tuvo un efecto diferente teniendo en cuenta lo reportado por Lo & Lin (2002) y Tucci et al., (2011). Estos autores observaron que, inclusive cepas de la misma especie muestran diferentes grados de acción sobre un cultivo y que también pueden variar de un cultivar a otro. Los autores señalan que esto podría estar influenciado por factores aún desconocidos. En concordancia con lo antes dicho, y como lo expresa Baker (1991) estos factores podrían estar relacionados con la habilidad saprofítica competitiva o la afinidad para sobrevivir en la rizósfera lo que podría haber sucedido con la cepa Th5cc en los distintos años de ensayo. De acuerdo a los resultados obtenidos en este trabajo, y al amplio potencial de acción que tiene el hongo T. harzianum como antagonista de fitopatógenos es necesario profundizar la investigación, tanto para la cepa Th5cc, por su comportamiento diferencial, como para la Th118. Esta última, al ser aplicada como riego a los plantines podría ser incorporada como una buena alternativa dentro de un plan de manejo integrado de enfermedades en el cultivo de tomate platense.
Referencias
Abo-Elyousr, K.A.M., H.M.M. Khalil Bagy, M. Hashem, S.A.M. Alamri & Y.S. Mostafa. 2019. Biological control of the tomato wilt caused by Clavibacter michiganensis subsp. michiganensis using formulated plant growth-promoting bacteria. Egyptian Journal of Biological Pest Control 29: 54.7.
Anwar, J. & Z. Iqbal. 2017. Effect of growth conditions on antibacterial activity of Trichoderma harzianum against selected pathogenic bacteria. Sarhad Journal of Agriculture 33: 501-510.
Bailey, B., H. Bae, R. Melnick & J. Crozier. 2011. The endophytic Trichoderma
hamatum isolate DIS 219 b enhances
seedling growth and delays the onset of drought stress in Theobroma cacao. En: Endophytes
of Forest Trees: Biology and Applications. M. Pirttila, C. Frank, M. Pirttila,
& C. Frank, Ed, Netherlands: Springer. pp: 157-172.
Baker, R. 1991. Induction of rhizosphere competence in biocontrol fungus Trichoderma spp. In The Rhizosphere and Plant Growth. Keiter D.L. & P. Cregan, eds, Kluwer Academic Publishers, Boston, pp: 221-228.
Bal, U. & S. Altintas. 2006. A positive side effect from Trichoderma harzianum, the biological control agent: Increased yield in vegetable crops. Journal of Environmental Protection and Ecology 7: 383-387.
Brotman, Y., U. Landau, A. Cuadros-Inostroza, T. Tohge, T. Takayuki, A. Fernie & L. Willmitzer. 2013. Trichoderma-plant root colonization: escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance. PLoS Pathogens 9: 1-15.
Brunner, K., S. Zeilinger, R. Ciliento, S.L. Woo, M. Lorito, C.P. Kubicek & R. Mach. 2005. Improvement of the fungal biocontrol agent Trichoderma artoviride to enhance both antagonism and induction of plant systemic disease resistance. Applied Environmental Microbiology 71: 3959-3965.
CABI. 2015. Centre for Agricultural Bioscence International. Datasheet: Clavibacter michiganensis subsp. michiganensis (bacterial canker of tomato). Disponible en https://www.cabi.org/isc/datasheet/15338. Ultimo acceso: octubre de 2020.
Chalupowicz, L., I. Barash, M. Reuven, O. Dror, G. Sharabani, K.H. Gartemann & S. Manulis-Sasson. 2016. Differential contribution of Clavibacter michiganensis subsp. michiganensis virulence factors to systemic and local infection in tomato. Molecular Plant Pathology 18: 336–346.
CHFBA. 2005. Censo Horti- Florícola Provincial de Buenos Aires. Ministerio de Asuntos Agrarios de la Provincia de Buenos Aires, Consejo Federal de Inversiones y Secretaria de Agricultura, Ganadería, Pesca y Alimentación de la Nación. Disponible en http://www.estadistica.ec.gba.gov.ar/dpe/Estadistica/chfba/chfba2005.pdf. Ultimo acceso: septiembre de 2021.
Cordo, C., C. Mónaco, C. Segarra, A. Perelló, D. Bayo, A. Mansilla, N. Kripelz & R. Conde. 2007. Trichoderma spp. as elicitors in the defense responses of wheat plants against Septoria tritici. Biocontrol Science and Technology 17: 687-698.
Corvo Dolcet, S. 2005. Zonas de producción del cultivo de tomate en la Argentina. Secretaría de Agricultura, Ganadería, Pesca y Alimentos. pp: 15. Disponible en https://www.seedquest.com/News/releases/2005/pdf/13528.pdf. Ultimo acceso: septiembre de 2021.
Dal Bello, G., M.C. Rollán, G. Lampugnani, C. Abramoff, L. Ronco, S. Larran, M. Stocco & C. Mónaco. 2011. Biological control of leaf grey mould of greenhouse tomatoes caused by Botrytis cinerea. International Journal of Pest Management 57: 177–182.
Davis, M. J., A.G.Jr. Gillaspie, A.K. Vidaver & R. Harris. 1984. Clavibacter: a new genus containing some phytopathogenic Coryneform bacteria, including Clavibacter xyli subsp. xyli sp. nov., subsp. nov., and Cavibacter xyli subsp. cynodonis subsp. nov., pathogens that cause Ratoon stunting disease of sugarcane and Bermudagras stunting disease. International Journal of Systematic Bacteriology 34: 107-117.
De León, L., F. Silverio, M.M. López & A. Rodriguez. 2011. Clavibacter michiganensis subsp. michiganensis, a seedborne tomato pathogen: healthy seeds are still the goal. Plant Disease 95: 1328-1338.
De Pino, M. 2020. Guía didáctica: Cultivo y manejo del cultivo de tomate fresco. Curso de Horticultura y Floricultura, FCAyF, UNLP. Disponible en https://aulavirtual.agro.unlp.edu.ar/pluginfile.php/47324/mod_folder/content/0/5.%20Guia%20de%20Tomate%202020.pdf?forcedownload=1. Ultimo acceso: Octubre de 2021.
Di Rienzo, J.A., F. Casanoves, M.G. Balzarini, L. Gonzalez, M. Tablada & C.W. Robledo. 2015. InfoStat versión. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. URL http://www.infostat.com.ar.
EPPO. 2013. Organisation Européenne et Mediterranéenne pour la Production des Plantes European and Mediterranean Plant Protection Organization. Clavibacter michiganensis subsp. michiganensis. Diagnostics PM 7/42. Bulletin OEPP/EPPO 43:46-67.
EPPO/ CABI. 1998. Map 253. In: Distribution Maps of Quarantine Pests for Europe. Smith IM, McNamara DG, Scott PR & KM Harris Eds, CAB International, Wallingford (GB) 98 pp.
FAOSTAT. 2016. Food Agricultural Organization of the United Nations. http://www.fao.org/faostat/es/#data/QC Último acceso: octubre de 2020.
Galeano, M., F. Mendez, & A. Urbaneja. 2002. Efecto de Trichoderma harzianum Rifai (cepa T-22) sobre cultivos hortícolas. Koppert Biological Systems 286: 1-11.
Garat, J. 2002. Tomate platense en La Plata, Argentina. Biodiversidad 34: 19-21.
García, M. 2011. El Cinturón hortícola platense: Ahogándonos en un mar de plásticos. Un ensayo acerca de la tecnología, el ambiente y la política. THEOMAI Nº23. Primer semestre 2011.
Gleason, M. L., R.D. Gitaitis & M. Ricker. 1993. Recent progress in understanding and controlling bacterial canker of tomato in Eastern North America. Plant Disease 77: 1069-1076.
González, Y.P., Sifontes, J.L.A. & M. Hurtado. 2013. Efecto bioestimulante de dos formulados líquidos de Trichoderma harzianum Rifai A-34 en la producción protegida de tomate el cultivo de tomate protegido. Centro Agrícola 40: 53-56.
Grondona, I., Hermosa R.,
Tejada M., Gomis M.D., Mateos P.F., Bridge P.D., Monte E. & I. Garcia-Acha. 1997. Physiological and biochemical
characterisation of Trichoderma harzianum,
as biological control agent against soilborne fungal plant pathogens. Applied and Environmental 63:
3189-3198.
Guerrero, R., C. Mónaco, M.
Stocco, J. Rolleri & N. Guerrero. 2017a. Selección de aislamientos de Trichoderma spp. para el control del
cáncer bacteriano (Clavibacter
michiganensis subsp. michiganensis)
del tomate (Lycopersicum esculentum
Mill.) Revista Amazónica Ciencia y Tecnología 6: 9-20.
Guerrero, R., Mónaco C.,
Stocco M., Consolo V., Rolleri J. & N. Guerrero. 2017b. Aplicación de Trichoderma harzianum para el control del cáncer bacteriano (Clavibacter michiganensis subsp. michiganensis) del tomate (Lycopersicum esculentum Mill.) Revista Amazónica Ciencia y Tecnología 6: 230-243.
Harman, G., R. Howell, A.
Viterbo, I. Chet & M. Lorito. 2004. Trichoderma
species. Opportunistic, avirulent plant symbionts” Nature Reviews. Microbiology
2: 43-56.
Hermosa,
R., A. Viterbo, I. Chet & E.
Monte. 2012. Plant-beneficial effects of Trichoderma and of its genes.
Microbiology 158: 17-25.
Hoitink, H., L.
Madden & A. Dorrance. 2006. Systemic resistance induced by Trichoderma spp.: interactions between
the host, the pathogen, the biocontrol agent, and soil organic matter quality. Phytopathology 96: 186-189.
INTA & CMCBA. 2009. Instituto Nacional de
Tecnología Agropecuaria y Corporación del Mercado Central de Buenos Aires.
2009. Boletín electrónico de tomate N°18. Disponible en http://www.mercadocentral.gob.ar/boletin/pdf/Tomate18.pdf Último acceso:
octubre de 2020.
Jiménez, C., N.S. de
Albarracin, G. Altuna & M. Alcano. 2011. Efecto de Trichoderma harzianum (Rifai) sobre el crecimiento de plantas de
tomate (Lycopersicon esculentum L.).
Revista de la Facultad de Agronomía LUZ 28: 1-10.
Kariuki, C.K., E.W. Mutitu & W. M. Muiru. 2020. Effect of Bacillus and Trichoderma
species in the management of the bacterial wilt of tomato (Lycopersicum esculentum) in
the field. Egyptian Journal of Biological Pest Control 30: 4-8.
Kawaguchi A., K. Tanina &
K. Inoue. 2010.
Molecular typing and spread of Clavibacter
michiganensis subsp. michiganensis
in Greenhouses in Japan. Plant Pathology 59:76-83.
Lo, C. & C. Lin. 2002. Screening Strains of Trichoderma
spp. for plant growth enhancement in Taiwan. Plant Pathology 11: 215-220.
Lorito,
M., S. Woo, G. Harman & E. Monte. 2010.
Translational research on Trichoderma
from omics to the field. Annual
Review of Phytopahology 48: 395-417.
MDA. 2018. Ministerio Desarrollo
Agrario de la provincia de Buenos Aires, Dirección de Economía, estadísticas y
mercados. Area Teledetección y SIG. Cuantificación de superficie cubierta por
invernáculos mediante Sensores Remotos satelitales. Informe
preliminar. Disponible en file:///C:/Users/viver/Downloads/RESUMEN%20GENERAL%20INVERNACULOS%20(1).pdf Ultimo acceso: marzo de 2019.
Montesinos,
E. & E. Bardají.
2008. Synthetic Antimicrobial Peptides as Agricultural Pesticides for Plant‐Disease Control. Chemistry & Biodiversity: 5: 1225-1237.
Moo-Koh, F.A., J.
Cristóbal-Alejo, A. Reyes-Ramírez, J.M. Tun Suárez & M. Gamboa-Angulo. 2017. Identificación molecular de
aislados de Trichoderma spp. y su
actividad promotora en Solanum
lycopersicum L. Investigación y Ciencia 25: 5-11.
Nawrocka, J.
& U. Malolepsza. 2013. Diversity in plant systemic resistance inducedby
Trichoderma. Biological
Control 67: 149-156.
Nguyen, M.T. & S.L. Ranamukhaarachchi. 2010. Soil
borne-antagonists for biological control of bacterial wilt disease caused by Ralstonia solanacearum in tomato and
pepper. Journal of Plant Pathology
92: 395–405.
Noshad,
A., M. Iqbal, L. Folkers, C. Hetherington, A. Aamir Khan, M. Numan & S.
Ullah. 2019. Antibacterial Effect of Silver Nanoparticles
(AgNPs) Synthesized from Trichoderma
harzianum against Clavibacter
michiganensis. Journal of Nano Research 58: 10-19.
Otero,
J., J.J. Garat, J. Vera Bahima, A. Ahumada, M.P. May & A. Nico. 2014. Multiplicación,
Estudio y Difusión de variedades hortícolas locales en el Cinturón Verde
Platense. XVII Jornadas Nacionales de Extensión Rural y IX del Mercosur. El
encuentro en la diversidad. Facultad de Ciencias Agrarias-UNR, Santa Fe. 19 al
21 de noviembre. Disponible en:https://www.researchgate.net/profile/Jeremias-Otero/publication/317617962_MULTIPLICACION_ESTUDIO_Y_DIFUSION_DE_VARIEDADES_HORTICOLAS_LOCALES_EN_EL_CINTURON_VERDE_PLATENSE/links/5943d1ceaca2722db49d0633/MULTIPLICACION-ESTUDIO-Y-DIFUSION-DE-VARIEDADES-HORTICOLAS-LOCALES-EN-EL-CINTURON-VERDE-PLATENSE.pdf. Ultimo acceso: 30 de septiembre 2020.
Pastrik, K.H.
& F.A. Rainey. 1999. Identification and differentiation of Clavibacter michiganensis subspecies by polymerase chain reaction based techniques. Journal of
Phytopathology 147: 687-693.
Peralta, I. E.,
S. Knapp & D. Spooner. 2005. New species of wild tomatoes (Solanum section Lycopersicon:
Solanaceae) from Northern Peru. Systematic Botany 30: 424-434.
Recinos-Cabrera, H.V. 2015. Evaluación de
frecuencia de aplicación de Trichoderma
harzianum sobre el desarrollo radicular de tomate. Salamá, baja Vera Paz.
Tesis de Grado. Universidad Rafael Londívar. Facultad de Ciencias Ambientales y
Agrícolas, Guatemala, 55 pp.
Rolleri, J. 2015. Cancro bacteriano del
tomate: diagnóstico y prevención de su dispersión en el cultivo. M. Sc. Tesis.
Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata,
La Plata, Argentina, 77 pp.
Samuels,
G.J. 2006. Trichoderma:
Systematics, the sexual state, and ecology. Phytopathology 96: 195–206.
Schaad, N. W., J.B. Jones & W. Chun. 2001. Laboratory guide for identification of plant
pathogenic bacteria. American Phytopathological Society Press, St. Paul, 373 pp.
Shirakawa, T.,
T. Sasaki & K. Ozaki. 1991. Ecology and control tomato bacterial canker and
detection methods of this pathogens. Japan Agricultural Research Quarterly 25:
27-32.
Smith, E. F. 1910. A new
tomato disease of economic importance. (Abstr.). Science (N.S.) 31: 794-796.
Stocco, M., A. Mansilla, C.
Mónaco, C. Segarra, G. Lampugnani, C. Abramoff, M. Marchetti, N. Kripelz, C.
Cordo & V. Consolo. 2015. Native isolates of Trichoderma
harzianum inducting resistance to Mycosphaerella
graminicola, on wheat plants. Boletín de la Sociedad Argentina de Botánica 50: 291-301.
Stocco, M., C. Mónaco,
C. Abramoff, G. Lampugnani, G. Salerno,
N. Kripelz, C. Cordo & V. F. Consolo. 2016. Selection and characterization of Argentine
isolates of Trichoderma harzianum for
effective biocontrol of Septoria leaf blotch of wheat. World Journal of
Microbiology and Biotechnology 32: 2-10.
Stocco,
M., G. Lampugnani, S. Zuluaga, C. Abramoff, C. Cordo & C. Mónaco. 2019. Fungicida biológico a
base de una cepa del hongo Trichoderma harzianum: su supervivencia en el
suelo. Revista de la Facultad de Agronomía 118 : 1-5.
Tancos, M. A., L.
Chalupowicz, I. Barash, S. Manulis-Sasson & C. D. Smart. 2013. Tomato fruit and
seed colonization by Clavibacter
michiganensis subsp. michiganensis through
external and internal routes. Applied
and Environmental Microbiology 79: 6948-6957.
Tucci,
M., M. Ruocco, L. De Masi, M. De Palma & M. Lorito.
2011. The beneficial effect of Trichoderma spp. on tomato
is modulated by the plant genotype. Molecular Plant Pathology 12: 341–354.
Utkhede,
R. &
C. Koch. 2004. Biological treatments to
control bacterial canker of greenhouse tomatoes. BioControl 49: 305–313.
Valdes Morales, M. 2016. Bacterias
antagonistas para el control biológico de Ralstonia solanacearum (e. f.
Smith) en tomate (Solanum lycopersici
L.). Tesis para optar al título de Maestría en Ciencias. Coordinación Culiacán
del CIAD en Ciencia y Tecnología para productos agrícolas de zonas tropicales y
subtropicales. Ciad Repositorio, México, 83 pp.
Vinale,
F. K., E.L. Sivasithamparam, R. Ghisalberti, S.L. Marra Woo & M. Lorito. 2008. Trichoderma plant pathogen interactions.
Soil Biology and Biochemistry 40: 1-10.
Volksch, B.
& R. May. 2001. Biological control of Pseudomonas syringae pv. glycinea
by epiphytic bacteria under field conditions. Microbial Ecology 41: 132-139.
Wilson, M., H.L.
Campbell, P. Ji,
J.B. Jones & D. Cuppels. 2002. Biological control of bacterial speck of
tomato under field conditions at several locations in North America.
Phytopathology 92: 1284-1292.
Yedidia,
I., A.K. Srivastva, Y. Kapulnik
& I. Chet. 2001. Effects of Trichoderma harzianum
on microelement concentrations and increased growth of cucumber plants. Plant
and Soil 235: 235-242.
Zahir,
I., M. Babouchi, H. Boulanour & M. El Louyti. 2018. Effet des
microorganismes isolés á partir des biotipes Marocains sur les phytopatogénes. Revue
bibliographique: Revue Agrobiologique
8: 971-983.







