INTRODUCCIÓN
Las tortugas marinas se diferencian de las terrestres por su incapacidad de retraer la cabeza y extremidades hacia dentro del caparazón (Meylan & Meylan, 2000). Éstas especies se encuentran amenazadas a nivel mundial por el incremento de las actividades antropogénicas, la pérdida y fragmentación del hábitat, el desarrollo costero, la contaminación marina, el comercio de sus huevos y la captura incidental (CIT, 2004 a,b). En adición, el ciclo de vida de las tortugas marinas es muy
complejo debido a su lento crecimiento y maduración sexual tardía, por lo que se debe dar un uso sostenible a la explotación del recurso para no llevar al colapso las poblaciones (Márquez, 1996).
La protección de las especies de tortugas marinas que se encuentran en peligro de extinción, son importantes para las poblaciones mundiales, ya que, éstas son especies indicadoras de los cambios climáticos y el bienestar de los océanos (CIT, 2011). El cambio climático afectará la anidación de las tortugas marinas, por medio de cambios en la morfología de las costas, producto del incremento del nivel del mar y el calentamiento de las playas (Poloczanska et al., 2009). Las poblaciones de tortugas marinas pueden verse afectadas, ya que, hoy es bien sabido que la característica de la arena sobre todo la temperatura influye en la proporción sexual de los neonatos de cada nido (Mrosovsky & Yntema, 1980).
Los hábitats de anidación representan una parte clave en el ciclo de vida de las tortugas marinas, razón por la cual se han realizado trabajos de caracterización de playas (Rubiano, 2011). El sitio en donde son construidos los nidos condiciona el ambiente de su interior a la vez que mantienen la humedad y temperatura con cierta estabilidad. Así, las condiciones del entorno varíen de forma brusca, en el interior de la cámara de incubación existe un microclima que favorece la incubación de los huevos y el óptimo desarrollo de los embriones (Ackerman, 1997).
Los nidos puestos en la zona cercana a la línea de mareas son más susceptibles a ser inundados durante las mareas altas y los fuertes oleajes con lo cual varían las condiciones ambientales del mismo (Mrosovsky, 1983). Las medidas de conservación para las tortugas marinas van desde la investigación, monitoreo de playas de anidación y áreas de alimentación (arrecifes y pastos), hasta la educación ambiental en las comunidades (Chacón, 2004). Además, las medidas de protección de las tortugas marinas se han aumentado, siendo los países más ricos los que brindan mayor protección a las mismas. Los resultados obtenidos en distintos estudios permiten la evaluación y seguimiento de la condición
de las poblaciones de tortugas marinas (Schroeder & Murphy, 2000).
El propósito de este estudio es corroborar la importancia que tiene playa Lagarto como sitio de anidación de tortugas marinas, de esta manera, se puede determinar cómo las alteraciones antropogénicas afectan a la población.
MATERIALES Y MÉTODOS
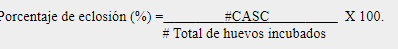
El estudio se llevó a cabo en playa Lagarto, ubicada en el distrito de Pedasí, provincia de Los Santos y pertenece al área protegida Pablo Arturo Barrios, con una extensión de 15,026 ha. Los límites del área protegida colindan al norte con el río Purio y el golfo de Panamá (845205.27 N; 602918.71 W), al este con el RVS Isla Iguana y el golfo de Panamá (845220.72 N; 603546.06 W), al sur con punta Mala y el océano Pacífico (845367.06 N; 609823.77 W) y al oeste con los corregimientos de Purio, Mensabé y Pedasí (843836.08 N; 609842.48 W) (ver Fig. 1). Este sitio es de gran importancia ecológica, económica y social, y posee ambientes terrestres, fluviales, estuarinos y marino costeros (ANAM, 2009).
De cada muestra se pesaron 400 g de arena húmeda en una balanza electrónica Scott Pro, que luego son llevadas a un horno eléctrico graduado a 75-80 oC por 24 h, después la arena es vuelta a pesar para calcular el porcentaje de humedad (González, 2013). De la arena seca de cada submuestra se extrajeron 100 g, estos fueron vertidos en una batería estándar de tamices (USA Standard Testing Sieves de 2.00, 1.00, 0.500, 0.250, 0.125 y 0.063 mm) colocadas de mayor a menor en un rotor eléctrico Roctac por 5 min, según el tamaño y grosor de las partículas nos permite clasificar el tipo de sedimento de la playa (Holme & McIntrye, 1984). Para el análisis del contenido orgánico de cada muestra (zona alta, media y baja) se incineraron 25 g en una mufla eléctrica (500 oC, 1 h), luego son puestas a reposar en un desecador por 15 min y vuelta a pesar en la balanza (Holme & McIntyre, 1984). Todas las muestras fueron llevadas y procesadas en el laboratorio de biología marina de la UMIP (González, 2013).
Las especies de tortugas marinas se identificaron a través de guías, observación directa, biometría y rastros (Rueda-Almonacid et al., 2007).
Se
utilizaron las medidas del Largo Curvo del Caparazón o LCC, medido desde la
muesca del escudo nucal a la mitad de la muesca posterior entre los escudos
supra caudales y el Ancho Curvo del Caparazón o ACC, medido desde la parte
transversal sobre la parte más ancha del caparazón de la tortuga (Bjorndal & Bolten,
1989). Luego a los rastros observados se le
tomaron medidas del ancho de la huella interna (menos profunda) o HI, y el
ancho de la huella externa (más profunda) o HE, de tal manera, que se hizo una
comparación de rastros para registrar el tamaño promedio de la temporada y el
tipo de simetría (Chacón et al.,
2007; Brenes, 2010).
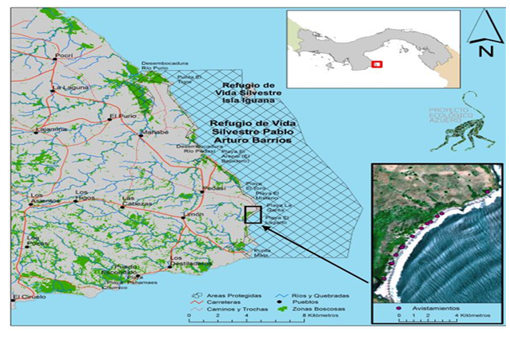 Fig. 1
Mapa del área de estudio de playa Lagarto dentro del Refugio de
Vida Silvestre Pablo A. Barrios
Duran, 2012
Fig. 1
Mapa del área de estudio de playa Lagarto dentro del Refugio de
Vida Silvestre Pablo A. Barrios
Duran, 2012
El estado de los nidos encontrados se clasificó entre categorías en tres categorías, saqueados, reubicados y depredados, de tal manera que se obtuvo el porcentaje por estado de los nidos encontrados en el sitio de anidación (Chacón et al., 2007; Brenes, 2010). El éxito de oviposición se obtuvo luego de reubicar todas las nidadas y de hacer el censo total de nidos que incluía los nidos saqueados y depredados. Finalmente, se
calculó el porcentaje de éxito de oviposición para toda la temporada haciendo uso de la siguiente fórmula: Total de nidos con nidadas / Total de nidos * 100 (Brenes, 2010).
Las exhumaciones son importantes para evaluar el éxito de incubación de las nidadas reubicadas en playa o en vivero, para establecer la salud general de la población anidadora. Este proceso se realiza pasado los tres días de la emergencia de la mayoría de las crías para conocer el grado de conservación de las nidadas, esto se hizo tomando en cuenta las siguientes variables, número de cascarones (> 50 % completo), número de crías vivas, número de huevo sin desarrollo (estadio 0) o HSDA y con desarrollo aparente (estadio I, II, III y IV) o HCDA y número de crías muertas (estadio V). Los estadios de desarrollo embrionario se identifican dividiendo en cuatro partes la cavidad del huevo, para saber en qué estadio se encontraba el embrión cuando murió (Chacón et al., 2007; Royo, 2014).
El éxito de eclosión se refiere al número de crías que eclosionan o rompen el cascarón y al número de cascarones vacíos dentro del nido, expresado en porcentaje (Royo, 2014). En este estudio es importante determinar el porcentaje promedio del éxito de eclosión para toda la temporada de anidación en playa Lagarto. El porcentaje de eclosión se calculó con el fin de obtener datos que nos indiquen las razones por las cuales los huevos o neonatos no logran desarrollarse, para ello se utilizó la siguiente ecuación (CIT, 2011):
Para la
protección y conservación de las tortugas marinas, se elaboró una matriz de
conflicto de las actividades antropogénicas que se realizan en el sitio y pueden
impactar en la anidación de las tortugas marinas. La matriz de conflicto
presenta cuatro niveles de conflicto, alto, intermedio, bajo y compatible.
Finalmente, se analizan dichos conflictos de manera tal que podamos inferir las
causas y posibles soluciones que se puedan recomendar para el sitio de
anidación sin perturbar tanto a las tortugas anidantes (Vidal,
2015).
RESULTADOS Y
DISCUSIÓN
El
estudio indica que la zona alta de la playa presenta el menor porcentaje
promedio de humedad de 9.0 %, siendo al mismo tiempo la zona donde más
actividad de anidación realizó la tortuga verde (Chelonia mydas). La parte media de la playa presenta un promedio de
11.4 % de humedad y fue la zona donde más actividad de anidación realizó la
tortuga lora (Lepidochelys olivacea).
Finalmente, se observó que la zona baja presentó un mayor promedio de humedad
de 16.6 %, De esta manera podemos saber que existen variaciones significativas
de humedad por zonas (ver Fig. 2). Estos datos coinciden con lo planteado en
otros estudios que indican que las tortugas lora y verde presentan mayor número
de anidaciones con una humedad relativa entre 7 y 11 %, distribuidos a lo largo
de toda de la playa (Bolongaro et al.,
2010).
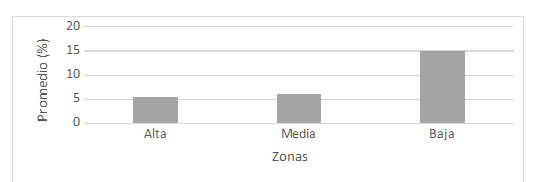 Fig. 2
Humedad encontrada por zonas en playa Lagarto, agosto 2016
a enero 2017
Fig. 2
Humedad encontrada por zonas en playa Lagarto, agosto 2016
a enero 2017
Estudios indican que ante un
nivel excesivo o escaso de humedad disminuye la capacidad de intercambio de
agua entre los huevos y el sustrato, lo que puede generar la pérdida del nido
(Arzola, 2007). La poca humedad del substrato causa resequedad y ésta tiene
efectos negativos en la supervivencia, ya que los huevos se deshidratan,
desecan y colapsan (McGehee, 1979). Otros estudios sugieren que una menor
humedad de la arena en la playa puede ser explicada debido a la constante
erosión que presenta el área debido al desarrollo costero (Witherington, 1999;
Bolongaro et al., 2010).
En este estudio también se
encontró un mayor porcentaje de contenido orgánico en la zona alta de la playa
reportando un promedio de 15.5 %, seguido de la zona baja con promedio de 10.0
% y la zona media con promedio de 6.5 %. Todas las zonas de la playa tuvieron
en conjunto un valor promedio de 10.7 % (ver Fig. 3). Nuestros datos difieren
de lo reportado en un estudio realizado en Mata Oscura donde se encontró mayor
porcentaje de contenido orgánico en la zona baja de la playa con promedio de
1.1 %, en la zona media con un valor promedio de 1.0 % y la zona alta con un
promedio de 0.9 % (González, 2013). Es muy posible que los altos porcentajes de
contenido orgánico en la zona alta de nuestro estudio se deban a la presencia
de un estuario cercano que cada vez que crece inunda las zonas aledañas en este
estudio. Se conoce que para presentar valores más altos de contenido orgánico
es necesario la cercanía de ríos y que éstos se encuentren asociados a una
fuente de componente mareal (Hernández et
al., 1998).
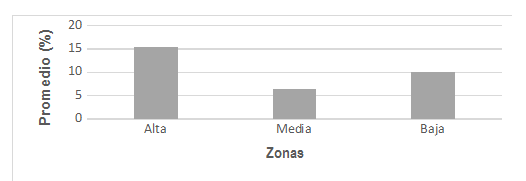 Fig. 3
Contenido orgánico por
zonas en playa Lagarto, agosto 2016 a enero 2017
Fig. 3
Contenido orgánico por
zonas en playa Lagarto, agosto 2016 a enero 2017
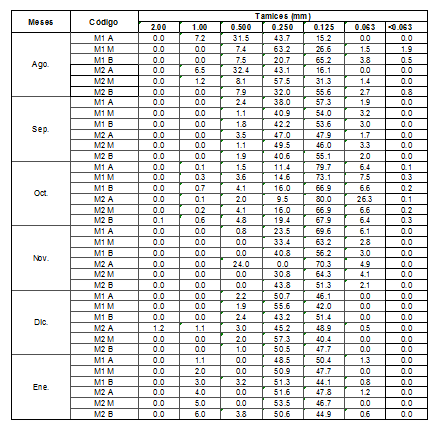
El análisis granulométrico demuestra que existen variaciones significativas por zona entre las muestras colectadas. El tipo de grano de arena de mayor abundancia en playa Lagarto fue de arena fina (0.125 mm) con un promedio de 52.5 %, seguido de arena mediana (0.250 mm) con un promedio de 38.5 % (ver Cuadro 1). Estos resultados sugieren que se registra menor anidación de tortugas marinas en playa Lagarto que se inclinan por anidar en playas con arenas de grano medio, ya que este proporciona la estabilidad necesaria para mantener la humedad y temperatura en los nidos durante el desarrollo (Bolongaro et al., 2010). Si en su totalidad en la zona de los nidos, la arena presenta granos finos
se aumenta la posibilidad de que sufran condiciones anaeróbicas y que afecte la natalidad de estas especies (Honarvar et al., 2008).
Cuadro 1.
Granulometría realizada en
playa Lagarto, agosto 2016 a
enero 2017 M: Muestra 1 y 2, A: Alta, M: Media y B: Baja
Los monitoreos nocturnos realizados a lo largo de seis meses de muestreo en playa Lagarto permitieron identificar dos especies de
tortugas marinas, la verde (Chelonia mydas) y la lora (Lepidochelys olivacea). Estos datos coinciden con estudios realizados en áreas aledañas a las nuestras, el RVS Isla Cañas y playa Cambutal que reportan la presencia de estas dos especies (Córdoba, 1999). Sin embargo, es importante mencionar que mediante los monitoreos no se realizó ningún tipo de marcaje, de manera que no se pudo comprobar si todas las hembras eran distintas o simplemente volvían a reanidar.
Los datos biométricos de la tortuga verde (Chelonia mydas), demuestran un LCC promedio de 95.6 cm (107.0-89.0 cm) y un ACC promedio de 88.4 cm (98.0-82.0 cm). En cuanto a la huella externa (HE) promedio para esta especie fue de 94.0 cm (110.0-81.0 cm) y con una huella interna (HI) promedio de 47.9 cm (70.0-24.0 cm). Nuestros datos coinciden relativamente con estudios realizados en playa Cambutal donde se reporta un promedio de LCC de 94.3 cm y un ACC de 87.8 cm (González, 2014).
Para la tortuga lora (Lepidochelys olivacea), se obtuvo un LCC promedio de 66.2 cm (74.0-50.0 cm) y un ACC promedio de 66.9 cm (74.0-55.0 cm). El HE promedio fue de 75.6 cm (87.0-7.0 cm) y con un HI promedio de 43.4 cm (71.0-26.0 cm). Nuestros datos de LCC y ACC para tortuga lora coinciden con las medidas reportadas por estudios previos realizados en Cambutal, Isla Cañas y Perú (Vera & Rosales, 2012; González, 2013 y 2014).
En cuanto al estado de los nidos encontrados en playa Lagarto, se observó un 68 % de nidos saqueados, un 25 % de nidos reubicados y un 7 % de nidos depredados (ver Fig. 4). Es importante resaltar que el nido 1 fue afectado por las inundaciones provocadas por las fuertes lluvias, mientas que el nido 13 fue saqueado después de haber sido reubicado. Este es un problema general que enfrentan las nidadas en las playas del área, estudios realizados en el RVS Isla Cañas reportan que las arribadas de tortuga lora (Lepidochelys olivacea) han disminuido a causa de la intensa cosecha de huevos de manera ilegal (Comer-Santos et al., 2014).
Durante
la temporada de septiembre 2016 a enero 2017 se
pudieron reubicar cuatro nidos con un total de
398 huevos para la tortuga verde,
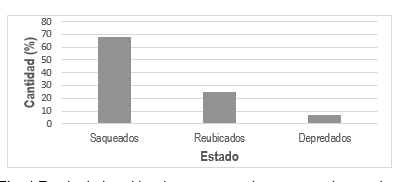 Fig.
4
Estado de los nidos de tortugas marinas encontrados en playa Lagarto, agosto 2016 a febrero 2017
Fig.
4
Estado de los nidos de tortugas marinas encontrados en playa Lagarto, agosto 2016 a febrero 2017
con un promedio de huevos obtenidos para el mes de septiembre de 108.0, para el mes de noviembre 99.0 y para el mes de enero 95.5. El promedio total de huevos para la temporada de tortuga verde fue de 99.5. En cuanto a la tortuga lora se pudieron reubicar 11 nidos con un total de 1 013 huevos con un promedio de huevos obtenidos para el mes de septiembre de 88.0, para el mes de octubre de 92.3 y para el mes de enero 93.5. El promedio total de huevos para la temporada de tortuga lora fue de 92.1. En un estudio similar realizado en Mata Oscura se calculó el tamaño de la nidada, el cual dio un promedio de 82.7 de huevos por nido (Royo, 2014).
En cuanto a la exhumación, se pudieron incubar un total de 1, 411 huevos los cuales fueron sembrados en playa, de esta cantidad de huevos un 3.4 % no eclosionaron. El HSDA presenta un 4.1 %, el 3.0 % lo representa el HCDA y un 1.0 % los neonatos muertos dentro del nido por sofocación. Con respecto al número de cáscaras, resultó un 74.7 %
de huevos eclosionados (ver Cuadro 2). La exhumación de los nidos dio como resultados porcentajes inferiores HSDA y HCDA, a los registrados en los estudios de playa Mata Oscura (Royo, 2014). Estudios en Colombia indican que la cantidad de huevos sin desarrollo aparente se puede producir por diversos factores abióticos, tales como la manipulación al sembrar los huevos, la temperatura de incubación, el tipo de grano de arena, las erosiones e inundaciones por marea u oleaje (Quiñones et al., 2007).
Cuadro 2.
Variables de exhumación
en nidos de tortugas marinas para obtener el éxito de eclosión en playa Lagarto HSDA= Huevos sin desarrollo
aparente, HCDA= Huevos con desarrollo aparente, Estadio V= neonatos muertos
dentro del nido

El porcentaje promedio del éxito de eclosión para toda la temporada en playa Lagarto fue de 79.4 %, en comparación al estudio realizado en playa Mata Oscura se obtuvo un porcentaje de éxito de eclosión de 86.5 %. Es importante mencionar que los análisis de playa Mata Oscura se llevan a cabo en viveros, por lo que es de suponer que el éxito de eclosión en viveros es más exitoso que en nidos reubicados en a la misma playa ya que en las misma sigue influyendo distintas actividades antrópicas que impactan el éxito de eclosión. Según estudios realizados en Colombia el éxito medio de eclosión para nidos trasladados fue de 27.7 %, mientras que para los nidos naturales protegidos in situ fue de 57.1 %. Sin embargo, no se han detectado diferencias significativas al comparar medias de la longitud del caparazón de crías provenientes de nidos in situ y translocados (Quiñones et al., 2007).
Se identificó que en playa Lagarto se llevan a cabo actividades que no son compatibles con el proceso de anidación de las tortugas marinas. Sin
embargo, estas impactan negativamente el proceso de anidación, el desplazamiento de las tortugas adultas y el nacimiento de neonatos. Entre las actividades antropogénicas o asociadas a ellas identificadas en este estudio como de alto conflicto para el proceso de anidación se indican los equinos en soltura, el turismo recreativo, la contaminación sólida, la urbanización costera y la extracción ilegal de huevos (ver Cuadro 3).
Cuadro 3.
Matriz de conflicto de las
actividades antrópicas que se realizan en playa Lagarto, agosto 2016 a febrero
2017
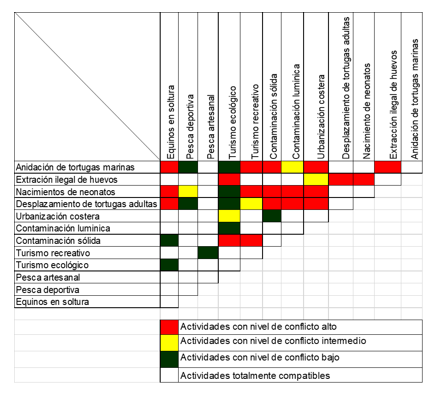
El turismo recreativo es una actividad que está repercutiendo en la anidación y el nacimiento de neonatos, debido a la presencia de
vehículos en la playa que compactan la arena interviniendo en la emergencia de los neonatos en el nido. Esta actividad va directamente ligada a la contaminación sólida debido a los turistas que dejan basura en la playa, estos desechos dificultan el desplazamiento de las tortugas que llegaban a desovar y también obstaculiza la llegada de los neonatos al mar. Por otro lado, está la posible ingestión de material no digerible, ya que las tortugas marinas en ocasiones confunden los desechos como bolsas plásticas, globos, etc. con alimento causándoles problemas digestivos e incluso la muerte (Meylan, 1988).
Las urbanizaciones costeras afectan a las tortugas marinas desde el inicio del proceso de construcción. Esto genera deforestación y fragmentación de hábitat, debido a la actividad de maquinarias pesadas y la extracción de arena. En playa Lagarto se pudo observar un desarrollo urbanístico en la línea de costa siendo una actividad que amenaza el proceso de anidación, el desplazamiento de tortugas adultas y el nacimiento de neonatos, debido a las luces artificiales. Se encontró que las luces artificiales afectan el comportamiento de los neonatos, ya que los desorientan en su camino del nido al mar, dejándolos vulnerables a depredadores o a una muerte segura, exhausta y deshidratados por el sol (Witherington, 1999).
Una de las actividades críticas que se realiza en el sitio de anidación es la extracción ilegal de huevos, esto afecta de manera directa a las poblaciones de tortugas marinas, ya que impide la recuperación de estas especies. En el país existe dificultad para controlar el comercio ilegal de huevos de estas especies, ya que hay insuficiencia de monitoreo e inspección en todas las playas de anidación existentes. Estudios realizados en Panamá indican que un número no estimado de huevos ingresan al mercado ilegal, producto de la extracción ilegal en varias playas de la península de Azuero (MIAMBIENTE, 2017).
CONCLUSIONES
Se encontró que la humedad en playa Lagarto tiende a ser menor en la zona alta de la playa al contrario del contenido orgánico, la playa se encuentra compuesta mayoritariamente por arena fina con un 52.5 % y arena mediana con un 38.5%.
Se registró la presencia de dos especies de tortugas marinas que anidan en playa Lagarto, la tortuga lora (Lepidochelys olivacea) con LCC de 66.2 cm, ACC de 66.9 cm, HE de 75.6 cm y HI de 43.4 cm y la tortuga verde (Chelonia mydas) con LCC de 95.6 cm, ACC de 88.4 cm, HE de 94.0 cm y HI de 47.9 cm.
Las principales actividades antropogénicas detectadas que aparentemente afectan el proceso de anidación en playa Lagarto son la contaminación sólida, la urbanización costera y la extracción ilegal de huevos.
Agradecimientos
A
Tortugas Pedasí por el acceso en playa Lagarto y brindar voluntarios. A Miguel
Regalado y Orlando Regalado por su colaboración durante los monitoreos. A
Beatriz Medina (UMIP) por su colaboración brindada y a Marino Eugenio Ábrego
por la revisión editorial.
Referencias
Ackerman, R. 1997. The nest environment and the embryonic development of sea turtles. Biology of Sea Turtles 1: 83-106.
Arzola, J. 2007. Humedad y temperatura en nidos naturales y artificiales de tortuga golfina Lepidochelys olivacea (Eschssholtz, 1829). Biología Marina y Oceanografía 42(3): 377-383.
ANAM. 2009. Gaceta oficial del refugio de vida silvestre
Pablo Arturo Barrios.
https://www.gacetaoficial.gob.pa/pdfTemp/26280/17624.pdf
Bjorndal, K. & A. Bolten. 1989. Comparison of straight-line and over-the-curve measurements for growth rates of green turtles, Chelonia mydas. Science 45(1): 189-192.
Bolongaro, A., A. Márquez, V. Torres & A. García. 2010.
Vulnerabilidad de sitios de anidación de tortugas marinas por efectos de
erosión costera
en el estado de Campeche. En: Botello, A. et al. (eds)
Vulnerabilidad de las zonas costeras mexicanas ante el cambio climático. Ciudad
de México: Universidad Autónoma de Campeche, pp 73-96.
Brenes, O. 2010. Proyecto de conservación de tortugas marinas, playa Tortuga, Ojochal de Osa, Puntarenas Costa Rica, temporada 2010. http://reservaplayatortuga.org/wp-content/uploads/2014/03/reporte-tortuga-temporada-2010.pdf
Chacón, D. 2004. La tortuga carey del Caribe - Introducción a su biología y estado de conservación. WWF-Programa regional para américa latina y el Caribe, San José, Costa Rica.
Chacón, D., J. Sánchez, J. Calvo & J. Ash. 2007. Manual para el manejo y la conservación de las tortugas marinas en Costa Rica, con énfasis en la operación de proyectos en playa y viveros. Sistema nacional de áreas de conservación, San José, Costa Rica.
CIT. 2004a. Convención interamericana para la protección y conservación de las tortugas marinas-una introducción. Secretaria pro tempore CIT, San José, Costa Rica.
CIT. 2004b. Una introducción a las especies de tortugas marinas del mundo. Asociación ANAI-WIDECAST, San José, Costa Rica.
CIT. 2011. Manual sobre técnicas de manejo para la conservación de las tortugas marinas en playas de anidación. Secretaria pro tempore CIT, San José, Costa Rica.
Comer-Santos, K., B. Birdwell, J. Rodríguez-Murillo, E. Samaniego, S. Peres-Valdés, D. Valdés-Castro, L. Agrazal-Melendez, A. Hines & R. Valverde. 2014. State of the isla Cañas arribada neach in Panama. MiAMBIENTE, Panamá.
Córdoba, L.Z. 1999. Panamá: un estado y comunidad que asumen una responsabilidad compartida. UICN/ANAM, San José, Costa Rica.
Duran, G. 2012. Mapa del refugio de vida silvestre Pablo Arturo Barrios, playa Lagarto. Proyecto ecológico azuero, Panamá.
González, A. 2013. Caracterización física y biológica de la playa de anidación de tortugas marinas de Mata Oscura, Veraguas, Panamá. Tesis de licenciatura. Facultad de Ciencias del Mar. Panamá: Universidad Marítima Internacional de Panamá.
González, L. 2014. Descripción y biometría de las especies de tortugas marinas en playas de anidación de Cambutal, Los Santos Panamá. Tesis de licenciatura. Facultad de Ciencias del Mar. Universidad Marítima Internacional de Panamá, Panamá.
Hernández, C., S. Contreras, J. Gallardo & J. Cancino. 1998. Estructura comunitaria de la macroinfauna a lo largo de una playa arenosa de Chile central: Lenga, bahía San Vicente. Rev. Chilena de Historia Natural 71: 303-311.
Holme, N. & A. Mclntyre. 1984. Methods of the study of marine benthos. II edición. IPB Handbook No. 16. Blackwell scientifics publication, Washington, D.C., EE.UU.
Honarvar, S., M. O’Connor & J. Spotila. 2008. Density dependent effect on hatching success of the olive ridley turtle, Lepidochelys olivacea. Oecologia 157(2): 221-230.
Márquez, R. 1996. Las tortugas marinas y nuestros tiempos. Fondo de cultura económica, Ciudad de México, México.
McGehee, M. 1979. Effects of moisture on eggs and hatchlings of loggerhead sea turtles (Careta caretta). Herpetology 3: 251-258.
Meylan A. 1988. Spongivory in hawksbill turtles: A diet of glass. Science 239: 393-395.
Meylan, A. & P. Meylan. 2000. Introducción a la
evolución, historia de vida y biología de las tortugas marinas. En: Eckert, K.
et al. (eds)
Técnicas de investigación y manejo para la conservación de
las tortugas marinas.Traducción al español. Washington, D.C.: Grupo
especialista en tortugas marinas IUCN/CSE, pp 3-5.
MIAMBIENTE. 2017. Diagnóstico de la situación de tortugas marinas en Panamá y plan de acción nacional para su conservación. Tiwys workShop S.A., Panamá.
Mrosovsky, N. 1983. Ecology and nest side selection of leatherback turtles (Dermochelys coriacea). Rev. Biol. Conserv. 26(1): 47-56.
Mrosovsky, N. & C. Yntema. 1980. Temperature dependence of sexual differentiation in sea turtles: Implications for conservation practices. Rev. Biol. Conserv. 18(1): 271-280.
Poloczanska, E., C. Limpus & G. Hays. 2009. Vulnerability of marine turtles to climate change. Advances in Marine Biology 56: 151-211.
Quiñones, L., J. Patiño & A. Marco. 2007. Factores que influyen en la puesta y el éxito de eclosión de la tortuga laúd, Dermochelys coriacea, en La Playona, Chocó, Colombia. Esp. Herp. 21: 5-17.
Royo, P. 2014. Evaluación del éxito de incubación en vivero de tortuga lora (Lepidochelys olivacea) en playa Mata Oscura, Veraguas, Panamá. Tesis de licenciatura. Facultad de Ciencias del Mar. Universidad Marítima Internacional de Panamá, Panamá.
Rubiano, D. 2011. Caracterización de playas de anidación de tortugas marinas en isla Fuerte, Bolívar, Caribe colombiano. Trabajo de grado. Facultad de Ciencias. Pontificia Universidad Javeriana, Bogotá, D.C., Colombia.
Rueda-Almonacid, J., R. Mittermeier, J. Rodríguez-Mahecha, R. Mast, R. Vogt, A. Rhodin, J. De la Ossa & C. Mittermeier. 2007. Convención internacional serie de guía de bolsillo tortugas marinas de américa. Formas e impresos, S.A., Bogotá, D.C., Colombia.
Schroeder, B. & S. Murphy. 2000. Prospecciones poblacionales (terrestres y aéreas) en playas de anidación. En: Eckert, K. et al. (eds) Técnicas de Conservación y Manejo de las Tortugas Marinas. Traducido al español. Washington, D.C.: Grupo especialista en tortugas marinas IUCN/CSE, pp 51-63.
Vera, M. & C. Rosales. 2012. Size structure of olive ridley turtle Lepidochelys olivacea (Testudines: Cheloniidae) in Tumbes, Peru. Revista Peruana de Biología 19(2): 175-180.
Vidal G. 2015. Usos y conflictos orientados al ordenamiento espacial marino en los manglares del golfo de Chiriquí, Panamá. Tesis de licenciatura. Facultad Ciencias del Mar. Universidad Marítima Internacional de Panamá, Panamá.
Witherington, B. 1999. Reducing threats nesting habitat. En: Eckert, K. et al. (eds) Research and management techniques for the conservation of sea turtles. Washington, D.C.: Marine turtles specialist group IUCN/CSE, pp 179-183.
Salkind, J. 1999. Métodos de
investigación. Prentice Hall, Ciudad de México, México.