INTRODUCCIÓN
En América, el 41 por ciento de los suelos son ácidos según Instituto Geográfico Agustín Codazzi, citado por Acosta y Ramírez (2010). En Panamá, cerca del 40 por ciento de los suelos considerados agrícolas, pertenecen a los suelos acrisoles y alisoles (ultisoles), los cuales presentan problemas de acidez (Villarreal, Agudo y Villalaz, 2010) y según Wilding et al. (citado en Chinchilla, Mata y Alvarado, 2011) son poco fértiles; contienen bajo contenido de cationes básicos, por ende, una baja saturación de bases, generalmente con altos contenidos de aluminio intercambiable y baja disponibilidad de Fósforo.
Por sus características, estos suelos no son aptos o son poco aptos para la agricultura, o donde no todos los cultivos pueden desarrollarse. Sin embargo, según la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO, 2015), en los últimos 50 años gracias a los avances tecnológicos se ha mantenido la producción de alimentos, impulsando así la seguridad alimentaria mundial, permitiendo desarrollar la agricultura en suelos con estas características.
Una de las alternativas para corregir la acides de estos suelos, se realiza mediante enmiendas y fertilizaciones y si bien es cierto, estas prácticas han permitido corregir la fertilidad de los suelos para la agricultura, estos traen un impacto ambiental adverso, como la eutrofización, la contaminación de mantos acuíferos con nitrato (NO3-), lluvia ácida y calentamiento global (Armenta et al., 2010).
En la búsqueda de llevar a cabo una agricultura sostenible y biológica, no solo para asegurar la producción de alimentos de manera sostenible y respetuosa con el ambiente, sino también para mantener otros servicios ambientales necesarios para la vida, surge la tecnología de Microorganismos Eficientes (EM) o microorganismos promotores del crecimiento vegetal, desarrollada por el Doctor Teruo Higa (Gill et al., 2005). Según Cerozi y Fitzsimmons (2016) esta tecnología también representa una alternativa biológica a la la remediación de suelos ácidos, ya que los microorganismos promotores del crecimiento vegetal mejoran la disponibilidad de Fósforo para las plantas al mineralizar el Fósforo orgánico y fosfatos precipitados solubilizantes.
En esta investigación se evaluaron los efectos de la inoculación con Bacillus subtilis sobre el pH, aluminio intercambiable y la disponibilidad de fósforo, en un suelo ultisol, sometido a condiciones de invernadero, durante 120 días.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el invernadero del Departamento de Suelos y Aguas de la Facultad de Ciencias Agropecuarias, Universidad de Panamá-sede de Chiriquí, ubicado a 927974.99 Latitud Norte y 353501.27 Longitud Este. La metodología empleada para llevar a cabo la investigación contempló dos fases; una en laboratorio y una en invernadero, en macetas con capacidad de 1.2 kilogramos, mediante el diseño de bloques completos al azar en arreglo factorial. Se emplearon cinco tratamientos: testigo sin inoculo (tratamiento uno (T1)), inoculación con 1x106, 1x107, 1x108, 1x109 unidades formadoras de colonias (ufc) de la bacteria Bacillus subtilis. De cada tratamiento se realizaron cinco repeticiones con planta de frijol Vigna sinensis (Cp) y cinco repeticiones sin planta (Sp) para cuatro periodos de muestreo, a los 30, 60, 90 y 120 días, lo que representó un total de 200 unidades experimentales.
Se extrajeron 400 kilogramos de suelo del horizonte subsuperficial Bt, de un ultisol en el Centro de Investigación Agropecuaria de Chiriquí (CEIACHI). El suelo fue sometido al proceso de solarizado durante dos meses en el invernadero (técnica empleada para desinfección del suelo). Para este fin, el suelo estuvo dispuesto en bandejas de madera, con profundidad de cinco centímetros, 0.61 metros de ancho, 1.22 metros de largo y cubierto con plástico de polietileno transparente calibre 20 micras.
Al finalizar el proceso de solarización, se adicionaron 1.2 kilogramos de suelo en 200 macetas acorde con el diseño experimental. Se procedió a ordenar las macetas en las mesas del invernadero, de acuerdo con el diseño experimental por bloque (repetición) iniciando con las macetas de los primeros 30 días y dejando en reserva las macetas para reemplazo a los 60, 90 y 120 días.
Una vez colocadas las macetas al azar, se llevó el suelo a humedad cercana a capacidad de campo y se trasplantaron las plántulas en las 100 macetas de los tratamientos con planta. Debajo de cada maceta se colocó un plato de aluminio de 18 centímetros de diámetro, para mantener una lámina de agua permanente y de este modo permitir a las plantas absorber agua por capilaridad, posteriormente se adicionaron cinco mililitros de inoculo de Bacillus subtilis (concentración 1: 1x 106, concentración 2: 1 x 107, concentración 3: 1x 108 y concentración 4: 1 x 109 unidades formadoras de colonias) a las macetas de acuerdo con los tratamientos con y sin planta. La cepa bacteriana se obtuvo del producto comercial M4, (B. subtilis).
Para realizar la inoculación de B. subtilis, se preparó una concentración madre de 50 gramos de B. subtilis en 250 mililitros de agua desionizada, partiendo de la concentración establecida en el producto, la cual indica que un gramo de producto en cinco mililitros de agua equivale a 1x109 unidades formadoras de colonias (Figura 1).
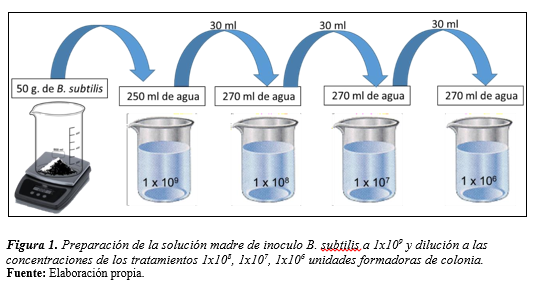 Figura 1.
Preparación de la solución madre de inoculo B. subtilis a 1x109
y dilución a las concentraciones de los tratamientos 1x108, 1x107,
1x106 unidades formadoras de colonia.
Figura 1.
Preparación de la solución madre de inoculo B. subtilis a 1x109
y dilución a las concentraciones de los tratamientos 1x108, 1x107,
1x106 unidades formadoras de colonia.
Fuente:
Elaboración
propia.
Se realizaron muestreos destructivos a los 30, 60, 90 y 120 días, los cuales consistieron en cortar las plantas desde la base para su análisis de materia seca; se tomaron 10 gramos de suelo para la prueba de concentración de bacterias y en retirar las macetas de los bloques, siendo reemplazadas por las macetas nuevas correspondientes a los tratamientos del siguiente periodo de muestreo.
Las muestras de suelo reemplazadas se colocaron en los platos de aluminio para secarlas al aire y posteriormente realizar los análisis; una vez seco el suelo se guardó en bolsas de papel y se trasladó al laboratorio donde se tomó una muestra de suelo de cada tratamiento y se tamizó con un tamiz de maya dos milímetros para analizar las variables químicas (pH, aluminio intercambiable y fósforo disponible).
El pH se determinó por potenciometría, en una suspensión suelo agua en proporción 1:2.5, la determinación del fósforo disponible en el suelo se realizó por el método de Mehlich o Carolina del Norte (extractante ácido sulfúrico al 0.025 N – ácido clorhídrico al 0.05 N y colorimetría sulfomolibdica a 660 nanómetros (nm) (Samudio, 1998). La acidez y aluminio intercambiable en suelos se realizó por titulación de acuerdo con la guía metodológica del Laboratorio de Suelos y Foliares de la Universidad de Costa Rica (UCR, s.f.).
Los resultados de las variables químicas (pH, aluminio intercambiable y fósforo disponible) se analizaron con el paquete estadístico SAS (López, Pérez y Kleinn, 2000). Obteniéndose análisis de varianza y prueba de comparación de Rangos Múltiples de Duncan para medias de tratamientos con un alfa (α) de 0.05.
RESULTADOS Y
DISCUSIÓN
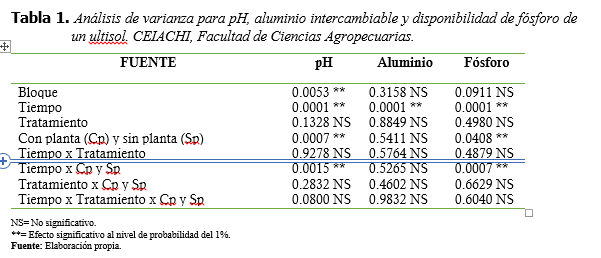
Previo a la inoculación con B. subtilis, el ultisol estudiado presentó un valor de pH de 4.6, considerado muy fuertemente ácido; baja disponibilidad de fósforo, equivalente a 9.2 partes por millón; concentración de aluminio intercambiable de 1.93 cmol(+)/kg de suelo. El análisis de varianza para las variables estudiadas: aluminio intercambiable, fósforo disponible, mostró que no existen diferencias significativas entre bloques (p>0.05) para las variables de respuesta, con excepción del pH, donde se presentó una diferencia altamente significativa (p<0.01), lo que puede deberse a la variabilidad de la ubicación de las mesas en el invernadero (Tabla 1).
Se observó un efecto altamente significativo (p<0.01) del tiempo de muestreo para todas las variables, de igual forma una interacción altamente significativa (p<0.01) del tiempo de muestreo
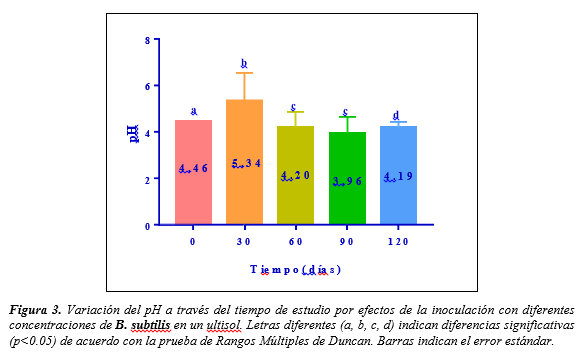
con la presencia y ausencia de plantas (Tiempo x Cp y Sp) para las variables de pH y fósforo, más no, para aluminio. Existen diferencias significativas de los valores de pH a través del tiempo. El valor de pH a los 30 días difiere significativamente con los valores de pH de los 60, 90 y 120 días (Figura 3).
A los 30 días hubo un incremento significativo del pH a 5.34, respecto al pH inicial que fue de 4.46; sin embargo, a partir de los 30 días, el pH disminuyó hasta el final del estudio, sin diferencias significativas. Estos resultados coinciden con lo informado por Acosta y Ramírez (2010), donde el pH incrementó hasta los 90 días y luego disminuyó.
Tabla 1.
Análisis de varianza para pH,
aluminio intercambiable y disponibilidad de fósforo de un ultisol. CEIACHI,
Facultad de Ciencias Agropecuarias.
Esto puede deberse, a que a pesar de que las diferentes concentraciones de bacterias aplicadas como tratamientos al suelo, no incidieron significativamente en el pH, este incremento a los 30 días está probablemente relacionado con la presencia de B. subtilis, ya que según autores como (Acosta y Ramírez, 2010 y Cañas s.f.), estas bacterias tienen la capacidad de favorecer la precipitación de carbonato de calcio provocando un “encalamiento biológico”, producir exudados bacterianos y condiciones alcalinas en el medio (Figura 2).
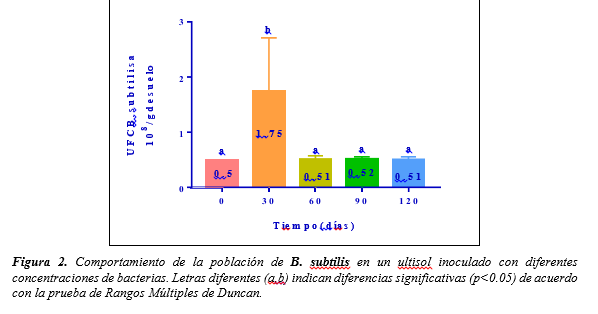 Figura 2
Comportamiento de la población de B.
subtilis en un ultisol inoculado con diferentes concentraciones de bacterias. Letras diferentes (a,b) indican diferencias significativas (p<0.05) de acuerdo
con la prueba de Rangos Múltiples de Duncan.
Figura 2
Comportamiento de la población de B.
subtilis en un ultisol inoculado con diferentes concentraciones de bacterias. Letras diferentes (a,b) indican diferencias significativas (p<0.05) de acuerdo
con la prueba de Rangos Múltiples de Duncan.
Figura 3.
Variación del pH a través del tiempo de estudio por efectos de la
inoculación con diferentes concentraciones de B. subtilis en un ultisol. Letras diferentes (a, b, c, d) indican
diferencias significativas (p<0.05) de acuerdo con la prueba de Rangos
Múltiples de Duncan. Barras indican el error estándar.
Los resultados de la prueba de Rangos Múltiples de Duncan para la variable aluminio, indican una disminución de la concentración de
aluminio intercambiable durante los 120 días del estudio con respecto a la
concentración inicial de 1.93 cmol(+)/kg de suelo (Figura
4). Existen diferencias significativas entre las
concentraciones de aluminio intercambiable de los 30 y 60 días con las
concentraciones de los 90 y 120 días. Siendo las concentraciones de los 30 y 60 días menores, con valores
de 0.0018 y 0.0042 cmol(+)/ kg de suelo
respectivamente; sin embargo, a partir de los 60 días el
nivel de las concentraciones de aluminio comienza a incrementarse hacia los 90
y 120 días con valores de 0.145 y 0.1758 cmol(+)/ kg de suelo respectivamente.
Este comportamiento de la concentración de aluminio intercambiable es similar al ocurrido en el estudio de Acosta y Ramírez (2010), donde la concentración de aluminio intercambiable disminuyó durante todo el experimento con respecto a la concentración inicial.
La disminución del aluminio intercambiable durante los 30 y 60 días puede deberse al incremento
inicial del pH a los 30 días, ya que autores como (Acosta y Ramírez, 2010 ; Munera y Meza, s.f. y Llanos, 2017) indican que las
concentraciones del aluminio disminuyen al incrementar el pH y según Oliva,
(2009) antagónicamente las concentraciones de aluminio se incrementan con pH
inferior a cinco, lo que ocurrió en su estudio, en suelos de la cuenca del
Pacífico en El Salvador, Honduras y Nicaragua, donde con pH superiores a 5.5.el
aluminio intercambiable disminuyó y se incrementó con pH inferiores a 5.5.
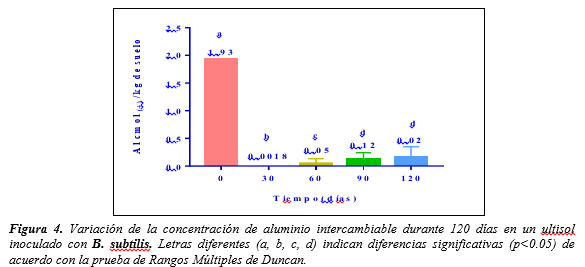 Figura 4.
Variación de la concentración de aluminio intercambiable durante 120
días en un ultisol inoculado con B.
subtilis. Letras diferentes (a, b, c, d) indican diferencias significativas
(p<0.05) de acuerdo con la prueba de Rangos Múltiples de Duncan.
Figura 4.
Variación de la concentración de aluminio intercambiable durante 120
días en un ultisol inoculado con B.
subtilis. Letras diferentes (a, b, c, d) indican diferencias significativas
(p<0.05) de acuerdo con la prueba de Rangos Múltiples de Duncan.
Los resultados de la prueba de Rangos Múltiples de Duncan
para la variable fósforo muestran valores similares de fósforo disponible al valor
inicial en las concentraciones de los 30 y 60 días sin diferencias
significativas, siendo a los 60 días el tiempo donde se presenta la
concentración más alta de fósforo disponible (9.67 partes por millón). Estos
valores difieren significativamente con la concentración de fósforo a los 90
días y esta a su vez con la concentración de los 120 días, donde el valor de
fósforo es significativamente menor con 3.4 partes por millón de fósforo
disponible (Figura 5).
Acosta
y Ramírez (2010), reportaron un incremento de la concentración de fósforo
disponible hasta los 90 días, momento en que disminuyó hasta los 120 días, lo
que se relaciona con el incremento del pH hasta los 90 días en su estudio y la
disminución al final del experimento por absorción del elemento por la planta. Sin embargo, en el presente estudio el pH disminuyó a partir
de los 30 días y aunque la concentración de aluminio disminuyó para este
periodo, tuvo una tendencia al incremento hacia los 60, 90 y 120 días, lo que
se atribuye a lo sugerido por (Munera y Meza, s.f.; Fernández, 2007), en donde señalan que en los suelos ácidos existen concentraciones de hidróxidos de aluminio
que favorecen la retención del fósforo en la superficie.
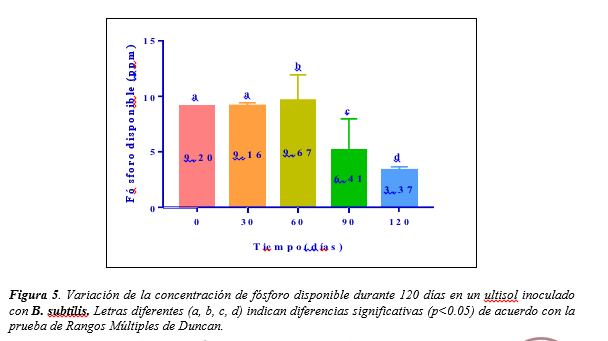 Figura 5.
Variación de la concentración de fósforo disponible durante 120 días
en un ultisol inoculado con B. subtilis.
Letras diferentes (a, b, c, d) indican diferencias significativas
(p<0.05) de acuerdo con la prueba de Rangos Múltiples de Duncan.
Figura 5.
Variación de la concentración de fósforo disponible durante 120 días
en un ultisol inoculado con B. subtilis.
Letras diferentes (a, b, c, d) indican diferencias significativas
(p<0.05) de acuerdo con la prueba de Rangos Múltiples de Duncan.
Cisneros, Sánchez y Mejinvar (2017), obtuvieron mayores resultados, tanto de pH como de fósforo con la aplicación de Kocuria sp. y Bacillus subtilis. Sin embargo, ellos aplicaron pulpa de café al suelo como aporte de materia orgánica, contrario a lo que se realizó en la presente investigación, donde no se aplicó al suelo más que el inoculo de B. subtilis y agua. La aplicación de materia orgánica (pulpa de café) posiblemente sirvió de aporte de energía a las bacterias incrementando su capacidad de solubilización como también pudo tener un efecto sinérgico entre los microorganismos del compost (suelo pulpa de café) con los microorganismos inoculados, provocando una disponibilidad del fósforo proveniente de la mineralización de la pulpa de café.
La baja solubilidad de fósforo durante el estudio también pudo deberse a la baja disponibilidad del elemento en el suelo y a la falta de una fuente que le suministrara del mismo a las bacterias, lo que se puede relacionar con lo implementado por Muhammed et al. (2018), quienes además de aplicar bacterias solubilizadoras de fósforo aplicaron en conjunto fósforo bio-orgánico y fertilizante obteniendo mejores resultados que la aplicación individual de cada uno, lo que revela un efecto sinérgico entre bacterias y biofertilizante; la fuente de fósforo colabora en el crecimiento bacteriano que a su vez mejora la solubilidad y liberación de fósforo del fertilizante.
Interacción pH-fósforo- aluminio
Los resultados indican que existe una relación directamente proporcional entre las medias de las variables pH-fósforo (Figura 6). Se presenta un incremento inicial del pH y del fósforo a los 30 días de 5.34 y 9.16 partes por millón respectivamente con respecto a las concentraciones iniciales, la mayor disponibilidad de fósforo se presenta a los 60 días y luego disminuye hasta los 120 días, lo que afirma que a medida que los niveles de pH se tornan ácidos y la concentración de aluminio comienza a incrementarse, la disponibilidad de fósforo disminuye.
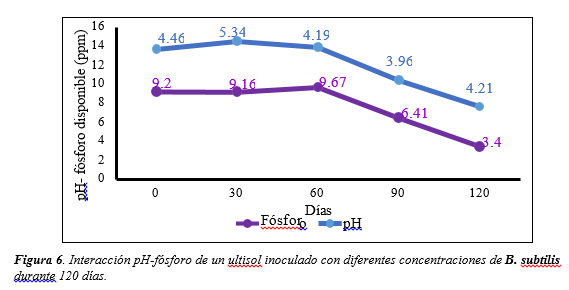 Figura 6
Interacción pH-fósforo de un ultisol inoculado con diferentes
concentraciones de B. subtilis
durante 120 días.
Figura 6
Interacción pH-fósforo de un ultisol inoculado con diferentes
concentraciones de B. subtilis
durante 120 días.
Efecto de la presencia o ausencia de plantas
Los resultados indican, que no hubo un efecto significativo (p>0.05) de la presencia o ausencia de plantas sobre las variables aluminio intercambiable y concentración de bacterias, sin embargo, para las variables pH y concentración de fósforo disponible si hubo diferencias significativas (p<0.05) entre la presencia y ausencia de plantas (Tabla 2). En el caso del pH, las concentraciones son mayores en tratamientos sin planta, lo que coincide con lo reportado por Acosta y Ramírez (2010), relacionándose con la pérdida de cationes del suelo que ocurre por absorción de las plantas, y que para mantener el equilibrio en su interior estas liberan iones de hidrógeno (H+) al medio incrementando la acidez (Espinosa y Molina 1999).
Acosta y Ramírez (2010), obtuvieron mayores concentraciones de fósforo disponible, en los tratamientos en ausencia de plantas, sin embargo en el presente estudio ocurrió lo contrario; las mayores concentraciones de fósforo se presentan en los tratamientos con planta, lo que puede deberse a la producción de ácidos orgánicos y enzimas fosfatasa que no solo son producidos por parte de microorganismos sino también por las raíces de las plantas (Cisneros et al., 2017; Llanos, 2017; Muhammad et al., 2018; Tejera, Rojas y Heydrich, 2011).
Tabla 2.
Efecto de
la presencia o ausencia de plantas en las variables de respuesta en un ultisol
inoculado con b. subtilis.
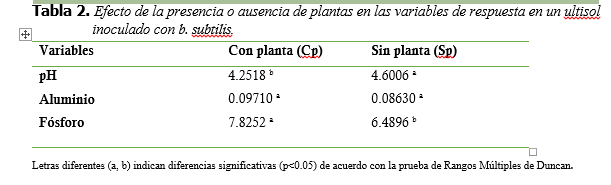 Letras diferentes (a, b) indican diferencias
significativas (p<0.05) de acuerdo con la prueba de Rangos Múltiples de
Duncan.
Letras diferentes (a, b) indican diferencias
significativas (p<0.05) de acuerdo con la prueba de Rangos Múltiples de
Duncan.
CONCLUSIONES
 La presencia de B subtilis al inicio del experimento, provocó cambios relevantes en las concentraciones de pH y aluminio intercambiable a los 30 días, periodo en el cual hubo incremento del pH y disminución del aluminio intercambiable; sin embargo, este efecto no perdura en el tiempo a medida que la concentración bacteriana disminuye. En cuanto al fósforo, los cambios se relacionan con el incremento del pH al inicio del experimento y la tendencia del aluminio a incrementarse hasta el final del estudio.
La presencia de B subtilis al inicio del experimento, provocó cambios relevantes en las concentraciones de pH y aluminio intercambiable a los 30 días, periodo en el cual hubo incremento del pH y disminución del aluminio intercambiable; sin embargo, este efecto no perdura en el tiempo a medida que la concentración bacteriana disminuye. En cuanto al fósforo, los cambios se relacionan con el incremento del pH al inicio del experimento y la tendencia del aluminio a incrementarse hasta el final del estudio.
 Aunque no hubo efectos significativos de las diferentes concentraciones de B. subtilis en la producción de materia seca de V. sinensis; se considera, que la tendencia al incremento de materia seca pudiera deberse a las condiciones favorables que se dieron entre los 30 y 60 días del estudio; aumento de pH y fósforo disponible y disminución de aluminio intercambiable.
Aunque no hubo efectos significativos de las diferentes concentraciones de B. subtilis en la producción de materia seca de V. sinensis; se considera, que la tendencia al incremento de materia seca pudiera deberse a las condiciones favorables que se dieron entre los 30 y 60 días del estudio; aumento de pH y fósforo disponible y disminución de aluminio intercambiable.
Referencias
Acosta Olayal, G.E., y Ramírez Pisco, R. (2010). Evaluación de los cambios en algunas propiedades físicas y químicas de un Ultisol por efecto de Bacillus subtilis. Revista Colombiana de Biotecnología 12(2).
Armenta Bojórquez, A.D., García Gutiérrez, C., Camacho Báez, J.R., Apodaca Sánchez, M.A., Gerardo-Montoya, L., y Nava Pérez, E. (2010). Biofertilizantes en el desarrollo agrícola de México. Ra Ximhai 6(1): 51-56.
Cañas Rodríguez, E. s.f. La bacteria bacillus subtilis genera carbonatos de calcio o cal, sustancias que fortalecen el suelo: Microorganismo redentor del suelo. Colombia: Unimedios. Recuperado de http://www.bioquirama.com/pdf/La-bacteria-Bacillus-subtilis.pdf
Cerozi, B.d.S., y Fitzsimmons, K. (2016). Use of Bacillus spp. to enhace phosphorus availability and serve as a plant growth promoter in aquaponics systems. Scientia Horticulturae. 211(2016). 277-282. Doi: http://dx.doi.org/10.1016/j.scienta.2016.09.005
Chinchilla, M., Mata, R., y Alvarado, A. (2011). Caracterización y clasificación de algunos ultisoles de la región de Los Santos, Talamanca, Costa Rica. Agronomía Costarricense 35(1): 59-81.
Cisneros-Rojas, C.A., Sánchez-de Prager, M.S., y Menjivar-Flores, J.C. (2017). Efecto de bacterias solubilizadoras de fosfatos sobre el desarrollo de plántulas de café. Agronomía Mesoamericana 28(1): 149-158.
Espinosa, J., y Molina, E. (1999). Acidez y encalado de los suelos. Recuperado de http://www.cia.ucr.ac.cr/pdf/libros/Acidez%20y%20encalado%20de%20suelos,%20libro
FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura, Italia). (2015). Los suelos sanos son la base para la producción de alimentos saludables. Recuperado de http://www.fao.org/3/a-i4405s.pdf
Fernández, M.T. (2007). Fósforo: amigo o enemigo. ICIDCA (Sobre los derivados de la caña de azúcar) 41(2): 51-57.
Gill Espinosa, M.M., Rueda Peña, P.A., Salgado López, A., y Varela Borja, A.B. (2005). Guía de Uso de la Tecnología EM. Bogotá, Colombia: FUNDASES.
Llanos Machaca, M.Y. (2017). Bacterias solubilizadoras de fosfato del género Bacillus en suelos de la provincia del Collao (Puno) y su efecto en la germinación y crecimiento de quinua (Chenopodium quinoa willd.) En condiciones de invernadero. (Tesis de grado). Universidad Nacional del Altiplano, Perú.
López, G., Pérez J., y Kleinn, C. (2000). SAS: Aplicaciones en el campo agropecuario y de los recursos naturales. Turrialba, Costa Rica: Centro de Agronómico Tropical de Investigación y Enseñanza.
Muhammad, T., Umaira, K., Muhammad I., Ghulam, M.S., Muhammad, A.N., Muhammad, S., Khalid, M., Naveed, A., y Fazal, K. (2018). Combined application of bio-organic phosphate and phosphorus solubilizing bacteria (Bacillus strain MWT 14) improve the performance of bread wheat with low fertilizer input under an arid climate. 2018. Btazilian Jounal of Microbiology. 49 (2018), 15-24. Doi: https://doi.org/10.1016/j.bjm.2017.11.005
Munera Velez, G.A., y Meza Sepúlveda,
D.C. s.f. El fósforo elemento indispensable para la vida. Recuperado de
http://repositorio.utp.edu.co/dspace/bitstream/handle/11059/5248/el%20fosforo%20elem ento.pdf?sequence=1
Oliva Escobar, D.P. (2009). Determinación de la acidez intercambiable (Al+3+H+) a partir del pH para la estimación de la capacidad de intercambio catiónico (CIC) en suelos de la cuenca del Pacífico en El Salvador, Honduras y Nicaragua. (Tesis de grado). Recuperado de https://bdigital.zamorano.edu/bitstream/11036/386/1/T2804.pdf
Samudio, A. (1998). Guías de laboratorio: Fertilidad de suelos (EDA 435), Fertilidad y análisis (EDA 455). David, Panamá: Universidad de Panamá, Facultad de Ciencias Agropecuarias.
Tejera Hernández, B; Rojas Badía, M.M; Heydrich Pérez, M. (2011). Potencialidades del género Bacillus en la promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. CENIC (Ciencias Biológicas) 42(3): 131-138.
UCR (Universidad de
Costa Rica,). s.f. Determinación de acidez y aluminio intercambiable.
Recuperado de
http://www.cia.ucr.ac.cr/pdf/LSF/20130520/Info%20Acidez%20y%20Al.pdf
Villarreal, J.E., Agudo, L., y Villalaz, J. (2010). Clasificación de suelos de Panamá y sus equivalencias. Instituto de Investigación Agropecuaria de Panamá. Recuperado de










 La presencia de B subtilis al inicio del experimento, provocó cambios relevantes en las concentraciones de pH y aluminio intercambiable a los 30 días, periodo en el cual hubo incremento del pH y disminución del aluminio intercambiable; sin embargo, este efecto no perdura en el tiempo a medida que la concentración bacteriana disminuye. En cuanto al fósforo, los cambios se relacionan con el incremento del pH al inicio del experimento y la tendencia del aluminio a incrementarse hasta el final del estudio.
La presencia de B subtilis al inicio del experimento, provocó cambios relevantes en las concentraciones de pH y aluminio intercambiable a los 30 días, periodo en el cual hubo incremento del pH y disminución del aluminio intercambiable; sin embargo, este efecto no perdura en el tiempo a medida que la concentración bacteriana disminuye. En cuanto al fósforo, los cambios se relacionan con el incremento del pH al inicio del experimento y la tendencia del aluminio a incrementarse hasta el final del estudio.  Aunque no hubo efectos significativos de las diferentes concentraciones de B. subtilis en la producción de materia seca de V. sinensis; se considera, que la tendencia al incremento de materia seca pudiera deberse a las condiciones favorables que se dieron entre los 30 y 60 días del estudio; aumento de pH y fósforo disponible y disminución de aluminio intercambiable.
Aunque no hubo efectos significativos de las diferentes concentraciones de B. subtilis en la producción de materia seca de V. sinensis; se considera, que la tendencia al incremento de materia seca pudiera deberse a las condiciones favorables que se dieron entre los 30 y 60 días del estudio; aumento de pH y fósforo disponible y disminución de aluminio intercambiable. 

