INTRODUCCIÓN
Para
mejorar las condiciones de crecimiento de la microalga Chlorella vulgaris se
han desarrollado diferentes proyectos, tales como la evaluación del crecimiento
desde varios tipos de fotobiorreactores (tipos placa plana y airlift).
Sin embargo, no se ha llevado a cabo un análisis con respecto a la agitación.
Por ello, esta investigación busca proponer e incluir este factor en el cultivo
de Chlorella vulgaris, al ser una alternativa prometedora en procesos de
biorremediación de CO2 que garantiza la mejor distribución de la microalga en
el medio cultivo.
Teniendo en cuenta que las microalgas en fotobiorreactores de
placa plana poseen altas eficiencias fotosintéticas, pero al mismo tiempo
presentan problemas en el control de difusión de CO2 relacionados
principalmente con la transferencia de masa (Soo & Chould-Gyun, 2003), la
evaluación de la variable agitación resulta necesaria. El hecho de que la
agitación se relacione con la transferencia afecta la disponibilidad de CO2 para
la microalga Chlorella vulgaris y, por lo tanto, la producción de
biomasa en este tipo de fotobiorreactores.
Para
la evaluación del parámetro agitación en este tipo de fotobiorreactores se hizo
necesario evaluar el diseño de los difusores (tubo perforado) que involucran
aspectos como cantidad de burbujas y diámetro de burbuja (Ladislav et al., 2010)
desde la
agitación neumática utilizada. Los aspectos antes mencionados fueron objeto de
estudio en la presente investigación, la cual se enfoca en el parámetro
agitación debido a su efecto en la transferencia de masa, variable que afecta la disponibilidad de nutrientes e influye en
un nivel de producción más elevado al proporcionar un suministro adecuado de CO2 a través de la interface cultivo-burbuja y la
eliminación de O2 por generación de turbulencia en el medio (St-Onge,
2013). Aunque el parámetro agitación no ha sido considerado en otras
evaluaciones, este es una variable condicionante en la producción de biomasa
microalgal.
METODOLOGÍA
La
cepa microalgal empleada en esta investigación es Chlorella vulgaris, la
cual fue suministrada por el grupo de investigación biotecfua de la Fundación
Universidad de América y se encontraba en medio líquido en tubos de ensayo,
siendo un back up de la cepa pura previamente adquirida por otros
grupos. Se utilizó como medio de cultivo, agua y el fertilizante agrícola
foliar Foliagro en una proporción de 2:1000. El medio de cultivo fue usado
desde la fase de incubación hasta el escalamiento al fotobiorreactor, el cual
fue esterilizado a una temperatura de 120 °C durante 40 minutos previo a su
uso.
La
microalga se inoculó y se incubó implementando una incubadora que cumplía con
las siguientes condiciones: temperatura óptima de 25 °C, fuente lumínica de
halógeno de 8W de color rojo y un fotoperiodo 12/1.
El
escalamiento a partir del inóculo inició con un volumen de 10 mL de microalga
y 30 mL de medio de cultivo, al cual se le agregó 50 mL de medio de cultivo
hasta alcanzar un volumen de 500 mL. Posteriormente, se agregó 100 mL de medio
de cultivo hasta alcanzar 1 L y por último, 150 mL hasta alcanzar 3 L, tras lo
cual se procedió con su escalamiento al fotobiorreactor de panel plano.
El
desarrollo de esta investigación se enfocó en dos etapas: una fase
preexperimental en la cual se seleccionaron los diámetros de aspersor en los
tubos difusores con respecto a las curvas de crecimiento, seguida de una fase
experimental en la que se evaluó el crecimiento al adicionar una mezcla de co2 y aire como fuente de agitación tras emplear los
diámetros seleccionados.
Fase preexperimental
En
esta fase se llevó a cabo la construcción de dos fotobiorreactores de panel
plano en polimetil-metacrilato (PMMA), los cuales contaban con un ducto desgasificador
y un termostato en su interior. La figura 1 muestra uno de los
fotobiorreactores empleados.
 Figura 1
Fotobiorreactor panel plano
Fuente: elaboración propia.
Figura 1
Fotobiorreactor panel plano
Fuente: elaboración propia.
El
dimensionamiento de los difusores implicó el conocimiento tanto del diámetro
de los aspersores como el espaciamiento entre estos. Lo anterior se calculó
mediante la ecuación 1, en la que se consideró la misma longitud (0,392 m) y
cantidad de aspersores.
Los
tubos difusores fueron elaborados en policloruro de vinilo (pvc) y se
adicionaron a las láminas laterales del fotobiorreactor empleando silicona para
vidrios. Estos tubos se cambiaban de forma manual conforme al diámetro con el
cual se iba a experimentar. La figura 2 (izquierda) muestra las dimensiones del
equipo y las características del tubo difusor (derecha).
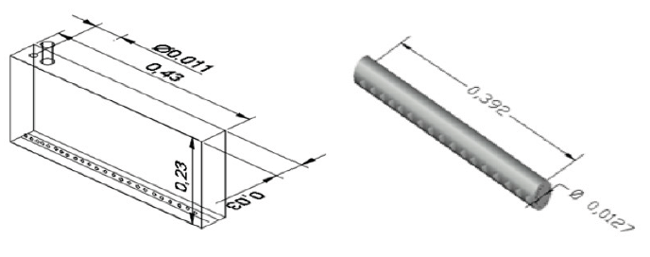 Figura 2
Dimensiones del fotobiorreactor panel plano y los tubos difusores en metros (m)Fuente: elaboración propia.
Fuente: elaboración propia.
Figura 2
Dimensiones del fotobiorreactor panel plano y los tubos difusores en metros (m)Fuente: elaboración propia.
Fuente: elaboración propia.
Por
otra parte, la ecuación que permitió determinar si el equipo resultaba adecuado
para el proceso fotosintético fue la relación superficie-volumen (ecuación 2)
cuyas unidades son m-1
(Rubio-Fernández & Hernández,
2016):
El
valor de la relación superficie-volumen cumplió con el rango entre 20 y 200 m-1 para la adecuación de luz, por lo que el equipo
presentaba buen acceso a la luz, permitiendo que el inóculo realizara el
proceso fotosintético sin dificultades.
El
montaje del sistema de la etapa preexperimental contaba con una bomba de aire
marca Resun AC9904 de 4 salidas que se conectaba a un filtro de trompo mediante
mangueras de 6 mm de espesor; este filtro permitió garantizar la esterilidad
del aire que entraba al equipo. Luego, se conectó un manómetro Ritherm® 2 ½” que permitió conocer la presión del sistema, la
cual se regulaba mediante un sistema de llaves ubicadas a la salida del
manómetro. Las mangueras que salían de estas llaves fueron conectadas a los
extremos laterales del fotobiorreactor.
Se
realizó el conteo celular de microorganismos en un microscopio marca BioBlue
mediante una cámara Neubauer durante 15 días (para un mayor período de estudio)
cada 24 horas para cada diámetro, obteniendo 3 réplicas de cada diámetro. El
número de células por mL se determinó mediante la ecuación 3, donde el volumen
de la cámara es de 0,1 mm3
y los cuadrantes totales son 25 (Hernández, 2014).
Análisis estadístico
Las
curvas de crecimiento de cada difusor fueron evaluadas bajo un análisis de
varianza (anova) de un factor con el fin de conocer si existían diferencias
significativas en las tasas de crecimiento celular como resultado de los
diámetros del aspersor. Las hipótesis planteadas fueron las siguientes:
Hipótesis
nula (Ho): no existe una diferencia significativa en las tasas de crecimiento
por el cambio en el diámetro en los aspersores.
Hipótesis
alterna (Ha): existe una diferencia significativa en las tasas de crecimiento
por el cambio en el diámetro en los aspersores.
La
hipótesis nula fue aceptada utilizando como criterio de comparación el valor
registrado de F con respecto al valor de F crítico a un nivel de
significancia de 0,05. Por lo anterior, y como segundo tratamiento estadístico,
se procedió a desarrollar la comparación entre parejas para simplificar los
niveles (diámetros) y encontrar aquellos que afectaban la variable respuesta
(tasas de crecimiento) mediante la comparación del valor de la probabilidad de
dos colas P (T <= t) y la probabilidad de la tabla anova.
Fase experimental
En
esta fase se emplearon los diámetros de aspersor de 1 y 2 mm en los tubos
difusores que fueron seleccionados en la etapa preexperimental mediante la
prueba t student.
Antes de iniciar la fase experimental se seleccionó una concentración de CO2 de 9 % co2 y 91 % aire.
El
montaje del sistema de la parte experimental (figura 3) involucró el mismo
montaje de la parte preexperimental, adicionando un cilindro de 6 m3 con mezcla (9 % co2 v/v)
y una tarjeta K-33 ICB como sensor para verificar el porcentaje de co2 que entraba al fotobiorreactor de panel plano.
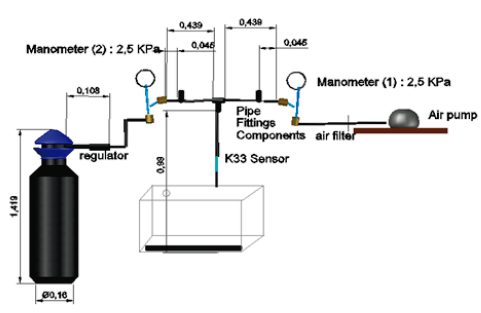 Figura 3
Montaje del sistema experimental y dimensiones de las conexiones (m)
Fuente: elaboración propia.
Figura 3
Montaje del sistema experimental y dimensiones de las conexiones (m)
Fuente: elaboración propia.
Haciendo
uso del sistema antes descrito, se llevó a cabo la agitación por períodos de 6
y 18 horas con mezcla y aire, respectivamente, manteniendo el caudal fijo
mediante un regulador de flujo que manejaba un rango de 0 a 4 L/min.
Teniendo
en cuenta que las microalgas muestran una gran dependencia respecto al pH, el
cual varía conforme a la cantidad de CO2 disuelto,
este fue monitoreado mediante un potenciómetro marca Milwaukee (figura 4), que
registró un valor máximo de 7,5. Para esta fase, el conteo celular se llevó a
cabo en una cámara Neubauer durante 10 días para los diámetros de 1 y 2 mm,
llevando a cabo 3 réplicas de cada uno. El conteo se realizó durante el tiempo
de agitación con el cilindro de CO2. El
número de células por mL se determinó nuevamente con la ecuación 2,
incorporando esta vez el factor de dilución debido a que se realizaron
diluciones seriadas con un factor de 1:10.
 Figura 4
Potenciómetro marca Milwaukee
Fuente: elaboración propia.
Figura 4
Potenciómetro marca Milwaukee
Fuente: elaboración propia.
Haciendo
uso de parámetros poblaciones como la velocidad específica de crecimiento,
también conocida como tasa de crecimiento (μ) (Arredondo et al., 2007), y en vista de que las
microalgas se reproducen mediante división binaria, la ecuación 4 fue utilizada
para el análisis de resultados.
RESULTADOS Y ANÁLISIS
Se
dimensionaron los tres difusores con los respectivos diámetros de aspersor
(1,2 y 4 mm). Para este fin, se calculó la distancia entre un aspersor y otro,
la cual depende primordialmente de la longitud del tubo y de la cantidad de
aspersores totales con los que cuenta el difusor. Por lo anterior, se aplicó
la ecuación 1 para cada tubo difusor. La figura 5 presenta el resultado final
de cada difusor.
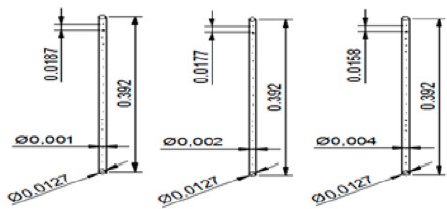 Figura 5
Dimensionamiento del espaciamiento entre los aspersores de los tubos difusores (m)
Fuente: elaboración propia.
Figura 5
Dimensionamiento del espaciamiento entre los aspersores de los tubos difusores (m)
Fuente: elaboración propia.
Fase preexperimental
Presión de entrada de aire al sistema
Luego
de la elaboración de los difusores, con sus respectivos diámetros, se procedió
a calcular la presión de entrada de aire al difusor, la cual influye en la formación
de la burbuja. Esta se calculó haciendo uso de la ecuación de continuidad y la
ecuación de Bernoulli.
Los
valores necesarios tanto para la ecuación de continuidad como para la ecuación
de Bernoulli se reportan en la tabla 1 y 2, respectivamente, con lo cual se
obtuvo que la velocidad 2 y la presión 2 tienen un valor de 0,0665 m/s y
2.511,60 Pa, respectivamente.
Tabla 1.
Valores necesarios para la ecuación de continuidad
 Fuente: elaboración propia.
Fuente: elaboración propia.
Tabla 2
Valores ecuación de Bernoulli
 Fuente: elaboración propia.
Fuente: elaboración propia.
Curvas de crecimiento con aire
Teniendo
en cuenta el promedio de cada una de las réplicas por día obtenidas mediante la
ecuación 2, a las cuales se aplicó el logaritmo natural para cada concentración,
se obtuvieron los resultados señalados en la figura 6.
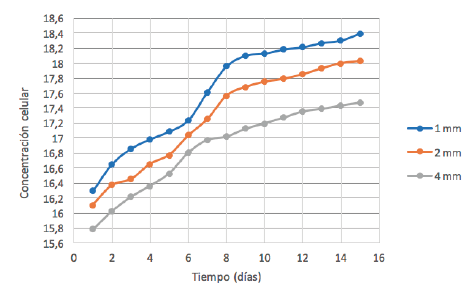 Figura 6
Curvas de crecimiento de Chlorella vulgaris con los diferentes diámetros de aspersor
Fuente: elaboración propia.
Figura 6
Curvas de crecimiento de Chlorella vulgaris con los diferentes diámetros de aspersor
Fuente: elaboración propia.
Como
se aprecia en la figura 6, la curva de 4 mm posee una fase exponencial que se
prolonga desde el día 5 hasta el día 7. En contraste, la fase exponencial de la
curva de 2 mm se ve reflejada entre los días 6 y 9. Por último, la curva de 1
mm presenta una fase exponencial más prolongada que inicia en el día 6 y se
extiende hasta el día 10.
A
partir de la investigación desarrollada por Mohsenpour y Willoughby (2015),
que muestra la tasa de crecimiento para un cultivo con aireación de 99,97 % de
aire y 0,03 % de CO2, se encuentra que los resultados reportados por estos
autores corresponden al doble de la mejor tasa de crecimiento obtenida en la presente
investigación, la cual se registró con el diámetro de 1 mm, como se aprecia en
la tabla 3. Esto se debió a la cantidad de flujo de aire que afecta el
crecimiento, puesto que para obtener una alta tasa de crecimiento a volúmenes
de cultivo similares se debe emplear un flujo de 4,44 vvm, como reporta el
trabajo de los autores antes mencionados, quienes obtuvieron buenos resultados
utilizando dicho flujo y bajo la incidencia de la luz roja. En este sentido, y
por cuestiones económicas, esta investigación empleó un flujo de 0,17 vvm, que
resulta menor al flujo anteriormente mencionado, lo cual, en efecto, provocó
que la fluidización no fuese suficiente para que cada una de las microalgas
recibiera la misma cantidad de luz proveniente de las lámparas de halógeno de
luz roja. Por lo anterior, se produjo una desaceleración en el crecimiento del
cultivo.
Tabla 3
Tasas de crecimiento
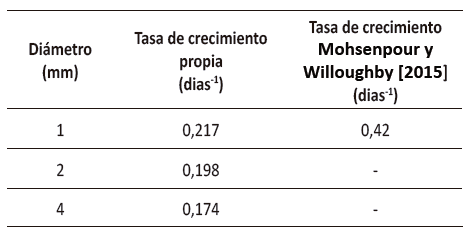 Fuente: elaboración propia.
Fuente: elaboración propia.
Por
otro lado, los valores promedio de las tasas de crecimiento permitieron
apreciar que bajo los diámetros de aspersor de 1 y 2 mm se presentó una mayor
velocidad de crecimiento con respecto al diámetro de 4mm. Lo anterior fue
puesto a prueba posteriormente con el análisis de varianza anova y la prueba
t.
El
análisis estadístico se llevó a cabo con una tabla anova de un factor donde se
compararon las tasas de crecimiento con respecto a los diámetros de aspersor
en el difusor, utilizando un valor de significancia de 0,05. La tabla 4
presenta los resultados de los análisis de varianza indicando que no existe una
diferencia significativa en las tasas de crecimiento al obtener un valor de F
menor al F crítico (3,2199).
Tabla 4
Resultados análisis de varianza anova
 Fuente: elaboración propia.
Fuente: elaboración propia.
En
vista de los resultados obtenidos, se realizó una comparación entre parejas
para simplificar los diámetros y encontrar aquellos que afectaban las tasas de
crecimiento. Mediante el método de Dunnet, se obtuvo que los diámetros de 1 y 2
mm presentaban cambios significativos debido a la comparación de probabilidad
de 2 colas con respecto a la probabilidad de la tabla anova, la cual es mayor,
como se aprecia en la tabla 5. Por ende, se determinó que estos diámetros (1 y
2 mm) eran adecuados para llevar acabo la fase experimental.
Tabla 5
Análisis de varianzas desiguales entre los grupos de 1mm y 2 mm
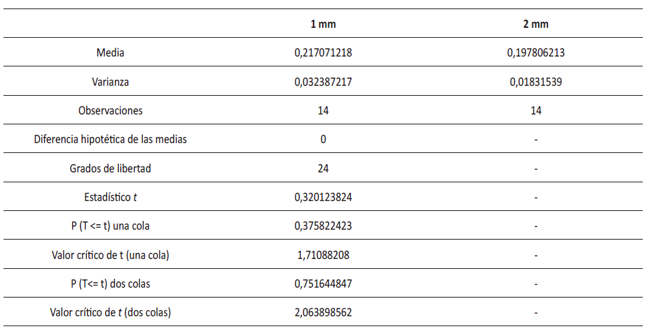 Fuente: elaboración propia.
Fuente: elaboración propia.
Fase experimental
Utilizando
la ecuación de continuidad y la ecuación de Bernoulli se calculó la presión con
la que la mezcla de co2
ingresaría al difusor. Debido a que
la densidad de la mezcla en la parte experimental varía con respecto a la
densidad de la fase preexperimental (aire) fue necesario calcular la densidad
de la mezcla con un valor de 1,25 Kg/m3.
Con
la densidad calculada anteriormente y los valores que se presentan en la tabla
6 se halló la presión a la entrada del difusor. Todas las variables de esta
ecuación se mantuvieron constantes con respecto a la fase preexperimental,
exceptuando la densidad. El resultado obtenido señala que la presión 2 debe
ser de 2.534,19 Pa. Teniendo en cuenta este resultado, se observó que el valor
de P2 de la fase pre-experimental reportó una diferencia
porcentual de 0,00892 con respecto al valor de P2 de la
fase experimental. Por lo anterior, este valor no presento una diferencia
significativa.
Tabla 6
Valores ecuación de Bernoulli
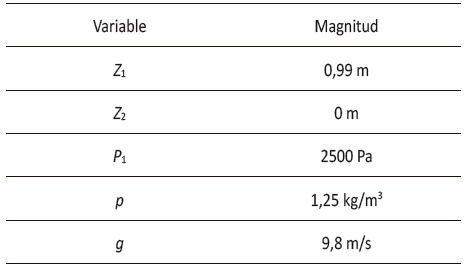 Fuente: elaboración propia.
Fuente: elaboración propia.
Curvas de crecimiento con CO2
Utilizando
los diámetros de aspersor seleccionados en la fase preexperimental (1 y 2 mm)
se procedió a desarrollar la curva de crecimiento de la microalga, la cual se
representó con el promedio de cada una de las réplicas por día. A dichas
replicas, a su vez, se les aplicó el logaritmo natural para cada concentración.
Por
un lado, con el diámetro de 2 mm se obtuvo una tasa de crecimiento de 0,35 dias-1 (10 días de cultivo), la cual resulta superior a la
reportada por Suárez-Chaparro
y Chicagui (2014), quienes utilizaron
el mismo porcentaje de mezcla e igual diámetro y obtuvieron un valor promedio
de tasa de crecimiento de 0,18 días-1 (5
días de cultivo). Lo anterior se debe a que la presente investigación consideró
los caudales a suministrar al difusor en contraste con la investigación realizada
por estos autores, lo que influenció la manera en que se llevó a cabo la
mezcla. Por otra parte, con un diámetro de aspersor de 1 mm se obtuvo una tasa de
crecimiento de 0,37 dias-1, que es superior a la registrada con el diámetro de 2
mm.
El
incremento celular registrado se debe a que las burbujas formadas con el
diámetro de aspersor de 1 mm subían a baja velocidad, haciendo que estas permanecieran
más tiempo en el cultivo. De esta forma, el co2 que
se encontraba en la burbuja tenía más tiempo para disolverse. La figura 7
muestra las curvas de crecimiento con 1 y 2 mm de diámetro de aspersor en el
difusor usando la mezcla de CO2.
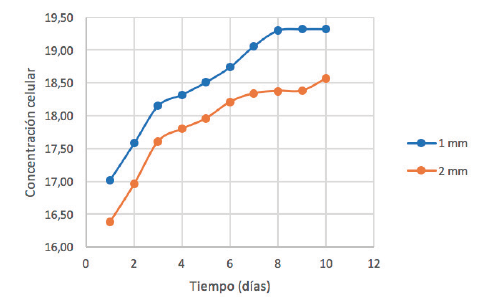 Figura 7
Curvas de crecimiento con CO2 a diferentes diámetros de aspersor
Fuente: elaboración propia.
Figura 7
Curvas de crecimiento con CO2 a diferentes diámetros de aspersor
Fuente: elaboración propia.
Según
el trabajo de los investigadores Doucha et al. (2005), el rango de
presión mínimo de CO2
que debe ingresar al cultivo es de
0,1-0,2 KPa, el cual tiene como objetivo evitar que se limite el crecimiento de
la microalga por escasez de CO2
y minimizar las emisiones de este
compuesto a la atmósfera. Por ello, la presión parcial de CO2 utilizada en esta investigación fue de 0,225 KPa, la
cual se relaciona con el caudal empleado y explicado en la parte
preexperimental.
Los
resultados presentados en la tabla 7 permiten apreciar que a menor diámetro de
aspersor aumenta la tasa de crecimiento. Esto se debe a que las burbujas con
diámetros inferiores se comportan como esferas rígidas con una superficie
inmóvil (Doucha & Lívanskjý, 1998), lo que disminuye la probabilidad de
coalescencia entre burbujas y evita que incremente tanto su tamaño como la
velocidad con la que asciende (Kadic & Heindel, 2014), por lo cual se
mantienen intactas desde su salida en el difusor hasta la superficie del
líquido, contribuyendo a homogeneizar las diferentes zonas dentro del cultivo.
Al respecto, cabe resaltar que una burbuja que asciende con menor velocidad
tendrá un mayor tiempo de residencia en el fotobiorreactor de panel plano (Kadic & Heindel, 2014).
Tabla 7
Tasas de crecimiento con CO2
 Fuente: elaboración propia.
Fuente: elaboración propia.
Por
otro lado, Mohsenpour y Willoughby registran tasas de crecimiento menores en
comparación con las obtenidas en esta investigación, como se aprecia en la
tabla 7. Esta situación se debe al bajo caudal utilizado en nuestro
experimento, el cual evitó que la concentración de CO2 empleada (9 % de CO2)
ocasionara una reducción considerable en el pH, que, como resultado, disminuye
la actividad fotosintética e inhibe el crecimiento.
Estos
valores confirmaron el hecho de que bajo las condiciones del difusor de 1 mm en
el aspersor se obtienen burbujas con mayor área interfacial lo cual conduce a
una mayor transferencia de CO2
en las fases gas-líquido (Kadic & Heindel, 2014).
Planteamiento teórico de las ecuaciones de transferencia de masa en el fotobiorreactor panel plano
Dentro
de la revisión bibliográfica realizada se encontró el modelo de la película
que permite explicar la transferencia de masa dentro del fotobiorreactor de
panel plano, el cual explica la trayectoria del sustrato gaseoso desde la
burbuja hasta un organelo en el microorganismo mediante una serie de
resistencias.
Al
emplear el anterior modelo y utilizar como supuestos teóricos que (i) la fase
líquida está a igual temperatura que la fase gaseosa (donde las burbujas
tenían un tamaño uniforme y constante); (ii) la presión de CO2 en cada burbuja alcanzaba la presión de saturación; y
(iii) que el sistema se encontraba perfectamente mezclado, la transferencia de
masa en la interfase gas-líquido como paso limitante a la transferencia de
masa general se expresa como se muestra en la ecuación 5.
La
ecuación 5 presenta dos parámetros experimentales (coeficiente de
transferencia de masa y área interfacial) que son difíciles de medir por sí
solos, por lo que estos se combinan en uno dando lo que se conoce como el
coeficiente volumétrico de transferencia de masa [ ( Dutta, 2008).
Se
debe aclarar que el área interfacial (que hace parte del producto ) se
relaciona con el atrapamiento del gas () y el diámetro de la burbuja (), como
se aprecia en la ecuación 6. Este parámetro permite explicar los resultados
obtenidos en esta investigación utilizando como variable los diámetros de
aspersor en el difusor (Kadic & Heindel, 2014), puesto que al disminuir el
diámetro de aspersor en el difusor, y por tanto el tamaño de la burbuja,
aumenta el área interfacial que se relaciona directamente con el flujo de CO2 desde la fase gaseosa a la fase líquida.
CONCLUSIONES
Los
fotobiorreactores de panel plano construidos en láminas de PMMA de 0,008 m presentaron
buena resistencia térmica y mecánica. Así mismo, tanto el área de las placas
como el volumen del equipo aseguraron una relación superficie/volumen que
cumple con rangos establecidos por otros investigadores para garantizar el
proceso fotosintético. A su vez, la selección de PVC como material para la
elaboración de los difusores garantizó una fácil manipulación y un bajo costo
al momento de su implementación en el fotobiorreactor de panel plano.
Los
diámetros utilizados en la parte preexperimental corresponden a 1, 2 y 4 mm.
Mediante el análisis anova y la prueba t se comprobó que aunque no
existe una diferencia significativa en las tasas de crecimiento celular entre
estos (0,217 días-1, 0,198 días-1 y
0,174 días-1, respectivamente) a causa del caudal empleado de 0,17
vvm, la pareja conformada por los diámetros 1 y 2 mm sí presenta cambios
significativos. Por consiguiente, se realizó la parte experimental con estos
dos diámetros.
Empleando
una mezcla de 9 % co2
v/v y utilizando los diámetros de
1 y 2 mm durante la fase experimental, se obtuvieron tasas de crecimiento 0,37
días-1 y 0,35 días-1,
respectivamente. Estos resultados demuestran que a menor diámetro de aspersor
se obtiene un aumento en la tasa de crecimiento. Así mismo, permiten comprobar
que a pesar de utilizar un bajo caudal (0,17 vvm) y una alta presión parcial de
co2 (0,225 KPa), con respecto a investigaciones anteriores,
se logra evitar una reducción del pH y, con ello, disminuir la actividad
fotosintética e inhibir el crecimiento.
El modelo de la película junto con los supuestos expresados para el sistema permiten confirmar que el tamaño de la burbuja generado por el aspersor afecta directamente el crecimiento del cultivo. En contraste,se comprueba que una burbuja pequeña con mayor área interfacial, la cual asciende con menor velocidad por el medio de cultivo y por lo tanto tiene un mayor tiempo de residencia en el fotobiorreactor,conduce a una mayor transferencia de masa entre las fases gas-líquido.
Referencias
Arredondo, B. O., Voltolina, D., & Cordero, B.
(2007). Concentración, recuento celular y tasa de crecimiento. En B. O.
Arredondo, D. Voltolina, T. Zenteno, M. Arce, & G. A. Gómez (eds.), Métodos
y herramientas analíticas en la evaluación de la biomasa microalgal (pp.
25-27). conacyt.
Doucha, J., & Lívansjý, K. (1998). Influence of solar irradiance, culture temperature and co2 supply on daily course of O2 evolution by Chlorella mass cultures in outdoor open thin-layer culture units. Algological Studies, 89, 137-149. https://doi. org/10.1127/algol_stud/89/1998/137
Doucha, J., Straka, F., & Lívanský, K. (2005). Utilization of flue gas for cultivation of microalgae (Chlorella sp.) in an outdoor open thin-layer photobioreactor. Journal of Applied Phycology, 17, 403-412. https:// doi.org/10.1007/s10811-005-8701-7
Dutta, R. (2008). Fundamentals of Biochemical Engineering. Springer. https://doi. org/10.1007/978-3-540-77901-8
Hernández, G. A. (2014). Evaluación de las incidencias de salinidad y pH sobre la biomasa, productividad y acumulación de lípidos en cultivos de Chlorella Vulgaris en un fotobiorreactor de placa plana [trabajo de grado, Fundación Universidad de América]. Repositorio Fundación Universidad de América.
Kadic, E., & Heindel, T. J. (2014). An introduction to bioreactor hydrodynamics and gas-liquid mass transfer. John Wiley & Sons. https://doi. org/10.1002/9781118869703
Ladislav, N., Cervený, J., Keren, N., & Kaplan, A.
(2010). Experimental validation of a nonequilibrium model of co2 fluxes
between gas, liquid medium, and algae in a flat-panel photobioreactor. Journal
of Industrial Microbiology and Biotechnology, 37(12), 1319-1326.
https://doi.org/10.1007/s10295-010-0876-5
Mohsenpour,
S. F., & Willoughby, N. (2013). Luminescent photobioreactor design for
improved algal growth and photosynthetic pigment production through spectral
conversion of light. Bioresource Technology, 142, 147-153.
https:// doi.org/10.1016/j.biortech.2013.05.024
Mohsenpour,
S. F., & Willoughby, N. (2015). Effect of co2 aeration
on cultivation of microalgae in luminescent photobioreactors. Biomass and
Bioenergy, 85, 168-177. https://doi.org/10.1016/j.
biombioe.2015.12.002
Rubio-Fernández,
D., & Hernández, G. A. (2016). Evaluación de las incidencias de salinidad y
pH sobre la biomasa, productividad y acumulación de lípidos en cultivos de Chlorella
vulgaris en un fotobiorreactor de placa plana. iteckne, 13(1),
44- 56. https://doi.org/10.15332/iteckne.v13i1.1381
Soo,
S., & Choul-Gyun, L. (2003). Photobioreactor engineering: design and
performance. Biotechnology and Bioprocess Engineering, 8, 313-
321. https://doi.org/10.1007/BF02949274
St-Onge,
P. (2013). Optimisation en temps réel de la production de microalgues en
photobioréacteur par la commande extrémale. Université du Québec.
Suárez-Chaparro, M. Y., & Chicagui-Larrota, J. E. (2014). Evaluación
de la influencia del dióxido de carbono y la concentración inicial de Chlorella
Vulgaris sobre la producción de lípidos a escala laboratorio [trabajo de
grado, Fundación Universidad de América]. Repositorio Fundación Universidad de
América.



 [Ec. 1]
[Ec. 1]
 [Ec. 2]
[Ec. 2] [Ec. 3]
[Ec. 3]

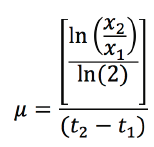 [Ec. 4]
[Ec. 4]









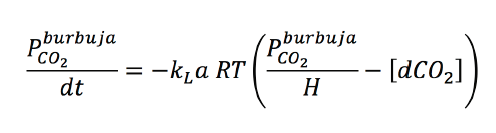 [Ec. 5]
[Ec. 5]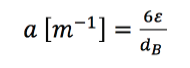 [Ec. 6]
[Ec. 6]

