RESUMEN
La alerta por la pandemia causada por el
coronavirus SARS-CoV-2 ha desatado una carrera contra el tiempo por búsqueda de
un posible tratamiento. Varios fármacos antivirales empleados para controlar el
desarrollo de la enfermedad, son derivados de moléculas obtenidas de plantas,
sin embargo, su aislamiento puede resultar en la disminución o anulación del
efecto. El uso de plantas ancestrales en países en vías de desarrollo, donde el
acceso a un tratamiento farmacológico específico aún es limitado, las terapias
naturales representan la primera línea de defensa frente al virus. En el
presente estudio, se analizaron varias investigaciones respecto a la actividad in
vitro de plantas sudamericanas con potencial actividad antiviral,
clasificadas por países (Argentina, Brasil, Bolivia, Chile, Colombia, Ecuador,
Paraguay, Perú, Uruguay y Venezuela). La familia
Asteraceae presentó el mayor porcentaje de uso para el tratamiento de
enfermedades respiratorias con un 18 %. Se concluye que la biodiversidad
de plantas sudamericanas puede ser aprovechada, por lo que se sugiere realizar
un estudio in vitro sobre el virus SARS-CoV-2.
ABSTRACT
The alert for the
pandemic caused by the SARS-CoV-2 coronavirus has unleashed a race against time
in search of a possible treatment. Several antiviral drugs used to control the
development of the disease are derived from molecules obtained from plants, however,
their isolation can result in the reduction or cancellation of the effect. The
use of ancestral plants in developing countries, where access to a specific
pharmacological treatment is still limited, natural therapies represent the
first line of defense against the virus. In the present study, several
investigations regarding the in vitro activity of South American plants
with potential antiviral activity were analyzed, classified by country
(Argentina, Brazil, Bolivia, Chile, Colombia, Ecuador, Paraguay, Peru, Uruguay
and Venezuela). The Asteraceae family presented the highest percentage of use
for the treatment of respiratory diseases with 18 %. It is concluded that the
biodiversity of South American plants can be exploited, so it is suggested to
carry out an in vitro study on the SARS-CoV-2 virus.
INTRODUCCIÓN
Desde la existencia de la humanidad, los virus han sido responsables de varias enfermedades (Susan van et. al., 2010). La Organización Mundial de la Salud (OMS), estima que el virus de la gripe (influenza) cada año infecta de 25 a 50 millones de personas en todo el mundo (Mousa, 2017).
Los coronavirus (CoVs) pertenece a la familia Coronaviridae, han sido causantes de varias epidemias, tanto en animales como en seres humanos (Möstl, 1990). Se clasifican en las subfamilias: Coronavirinae y Torovirinae. Considerando las características serológicas y moleculares la subfamilia Coronavirinae, se clasifica en coronavirus: alfa, beta, delta y gama, mientras que la subfamilia Torovirinae en: torovirus y bafinivirus (Cho & Hoet, 2014; Kasmi et. al., 2019). Las estructuras del CoVs son esféricas y miden entre 120 y 220 nm de diámetro (Masters, 2006), sus glicoproteínas poseen una forma puntiaguda y recubren la estructura del virus, dando una apariencia de corona (Kasmi et. al., 2019). Estos virus contienen el genoma no segmentado de ARN viral positivo más grande conocido, va desde 23 a 33 kb de longitud, además son capaces de codificar proteínas pertenecientes a membranas que agregan virones: nucleoproteínas, membrana, envoltura y espiga (Cotten et. al., 2014). Los coronavirus humanos (HCoVs), se localizan principalmente en el tracto respiratorio y en su mayoría provocan afecciones graves (de Groot et. al., 2012). Estos virus poseen una similitud genética y filogenética con los coronavirus presentes en animales. Los murciélagos son portadores de varios coronavirus, incluyendo el síndrome respiratorio agudo severo (SARS-CoV) y el síndrome respiratorio del Medio Oriente (MERS-CoV) (Chan et. al., 2013). La evidencia genética y serológica determinó que, a finales del 2002, el virus del SARS-CoV pasó la barrera de especies a los seres humanos, por medio de los pagumas (Paguma larvata), mientras que el MERS-CoV a través de los camellos (Camelus sp.) hace aproximadamente 30 años (De Wit et. al., 2016). El brote del SARS-CoV en 2003 y del MERS-CoV en 2012, fue propagado entre humanos por trasmisión nosocomial (Petrosillo et. al., 2020). La OMS, consideró a estos virus como patógenos emergentes (Kasmi et. al., 2019). Un patógeno emergente es un agente infeccioso, cuyo rango geográfico incrementa después de su primer ataque, mientras que un patógeno reemergente, es aquel que se disemina geográficamente en una población conocida (Engering et. al., 2013).
A finales del año 2019, fue descubierto en Wuhan, provincia de Hubei (China), un nuevo CoV denominado SARS-CoV-2, mismo que se manifiesta como una neumonía atípica (Walls et. al., 2020). La relación con el SAR-CoV no solo radica en el nombre sino en su origen, los murciélagos como se mencionó anteriormente. Sin embargo, la trasmisión zoonótica no fue directa, ya que el SARS-CoV-2 utilizó un animal intermedio que aún es desconocido (Zhang et. al., 2020). La búsqueda del huésped intermedio es de gran importancia para el bloqueo de la trasmisión entre especies. Los pangolines malayos (Manis javanica) han sido objeto de estudio, debido a que en el último año presentaron afecciones pulmonares con un virus que tiene un rango de similitud del 80 a 89% con el virus SARS-CoV-2 (Huang et. al., 2020; Liu et. al., 2019). El virus SARS-CoV-2 tiene un tiempo de incubación de 2 a 14 días. Los síntomas pueden iniciar con una afección respiratoria leve, seguida de una neumonía grave y terminar con un shock séptico (Shen et. al., 2020). Su rango de letalidad va del 2 al 3 % en la población pediátrica (menos propensa), para el caso de la población adulta con enfermedades preexistentes, la letalidad es mucho mayor (Chen et al., 2020). Si bien su letalidad es menor que la del virus SARS-CoV con un 30 % y MERS-CoV con un 36 %, su velocidad de contagio de humano a humano es mucho más rápida (Bonilla-Aldana et al., 2020; De Wit et al., 2016; Calvo et al., 2020). La OMS a finales de enero de 2020, informó a nivel internacional la emergencia de salud pública en China por el brote de SARS-CoV-2 (WHO, 2020). El virus SARS-CoV-2, pasó de ser un problema local a una problemática mundial. No se dispone de un tratamiento específico que sea totalmente efectivo, ni de una vacuna preventiva que limite el contagio (Robson, 2020).
Las plantas son un tratamiento alternativo para las enfermedades que producen ciertos virus. Muchas de ellas poseen características antivirales, antibacterianas, anticancerígenas y antiinflamatorias (Chiru et. al., 2020). Por su capacidad virucida, han sido utilizadas para combatir varios virus de la familia Coronaviridae, como el virus SARS-CoV, la diarrea epidémica porcina (PEDV) y el coronavirus murino (MHV). Además, su eficacia se ha comprobado en otro tipo de virus como los de hepatitis (VHB), sida (VIH), herpes (VHS), entre otros (Kim et al., 2008; Cheng, Ng, Chiang, & Lin, 2006; Hao et al., 2012; Mohammadi Pour, Fakhri, Asgary, Farzaei, & Echeverría, 2019). Varios estudios han reportado que plantas usadas tradicionalmente, pueden ser útiles para aislar compuestos importantes, que se emplean en fármacos antivirales (Lee et. al., 2018). Uno de los fármacos usados para tratar el virus SARS-CoV-2, es Oseltamivir, un profármaco antiviral selectivo contra el virus de la influenza, obtenido a partir del ácido shikímico presente en el anís Illicium anisatum, o del ácido tánico que se encuentra en la corteza del eucalipto Eucalyptus globulus. La capacidad antiviral de las plantas depende de varios compuestos fitoquímicos: flavonoides, lignanos, cumarinas, alcaloides, poliinas, proteínas, péptidos, terpenoides, entre otros (Jassim & Naji, 2003). Su mecanismo de acción radica en limitar la formación de ARN viral, con lo cual se disminuye la replicación del virus (Chen & Du, 2020; Kim et. al., 2008; Yang et. al., 2020).
Las especies de las familias Asteraceae, Lamiaceae y Fabaceae presentan el mayor porcentaje de uso para el tratamiento de enfermedades respiratorias con un 16.50, 8,80 y 5,50 % respectivamente. Además, existen otras familias botánicas promisorias como son: Adoxaceae, Amaranthaceae, Anacardiaceae, Apiaceae, Betulaceae, Brassicaceae, Erythroxylaceae, Juglandaceae, Lauraceae, Myrtaceae, Plantaginaceae, Poaceae, entre otras. (Bussmann & Sharon, 2006).
Varias especies son empleadas en tratamientos de enfermedades respiratorias y como antivirales: Salvia L. (Ali-Shtayeh et. al., 2000), Alternanthera sp. (Biella et. al., 2008), Thymus L. (Jarić et. al., 2007), Apium graveolens L. (Atta & Alkofahi, 1998), Lavandula L. (Hajhashemi et. al., 2003), Juglans L. (Cruz-Vega et. al., 2008), Plantago L. y Eucalyptus sp. (Andrade-Cetto, 2009) (Rakover et. al., 2008), Raphanus L. (Ishtiaq et. al., 2007), Alnus sp. y Sambucus L. (Turner & Hebda, 1990), Perezia sp. (Enríquez et. al., 1980), Erythroxylum sp. (Weil, 1978), Myroxylon sp. (Linares & Bye, 1987), Clibadium L. (Pérez-García et. al., 2001), Cymbopogon sp. y Cinnamomum sp. (Girón et. al., 1991), Prosopis L. (Hebbar et. al., 2004), Schinus molle L. (Braga et. al., 2007), Acmella sp. (Holetz et. al., 2002), etc.
La región de América Latina y el Caribe cuenta con poco más de 2,000 millones de hectáreas de superficie terrestre, 15 % de la superficie terrestre del planeta y posee el mayor número de especies y ecorregiones del mundo.
En este estudio se presenta una revisión bibliográfica de la actividad antiviral in vitro de varias plantas sudamericanas agrupadas por países que pueden ser potencialmente ensayadas sobre el virus SARS-CoV-2.
METODOLOGÍA
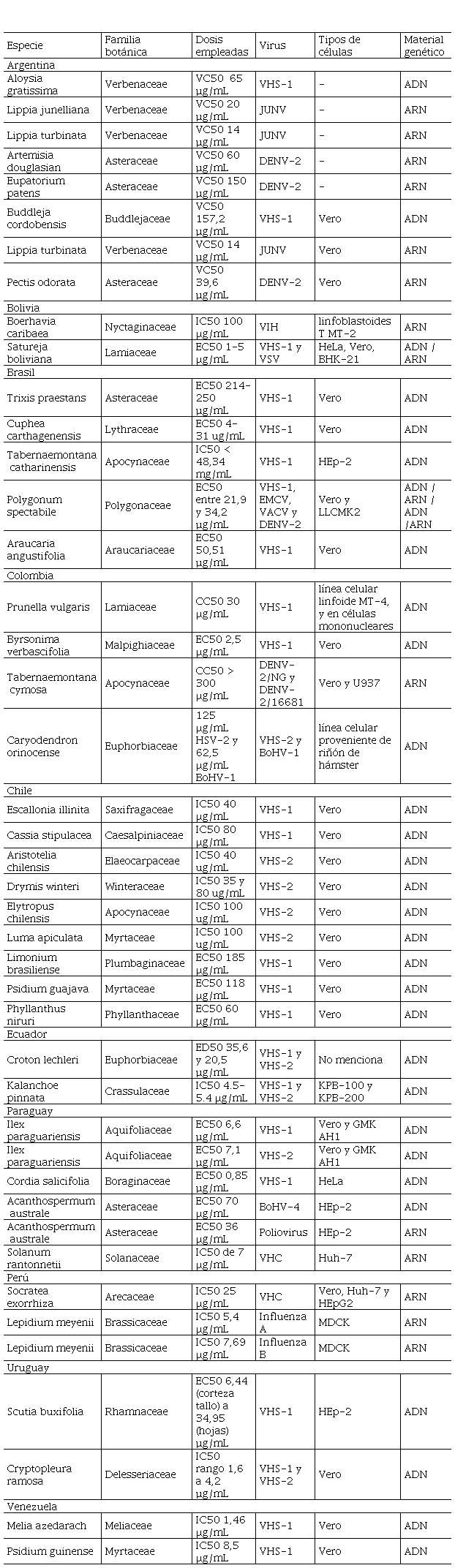
En la Tabla 1, se muestra un resumen de los
estudios revisados respecto a la actividad antiviral in vitro de las
plantas sudamericanas agrupadas por países.
Tabla 1.
Resumen de la actividad antiviral in
vitro de plantas sudamericanas clasificadas por países
|
Argentina
|
|
Aloysia gratissima
|
Verbenaceae
|
VC50 65
µg/mL
|
VHS-1
|
-
|
ADN
|
|
Lippia junelliana
|
Verbenaceae
|
VC50 20 µg/mL
|
JUNV
|
-
|
ARN
|
|
Lippia turbinata
|
Verbenaceae
|
VC50 14 µg/mL
|
JUNV
|
-
|
ARN
|
|
Artemisia douglasian
|
Asteraceae
|
VC50 60 µg/mL
|
DENV-2
|
-
|
ARN
|
|
Eupatorium patens
|
Asteraceae
|
VC50 150 µg/mL
|
DENV-2
|
-
|
ARN
|
|
Buddleja cordobensis
|
Buddlejaceae
|
VC50 157,2 µg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Lippia turbinata
|
Verbenaceae
|
VC50 14 µg/mL
|
JUNV
|
Vero
|
ARN
|
|
Pectis odorata
|
Asteraceae
|
VC50 39,6 µg/mL
|
DENV-2
|
Vero
|
ARN
|
|
Bolivia
|
|
Boerhavia
caribaea
|
Nyctaginaceae
|
IC50
100 μg/mL
|
VIH
|
linfoblastoides
T MT-2
|
ARN
|
|
Satureja boliviana
|
Lamiaceae
|
EC50
1-5 μg/mL
|
VHS-1 y VSV
|
HeLa, Vero, BHK-21
|
ADN / ARN
|
|
Brasil
|
|
Trixis praestans
|
Asteraceae
|
EC50
214-250 µg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Cuphea carthagenensis
|
Lythraceae
|
EC50
4-31 ug/mL
|
VHS-1
|
Vero
|
ADN
|
|
Tabernaemontana catharinensis
|
Apocynaceae
|
IC50
< 48,34 mg/mL
|
VHS-1
|
HEp-2
|
ADN
|
|
Polygonum spectabile
|
Polygonaceae
|
EC50
entre 21,9 y 34,2 µg/mL
|
VHS-1, EMCV, VACV y DENV-2
|
Vero y LLCMK2
|
ADN / ARN / ADN
/ARN
|
|
Araucaria
angustifolia
|
Araucariaceae
|
EC50 50,51 µg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Colombia
|
|
Prunella vulgaris
|
Lamiaceae
|
CC50 30
μg/mL
|
VHS-1
|
línea celular
linfoide MT-4, y en células mononucleares
|
ADN
|
|
Byrsonima
verbascifolia
|
Malpighiaceae
|
EC50
2,5 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Tabernaemontana cymosa
|
Apocynaceae
|
CC50 >
300 μg/mL
|
DENV-2/NG y
DENV-2/16681
|
Vero y U937
|
ARN
|
|
Caryodendron orinocense
|
Euphorbiaceae
|
125 μg/mL HSV-2
y 62,5 μg/mL BoHV-1
|
VHS-2 y BoHV-1
|
línea celular
proveniente de riñón de hámster
|
ADN
|
|
Chile
|
|
Escallonia illinita
|
Saxifragaceae
|
IC50
40 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Cassia stipulacea
|
Caesalpiniaceae
|
IC50
80 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Aristotelia chilensis
|
Elaeocarpaceae
|
IC50
40 ug/mL
|
VHS-2
|
Vero
|
ADN
|
|
Drymis winteri
|
Winteraceae
|
IC50
35 y 80 ug/mL
|
VHS-2
|
Vero
|
ADN
|
|
Elytropus chilensis
|
Apocynaceae
|
IC50
100 ug/mL
|
VHS-2
|
Vero
|
ADN
|
|
Luma apiculata
|
Myrtaceae
|
IC50
100 ug/mL
|
VHS-2
|
Vero
|
ADN
|
|
Limonium brasiliense
|
Plumbaginaceae
|
EC50
185 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Psidium guajava
|
Myrtaceae
|
EC50
118 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Phyllanthus niruri
|
Phyllanthaceae
|
EC50
60 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Ecuador
|
|
Croton lechleri
|
Euphorbiaceae
|
ED50 35,6 y 20,5 µg/mL
|
VHS-1 y VHS-2
|
No menciona
|
ADN
|
|
Kalanchoe pinnata
|
Crassulaceae
|
IC50 4.5-5.4 μg/mL
|
VHS-1 y VHS-2
|
KPB-100 y KPB-200
|
ADN
|
|
Paraguay
|
|
Ilex paraguariensis
|
Aquifoliaceae
|
EC50 6,6 µg/mL
|
VHS-1
|
Vero y GMK AH1
|
ADN
|
|
Ilex paraguariensis
|
Aquifoliaceae
|
EC50 7,1 µg/mL
|
VHS-2
|
Vero y GMK AH1
|
ADN
|
|
Cordia salicifolia
|
Boraginaceae
|
EC50 0,85
µg/mL
|
VHS-1
|
HeLa
|
ADN
|
|
Acanthospermum
australe
|
Asteraceae
|
EC50 70 μg/mL
|
BoHV-4
|
HEp-2
|
ADN
|
|
Acanthospermum
australe
|
Asteraceae
|
EC50 36 μg/mL
|
Poliovirus
|
HEp-2
|
ARN
|
|
Solanum rantonnetii
|
Solanaceae
|
IC50 de 7 μg/mL
|
VHC
|
Huh-7
|
ARN
|
|
Perú
|
|
Socratea exorrhiza
|
Arecaceae
|
IC50 25 μg/mL
|
VHC
|
Vero, Huh-7 y HEpG2
|
ARN
|
|
Lepidium meyenii
|
Brassicaceae
|
IC50 5,4 μg/mL
|
Influenza A
|
MDCK
|
ARN
|
|
Lepidium meyenii
|
Brassicaceae
|
IC50 7,69 μg/mL
|
Influenza B
|
MDCK
|
ARN
|
|
Uruguay
|
|
Scutia buxifolia
|
Rhamnaceae
|
EC50 6,44 (corteza tallo) a 34,95
(hojas) µg/mL
|
VHS-1
|
HEp-2
|
ADN
|
|
Cryptopleura
ramosa
|
Delesseriaceae
|
IC50 rango 1,6 a 4,2 µg/mL
|
VHS-1 y VHS-2
|
Vero
|
ADN
|
|
Venezuela
|
|
Melia azedarach
|
Meliaceae
|
IC50
1,46 μg/mL
|
VHS-1
|
Vero
|
ADN
|
|
Psidium guinense
|
Myrtaceae
|
IC50 8,5
μg/mL
|
VHS-1
|
Vero
|
ADN
|
Plantas de Argentina
Los aceites esenciales obtenidos de las hojas, flores e incluso frutos de ocho plantas aromáticas de la provincia de San Luis, Argentina, se analizaron para determinar su actividad antiviral contra el virus del herpes simple tipo 1 (VHS-1), el virus Junín (JUNV) y el virus del dengue tipo 2 (DEN-2). Para determinar la capacidad antiviral se llevaron a cabo ensayos in vitro con células Vero. El aceite esencial de Aloysia gratissima (Verbenaceae) inactivó a VHS-1 con una concentración virucida máxima promedio (VC50) de 65 µg/mL. La inhibición más potente contra JUNV se observó con el aceite esencial de Lippia junelliana (Verbenaceae) y Lippia turbinata (Verbenaceae) con valores de VC50 entre 20 y 14 µg/mL, respectivamente. Finalmente, Artemisia douglasiana (Asteraceae) y Eupatorium patens (Asteraceae) tuvieron un efecto perceptible sobre DEN-2 con valores de VC50 de 60 y 150 µg/mL, respectivamente (García et al., 2003).
Por otro lado, los aceites esenciales de siete plantas aromáticas de las provincias de Córdoba, San Luis y San Juan, Argentina, se examinaron contra el virus VHS-1, DENV-2 y JUNV en células Vero. Los aceites mostraron un efecto variable según el tipo virus. El aceite esencial de Buddleja cordobensis (Buddlejaceae) destacó por su CC50 y VC50 de 157,2 µg/mL y 54,1 g/mL, respectivamente, contra VHS-1. El valor más elevado de acción antiviral contra JUNV se observó con el aceite esencial de Lippia turbinata (Verbenaceae), con un VC50 de 14 µg/mL y un CC50 de 313,5 µg/mL. Finalmente, el mayor valor de actividad antiviral contra DENV-2 fue de Pectis odorata (Asteraceae) con valores de VC50 y CC50 de 39,6 y 73,9 µg/mL, respectivamente (Duschatzky et. al., 2005).
En otro estudio utilizaron extractos acuosos de las hojas y tallos de Polygonum punctatum (Polygonaceae), Lithraea molleoides (Anacardiaceae), Sebastiania brasiliensis (Euphorbiaceae), Sebastiania klotzschiana (Euphorbiaceae), Myrcianthes cisplatensis (Myrtaceae), para detectar actividad antiviral contra el virus VHS-1, el virus sincitial respiratorio (VSR) y adenovirus serotipo 7 (ADV-7) en células Vero y HEp-2. Polygonum punctatum, Lithraea molleoides, Sebastiania brasiliensis y Sebastiania klotzschiana mostraron actividad antiherpética con una dosis efectiva máxima promedio (ED50) entre 39 y 169 µg/mL, entre ellas la especie con mayor actividad antiviral fue Sebastiania klotzschiana. Por otro lado, Polygonum punctatum, Lithraea molleoides y Myrcianthes cisplatensis mostraron actividad antiviral contra RSV, con un ED50 de 78 a 120 µg/ml, siendo Lithraea molleoides la que presentó la mayor actividad antiviral. Ninguno de los extractos tuvo actividad antiviral contra ADV-7 (Kott et. al., 1998).
Plantas de Bolivia
En un estudio se analizaron los extractos acuosos y etanólicos de 60 especies de plantas medicinales bolivianas sobre VIH y su capacidad para proteger las células linfoblastoides T MT-2. El extracto con mayor actividad antiviral fue Boerhavia caribaea (Nyctaginaceae) con un IC50 de 100 μg/mL. Esta planta es conocida como hierba del arlomo y destaca por sus propiedades hepatoprotectoras, antiparasitarias, diuréticas, hipoglucémicas y analgésicas (Patil & Bhalsing, 2016). En los tallos verdes se encuentra boerhavina y ácidos boerhávicos (Abdel-Malek et. al., 1996).
En otra investigación, los extractos acuosos y etanólicos de siete especies de plantas utilizadas en la medicina tradicional boliviana, fueron probados por su actividad antiviral contra el virus VHS-1, virus de la estomatitis vesicular (VSV) y poliovirus tipo 1 utilizando células de HeLa (carcinoma epitelial cervical humano), Vero (riñón de mono verde africano) y BHK-21 (riñón de hámster bebé) (Abad et al., 1999). El extracto acuoso de Satureja boliviana (Lamiaceae) mostró actividad antiviral contra HSV-1 y VSV. Esta especie es conocida como muña y posee propiedades farmacológicas (antisépticas, antiespasmódicas, analgésicas y antiescabióticas) (Ryding, 1995). Su EC50 fue de 1-5 μg/mL, inhibió la replicación del poliovirus en un 100 %. Sin embargo, los extractos acuosos de la mayoría de las especies investigadas no mostraron actividad antiviral.
Plantas
de Brasil
Se estudiaron los extractos hidrometanólicos preparados a partir de las hojas de 54 plantas medicinales utilizadas en la medicina popular de Brasil, contra el virus VHS-1 en células Vero. De esta lista Trixis praestans (Asteraceae) mostró la mayor actividad antiviral con una CC50 y EC50 de 1500 y 214-250 µg/mL, respectivamente (Simões et. al., 1999). Esta especie es conocida en Brasil como assa-pelxe-manso es usado tradicionalmente para tratar el dolor de ojos y para reducir el flujo menstrual. Varios sesquiterpenos se han aislado de varias especies de Trixis siendo los principales compuestos de esta planta (De Riscala et. al., 1988).
Otro estudio, investigó la actividad antiviral de seis plantas medicinales del bosque tropical atlántico brasileño contra el virus VHS-1 también en células Vero. Los extractos hidroetanólicos de Cuphea carthagenensis (Lythraceae) mostraron la mayor actividad antiviral con una CC50 de 180-375 ug/mL y una EC50 de 4-31 ug/mL. Esta especie conocida localmente como Sete-sangrias es usada por su actividad antihipertensiva, enfermedades cardiovasculares, fiebre, laxante, como diurética y diaforética (Andrighetti-Fröhner et. al., 2005). Estos efectos pueden deberse, al menos en parte, a la gran variedad de compuestos que posee, entre los que destacan la quercetina y sus derivados glicosilados (Barboza et. al., 2016).
La actividad antiviral de los extractos de las hojas y corteza del tallo de Tabernaemontana catharinensis (Apocynaceae), se probaron contra el virus VHS-1 en células HEp-2. La fracción del extracto acuoso de la corteza del tallo y todas las fracciones de las hojas, exhibieron valores de IC50 bajo 48,34 mg/mL (Boligon et. al., 2015). Esta especie se conoce popularmente como jazmín, lechera de dos hermanos (algodoncillo) y cobra en cascada (piel de serpiente), además, esta especie es conocida por los alcaloides indoles y varios triterpenoides pentacíclicos con aproximadamente 240 bases estructuralmente diferentes. En la medicina popular, se usa como antídoto para las mordeduras de serpientes, para aliviar el dolor de muelas, para eliminar las verrugas y como antiinflamatorio (Pereira et. al., 2008).
Polygonum spectabile (Polygonaceae) es una planta nativa de zonas pantanosas de América del Sur, principalmente en Brasil, Uruguay y Argentina, caracterizada por ser una especie con un alto contenido de chalconas (cetonas aromáticas) (Dzoyem et. al., 2012). En Brasil, se le llama popularmente erva-de-bicho, se utiliza para el tratamiento de la diarrea, úlceras, gingivitis, reumatismo, y afectos de la piel, entre otros. En un estudio, esta especie fue valorada sobre el virus VHS-1, cardiovirus (EMCV) y vaccinia virus (VACV) y DEN-2. La inhibición de la replicación viral se observó únicamente con el extracto etanólico, que demostró baja citotoxicidad para las células Vero y LLCMK2 con una CC50 > 500 g/mL. Su EC50 se encontró entre 21,9 de 34,2 µg/mL para los tres tipos de virus (Brandão et. al., 2010).
Los extractos etanólicos de 14 plantas recolectadas en Minas Gerais, se sometieron análisis contra el rotavirus. Entre las especies estudiadas, Eugenia dysenterica (Myrtaceae) conocida como cagaiteira o cagaita y usada tradicionalmente en el tratamiento de diarrea, diabetes, ictericia, infecciones de riñón y vejiga, y también para el tratamiento de enfermedades cardiovasculares, esta especie generó interés por su potencial actividad antiviral. Además, posee efectos citoprotectores, que están relacionados con las proantocianidinas (taninos condensados) presentes en las hojas (Fidelis-de-Oliveira et. al., 2020). Se evaluó la capacidad de los extractos para inhibir el efecto citopático (CPE) en las células de la línea celular de riñón de mono rhesus MA-104 tratadas. Los extractos no presentaron citotoxicidad a 50 μg/mL, a diferencia de 5000 μg/mL. Se obtuvo una concentración máxima no tóxica (MCNC) entre 50 a 500 μg/mL (Cecílio et. al., 2012).
Araucaria angustifolia (Araucariaceae), es una planta medicinal brasileña conocida como pinheiro-do-paraná o pinheiro-brasileiro. Es utilizada tradicionalmente para el tratamiento de diversas enfermedades, como piel seca, heridas, herpes zóster y enfermedades de transmisión sexual. Sus componentes mayoritarios son biflavonoides y taninos encontrados en hojas y cortezas (Peralta et. al., 2016). Con el extracto etanólico crudo obtenido de las hojas, se evaluó su citotoxicidad y la actividad viral contra HSV-1 en células Vero. Se obtuvieron los valores de CC50 de 150,57 µg/mL y de EC50 de 50,51 µg/mL correspondientes a las concentraciones más bajas de las demás fracciones (Freitas et. al., 2009).
Plantas
de Colombia
Prunella vulgaris (Lamiaceae) es una planta colombiana conocida como brunela. En la medicina tradicional se utiliza para el tratamiento de enfermedades de las vías respiratorias. Está constituida por ácido betulínico, D-alcanfor, D-fenchona, entre otros compuestos (Böcher, 1967). Los extractos purificados de la planta fueron capaces de bloquear completamente la infección por VIH en la línea celular linfoide MT-4, y en células mononucleares con una citotoxicidad relativamente baja con una CC50 de 30 μg/mL (Yao et. al., 1992).
En un estudio efectuado en cuatro regiones de Colombia, se determinó la actividad antiviral y antimicrobiana en extractos metanólicos de 24 plantas medicinales para tratar infecciones de piel. La actividad antiviral se realizó mediante una inhibición total de los efectos citopáticos virales (CPE) frente una concentración no citotóxica del extracto. Los virus utilizados en los ensayos antivirales fueron el HSV-1 y el virus de poliovirus en monocapas de células Vero. Trece extractos mostraron actividad contra el HSV-1, mientras que ninguno fue efectivo contra el virus de la polio. El extracto con los mejores resultados contra el HSV-1 fue el de Byrsonima verbascifolia (Malpighiaceae) también conocida como nanci, presentó una EC50 de 2,5 μg/mL para inhibir el virus (Lopez et. al., 2001). Las propiedades nutraceúticas y medicinales de esta especie, se deben a la presencia de antioxidantes naturales, entre ellos, las catequinas (Trujillo & Lasso, 2017).
Tabernaemontana cymosa (Apocynaceae) es una planta que se encuentra en la región del caribe colombiano, se la conoce como jasmine crepé. Sus raíces se emplean para tratar la hipertensión, dolor de cabeza y sarnas. Se determinó la actividad antiviral de los extractos etanólicos derivados contra dos cepas de serotipo 2 del virus del dengue DENV-2/NG y DENV-2/16681 en células Vero y U937. Su CC50 fue mayor a 300 μg/mL (Hernández-Castro et. al., 2015). Se evidenció presencia de flavonoides como fitoconstituyentes más abundantes (Gómez-Estrada et. al., 2011).
A partir de los extractos en hexano, en acetato de etilo, en metanol y en agua de la especie Caryodendron orinocense (Euphorbiaceae), conocida como inchi, se evaluó su citotoxicidad y actividad antiviral contra los virus HSV tipo 2 y del herpes bovino tipo 1 (HVB-1) en la línea celular proveniente de riñón de hámster. El análisis fitoquímico reveló la presencia de aminoácidos, flavonoides, leucoantocianinas, compuestos fenólicos, taninos, triterpenoides y/o esteroides y quinonas. Como resultados, presentó la mayor reducción de la carga viral a 62,5 μg/mL HVB-1 y 125 μg/mL HSV-2 (Arboleda et. al., 2006). Esta especie, en la medicina tradicional, se utiliza como reconstituyente para el tratamiento de afecciones epidérmicas y como laxante (García et al., 2008).
Plantas de Chile
En un estudio 36 especies de plantas nativas e introducidas de Chile, se examinaron para detectar actividad antiviral contra HSV-1 y HSV-2 y el VIH en células Vero. Los extractos etanólicos de Escallonia illinita (Saxifragaceae) y Cassia stipulacea (Caesalpiniaceae) exhibieron la mayor actividad antiviral frente a HSV‐1, con valores de IC50 de 40 μg/mL y 80 μg/mL, respectivamente. Muestras pertenecientes a Aristotelia chilensis (Elaeocarpaceae) (IC50 de 40 ug/mL), Drymis winteri (Winteraceae) (valores IC50 de 35 y 80 ug/mL), Elytropus chilensis (Apocynaceae) y Luma apiculata (Myrtaceae) con un valor IC50 de 100 ug/mL mostraron actividad contra HSV‐2. Ninguno de los extractos mostró actividad contra el VIH a concentraciones no tóxicas para las células (Pacheco et. al., 1993).
En otro estudio 24 especies de plantas y cuatro de algas fueron analizados para detectar actividad antiviral contra HSV-1. Seis de los extractos metanólicos inactivaron las partículas virales por interacción directa y 14 presentaron actividad antiviral cuando se incubaron con las células Vero. Los valores de actividad antiviral más interesante fueron obtenidos con Limonium brasiliense (Plumbaginaceae), Psidium guajava (Myrtaceae) y Phyllanthus niruri (Phyllanthaceae), que inhiben la replicación del virus con valores de EC50 de 185, 118 y 60 μg/mL, respectivamente (Faral-Tello et. al., 2012).
De Heliotropium filifolium (Boraginacea), se determinó la actividad antiviral sobre los virus VHS-1 y 2, junín, polio y RSV en células Vero y Hep-2. Los compuestos naturales de esta planta son filifolinol y su éster senecilato de filifolinilo y los semisintéticos son filifolinona y ácido filifolinoico (Modak et. al., 2010). Los resultados obtenidos de DC50 sobre todo los virus fue de 21,5-38 µg/mL, mientras que los valores de IC50 para VHS1, VHS-2, Junin, Polio, y RSV fueron de 16,2-20; 12,7-20; 11,7-22,6; 5-25 y 7,5-20 µg/mL, respectivamente (Torres et. al., 2002).
Plantas
de Ecuador
En un estudio realizado por Chiriboga (2010), se analizó la actividad antiviral en 50 plantas medicinales de Ecuador, seis de las cuales, presentaron una excelente actividad antiviral (mayor al 80 %) sobre HSV-1, a la máxima concentración no citotóxica (MCNC). La planta con mayor actividad fue Chrysophyllum amazonicum T. D. Penn. (Sapotaceae) especie conocida como caimito de monte, tuvo un porcentaje de inhibición del 99 % (Chiriboga, 2010). Esta especie contiene pouterin, proteína citotóxica similar a la lectina con actividad inductora de apoptosis en células tumorales (Morton, 1977).
Otro estudio se determinó la actividad antiviral del virus HSV-1, estomatitis vesicular (VSV) y el poliovirus tipo 1. La inhibición más importante se observó con un extracto acuoso de Baccharis trinervis (Asteraceae), conocida como chilca utilizada como desinflamante, inhibió la replicación de VHS-1 en un 100 % a 50-200 mg/mL, sin mostrar efectos citotóxicos.
Heisteria acuminata (Erythropalaceae) amarun kaspi utilizada como antidiarreica mostró resultados adecuados en el extracto etanólico contra los virus de HSV-1 y VSV, respectivamente. Los extractos acuosos de Tagetes pusilla (Asteraceae) anís de monte, utilizada para tratar los resfríos (100-250 mg/mL), Baccharis teindalensis (Asteraceae) puliz (50-125 mg/mL) y Eupatorium glutinosum (Asteraceae) matico, sus hojas se utilizan para tratar la sarna (50-125 mg/mL). También inhibieron la replicación de VSV, pero ninguno de los extractos probados tuvo efecto sobre la replicación del poliovirus tipo 1 (Abad et al., 1999).
Por otro lado, Arboleda et al. (2007), menciona que en general, los extractos de Caryodendron orinocense (Euphorbiaceae) maní del monte y Phyllanthus niruri (Leiothrichidae) chanca piedra, muestran citotoxicidad a concentraciones mayores de 250 μg/Ml. Además, contiene lupeol, principio activo triterpenoide utilizado en la medicina tradicional como antiinflamatorio.
El extracto de Caryodendron orinocense en acetato de etilo, registró el mayor factor de reducción viral para HSV-2 y HVB-1, el cual fue de 102 a una concentración de 125 μg/mL y de 104 a 62,5 μg/mL, respectivamente.
Croton lechleri (Euphorbiaceae) sangre de drago, utilizado como cicatrizante y desinflamante, contiene un oligómero de proantocianidina aislado del látex (SP-303), que ha mostrado una actividad virucida contra virus de ADN y ARN. También ha mostrado actividad inhibitoria significativa contra el HSV-1 y HSV-2. Las rutas de aplicación fueron vía tópica, con valores correspondientes al ED50 de 35,6 y 20,5 µg/mL para el HSV-1 y HSV-2, respectivamente (Ubillas et. al., 1994).
Extractos, fracciones y compuestos aislados de Kalanchoe pinnata (Crassulaceae) conocido como chukri yuyu, utilizada para tratar inflamaciones, tumores y forúnculos, han mostrado actividad contra varios virus como VHS-1 y VHS-2. El aislamiento de compuestos como KPB-100 y KPB-200 mostró valores de IC50 de 4,5-5,4 μg/mL (Cryer et. al., 2017). El efecto antiinflamatorio se debe a alfa y beta-amirina, un triterpeno pentacíclico.
Plantas de Paraguay
Ilex paraguariensis (Aquifoliaceae), es un árbol perenne nativo de América del Sur y conocido como yerba mate, se encuentra en Brasil, Uruguay, Paraguay y Argentina. Esta especie ha reportado varios beneficios para la salud, incluyendo capacidad antioxidante y efectos estimulantes del SNC, así como su utilidad en el control del peso y la obesidad y, protección del sistema cardiovascular. Sus efectos antioxidantes se deben a la cantidad amplia de compuestos fenólicos que se pueden obtener de sus hojas (Bastos et. al., 2007). Se investigó el efecto antiviral del extracto crudo obtenido de las hojas y sus fracciones purificadas contra VHS 1 y 2 en células Vero y GMK AH1. Su EC50 y CC50 sobre VHS-1 fueron de 6,6 y 1245,7 µg/mL, respectivamente, mientras que para VHS-2 fueron de 7,1 y 1879,7 µg/mL (Lückemeyer et. al., 2012).
Cordia salicifolia (Boraginaceae) crece en los bosques tropicales de Argentina, Brasil y Paraguay, es conocida como bugre, colita, gomita o café do mato y se usa como diurético. Contiene cafeína, alantoína y ácido alantoico (Caparroz-Assef et. al., 2005). Un extracto parcialmente purificado (COL 1-6) mostró un efecto inhibitorio sobre el HSV-1 en células HeLa. Se obtuvo como resultados una CC50 de 222 µg/mL y EC50 de 0.85 µg/mL (Hayashi et. al., 1990).
Acanthospermum australe (Asteraceae), es un arbusto ampliamente distribuido en América del Sur, principalmente en Paraguay y conocido como carrapichinho. En medicina popular, su tallo y hojas se usan como tónico, diaforético, eupéptico, vermífugo, antidiarreico, antipalúdico, antigonorreico, febrífugo y antianémico. Todas estas propiedades se deben a la presencia de compuestos polifenólicos, principalmente flavonoides (Sánchez et. al., 2009). El extracto etanólico de las partes aéreas se evaluaron contra el virus del herpes bovino (VHBo-4) y el poliovirus en células Hep-2. Mostró una EC50 de 70 y 36 μg/mL para cada virus, respectivamente. No presentaron citotoxicidad en ningún caso (Rocha Martins et. al., 2011).
Solanum rantonnetii (Solanaceae) es conocida como solano de flor azul o dulcamara perenne. En la medicina tradicional, se ha demostrado que se usa como un tratamiento eficaz para la dermatitis seborreica, tos y bronquitis (Weese & Bohs, 2007). Esta especie contiene una gran cantidad de flavonoides, dentro de los cuales la quercetina destaca por su abundancia en distintas formas. Los extractos metanólicos de las hojas, flores y tallos de fueron evaluados para determinar la actividad antiviral que presenta contra el virus de la hepatitis C (VHC) en células Huh-7. Los resultados mostraron que tiene una actividad antiviral significativa, con un IC50 de 7 μg/mL y sin toxicidad aparente. Además, se demostró que el extracto inhibe la entrada del virus, sin efecto cuando se agrega después de la infección (Rashed et. al., 2014).
Plantas de Perú
Se llevó a cabo un estudio etnofarmacológico con 15 comunidades quechua. Se analizaron 45 extractos metanólicos obtenidos de diferentes especies de plantas contra el virus de hepatitis C (VHC) en células Huh-7 y HepG2. El ensayo reveló una actividad interesante de 18 extractos con un IC50 de 25 μg/mL, con baja citotoxicidad para 15 de ellos. El análisis también mostró que al menos el 30 % del virus se inhibió a 25 μg/mL con el 60 % de los extractos de plantas, destacando la actividad antiviral de Socratea exorrhiza (Arecaceae) (Roumy et. al., 2020).
Lepidium meyenii (Brassicaceae) de los Andes del Perú, conocido como maca se lo utiliza tradicionalmente como alimento puesto, tiene un excelente valor nutricional debido a su alto contenido en carbohidratos, proteínas, vitaminas y minerales (Gonzales et. al., 2009). Esta especie presenta actividad antiviral contra los virus de la influenza A y B. El extracto metanólico mostró baja citotoxicidad e inhibió significativamente el efecto citopático inducido por virus, mientras que la carga viral se redujo mediante la inhibición en células MDCK infectadas. Los resultados reportados exhibieron un IC50 para el virus de la influenza A fue de 5,4 μg/mL mientras que la replicación del virus de la influenza B se inhibió con una IC50 de 7,69 μg/mL (del Valle Mendoza et. al., 2014).
Uncaria tomentosa (Rubiaceae), es una enredadera leñosa nativa de la selva amazónica y centroamericana que presenta actividades inmunomoduladoras, antiinflamatorias, citotóxicas y antioxidantes. El extracto hidroetanólico disminuyó significativamente la detección del virus DENV a una concentración de 10 μg/mL, mientras que la fracción alcaloide reveló una actividad más eficaz a 1 μg/mL (Reis et. al., 2008).
Plantas
de Uruguay
Se evaluó la actividad antiviral de las fracciones de la corteza, hojas y tallo de Scutia buxifolia (Rhamnaceae). Esta especie nativa de América del Sur, conocida como coronilha se encuentra en Brasil, Argentina y Uruguay, donde se usa popularmente como cardiotónico, antihipertensivo y diurético. Esta planta ha demostrado contener cuatro clases de compuestos biológicamente activos, compuestos fenólicos, flavonoides, alcaloides y triterpenos. (Boligon et. al., 2009). Se determinó su actividad antiviral contra el virus VHS-1 en células HEp-2. Las fracciones de la corteza del tallo y la fracción de las hojas exhibieron valores de CC50 de 91,03 a 171,08 µg/mL y una EC50 de 6,44 a 34,95 µg/mL, respectivamente (Boligon et. al., 2013).
A partir de los extractos acuosos de Cryptopleura ramosa (Delesseriaceae), se aisló un galactano sulfatado (SG) con bajo peso molecular (2800 g/mol aproximadamente). El compuesto fue un inhibidor selectivo de la replicación de HSV-1 y HSV-2 en células Vero, con una IC50 en el rango de 1,6 a 4,2 µg/mL y una CC50 de 476 µg/mL (Carlucci et. al., 1997).
Plantas
de Venezuela
Melia azedarach (Meliaceae) es una planta venezolana conocida popularmente como alelí. Las propiedades medicinales de la corteza de la raíz en infusión son purgante y emética. En su composición destaca el alcaloide margosina. Un compuesto purificado del fruto mostró un efecto antiviral sobre el VHS-1 en células Vero. Se obtuvo como resultado un IC50 de 1,46 μg/mL (Thompson, 2006).
Psidium guinense (Myrtaceae) conocida como guayabita sabanera, exhibe propiedades antivirales, antibacterianas, antifúngicas y antiinflamatorias (Mitra et. al., 2012). Los compuestos mayoritarios son dos flavonoides glicosilados isoméricos, guajavarina y avicularina, que son derivados de la quercetina y exhiben actividad antiviral (do Nascimento et. al., 2018). En un estudio, se evidenció su efecto contra el virus VHS-1 en células Vero. A partir de la purificación de un extracto bruto, se obtuvo un IC50 de 8,5 μg/mL, que se comparó con la quercetina con un IC50 53 μg/mL (Sabini et. al., 2016).
CONCLUSIÓN
Existe una gran
variedad de especies de plantas sudamericanas promisorias con actividad antiviral.
En esta revisión se analizaron varios estudios in vitro de plantas
sudamericanas de diez países, con un total de 32 familias. Las más
representativas fueron Asteraceae con 18 %, Verbenaceae y Myrtaceae con 8 %, Euphorbiaceae
y Apocynaceae
con 6 %. La familia Asteraceae presentó el mayor
porcentaje de uso para el tratamiento de enfermedades respiratorias, que pueden
ser potencialmente ensayados sobre el virus SARS-CoV-2.
LISTA DE REFERENCIAS
Abad, M J, Bermejo, P., Sanchez Palomino, S., Chiriboga, X., & Carrasco, L. (1999). Antiviral activity of some South American medicinal plants. Phytotherapy Research, 13(2), 142–146. https://doi.org/10.1002/(SICI)1099-1573(199903)13:2<142::AID-PTR392>3.0.CO;2-7
Abad, María José, Bermejo, P., Gonzales, E., Iglesias, I., Irurzun, A., & Carrasco, L. (1999). Antiviral activity of Bolivian plant extracts. General Pharmacology, 32(4), 499–503. https://doi.org/10.1016/S0306-3623(98)00214-6
Abdel-Malek, S., Bastien, J. W., Mahler, W. F., Jia, Q., Reinecke, M. G., Robinson, W. E., Shu, Y. H., & Zalles-Asin, J. (1996). Drug leads from the Kallawaya herbalists of Bolivia. 1. Background, rationale, protocol and anti-HIV activity. Journal of Ethnopharmacology, 50(3), 157–166. https://doi.org/10.1016/0378-8741(96)01380-3
Ali-Shtayeh, M. S., Yaniv, Z., & Mahajna, J. (2000). Ethnobotanical survey in the Palestinian area: a classification of the healing potential of medicinal plants. Journal of ethnopharmacology, 73(1–2), 221–232. https://doi.org/10.1016/s0378-8741(00)00316-0
Andrade-Cetto, A. (2009). Ethnobotanical study of the medicinal plants from Tlanchinol, Hidalgo, México. Journal of Ethnopharmacology, 122(1), 163–171. https://doi.org/10.1016/j.jep.2008.12.008
Andrighetti-Fröhner, C. R., Sincero, T. C. M., Da Silva, A. C., Savi, L. A., Gaido, C. M., Bettega, J. M. R., Mancini, M., De Almeida, M. T. R., Barbosa, R. A., Farias, M. R., Barardi, C. R. M., & Simões, C. M. O. (2005). Antiviral evaluation of plants from Brazilian Atlantic Tropical Forest. Fitoterapia, 76(3–4), 374–378. https://doi.org/10.1016/j.fitote.2005.03.010
Arboleda, D., Cañas, A. L., López, A., & Forero, J. E. (2006). Evaluación de la actividad antiviral in vitro de cuatro extractos de las especies Caryodendron orinocense y Phyllanthus niruri de la familia Euphorbiaceae contra los virus herpes bovino tipo 1 y herpes simplex tipo 2 Evaluation of the in vitro antiviral activity of four extracts from the species Caryodendron orinocense AND Phyllanthus niruri from Euphorbiaceae family against herpes simplex virus type 2 and bovine herpes virus type 1.
Arboleda, D., Cañas, A., López, A., & Forero, J. (2007). Evaluación de la actividad antiviral in vitro de cuatro extractos de las especies Caryodendron orinocense y Phyllanthus niruri de la familia Euphorbiaceae contra los virus herpes bovino tipo 1 y herpes simplex tipo 2. Vitae (Medellín), 55–60.
Atta, A. H., & Alkofahi, A. (1998). Anti-nociceptive and anti-inflammatory effects of some Jordanian medicinal plant extracts. Journal of ethnopharmacology, 60(2), 117–124. https://doi.org/10.1016/s0378-8741(97)00137-2
Barboza, L. N., Lívero, F. A. D. R., Prando, T. B. L., Ribeiro, R. D. C. L., Lourenço, E. L. B., Budel, J. M., De Souza, L. M., Acco, A., Dalsenter, P. R., & Gasparotto, A. (2016). Atheroprotective effects of Cuphea carthagenensis (Jacq.) J. F. Macbr. in New Zealand rabbits fed with cholesterol-rich diet. Journal of Ethnopharmacology, 187, 134–145. https://doi.org/10.1016/j.jep.2016.04.027
Bastos, D. H. M., Saldanha, L. A., Catharino, R. R., Sawaya, A. C. H. F., Cunha, I. B. S., Carvalho, P. O., & Eberlin, M. N. (2007). Phenolic antioxidants identified by ESI-MS from yerba maté (Ilex paraguariensis) and green tea (Camelia sinensis) extracts. Molecules, 12(3), 423–432. https://doi.org/10.3390/12030423
Biella, C. de A., Salvador, M. J., Dias, D. A., Dias-Baruffi, M., & Pereira-Crott, L. S. (2008). Evaluation of immunomodulatory and anti-inflammatory effects and phytochemical screening of Alternanthera tenella Colla (Amaranthaceae) aqueous extracts. Memorias do Instituto Oswaldo Cruz, 103(6), 569–577. https://doi.org/10.1590/s0074-02762008000600010
Böcher, T. W. (1967). Continuous variation and taxonomy. taxon, 16(4), 255–258. https://doi.org/10.2307/1216371
Boligon, A. A., Kubiça, T. F., Mario, D. N., de Brum, T. F., Piana, M., Weiblen, R., Lovato, L., Alves, S. H., Santos, R. C. V., dos Santos Alves, C. F., & Athayde, M. L. (2013). Antimicrobial and antiviral activity-guided fractionation from Scutia buxifolia Reissek extracts. Acta Physiologiae Plantarum, 35(7), 2229–2239. https://doi.org/10.1007/s11738-013-1259-0
Boligon, A. A., Pereira, R. P., Feltrin, A. C., Machado, M. M., Janovik, V., Rocha, J. B. T., & Athayde, M. L. (2009). Antioxidant activities of flavonol derivatives from the leaves and stem bark of Scutia buxifolia Reiss. Bioresource Technology, 100(24), 6592–6598. https://doi.org/10.1016/j.biortech.2009.03.091
Boligon, A. A., Piana, M., Kubiça, T. F., Mario, D. N., Dalmolin, T. V., Bonez, P. C., Weiblen, R., Lovato, L., Alves, S. H., Campos, M. M. A., & Athayde, M. L. (2015). HPLC analysis and antimicrobial, antimycobacterial and antiviral activities of Tabernaemontana catharinensis A. DC. Journal of Applied Biomedicine, 13(1), 7–18. https://doi.org/10.1016/j.jab.2014.01.004
Bonilla-Aldana, D. K., Holguin-Rivera, Y., Cortes-Bonilla, I., Cardona-Trujillo, M. C., García-Barco, A., Bedoya-Arias, H. A., Rabaan, A. A., Sah, R., & Rodriguez-Morales, A. J. (2020). Coronavirus infections reported by ProMED, February 2000–January 2020. Travel Medicine and Infectious Disease, 101575. https://doi.org/10.1016/j.tmaid.2020.101575
Braga, F. G., Bouzada, M. L. M., Fabri, R. L., de O. Matos, M., Moreira, F. O., Scio, E., & Coimbra, E. S. (2007). Antileishmanial and antifungal activity of plants used in traditional medicine in Brazil. Journal of Ethnopharmacology, 111(2), 396–402. https://doi.org/10.1016/j.jep.2006.12.006
Brandão, G. C., Kroon, E. G., Duarte, M. G. R., Braga, F. C., de Souza Filho, J. D., & de Oliveira, A. B. (2010). Antimicrobial, antiviral and cytotoxic activity of extracts and constituents from Polygonum spectabile Mart. Phytomedicine, 17(12), 926–929. https://doi.org/10.1016/j.phymed.2010.03.004
Bussmann, R. W., & Sharon, D. (2006). Traditional medicinal plant use in Northern Peru: Tracking two thousand years of healing culture. Journal of Ethnobiology and Ethnomedicine, 2, 47. https://doi.org/10.1186/1746-4269-2-47
Calvo, C., García López-Hortelano, M., de Carlos Vicente, J. C., Vázquez Martínez, J. L., Ramos, J. T., Baquero-Artigao, F., Navarro, M. L., Rodrigo, C., Neth, O., Fumadó, V., Menendez Suso, J. J., Slocker Barrio, M., Bustinza Arriortua, A., Jordán García, I., & Pilar Orive, J. (2020). Recomendaciones sobre el manejo clínico de la infección por el «nuevo coronavirus» SARS-CoV2. Grupo de trabajo de la Asociación Española de Pediatría (AEP). Anales de Pediatría. https://doi.org/10.1016/j.anpedi.2020.02.001
Caparroz-Assef, S. M., Grespan, R., Freire Batista, R. C., Bersani-Amado, F. A., Baroni, S., Araujo Dantas, J., Nakamura Cuman, R. K., & Bersani-Amado, C. A. (2005). Toxicity studies of Cordia salicifolia extract. Acta Scientiarum - Health Sciences, 27(1), 41–44. https://doi.org/10.4025/actascihealthsci.v27i1.1439
Carlucci, M. J., Scolaro, L. A., Errea, M. I., Matulewicz, M. C., & Damonte, E. B. (1997). Antiviral activity of natural sulphated galactans on herpes virus multiplication in cell culture. Planta Medica, 63(5), 429–432. https://doi.org/10.1055/s-2006-957727
Cecílio, A. B., Faria, D. B. De, Oliveira, P. D. C., Caldas, S., Oliveira, D. A. De, Sobral, M. E. G., Duarte, M. G. R., Moreira, C. P. D. S., Silva, C. G., & Almeida, V. L. De. (2012). Screening of Brazilian medicinal plants for antiviral activity against rotavirus. Journal of Ethnopharmacology, 141(3), 975–981. https://doi.org/10.1016/j.jep.2012.03.031
Chan, J. F. W., To, K. K. W., Tse, H., Jin, D. Y., & Yuen, K. Y. (2013). Interspecies transmission and emergence of novel viruses: Lessons from bats and birds. En Trends in Microbiology (Vol. 21, Número 10, pp. 544–555). Elsevier Current Trends. https://doi.org/10.1016/j.tim.2013.05.005
Chen, H., & Du, Q. (2020). Potential natural compounds for preventing 2019-nCoV infection. Preprints.
Chen, N., Zhou, M., Dong, X., Qu, J., Gong, F., Han, Y., Qiu, Y., Wang, J., Liu, Y., Wei, Y., Xia, J., Yu, T., Zhang, X., & Zhang, L. (2020). Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet, 395(10223), 507–513. https://doi.org/10.1016/S0140-6736(20)30211-7
Cheng, P. W., Ng, L. T., Chiang, L. C., & Lin, C. C. (2006). Antiviral effects of saikosaponins on human coronavirus 229E in vitro. Clinical and Experimental Pharmacology and Physiology, 33(7), 612–616. https://doi.org/10.1111/j.1440-1681.2006.04415.x
Chiriboga, X. (2010). Etnomedicina y etnobotánica avances en la investigación.
Chiru, T., Fursenco, C., Ciobanu, N., Dinu, M., Popescu, E., Ancuceanu, R., Volmer, D., & Raal, A. (2020). Use of medicinal plants in complementary treatment of the common cold and influenza – perception of pharmacy customers in Moldova and Romania. Journal of Herbal Medicine, 100346. https://doi.org/10.1016/j.hermed.2020.100346
Cho, K.-O., & Hoet, A. E. (2014). Toroviruses (Coronaviridae). En Reference Module in Biomedical Sciences. Elsevier. https://doi.org/10.1016/b978-0-12-801238-3.02674-x
Cotten, M., Watson, S. J., Zumla, A. I., Makhdoom, H. Q., Palser, A. L., Ong, S. H., Al Rabeeah, A. A., Alhakeem, R. F., Assiri, A., Al-Tawfiq, J. A., Albarrak, A., Barry, M., Shibl, A., Alrabiah, F. A., Hajjar, S., Balkhy, H. H., Flemban, H., Rambaut, A., Kellam, P., & Memish, Z. A. (2014). Spread, circulation, and evolution of the Middle East respiratory syndrome coronavirus. mBio, 5(1). https://doi.org/10.1128/mBio.01062-13
Cruz-Vega, D. E., Verde-Star, M. J., Salinas-González, N., Rosales-Hernández, B., Estrada-García, I., Mendez-Aragón, P., Carranza-Rosales, P., González-Garza, M. T., & Castro-Garza, J. (2008). Antimycobacterial activity of Juglans regia, Juglans mollis, Carya illinoensis and Bocconia frutescens. Phytotherapy Research, 22(4), 557–559. https://doi.org/10.1002/ptr.2343
Cryer, M., Lane, K., Greer, M., Cates, R., Burt, S., Andrus, M., Zou, J., Rogers, P., Hansen, M. D. H., Burgado, J., Satheshkumar, P. S., Day, C. W., Smee, D. F., & Johnson, F. B. (2017). Isolation and identification of compounds from Kalanchoe pinnata having human alphaherpesvirus and vaccinia virus antiviral activity. Pharmaceutical Biology, 55(1), 1586–1591. https://doi.org/10.1080/13880209.2017.1310907
de Groot, R. J., Baker, S. C., Baric, R., Enjuanes, L., Gorbalenya, A. E., Holmes, K. V, Perlman, S., Poon, L., Rottier, P. J. M., Talbot, P. J., Woo, P. C. Y., & Ziebuhr, J. (2012). Part II – The Positive Sense Single Stranded RNA Viruses Family Coronaviridae. En Virus taxonomy: ninth report of the International Committee on Taxonomy of Viruses (Número Figure 1, pp. 806–828). Elsevier. https://doi.org/10.1016/B978-0-12-384684-6.00068-9
De Riscala, E. C., Catalan, C. A. N., Sosa, V. E., Gutiérrez, A. B., & Herz, W. (1988). Trixane derivatives from Trixis praestans. Phytochemistry, 27(7), 2343–2346. https://doi.org/10.1016/0031-9422(88)80157-2
De Wit, E., Van Doremalen, N., Falzarano, D., & Munster, V. J. (2016). SARS and MERS: Recent insights into emerging coronaviruses. En Nature Reviews Microbiology (Vol. 14, Número 8, pp. 523–534). Nature Publishing Group. https://doi.org/10.1038/nrmicro.2016.81
del Valle Mendoza, J., Pumarola, T., Gonzales, L. A., & del Valle, L. J. (2014). Antiviral activity of maca (Lepidium meyenii) against human influenza virus. Asian Pacific Journal of Tropical Medicine, 7(S1), S415–S420. https://doi.org/10.1016/S1995-7645(14)60268-6
do Nascimento, K. F., Moreira, F. M. F., Alencar Santos, J., Kassuya, C. A. L., Croda, J. H. R., Cardoso, C. A. L., Vieira, M. do C., Góis Ruiz, A. L. T., Ann Foglio, M., de Carvalho, J. E., & Formagio, A. S. N. (2018). Antioxidant, anti-inflammatory, antiproliferative and antimycobacterial activities of the essential oil of Psidium guineense Sw. and spathulenol. Journal of Ethnopharmacology, 210, 351–358. https://doi.org/10.1016/j.jep.2017.08.030
Duschatzky, C. B., Possetto, M. L., Talarico, L. B., García, C. C., Michis, F., Almeida, N. V, De Lampasona, M. P., Schuff, C., & Damonte, E. B. (2005). Evaluation of chemical and antiviral properties of essential oils from South American plants. Antiviral Chemistry and Chemotherapy, 16(4), 247–251. https://doi.org/10.1177/095632020501600404
Dzoyem, J. P., Nkuete, A. H. L., Kuete, V., Tala, M. F., Wabo, H. K., Guru, S. K., Rajput, V. S., Sharma, A., Tane, P., Khan, I. A., Saxena, A. K., Laatsch, H., & Tan, N. H. (2012). Cytotoxicity and antimicrobial activity of the methanol extract and compounds from Polygonum limbatum. Planta Medica, 78(8), 787–792. https://doi.org/10.1055/s-0031-1298431
Engering, A., Hogerwerf, L., & Slingenbergh, J. (2013). Pathogen–host–environment interplay and disease emergence. Emerging Microbes & Infections, 2(1), 1–7. https://doi.org/10.1038/emi.2013.5
Enríquez, R., Ortega, J., & Lozoya, X. (1980). Active components in Perezia roots. Journal of Ethnopharmacology, 2(4), 389–393. https://doi.org/10.1016/S0378-8741(80)81018-X
Faral-Tello, P., Mirazo, S., Dutra, C., Pérez, A., Geis-Asteggiante, L., Frabasile, S., Koncke, E., Davyt, D., Cavallaro, L., Heinzen, H., & Arbiza, J. (2012). Cytotoxic, virucidal, and antiviral activity of South American plant and algae extracts. The Scientific World Journal, 5. https://doi.org/10.1100/2012/174837
Fidelis-de-Oliveira, P., Aparecida-Castro, S., Silva, D. B., Morais, I. B. de M., Miranda, V. H. M. de, de Gobbi, J. I., Canabrava, H. A. N., & Bispo-da-Silva, L. B. (2020). Hypotensive effect of Eugenia dysenterica leaf extract is primarily related to its vascular action: The possible underlying mechanisms. Journal of Ethnopharmacology, 251, 112520. https://doi.org/10.1016/j.jep.2019.112520
Freitas, A. M., Almeida, M. T. R., Andrighetti-Fröhner, C. R., Cardozo, F. T. G. S., Barardi, C. R. M., Farias, M. R., & Simões, C. M. O. (2009). Antiviral activity-guided fractionation from Araucaria angustifolia leaves extract. Journal of Ethnopharmacology, 126(3), 512–517. https://doi.org/10.1016/j.jep.2009.09.005
García, C. C., Talarico, L., Almeida, N., Colombres, S., Duschatzky, C., & Damonte, E. B. (2003). Virucidal activity of essential oils from aromatic plants of San Luis, Argentina. Phytotherapy Research, 17(9), 1073–1075. https://doi.org/10.1002/ptr.1305
García, J., Moratinos, H., & Perdomo, D. (2008). Caracterización de semillas y efectos de diferentes sustratos sobre la emergencia y desarrollo de plántulas de inchi (Caryodendron orinocense Karsten). En Rev. Fac. Agron. (Maracay) (Vol. 34).
Girón, L. M., Freire, V., Alonzo, A., & Cáceres, A. (1991). Ethnobotanical survey of the medicinal flora used by the Caribs of Guatemala. Journal of ethnopharmacology, 34(2–3), 173–187. https://doi.org/10.1016/0378-8741(91)90035-c
Gómez-Estrada, H., Díaz-Castillo, F., Franco-Ospina, L., Mercado-Camargo, J., Guzmán-Ledezma, J., Medina, J. D., & Gaitán-Ibarra, R. (2011). Folk medicine in the northern coast of Colombia: an overview. Journal of Ethnobiology and Ethnomedicine, 7(1), 1–11. https://doi.org/10.1186/1746-4269-7-27
Gonzales, G. F., Gonzales, C., & Gonzales-Castañeda, C. (2009). Lepidium meyenii (Maca): A plant from the highlands of peru - From tradition to science. En Forschende Komplementarmedizin (Vol. 16, Número 6, pp. 373–380). https://doi.org/10.1159/000264618
Hajhashemi, V., Ghannadi, A., & Sharif, B. (2003). Anti-inflammatory and analgesic properties of the leaf extracts and essential oil of Lavandula angustifolia Mill. Journal of ethnopharmacology, 89(1), 67–71. https://doi.org/10.1016/s0378-8741(03)00234-4
Hao, B.-J., Wu, Y.-H., Wang, J.-G., Hu, S.-Q., Keil, D. J., Hu, H.-J., Lou, J.-D., & Zhao, Y. (2012). Hepatoprotective and antiviral properties of isochlorogenic acid A from Laggera alata against hepatitis B virus infection. Journal of Ethnopharmacology, 144(1), 190–194. https://doi.org/10.1016/j.jep.2012.09.003
Hayashi, K., Hayashi, T., Morita, N., & Niwayama, S. (1990). Antiviral activity of an extract of Cordia salicifolia on herpes simplex virus type 1. Planta Medica, 56(5), 439–443. https://doi.org/10.1055/s-2006-961006
Hebbar, S. S., Harsha, V. H., Shripathi, V., & Hegde, G. R. (2004). Ethnomedicine of Dharwad district in Karnataka, India - Plants used in oral health care. Journal of Ethnopharmacology, 94(2–3), 261–266. https://doi.org/10.1016/j.jep.2004.04.021
Hernández-Castro, C., Diaz-Castillo, F., & Martínez-Gutierrez, M. (2015). Ethanol extracts of Cassia grandis and Tabernaemontana cymosa inhibit the in vitro replication of dengue virus serotype 2. Asian Pacific Journal of Tropical Disease, 5(2), 98–106. https://doi.org/10.1016/S2222-1808(14)60635-6
Holetz, F. B., Pessini, G. L., Sanches, N. R., Cortez, D. A. G., Nakamura, C. V., & Filho, B. P. D. (2002). Screening of some plants used in the Brazilian folk medicine for the treatment of infectious diseases. Memorias do Instituto Oswaldo Cruz, 97(7), 1027–1031. https://doi.org/10.1590/s0074-02762002000700017
Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., Zhang, L., Fan, G., Xu, J., Gu, X., Cheng, Z., Yu, T., Xia, J., Wei, Y., Wu, W., Xie, X., Yin, W., Li, H., Liu, M., … Cao, B. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet, 395(10223), 497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
Ishtiaq, M., Hanif, W., Khan, M. A., Ashraf, M., & Butt, A. M. (2007). An ethnomedicinal survey and documentation of important medicinal folklore food phytonims of flora of Samahni valley, (Azad Kashmir) Pakistan. Pakistan Journal of Biological Sciences, 10(13), 2241–2256. https://doi.org/10.3923/pjbs.2007.2241.2256
Jarić, S., Popović, Z., Mačukanović-Jocić, M., Djurdjević, L., Mijatović, M., Karadžić, B., Mitrović, M., & Pavlović, P. (2007). An ethnobotanical study on the usage of wild medicinal herbs from Kopaonik Mountain (Central Serbia). Journal of Ethnopharmacology, 111(1), 160–175. https://doi.org/10.1016/j.jep.2006.11.007
Jassim, S. A. A., & Naji, M. A. (2003). Novel antiviral agents: A medicinal plant perspective. Journal of Applied Microbiology, 95(3), 412–427. https://doi.org/10.1046/j.1365-2672.2003.02026.x
Kasmi, Y., Khataby, K., Souiri, A., & Ennaji, M. M. (2019). Coronaviridae: 100,000 years of emergence and reemergence. Emerging and Reemerging Viral Pathogens: Volume 1: Fundamental and Basic Virology Aspects of Human, Animal and Plant Pathogens, 127–149. https://doi.org/10.1016/B978-0-12-819400-3.00007-7
Kim, H.-Y., Shin, H.-S., Park, H., Kim, Y.-C., Yun, Y. G., Park, S., Shin, H.-J., & Kim, K. (2008). In vitro inhibition of coronavirus replications by the traditionally used medicinal herbal extracts, Cimicifuga rhizoma, Meliae cortex, Coptidis rhizoma, and Phellodendron cortex. Journal of Clinical Virology, 41(2), 122–128. https://doi.org/10.1016/j.jcv.2007.10.011
Kott, V., Barbini, L., Cruañes, M., Muñoz, J. D. D., Vivot, E., Cruañes, J., Martino, V., Ferraro, G., Cavallaro, L., & Campos, R. (1998). Antiviral activity in Argentine medicinal plants. Journal of Ethnopharmacology, 64(1), 79–84. https://doi.org/10.1016/S0378-8741(98)00098-1
Lee, J. Y., Abundo, M. E. C., & Lee, C. W. (2018). Herbal medicines with antiviral activity against the influenza virus, a systematic review. En American Journal of Chinese Medicine (Vol. 46, Número 8). https://doi.org/10.1142/S0192415X18500854
Linares, E., & Bye, R. A. (1987). A study of four medicinal plant complexes of Mexico and adjacent United States. Journal of Ethnopharmacology, 19(2), 153–183. https://doi.org/10.1016/0378-8741(87)90039-0
Liu, P., Chen, W., & Chen, J.-P. (2019). Viral Metagenomics Revealed Sendai Virus and Coronavirus Infection of Malayan Pangolins (Manis javanica). Viruses, 11(11), 979. https://doi.org/10.3390/v11110979
Lopez, A., Hudson, J. B., & Towers, G. H. N. (2001). Antiviral and antimicrobial activities of Colombian medicinal plants. Journal of Ethnopharmacology, 77(2–3), 189–196. https://doi.org/10.1016/S0378-8741(01)00292-6
Lückemeyer, D. D., Müller, V. D. M., Moritz, M. I. G., Stoco, P. H., Schenkel, E. P., Barardi, C. R. M., Reginatto, F. H., & Simões, C. M. O. (2012). Effects of Ilex paraguariensis A. St. Hil. (yerba mate) on herpes simplex virus types 1 and 2 replication. Phytotherapy Research, 26(4), 535–540. https://doi.org/10.1002/ptr.3590
Masters, P. S. (2006). The Molecular Biology of Coronaviruses. En Advances in Virus Research (Vol. 65, pp. 193–292). https://doi.org/10.1016/S0065-3527(06)66005-3
Mitra, S. K., Irenaeus, T. K. S., Gurung, M. R., & Pathak, P. K. (2012). Taxonomy and importance of Myrtaceae. Acta Horticulturae, 959, 23–34. https://doi.org/10.17660/ActaHortic.2012.959.2
Modak, B., Sandino, A. M., Arata, L., Cárdenas-Jirón, G., & Torres, R. (2010). Inhibitory effect of aromatic geranyl derivatives isolated from Heliotropium filifolium on infectious pancreatic necrosis virus replication. Veterinary Microbiology, 141(1–2), 53–58. https://doi.org/10.1016/j.vetmic.2009.09.005
Mohammadi Pour, P., Fakhri, S., Asgary, S., Farzaei, M. H., & Echeverría, J. (2019). The Signaling Pathways, and Therapeutic Targets of Antiviral Agents: Focusing on the Antiviral Approaches and Clinical Perspectives of Anthocyanins in the Management of Viral Diseases. Frontiers in pharmacology, 10, 1207. https://doi.org/10.3389/fphar.2019.01207
Möstl, K. (1990). Coronaviridae, pathogenetic and clinical aspects: An update. En Comparative Immunology, Microbiology and Infectious Diseases (Vol. 13, Número 4, pp. 169–180). Pergamon. https://doi.org/10.1016/0147-9571(90)90085-8
Mousa, H. A. L. (2017). Prevention and Treatment of Influenza, Influenza-Like Illness, and Common Cold by Herbal, Complementary, and Natural Therapies. Journal of Evidence-Based Complementary and Alternative Medicine, 22(1), 166–174. https://doi.org/10.1177/2156587216641831
Pacheco, P., Sierra, J., Schmeda‐Hirschmann, G., Potter, C. W., Jones, B. M., & Moshref, M. (1993). Antiviral activity of chilean medicinal plant extracts. En Phytotherapy Research (Vol. 7, Número 6, pp. 415–418). John Wiley & Sons, Ltd. https://doi.org/10.1002/ptr.2650070606
Patil, K. S., & Bhalsing, S. R. (2016). Ethnomedicinal uses, phytochemistry and pharmacological properties of the genus Boerhavia. En Journal of Ethnopharmacology (Vol. 182, pp. 200–220). Elsevier Ireland Ltd. https://doi.org/10.1016/j.jep.2016.01.042
Peralta, R. M., Koehnlein, E. A., Oliveira, R. F., Correa, V. G., Corrêa, R. C. G., Bertonha, L., Bracht, A., & Ferreira, I. C. F. R. (2016). Biological activities and chemical constituents of Araucaria angustifolia: An effort to recover a species threatened by extinction. En Trends in Food Science and Technology (Vol. 54, pp. 85–93). Elsevier Ltd. https://doi.org/10.1016/j.tifs.2016.05.013
Pereira, P. S., França, S. D. C., De Oliveira, P. V. A., Breves, C. M. D. S., Pereira, S. I. V., Sampaio, S. V., Nomizo, A., & Dias, D. A. (2008). Chemical constituents from Tabernaemontana catharinensis root bark: A brief NMR review of indole alkaloids and in vitro cytotoxicity. Quimica Nova, 31(1), 20–24. https://doi.org/10.1590/S0100-40422008000100004
Pérez-García, F., Marín, E., Adzet, T., & Cañigueral, S. (2001). Activity of plant extracts on the respiratory burst and the stress protein synthesis. Phytomedicine, 8(1), 31–38. https://doi.org/10.1078/0944-7113-00018
Petrosillo, N., Viceconte, G., Ergonul, O., Ippolito, G., & Petersen, E. (2020). COVID-19, SARS and MERS: are they closely related? Clinical Microbiology and Infection. https://doi.org/10.1016/j.cmi.2020.03.026
Rakover, Y., Ben-Arye, E., & Goldstein, L. H. (2008). [The treatment of respiratory ailments with essential oils of some aromatic medicinal plants]. Harefuah, 147(10), 783–788, 838.
Rashed, K., Sahuc, M. E., Deloison, G., Calland, N., Brodin, P., Rouillé, Y., & Séron, K. (2014). Potent antiviral activity of Solanum rantonnetii and the isolated compounds against hepatitis C virus in vitro. Journal of Functional Foods, 11(C), 185–191. https://doi.org/10.1016/j.jff.2014.09.022
Reis, S. R. I. N., Valente, L. M. M., Sampaio, A. L., Siani, A. C., Gandini, M., Azeredo, E. L., D’Avila, L. A., Mazzei, J. L., Henriques, M. das G. M., & Kubelka, C. F. (2008). Immunomodulating and antiviral activities of Uncaria tomentosa on human monocytes infected with Dengue Virus-2. International Immunopharmacology, 8(3), 468–476. https://doi.org/10.1016/j.intimp.2007.11.010
Robson, B. (2020). COVID-19 Coronavirus spike protein analysis for synthetic vaccines, a peptidomimetic antagonist, and therapeutic drugs, and analysis of a proposed achilles’ heel conserved region to minimize probability of escape mutations and drug resistance. Computers in Biology and Medicine, 103749. https://doi.org/10.1016/j.compbiomed.2020.103749
Rocha Martins, L. R., Brenzan, M. A., Nakamura, C. V., Dias Filho, B. P., Nakamura, T. U., Ranieri Cortez, L. E., & Garcia Cortez, D. A. (2011). In vitro antiviral activity from Acanthospermum australe on herpesvirus and poliovirus. Pharmaceutical Biology, 49(1), 26–31. https://doi.org/10.3109/13880209.2010.493177
Roumy, V., Ruiz, L., Ruiz Macedo, J. C., Gutierrez-Choquevilca, A. L., Samaillie, J., Encinas, L. A., Mesia, W. R., Ricopa Cotrina, H. E., Rivière, C., Sahpaz, S., Bordage, S., Garçon, G., Dubuisson, J., Anthérieu, S., Seron, K., & Hennebelle, T. (2020). Viral hepatitis in the Peruvian Amazon: Ethnomedical context and phytomedical resource. Journal of Ethnopharmacology, 255, 112735. https://doi.org/10.1016/j.jep.2020.112735
Ryding, O. (1995). Pericarp structure and phylogeny of the Lamiaceae-Verbenaceae-complex. Plant Systematics and Evolution, 198(1–2), 101–141. https://doi.org/10.1007/BF00985109
Sabini, M. C., Cariddi, L. N., Escobar, F. M., Mañas, F., Comini, L., Iglesias, D., Larrauri, M., Montoya, S. N., Sereno, J., Contigiani, M. S., Cantero, J. J., & Sabini, L. I. (2016). Potent inhibition of Western equine encephalitis virus by a fraction rich in flavonoids and phenolic acids obtained from Achyrocline satureioides. Brazilian Journal of Pharmacognosy, 26(5), 571–578. https://doi.org/10.1016/j.bjp.2016.05.004
Sánchez, M., Kramer, F., Bargardi, S., & Palermo, J. A. (2009). Melampolides from Argentinean Acanthospermum australe. Phytochemistry Letters, 2(3), 93–95. https://doi.org/10.1016/j.phytol.2008.12.007
Shen, K., Yang, Y., Wang, T., Zhao, D., Jiang, Y., Jin, R., Zheng, Y., Xu, B., Xie, Z., Lin, L., Shang, Y., Lu, X., Shu, S., Bai, Y., Deng, J., Lu, M., Ye, L., Wang, X., Wang, Y., & Gao, L. (2020). Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement. En World Journal of Pediatrics. Institute of Pediatrics of Zhejiang University. https://doi.org/10.1007/s12519-020-00343-7
Simões, C. M. O., Falkenberg, M., Mentz, L. A., Schenkel, E. P., Amoros, M., & Girre, L. (1999). Antiviral activity of South Brazilian medicinal plant extracts. Phytomedicine, 6(3), 205–214. https://doi.org/10.1016/S0944-7113(99)80010-5
Susan van, D., Beulens, J. W. J., Yvonne T. van der, S., Grobbee, D. E., & Nealb, B. (2010). The global burden of diabetes and its complications: an emerging pandemic. European Journal of Cardiovascular Prevention & Rehabilitation, 17(1_suppl), s3–s8. https://doi.org/10.1097/01.hjr.0000368191.86614.5a
Thompson, K. D. (2006). Herbal extracts and compounds active against herpes simplex virus. En Advances in Phytomedicine (Vol. 2, Número C, pp. 65–86). Elsevier. https://doi.org/10.1016/S1572-557X(05)02005-2
Torres, R., Modak, B., Urzúa, A., Delle Monache, F., & Pujol, E. D. Y. C. A. (2002). Propiedades antivirales de compuestos naturales y semi-sinteticos de la resina de Heliotropium filifolium. Boletin de la Sociedad Chilena de Quimica.
Trujillo, F., & Lasso, C. A. (Carlos A. (2017). Biodiversidad del Río Bita, Vichada, Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Turner, N. J., & Hebda, R. J. (1990). Contemporary use of bark for medicine by two Salishan native elders of southeast Vancouver Island, Canada. Journal of ethnopharmacology, 29(1), 59–72. https://doi.org/10.1016/0378-8741(90)90098-e
Ubillas, R., Jolad, S. D., Bruening, R. C., Kernan, M. R., King, S. R., Sesin, D. F., Barrett, M., Stoddart, C. A., Flaster, T., Kuo, J., Ayala, F., Meza, E., Castañel, M., Mcmeekin, D., Rozhon, E., Tempesta, M. S., Barnard, D., Huffman, J., Smee, D., … Nakanishi, K. (1994). SP-303, an antiviral oligomeric proanthocyanidin from the latex of Croton lechleri (Sangre de Drago). Phytomedicine, 1(2), 77–106. https://doi.org/10.1016/S0944-7113(11)80026-7
Walls, A. C., Park, Y. J., Tortorici, M. A., Wall, A., McGuire, A. T., & Veesler, D. (2020). Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. https://doi.org/10.1016/j.cell.2020.02.058
Weese, T. L., & Bohs, L. (2007). A Three-Gene Phylogeny of the Genus Solanum (Solanaceae). Systematic Botany, 32(2), 445–463. https://doi.org/10.1600/036364407781179671
Weil, A. T. (1978). Coca leaf as a therapeutic agent. American Journal of Drug and Alcohol Abuse, 5(1), 75–86. https://doi.org/10.3109/00952997809029262
WHO. (2020). Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected.
Yang, Y., Islam, S., Wang, J., Li, Y., & Chen, X. (2020). Traditional Chinese Medicine in the Treatment of Patients Infected with 2019-New Coronavirus ( SARS-CoV-2 ): A Review and Perspective. 16. https://doi.org/10.7150/ijbs.45538
Yao, X. J., Wainberg, M. A., & Parniak, M. A. (1992). Mechanism of inhibition of HIV-1 infection in Vitro by purified extract of Prunella vulgaris. Virology, 187(1), 56–62. https://doi.org/10.1016/0042-6822(92)90294-Y
Zhang, T., Wu, Q., & Zhang, Z. (2020). Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak. Current Biology, 30(7), 1346-1351.e2. https://doi.org/10.1016/j.cub.2020.03.022





