INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es la segunda causa de cáncer entre las mujeres alrededor del mundo; diagnosticándose anualmente alrededor de 500 000 nuevos casos de cáncer cervical invasor, de los cuales más de la mitad son mortales; en países subdesarrollados es el segundo cáncer más frecuente y la neoplasia ginecológica más frecuente(1). En Venezuela, según el Registro Central de Cáncer se reportaron 4 076 casos durante 2012, lo cual convierte al CCU en la segunda neoplasia más frecuente en las venezolanas, después del cáncer de mamas con una tasa cruda de casos de 27,84 x 100 000 mujeres y la tasa cruda de mortalidad de 11,13 x 100 000 mujeres; ocupando el estado Zulia el primer lugar con una incidencia de 648 casos con una tasa estandarizada según la población mundial de 34,52 x 100 000 mujeres(2).
Se conoce que el Virus del Papiloma Humano (VPH) representa la infección de transmisión sexual más frecuente en personas con vida sexual activa, con una prevalencia mundial de 30 millones de casos anuales y con más de 290 millones de mujeres infectadas por este virus, de las cuales 10%-17% se encuentran asintomáticas(3-6). Se estima que globalmente la prevalencia del VPH es del 12%, siendo el genotipo del VPH16 el más frecuente con una prevalencia del 3,2%(7); por su parte, en Latinoamérica y el Caribe la prevalencia en mujeres se encuentra entre 6,9% - 21,8%(8). En Venezuela, las cifras oficiales son poco fidedignas y no reflejan la verdadera diseminación del VPH en Venezuela, aunque, algunos investigadores han establecido una alta prevalencia de la infección en mujeres; reportándose prevalencias que varían desde 13,5% hasta 68,7% a nivel nacional y 91,10% en poblaciones del estado Zulia(9).
Según la Organización Mundial de la Salud(10), el VPH está asociado con 530.000 nuevos casos de CCU y 270.000 muertes; siendo los genotipos VPH-16 y VPH-18 responsables de aproximadamente 70% de todos los casos. Así pues, la infección por el Virus del Papiloma Humano (VPH) representa el paso previo que precede al desarrollo de una lesión intraepitelial escamosa (LIE), cuando la infección se hace persistente, aunado a otras condiciones y factores de riesgo, favorece el desarrollo de lesiones y su progresión de bajo (LIEBG) a un alto grado (LIEAG), y posteriormente carcinoma invasor, cuyo tiempo de evolución es variable y depende de diversos factores(5,8,9,11,12).
Actualmente, la población femenina inicia su actividad sexual cada vez más precozmente, esto inclina la balanza a que las adolescentes adquieran infecciones de trasmisión sexual como el VPH(13); los datos publicados muestran un rango de prevalencia de infección genital por VPH del 30 a 60% en mujeres entre los 15 y 25 años de edad(3). La alta prevalencia de las lesiones precursoras en mujeres entre 20 y 29 años también sugiere la importancia de la inclusión de adolescentes sexualmente activas en los programas de rastreo, puesto que la ocurrencia de las lesiones precursoras transcurre de 10 a 15 años antes del cáncer invasor; as mujeres cuya actividad sexual se inicia en la adolescencia, tienen numerosos compañeros sexuales, son portadoras de infecciones sexualmente transmisibles y tienen diversas gestaciones en la juventud, estadísticamente presentan mayor posibilidad de desarrollar un cáncer cervical puesto que son las más expuestos al riesgo de contaminación por el VPH(14).
En la adolescencia, la replicación celular y las sustancias presentes en el medio cervical facilitan la infección por VPH. Además de eso, el cuello uterino, la mayoría de las veces, presenta ectopia y zona de transformación inmadura, lo cual expone la mucosa glandular, que por ser más frágil, sufre agresión del pH ácido del medio vaginal, de microorganismos y/o por traumas, contribuyendo al desarrollo de procesos inflamatorios crónicos en el cérvix, lo que representa un factor de riesgo para infecciones de trasmisión sexual como la del VPH, el cual a partir de micro fisuras, puede alcanzar las células basales e iniciar el proceso de replicación viral y el desarrollo de lesiones cervicales pre-neoplásicas o neoplásicas(15).
En el embarazo, los cambios hormonales y los cambios inmunes parecen facilitar tanto la infección como la persistencia del VPH, aumentando el riesgo de cáncer y el riesgo de transmisión vertical hacia la placenta y el feto(16,17). Se ha sugerido que los altos niveles de estrógeno y progesterona que ocurren durante el embarazo disminuyen la inmunidad celular, que es crucial para resolver la infección por VPH(18); asimismo, recientemente se ha revelado que tanto el embarazo como la infección por VPH pueden aumentar la disbiosis de la microbiota vaginal, asociándose la infección por VPH en las embarazadas con un entorno microbiano más complejo y diverso(19).
Se ha demostrado una amplia variación en la prevalencia del VPH en gestantes, situada entre 5,5% y 65%(17). No obstante, aunque diversos estudios sugieren que el embarazo es un factor de riesgo de infección por VPH, los hallazgos de varias investigaciones han sido inconsistentes(20); solo algunos pocos estudios, que incluyen en su mayor parte pequeñas cohortes, realizaron seguimiento de las mujeres incluidas después del parto ni tampoco dejaban claro si el embarazo u otros factores de riesgo como el daño tisular del cuello uterino durante el parto, el comportamiento sexual o la edad, podrían explicar las diferencias en la detección del VPH observadas entre mujeres no embarazadas, embarazadas y en posparto(21).
Por su parte, la gestación en la adolescencia es considerada como un componente que incrementa el índice de riesgo permitiendo una fácil infección producida por VPH como resultante de los cambios fisiológicos en el canal vaginal así como las alteraciones hormonales e inmunologías que se producen durante este periodo. Para las adolescentes con VPH, el embarazo es una condición potencialmente grave, por ejemplo, los virus de los tipos 16 y 18 pueden causar papilomas laríngeos en recién nacidos y niños, además de hemorragia asociada al parto vaginal y verrugas genitales que crecen rápidamente y conllevan a obstrucción mecánica del canal de parto en el final de la gestación(22). Asimismo, la infección genital por VPH se ha asociado con un mayor riesgo de complicaciones obstétricas como abortos, preeclampsia, anormalidades placentarias, restricción del crecimiento intrauterino, parto pretérmino y rotura prematura de membranas ovulares(16,17); dado a que parece existir una maquinaria en las células trofoblásticas que facilitan la replicación e infección de la placenta por el VPH(17).
El aumento de la frecuencia de lesiones pre-neoplásicas cervicales en adolescentes y mujeres jóvenes apunta a la necesidad de estudio e investigación del comportamiento de esas alteraciones en ese grupo de edad, cuya comprensión podrá auxiliar el desarrollo de estrategias y mecanismos de intervención que reduzcan las tasas de morbilidad por esta neoplasia. En este estudio, se propuso comparar la presencia del VPH y de LIE en adolescentes embarazadas y no grávidas atendidas en la Maternidad Dr. Armando Castillo Plaza de Maracaibo, estado Zulia, Venezuela.
MÉTODOS
nvestigación comparativa con diseño no experimental, transeccional y de campo, en la cual se estudió una muestra intencionada y no aleatoria conformada por 96 mujeres adolescentes atendidas en la Maternidad “Dr. Armando Castillo Plaza”; las cuales se separaron en dos grupos: embarazadas (Grupo A) y no grávidas (Grupo B). Se incluyeron adolescentes sexualmente activas, con edades entre 13-19 años, reclutadas por diferentes estrategias de convocatoria (bola de nieve, grupos comunitarios organizados y citación por el personal de salud); quienes fueron remitidas a la consulta prenatal o de Planificación Familiar; excluyéndose pacientes con diagnóstico confirmado de cáncer cervical o lesiones pre-cancerosas, con contraindicaciones para la realización de la genotipificación viral y/o la citología cervico-vaginal, y aquellas que no aprobasen la realización de tales procedimientos.
Las adolescentes seleccionadas fueron valoradas en la consulta prenatal (Grupo A) o en la consulta de Planificación Familiar (Grupo B), donde con la ayuda de una ficha de trabajo diseñada ad hoc, se asentaron datos socio-demográficos y clínicos obtenidos por medio de la entrevista clínica, así como los resultados de las pruebas y procedimientos realizados. Seguidamente, se realizó una valoración por sistemas y un examen ginecológico, realizándose los siguientes procedimientos:
Toma de muestra para citología cervico vaginal: con la paciente en posición de litotomía, se procedió a visualizar los genitales externos e introducir un especulo vaginal de Graves desechable y una vez fijado el cuello uterino, se inspeccionó el mismo y se tomaron muestra de endocérvix con un cepillo (citoblush) y con espátula de Ayre para el exocérvix y fondo de saco vaginal posterior. Las muestras recolectadas se extendieron en una lámina portaobjeto, previamente rotulada, y se fijaron con fijador citológico en espray, a una distancia de un metro aproximadamente; manteniéndose almacenadas a temperatura ambiente en un laminario hasta el momento de su procesamiento. Posteriormente, fueron teñidas con la tinción de Papanicolaou y se procesaron en los laboratorios del Instituto de Investigaciones Clínicas Dr. Américo Negrette de la Universidad del Zulia. Los resultados se reportaron siguiendo la nomenclatura Bethesda y además en el informe de la citología se incluyeron los grados de inflamación observados, la presencia de microorganismos o cambios que sugieren la presencia del VPH(23).
Toma de muestra para genotipificación de VPH: Se tomó un hisopado del canal endocervical con un hisopo de dacrón esteril, el cual se insertó de 1 a 1,5 cms del orificio cervical externo del cuello uterino (zona de transición escamo-columnar de la región endocervical) y fue rotado 3 veces, retirado del canal e introducido en un tubo que contiene 1 ml de buffer de preservación-lisis estéril como medio de transporte, previamente identificado y rotulado. Las muestras se trasladaron al laboratorio de la Sección de Biología Molecular del Centro de Investigaciones Endocrinas Metabólicas Dr. Félix Gómez de la Facultad de Medicina de la Universidad del Zulia, mantenidas a 4º C y procesadas dentro de los primeros 3 días de su recepción.
En primer lugar, se realizó la extracción del ADN de las muestras endocervicales. Para ello, se transfirió 500 µl del buffer de lisis, contentivo del hisopo a un tubo de 1,5 ml, se centrifugó a 12.000 rpm por 10 minutos y el sedimento se resuspende en 500 µl de buffer de lisis (50 mM Tris-Hcl pH 7,5, 1% Triton X-100, 1 mM EDTA, 150 µg/ml de proteinasa K). La muestra es incubada a 56ºC por 2 horas, los lisados se centrifugan a 14.000 rpm y el sedimento se resuspende en 30 µl de buffer TE; se utiliza 10 µl de la muestra para ensayos de amplificación.
Para la detección y genotipificación viral se llevaron a cabo reacciones de amplificación por PCR utilizando un formato de PCR múltiple que incluyó oligonucleótidos iniciadores dirigidos a secuencias específicas del genoma viral de genotipos de bajo riesgo oncogénico VPH 6/11 (Oligonucleótidos VPH6/!F y VPH 6/11: R GenBank: KC300186.1) y cinco genotipos de alto riesgo oncogénico: VPH 16 (Oligonucleótidos VPH16F y VPH16R: GenBank: KF181718.1); VPH 18 (Oligonucleótidos VPH18!F y VPH18R, GenBank: KC470230.1); VPH 31 (Oligonucleótidos VPH31!F y VPH31R, GenBank: KC662562.1); VPH 33 (Oligonucleótidos VPH33F y VPH 33R, GenBank: JQ976784.1); y VPH 35 (Oligonucleótidos VPH35F y VPH 35R, GenBank: JX129488.1). La identidad y especificidad de los oligonucleótidos se verificó en las bases de datos genómicos del Centro Nacional de Información Biotecnológica (NCBI: National Center for Biotechnology Information) de Estados Unidos. Se incluyeron como control positivo ADN aislado de muestras caracterizadas con el kit Seeplex de Digene, USA y como control negativo se utilizará ADN genómico humano (PROMEGA); dichas reacciones se llevarán a cabo en un termociclador MJ Research PTC-100™.
Los productos obtenidos se analizaron en geles de agarosa al 2 %, los cuales fueron teñidos con bromuro de etidio, visualizados en transiluminador ultravioleta y fotografiados con sistema de fotodocumentación DigiDoc, UVP; una muestra se consideró positiva para uno o más genotipos determinados, cuando el patrón de migración de los productos de PCR amplificados a partir de la muestra, coincida con el patrón de migración (peso molecular) de los productos de PCR específicos de los genomas virales presentes en el control positivo. Los resultados positivos se calificaron según el riesgo oncogénico de los genotipos detectados y en caso de existir co-infección entre genotipos de alto y bajo riesgo se consideró como de alto riesgo.
Todas las pacientes participaron de manera voluntaria, suministrando su consentimiento informado para su inclusión en la investigación y no se encontraron expuestas a riesgos físicos o psicológicos, ni se vulneraban los principios de la Declaración de Helsinki para estudio en humanos; asimismo, el protocolo de estudio fue previamente revisado y aprobado por los comité de bioética de cada uno de los centros de salud donde se ejecutó la investigación. Posteriormente, fueron citadas para la entrega de resultados y los casos donde se detectó el virus o que presentaron alteraciones citológicas se derivaron a la consulta ginecológica para realización de colposcopia, toma de biopsias y recibir el manejo o tratamiento específico.
Para el procesamiento de los datos obtenidos se utilizó el Paquete Estadístico para Ciencias Sociales (SPSS), versión 21. Se ejecutó un análisis de tipo descriptivo, donde los mismos fueron expresados en frecuencias absolutas, frecuencias relativas (porcentajes), medidas de tendencia central (medias) o medidas de dispersión (desviación estándar) y se presentaron en tablas de distribución de frecuencias. Para la comparación entre los grupos, se utilizaron las pruebas del Chi cuadrado y la T de Student pareadas, para los datos cualitativos y cuantitativos, respectivamente; ambas pruebas con un nivel de confianza del 95% y significancia de p < 0,05; asimismo, se determinó la probabilidad de cada uno de los factores de riesgo asociados a las variables, mediante el cálculo de la razón de Riesgo u ODDS RATIO para cada factor y se utilizó la prueba de Chi Cuadrado para la correlación de la misma. Finalmente, los resultados conseguidos se presentaron en tablas.
RESULTADOS
Una vez aplicado el protocolo de estudio, fueron
seleccionadas 92 adolescentes, las cuales se dividieron en dos grupos de 46
sujetos cada uno. Como puede apreciarse en la tabla 1, se trataron
principalmente de mujeres en la adolescencia tardía (72,8%) o intermedia
(22,9%). La adolescencia temprana sólo se registró en 4,3 de la muestra
evaluada.
Tabla 1
Clasificación de las Adolescentes femeninas. Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza. Maracaibo, estado Zulia. Venezuela
 n= 46 para cada grupo
n= 46 para cada grupo
|
Clasificación
|
Adolescentes
embarazadas
(Grupo A)
|
Adolescentes
no embarazadas
(Grupo B)
|
Total
|
|
n
|
%
|
n
|
%
|
n
|
%
|
|
Adolescencia temprana
(10-13 años)
|
1
|
1,1
|
3
|
3,2
|
4
|
4,3
|
|
Adolescencia intermedia
(14-16 años)
|
7
|
7,6
|
14
|
15,3
|
21
|
22,9
|
|
Adolescencia tardía
(17-19 años)
|
38
|
41,3
|
29
|
31,5
|
67
|
72,8
|
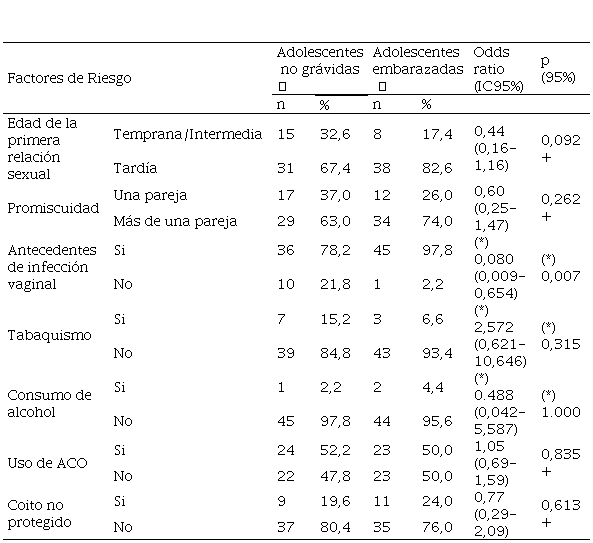
Con respecto, a los factores de riesgos interrogados asociados con la infección por VPH y a las LIE (tabla 2), se pudo obtener que para la edad de la primera relación sexual es el correspondiente a la adolescencia tardía que comprende de los 17 a los 19 años de edad para os grupos de adolescentes embarazadas y no grávidas (82,6%, y 67,4%, respectivamente. Ambos grupos reportan más de una pareja sexual con un porcentaje mayor para el de las embarazadas (74%). Así mismo el antecedente de algún proceso infeccioso vaginal también fue prevalente en los dos grupos de estudio predominando en las embarazadas con 97,8%.
Es de gran importancia considerar los resultados del coito no protegido, ya que para los dos grupos estudiados sus resultados fueron altos predominando en el grupo de las no embarazadas con 80,4%. Por otra parte, el factor de riesgo tabaco estuvo ausente en 93.4% de las embarazadas y en 84.8% de las no grávidas. Así mismo, el comportamiento es similar para el factor consumo de alcohol, ausente en un 97,8% y 95,6%, respectivamente.
Tabla 2
Factores de riesgo
epidemiológico asociado al VPH y la lesión intraepitelial cervical en
adolescentes. Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza". Maracaibo, estado Zulia. Venezuela
 ǂ n= 46+ X2 cuadrado* Test exacto de Fischer
ǂ n= 46+ X2 cuadrado* Test exacto de Fischer
|
Factores de Riesgo
|
Adolescentes no grávidas
ǂ |
Adolescentes
embarazadas ǂ |
Odds ratio
(IC95%)
|
p
(95%)
|
|
n
|
%
|
n
|
%
| | |
|
Edad de la primera
relación sexual
|
Temprana/Intermedia
|
15
|
32,6
|
8
|
17,4
|
0,44
(0,16-1,16)
|
0,092 + |
|
Tardía
|
31
|
67,4
|
38
|
82,6
|
|
Promiscuidad
|
Una pareja
|
17
|
37,0
|
12
|
26,0
|
0,60
(0,25-1,47)
|
0,262+ |
|
Más de una pareja
|
29
|
63,0
|
34
|
74,0
|
|
Antecedentes de
infección vaginal
|
Si
|
36
|
78,2
|
45
|
97,8
|
(*)
0,080
(0,009-0,654)
|
(*)
0,007
|
|
No
|
10
|
21,8
|
1
|
2,2
|
|
Tabaquismo
|
Si
|
7
|
15,2
|
3
|
6,6
|
(*)
2,572
(0,621-10,646)
|
(*)
0,315
|
|
No
|
39
|
84,8
|
43
|
93,4
|
|
Consumo de alcohol
|
Si
|
1
|
2,2
|
2
|
4,4
|
(*)
0.488
(0,042-5,587)
|
(*)
1.000
|
|
No
|
45
|
97,8
|
44
|
95,6
|
|
Uso de ACO
|
Si
|
24
|
52,2
|
23
|
50,0
|
1,05
(0,69-1,59)
|
0,835+ |
|
No
|
22
|
47,8
|
23
|
50,0
|
|
Coito no protegido
|
Si
|
9
|
19,6
|
11
|
24,0
|
0,77
(0,29-2,09)
|
0,613+ |
|
No
|
37
|
80,4
|
35
|
76,0
|
En la tabla 3, se
identifica el tipo de LIE en cada grupo de estudio, los cuales están conformado
por 46 adolescentes sin embarazo y 46 adolescentes embarazadas, para una
muestra total de 92 pacientes; evidenciándose que las LIE bajo grado por VPH,
representaron el 43,4% de total de observaciones; predominando en el grupo de
adolescente embarazadas (30,4%, n= 28 pacientes). Al asociar las variables incluidas y buscar
diferencias entre los grupos mediante la técnica estadística chi2,
se observa un valor p= 0,036 al 95% de confianza, con un más del doble de
riesgo de presentarse en las gestantes (OR= 2,44; IC95%: 1,05-5,65); estos
resultados muestran que las gestantes embarazadas evaluadas tenían un mayor
riesgo de presentar lesiones intraepiteliales por VPH que las no embarazadas.
Tabla 3
Lesiones intraepiteliales
cervicales en Adolescentes femeninas. Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza". Maracaibo, estado Zulia. Venezuela
 X2= 4,38; p= 0,036 Odds ratio:= 2,44; IC95%= 1,05-5,65
X2= 4,38; p= 0,036 Odds ratio:= 2,44; IC95%= 1,05-5,65
|
Tipo
de
lesión intraepitelial
|
Adolescentes
embarazadas
(Grupo A)
|
Adolescentes
no embarazadas
(Grupo B)
|
Total
|
|
n
|
%
|
n
|
%
|
n
|
%
|
|
LIE bajo grado por VPH
|
28
|
30,4
|
12
|
13,0
|
40
|
43,4
|
|
LIE bajo grado NIC1
|
02
|
2,2
|
08
|
8,7
|
10
|
10,9
|
|
Sin lesión intraepitelial
|
16
|
17,4
|
26
|
28,3
|
42
|
45,7
|
En
la tabla
4, puede apreciarse que la mitad de las adolescentes femeninas
evaluadas presentaron positividad para el VPH en la prueba de PCR (50%; n=
46/92), correspondiéndose el grupo de las adolescentes embarazadas con el mayor
número de casos positivo para el VPH (52,1%), en comparación al 47,9% de
positividad de la prueba en las gestantes no grávidas; sin embargo, esta
diferencia no resulto ser estadísticamente significativa (p >0,05) ni
constituyó un mayor riesgo para el gripo de adolescentes gestantes (OR = 1).
Tabla 4
Diagnóstico de VPH por PCR en Adolescentes femeninas. Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza" Maracaibo, estado Zulia. Venezuela
 X2= 0,043; p= 0,83 Odds ratio= 1,19;
IC95%= 0,52-2,69* Porcentajes estimados
con base al total de pacientes por grupo (n=46 para cada grupo)
X2= 0,043; p= 0,83 Odds ratio= 1,19;
IC95%= 0,52-2,69* Porcentajes estimados
con base al total de pacientes por grupo (n=46 para cada grupo)
|
Diagnóstico
|
Adolescentes
embarazadas
(Grupo A)
|
Adolescentes
no embarazadas
(Grupo B)
|
|
n
|
%* |
n
|
%* |
|
- Negativo para VPH
|
22
|
47.9
|
24
|
52,1
|
|
- Positivo para VPH
|
24
|
52,1
|
22
|
47,9
|
En
cuanto a las características de la infección por VPH identificada por PCR,
puede observarse en la tabla 5, que del total de pacientes
con positividad para VPH el 78,3% presentaban genotipos de alto riesgo
oncogénico; predominando en las adolescentes embarazadas (47,8%; n=22/46) en
comparación a las no grávidas (30,4%; n=14/46). Asimismo, en 65,2% de las
pacientes con PCR positiva solo se detectó un genotipo especifico de VPH
(mono-infección), en tanto que la co-infección por
diferentes genotipos del VPH se presentó en el 34.8% de los ensayos positivos
para VPH; en las gestantes adolescentes prevaleció la mono-infección, en tanto
que en las no grávidas fue más frecuente la co-infección.
Tabla 5
Caracterización
de la infección por VPH identificados en ensayos de PCR de hisopados cervicales
de
Adolescentes femeninas.
Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza". Maracaibo, estado Zulia. Venezuela
 Porcentajes estimados con base al total de pacientes con positividad para VPH
(n=46)
Porcentajes estimados con base al total de pacientes con positividad para VPH
(n=46)
|
Características
|
Adolescentes
embarazadas
(Grupo A)
|
Adolescentes
no embarazadas
(Grupo B)
|
Total
|
x2
|
p
|
|
n
|
%
|
n
|
%
|
n
|
%
| | |
|
- Riesgo oncogénico
| | |
|
Alto
riesgo
|
22
|
47,8
|
14
|
30,5
|
36
|
78,3
|
3,87
|
0,051
|
|
Bajo
riesgo
|
02
|
4,3
|
08
|
17,4
|
10
|
21,7
| | |
|
- Numero de genotipos detectados
| | |
|
Mono-
infección
|
18
|
39,1
|
12
|
26,1
|
30
|
65,2
|
1,31
|
0,252
|
|
Co-infección
|
6
|
13,0
|
10
|
21,8
|
16
|
34,8
| | |
Finalmente, en relación con el
diagnóstico genotipo-especifico del VPH, en la tabla 6
se evidencia que en el total de muestras que resultaron para positivas
predominaron los genotipos de alto riesgo 16 y 18 en 34,8% (n=16). En las
adolescentes gestantes prevaleció el genotipo 16 (26,1%; n=10/24), seguida del
genotipo 18 (21,8%; n=10/24) y los genotipos de bajo riesgo 6 y 11 (10,8%; n=
5/24); no se identificaron muestras positivas para los genotipos 31 y 33. A su
vez, en las adolescentes no grávidas, predominaron los genotipos de bajo riesgo
6 y 11 (19,6%; n= 9/22) seguido del genotipo 18 (13,1%; n=6/22), y genotipo 16
(8,6&; n= 4/22).
Tabla 6
Genotipificación del VPH en Adolescentes
femeninas.
Consulta de Alto Riesgo Obstétrico y
Planificación familiar. Maternidad “Dr. Armando Castillo Plaza". Maracaibo, estado Zulia. Venezuela
 Casos positivos para VPH= 46* Porcentajes estimados con base al total de casos positivos
Casos positivos para VPH= 46* Porcentajes estimados con base al total de casos positivos
|
Genotipificación
|
Adolescentes
embarazadas
(Grupo A)
|
Adolescentes
no embarazadas
(Grupo B)
|
Total
|
|
n
|
%* |
n
|
%* |
n
|
%* |
|
16
|
10
|
21,7
|
3
|
6,5
|
12
|
26,1
|
|
18
|
9
|
19,6
|
6
|
13,1
|
15
|
32,7
|
|
31
|
0
|
0
|
2
|
4,4
|
2
|
4,4
|
|
33
|
0
|
0
|
1
|
2,1
|
1
|
2,1
|
|
6,11
|
2
|
4,3
|
8
|
17,4
|
10
|
21,8
|
|
11,31
|
0
|
0
|
1
|
2,1
|
1
|
2,1
|
|
6,11,16
|
2
|
4,3
|
1
|
2,1
|
4
|
8,6
|
|
18,
52
|
1
|
2,2
|
0
|
0
|
1
|
2,2
|
|
Total
|
24
|
52,1
|
22
|
47,7
|
46
|
100,0
|
DISCUSIÓN
Como ha sido descrito en diversos estudios(3,13,14,24), las mujeres jóvenes menores de 25años y adolescentes presentan una mayor prevalencia de infección genital por el VPH y por tanto, un mayor riesgo de desarrollar LIE. Aunque es muy probable que las infecciones por VPH detectadas en las jóvenes sean transitorias, es destacable que en esta investigación se incluyeron adolescentes embarazadas o no, sin antecedentes de lesión cervical o estudio previo de Papanicolau alterado; asimismo, el hecho de que las mayores tasas de prevalencia se encuentren entre las adolescentes y las adultas jóvenes hace que las mismas sean consideradas como un grupo de alto riesgo a desarrollar lesiones premalignas y malignas del cérvix uterino(25).
Se estima que durante el embarazo de 0.5 a 3% delas citologías son anormales. Cuando la citología cervical resulta anormal durante el embarazo, se calcula que de 10 a 70% de los casos tendrán regresión, 25 a 89% persistirán y 3 a 30% evolucionarán a lesiones invasoras(26). De acuerdo con los resultados citológicos del estudio en la adolescencia el embarazo aumenta un poco más del doble el riesgo de presentar una LIE de bajo grado, observándose que del total de las pacientes el 43,4% presento LIE de bajo grado VPH y de ese porcentaje el 30,4% corresponde a mujeres embarazadas; estos resultados coinciden con los presentados por otros investigadores, donde la mayoría de las pacientes con citología alterada tenían una LIE de bajo grado por VPH(14,27).
Al respecto, una investigación realizada en embarazadas de Moscú, Rusia, determinó que la prevalencia de LIE era significativamente mayor en gestantes que en mujeres no grávidas (17,4% vs. 2,6%; p = 0,005); encontrándose asociada con factores como la infección por VPH de alto riesgo carcinogénico, falta de detección regular de cáncer de cuello uterino antes del embarazo, antecedentes de vaginosis bacteriana y con la práctica del coito interrumpido(28). Cabe destacar que a pesar de que las recomendaciones de diferentes guías internacionales indican que las mujeres menores de 21 años no deben acceder a la realización de la citología cérvicovaginal, dado que por sus condiciones fisiológicas y biológicas presentan una tasa importante de positividad cuando se comparan con su mismo grupo y a su vez una alta tasa de regresión de lesiones preneoplásicas(27); estos resultados llaman a replantearse la necesidad de la tamización de las adolescentes y a educar e indagar sobre factores condicionantes, hábitos y estilos de vida que pudiese estar influyendo al respecto.
En cuanto a los resultados de la prueba de PCR, se encontró una tasa de positividad para el total de la muestra de adolescentes estudiadas del 50%; coincidiendo con los resultados presentados por otros investigadores, como Jordá y Col(3) en Argentina reportaron que la prevalencia de VPH era significativamente mayor entre en mujeres de 15 a 24 años respecto a las mujeres entre 25 y 49 años (35,8% vs. 27,3%; OR: 1,48; IC 95%: 1,01-2,18; p < 0,05). De igual forma, en otro estudio realizado en Japón(29), se consiguió una mayor y significativa prevalencia de VPH entre las embarazadas menores de 25 años en comparación con las mayores a esta edad (22,6% vs.11,3%; p< 0,0005).
Aunque la condición del embarazo ha sido considerada un factor de riesgo tanto para adquirir la infección por VPH como para la persistencia de la misma, las prevalencias de esta infección en series de embarazadas ha sido muy amplia e inconsistentes(16-20). Al respecto, los resultados obtenidos en este estudio evidencian una mayor frecuencia en el diagnóstico molecular positivo para VPH en las adolescentes embarazadas; sin embargo, no representó una diferencia estadísticamente significativa (52.1 vs 47,9, p= 0,83)
Al igual que en otra investigaciones, como una realizada en India donde se encontró una prevalencia de embarazadas con PCR positiva para VPH de 39,4%(17) o como en un estudio desarrollado en México, el cual reportó que la infección por VPH fue 2,7 veces mayor en mujeres embarazadas (35% vs. 13%)(18). Los resultados de otros estudios realizados en Brasil también sugieren una mayor prevalencia de infección por VPH en mujeres embarazadas que en mujeres no embarazadas(30,31); hallazgos que puede estar relacionado con la inmunosupresión relativa observada en mujeres embarazadas, lo cual puede jugar un papel en la reactivación de los virus y conlleva a destacar la importancia de un adecuado seguimiento de la infección viral en esta población específica.
Un meta análisis realizado en 2014 demostró que la prevalencia del VPH en mujeres embarazadas y no embarazadas de la misma edad se encontraba entre 16,82% y 12,25%, respectivamente; encontrándose un riesgo significativamente mayor de infección por VPH en mujeres embarazadas, con un OR de 1, 42 (IC95%: 1, 25-1, 61), y de 1,79 (IC95%: 1, 22-2, 63) en las menores de 25 años(20). Sin embargo, contrario a los resultados presentados, una investigación efectuada en Hong Kong, China no mostró evidencia de una influencia del embarazo en la prevalencia del VPH y la mayoría de las gestantes infectadas con VPH tenían una citología cervical normal(32); mientras que en otro estudio argentino la condición de embarazo no representó un factor de riesgo para la infección genital por VPH (OR < 1), encontrándose una prevalencia de positividad del 18,7% en embarazadas (n= 29/106; p > 0,05)(3)
La relación causal entre la infección por ciertos tipos de VPH y el CCU está bien establecida, observándose que la infección persistente con algunos de los genotipos de alto riesgo incrementa la probabilidad de desarrollar enfermedad pre-invasiva de alto grado y CCU; en esta serie, los tipos virales de alto riesgo mostraron mayor prevalencia respecto a los de bajo riesgo y el VPH 16 fue el más frecuente, coincidiendo con reportes nacionales e internacionales(3,9). Los tipos de VPH 16, 18, 31, 52 y 58 se encuentran entre los 10 tipos más comunes, siendo el VPH 16 el genotipo más frecuente del grupo de alto riesgo y ha sido identificado en casi la mitad de todos los cánceres de cuello uterino(3).
A su vez en investigaciones africanas(16,33), al igual que en esta serie, muestran una mayor prevalencia de VPH de alto riesgo con alta tasas de persistencia del VPH posterior al parto (53,4% - 64%). Asimismo, estos resultados presentados, muestran una diferencia con otros estudios realizados en el país, donde el genotipo más frecuente observado en sus muestras fue el 6 y 11; confirmando lo señalado en la literatura sobre la heterogeneidad en la distribución mundial de los genotipos de VPH(34,35).
En este estudio, la co-infección por varios genotipos diferentes del VPH no mostró diferencias significativas entre grupos; siendo menor al 57,67% de pacientes con infección por varios genotipos de VPH obtenido en una población de mujeres en edad reproductiva en Zulia, Venezuela, donde se utilizó una metodología molecular de detección de VPH semejante a la técnica empleada en la presente investigación(9). De forma contraria, otras investigaciones internacionales también reportan mayores porcentajes de embarazadas con co-infección por diferentes genotipos virales(17,18).
Además de la condición de la gestación o la edad menor a 25 años, se han reportado otros factores asociados significativamente a un mayor riesgo de presentar VPH, tales como un mayor número de parejas sexuales(3,36) o el consumo de alcohol(37). En esta serie, no se encontraron diferencias significativas en la presentación de estos factores entre las adolescentes embarazadas o no; asimismo, ni tampoco entre otras condiciones investigadas que han sido asociado en la literatura con un riesgo mayor de presentar esta infección, tales como métodos anticonceptivos (uso de contraceptivos orales o la no utilización del preservativo), edad de inicio de las relaciones sexuales, presencia de vaginosis bacteriana y tabaquismo(3,38).
A pesar de lo antes expuesto, puede observarse que ninguno de los factores epidemiológicos incluidos y desarrollados en el estudio presentó valores que permitan demostrar el riesgo o la asociación de dichas variables con el VPH y la LIE, en adolescentes embarazadas y no grávidas; lo cual, probablemente, esté relacionado con el tamaño de muestra evaluada;, por lo que resultaría conveniente realizar un estudio más amplio para demostrar estas asociaciones que son de gran valor para la prevención en la infección del VPH. Asimismo, sería interesante conocer el comportamiento de los resultados de la prueba de PCR durante y después de la gestación; puesto que si las mujeres son más propensas a la infección por VPH durante o poco después del embarazo, es posible que se necesiten medidas de prevención adicionales a la vacunación, como un mayor número de exámenes de detección del cuello uterino y seguimiento posparto, especialmente porque la paridad es un factor de riesgo para el cáncer de cuello uterino(19,30).
Entre las fortalezas del estudio realizado, puede destacarse el hecho de haber efectuado el diagnóstico molecular del VPH mediante la PCR, la cual es la más sensible de todas las pruebas actualmente utilizadas para la detección de la infección por estos virus; siendo la tendencia actual de los programas de pesquisa para la prevención del CCU en países desarrollados establecer el diagnóstico molecular del VPH como primera opción en el algoritmo de dichos programas, seguida de la citología para los casos positivos o realizar una nueva pesquisa al cabo de los 5 años en aquellas mujeres con prueba de VPH negativa(25)
Por tanto, este estudio sirve como una alerta para que se discuta la inclusión de adolescentes y mujeres más jóvenes en los programas de rastreo o monitoreo de lesiones precursoras del CCU, una vez que el índice ocurrencia de estas alteraciones citológicas viene aumentando en estos grupos. Asimismo, esta investigación destaca una alta prevalencia en gestantes adolescentes y de allí la importancia de monitorear esta infección viral durante el embarazo, por lo que, es esencial disponer de buenos métodos de diagnóstico para la detección y el cribado del VPH en el embarazo para controlar la carga de infección; así como otras co-infecciones que podrían afectar a la madre, el feto o el recién nacido.
Si bien el tipo y diseño de la investigación aplicado presenta algunas limitaciones para efectuar un análisis de causa-efecto directo puesto que no considera un control riguroso para la selección y aleatorización de la muestra y el tamaño de los grupos evaluados fue algo estrecho, los resultados del trabajo informa una alta frecuencia de infección por VPH en adolescentes detectada por ensayos de PCR, siendo las embarazadas las que presentaban mayor riesgo de presentar lesión intraepiteliales identificadas mediante la citología vaginal. Otra de las limitaciones del estudio fue no haber discriminado entre los trimestre del embarazo en el que se encontraban las pacientes estudiadas; así pues en un estudio realizado en Corea(39), los genotipos de VPH de alto riesgo fueron significativamente más prevalentes en el segundo trimestre (23,8%) en comparación con los otros períodos (primer trimestre, 13,2%; tercer trimestre, 17,4%; posparto, 15,1%; P = 0,010).
CONCLUSIONES
En virtud a los hallazgos obtenido, se concluye que
las embarazadas adolescentes presentan una mayor prevalencia de LIE e infección
genital por VPH, asociado a un riesgo significativo del doble de probabilidad
de presentar una LIE respecto a las adolescentes no grávidas. Existe
relación entre las variables del estudio, el VPH y la LIE, evidenciándose en
las mujeres embarazadas mayor frecuencia que en las no embarazadas, motivo por
el cual, se considera el embarazo un factor de gran relevancia al momento de
evaluar los cambios cervicales; por consiguiente, se debe concientizar,
orientar a esta población en la importancia de su control ginecológico desde el
inicio de las relaciones sexuales, para disminuir la presencia de esta
patología desde temprana edad.
Agradecimientos
Al Fondo Nacional de
Ciencia, Investigación y Tecnología (FONACIT) – Programa de Estímulo a la
Investigación e Innovación (PEII), por la subvención para el proyecto registrado bajo el Nº 2012001251
REFERENCIAS
1. Iacono C, Urdaneta JR. García JE, Villalobos N, Contreras A, Baabel N, et al. Calidad de vida en supervivientes al cáncer de cuello uterino. Rev Venez Oncol 2017; 29(3):219-228
2. Capote LG. Resumen del cáncer en Venezuela 2012. Rev Venez Oncol. 2015; 27(4):256- 268.
3. Jordá GB, Ramos JM, Mosmann J, Lopez ML, Wegert A, Cuffini C. Prevalencia del virus papiloma humano y factores de riesgo asociados en mujeres afiliadas al seguro de salud estatal en Posadas, Misiones (Argentina). Rev Chilena Infectol 2020; 37 (2): 111-116
4. Barnack JL, Serpico JR, Ahluwalia M, Ports KA. "I have human papillomavirus": An analysis of illness narratives from the Experience Project. Appl Nurs Res. 2016; 30: 137 141.
5. Gutiérrez C, Peña C, Zamorano D. Medidas de autocuidado y genotipificación del virus papiloma humano en mujeres de la unidad de patología cervical, Hospital Carlos Van Buren. Rev Chil Salud Pública. 2016; 20 (1): 19 – 28.
6. Pose C. Enfermedades de transmisión sexual: de la epidemiología a la ética. EIDON. 2015; (45): 102 – 117.
7. Sarr EHM, Mayrand MH, Coutlée F, Niyibizi J, Laporte L, Monnier P, et al. Exploration of the effect of human papillomavirus (HPV) vaccination in a cohort of pregnant women in Montreal, 2010-2016. Heliyon. 2019; 5(8): e02150. [Periódico en linea] Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6704337/pdf/main.pdf Fecha de consulta 17-12-2020. Fecha de consulta 10-12-2020
8. Melo A, Lagos N, Montenegro S, Orellana JJ, Vásquez AM, Moreno S, et al. Virus papiloma humano y Chlamydia trachomatis según número de parejas sexuales y tiempo de actividad sexual en estudiantes universitarias en la Región de La Araucanía, Chile. Rev Chilena Infectol; 2016; 33 (3): 287 – 292.
9. Urdaneta J, Baabel N, Maggiolo I, Contreras A. Genotipificación del Virus del Papiloma Humano en mujeres en edad reproductiva del estado Zulia, Venezuela. Vitae; 2018 (75). [Documento en línea]. Disponible en: https://vitae.ucv.ve/index_pdf.php?module=articulo_pdf&n=5878&rv=142. Fecha de consulta: 21-11-2019.
10. World Health Organization. World Health Organization; Human papillomavirus and cervical cancer. 2013 [Documento en línea]. Disponible en: http://www.who.int/mediacentre/factsheets/fs380/en/. Fecha de consulta: 11-08-2020
11. Flores S, García CS, Soriano DM, Figueroa R, Márquez G. Genotipificación del virus del papiloma humano en mujeres que asisten a un hospital gineco-obstétrico de tercer nivel de la Ciudad de México. Rev Chil Obstet Ginecol. 2016; 81(5): 381 – 387
12. Carrero YN. Virus de Papiloma Humano (VPH): Protagonista en el proceso de transformación neoplásica. Kasmera. 2015; 43 (1): 5 – 6.
13. Viñas LN, Chávez M, Calderón M. Papiloma virus humano en adolescentes y jóvenes menores de 25 años. Arch méd Camagüey. 2020; 24( 3 ): e6823. [Periódico en line] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S102502552020000300007&lng=es. Fecha de consulta 13-12-2020
14. Baggio K, Silva B, Prestes MO, Diehl C, Ferraz M, Coser J, et al. Examen de Papanicolaou en adolescentes y mujeres jóvenes: análisis del perfil citológico. Adolesc Saude. 2018; 15 (3):44-51
15. Coser J, Fontoura S, Belmonte C, Vargas V. Relaçao entre fatores de risco e lesao precursora do câncer do colo do útero em mulheres com e sem ectopia cervical. Revista Brasileira de Análises Clínicas 2012; 44(1):50-4.
16. Juliana NCA, Juma MH, Heijmans R, Ouburg S, Ali SM, Chauhan AS, et al. Detection of high-risk human papillomavirus (HPV) by the novel AmpFire isothermal HPV assay among pregnant women in Pemba Island, Tanzania. Pan Afr Med J. 2020; 37:183. [Periódico en linea] Disponible en: https://www.panafrican-med-journal.com/content/article/37/183/pdf/183.pdf Fecha de consulta 23-12-2020
17. Pandey D, Solleti V, Jain G, Das A, Shama Prasada K, Acharya S, et al. Human Papillomavirus (HPV) Infection in Early Pregnancy: Prevalence and Implications. Infect Dis Obstet Gynecol. 2019; 2019: 4376902. [Periódico en line] Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6451823/pdf/IDOG2019-4376902.pdf Fecha de consulta 15-12-2020
18. Martínez B, Álvarez KI, Sánchez H, Dávila MI, Cortés EI. Human papillomavirus as a single infection in pregnant women from Northeastern Mexico: Cross-sectional study. Int J Reprod Biomed. 2020; 18 (2): 129-134.
19. Chen Y, Hong Z, Wang W, Gu L, Gao H, Qiu L, et al. Association between the vaginal microbiome and high-risk human papillomavirus infection in pregnant Chinese women. BMC Infect Dis. 2019; 19(1):677. [Periódico en línea] Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6669982/ Fecha de consulta 23-12-2020
20. Liu P, Xu L, Sun Y, Wang Z. The prevalence and risk of human papillomavirus infection in pregnant women. Epidemiol Infect. 2014; 142 (8):1567-78.
21. Chen J, Gopala K, Puthatta A, Struyf F, Rosillon D. Prevalence and Incidence of Human Papillomavirus (HPV) Infection Before and After Pregnancy: Pooled Analysis of the Control Arms of Efficacy Trials of HPV-16/18 AS04-Adjuvanted Vaccine. Open Forum Infectious Diseases. 2019; 6(12):ofz486. [Periódico en line] Disponible en: https://europepmc.org/backend/ptpmcrender.fcgi?accid=PMC6892569&blobtype=pdf Fecha de consulta 15-12-2020
22. Costa ACPJ, Almeida DRM, Santos Neto M, Araújo TM, Araújo MFM, Vieira NFC. Perceptions of pregnant adolescents on human papillomavirus: an exploratory study. Online braz j nurs 13 (4):634-44. [Periódico en line] Disponible en: http://www.objnursing.uff.br/index.php/nursing/article/view/4730. Fecha de consulta 21-12-2020. Fecha de consulta 12-12-2020
23. Lacruz C. Nomenclatura de las lesiones cervicales (de Papanicolau a Bethesda 2001. Rev esp patol. 2003; 36 (1): 5 – 10.
24. Cermak M, Cottrell R, Murnan J. Women's knowledge of HPV and their perceptions of physician educational efforts regarding HPV and cervical cáncer. J Community Health. 2010; 35 (3): 229 – 234.
25. Domínguez SR, Trujillo T, Aguilar K, Hernández M. Infección por el virus del papiloma humano en adolescentes y adultas jóvenes. Rev Cubana Obstet Ginecol. 2018; 44(1) [Periódico en línea] Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2018000100017&lng=es&tlng=es. Fecha de consulta 16-12-2020
26. Arteaga AC, Delgado DE, Medina V, Castillo R Neoplasia intraepitelial cervical durante el embarazo, experiencia institucional. Ginecol Obstet Mex. 2017; 85 (8): 504-509.
27. Osorio JH, Montoya CP, Pérez M, Cardona FA. Características clínicas de adolescentes con alteraciones citológicas. Rev Obstet Ginecol Venez. 2020; 80 (3): 207-214.
28. Bebneva T.N., Dikke G.B. Cervical diseases in pregnant women. Socio-demographic and clinical-anamnestic risk factors. Medical Council. 2020; (13):131-136.
29. Takakuwa K, Mitsui T, Iwashita M, Kobayashi I, Suzuki A, Oda T, et al. Studies on the prevalence of human papillomavirus in pregnant women in Japan. J Perinat Med. 2006; 34 (1):77-9.
30. Salcedo MM, Damin AP, Agnes G, Pessini SA, Beitune PE, Alexandre CO, et al. Prevalence of human papillomavirus infection in pregnant versus non pregnant women in Brazil. Arch Gynecol Obstet 2015; 292:1273–8.
31. Freitas LB, Pereira CC, Checon R, Leite JP, Nascimento JP, Spano LC. Adeno-associated virus and human papillomavirus types in cervical samples of pregnant and non-pregnant women. Eur J Obstet Gynecol Reprod Biol. 2009; 145 (1):41 - 44.
32. Chan PK, Chang AR, Tam WH, Cheung JL, Cheng AF. Prevalence and genotype distribution of cervical human papillomavirus infection: Comparison between pregnant women and non-pregnant controls. J Med Virol. 2002; 67(4): 583 - 588.
33. Vyankandondera J, Wambua S, Irungu E, Mandaliya K, Temmerman M, Ryan C, et al. Type-specific human papillomavirus prevalence, incident cases, persistence, and associated pregnancy outcomes among HIV-infected women in Kenya. Sex Transm Dis. 2019; 46(8):532-539.
34. Posso AG, Rangel MA, Marchan N y González M. Lesión intraepitelial cervical en adolescentes. Rev Obstet Ginecol Venez. 2014;.74 (3): 193 - 202.
35. Sanoja LM. Detección y Tipificación del Virus del Papiloma Humano mediante reacción en cadena de polimerasa en muestras cervicales de estudiantes. Universidad de Carabobo. Venezuela. Comunidad y Salud, 2013; 11 (2): 1-10.
36. Kasamatsu E, Rodríguez MI, Soilan AM, Ortega M, Mongelós P, Páez M, et al. Factors associated with high-risk human papillomavirus infection and high-grade cervical neoplasia: A population-based study in Paraguay. PLoS ONE. 2019; 14 (6): e0218016. [Periódico en línea] Disponible en: https://doi.org/10.1371/journal.pone.0218016 Fecha de consulta 05-12-2020
37. Liang X, Carroll X, Zhang W, Zhang W, Liu G, Li S, et al. Socioeconomic and lifestyle factors associated with HPV infection in pregnant women: a matched case-control study in Beijing, China. Reprod Health. 2018;15(1):200. [Periódico en línea] Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6282257/pdf/12978_2018_Article_645.pdf Fecha de consulta 21-12-2020
38. Tanaka EZ, Kamizaki SS, Quintana SM, Pacagnella RC, Surita FG. Knowledge of Pregnant Adolescents about Human Papillomavirus. Rev. Bras. Ginecol. Obstet. 2019; 41 ( 5 ): 291-297.
39. Kim YH, Park JS, Norwitz ER, Park JW, Kim SM, Lee SM, et al. Genotypic prevalence of human papillomavirus infection during normal pregnancy: a cross-sectional study. J Obstet Gynaecol Res. 2014; 40 (1):200-7.
Información adicional
Cómo
citar: Mendoza L, Urdaneta J, Silva C, Maggiolo I, Baabel N, Mejía R. Virus de papiloma humano y lesión
intraepitelial cervical en adolescentes embarazadas. Rev Digit Postgrado. 2022; 11(1): e329. doi: 10.37910/RDP.2022.11.1.e329
Conflicto
de interés: los autores declaran no tener conflicto de interés.











