INTRODUCCIÓN
La aplasia medular pura de células rojas es un trastorno descrito por primera vez en 1922 por Kaznelson, se caracteriza por anemia con la ausencia casi completa de precursores de células rojas en la médula ósea, pero esencialmente con granulopoyesis y megacariopoyesis normal. El recuento de reticulocitos es bajo, mientras que el recuento de plaquetas, recuento de leucocitos y diferencial de leucocitos son normales.(1)
Puede estar causada por enfermedades virales, autoinmunes, varios tipos de neoplasias y por efecto de medicamentos. En la mitad de los casos no se logra identificar la causa y se clasifica como idiopática. La forma constitucional, mejor conocida como anemia de Diamond-Blackfan, puede ser congénita o hereditaria.(2)
La anemia de Diamond Blackfan es una ribosomopatía genética y clínicamente heterogénea, corresponde a un síndrome de insuficiencia de la médula ósea caracterizada por anemia, reticulocitopenia y la disminución de precursores eritroides en la médula ósea.(3)
CASO CLÍNICO
Se trata de lactante menor masculino de 2 meses de edad, cuya madre evidencia palidez cutánea mucosa progresiva asociada a hiporexia, por lo que decide acudir a centro de salud donde realizan paraclínicos evidenciando disminución de cifra de hemoglobina por lo que refieren a nuestro centro.
Producto de madre de 32 años de edad, quinta gesta, obtenido por cesárea segmentaria anterior a las 42 semanas por embarazo cronológicamente prolongado; peso y talla adecuada al nacer, egresa como recién nacido sano.
Al examen físico de ingreso presenta un peso de 4700 gramos y talla de 57 centímetros, con percentiles antropométricos dentro de la norma; clínicamente se evidencia paciente en malas condiciones generales, taquicardico, taquipneico con palidez cutáneo mucosa acentuada, llenado capilar en 5 segundos, con ruidos respiratorios presentes sin agregados y ruidos cardiacos rítmicos con soplo holosistólico grado III/VI, abdomen blando, deprimible con esplenomegalia Boyd I.
Se realizan paraclínicos que reportan leucopenia (Glóbulos blancos: 3.200/uL, Neutrófilos: 13,1%, Linfocitos: 85,5%, Monocitos: 1,4%), anemia macrocítica normocrómica (Hemoglobina: 1,7g/dL, Hematocrito: 7%, Volumen corpuscular medio: 122,8, Hemoglobina corpuscular media: 33) con contaje plaquetario en 161.000 y Reticulocitos en 1,3%; así mismo, se realiza química sanguínea que reporta bilirrubina total: 1mg/dL a expensas de bilirrubina indirecta, transaminasas dentro de límites normales y tiempos de coagulación sin alteraciones. Se realiza uroanálisis donde no existe evidencia de alteraciones.
Se decide ingresar con diagnóstico de Bicitopenia en estudio: Neutropenia afebril y Anemia macrocítica normocrómica. Se descarta hemoglobinopatías y enfermedades linfoproliferativas.
Se realiza frotis de sangre periférica donde se evidencia anisopoiquilocitosis, dacriocitos con esferocitos y esquistocitos, con serie megacariocítica y serie blanca sin alteraciones; en vista de hallazgos se programa para aspirado de médula ósea que reporta serie eritroide muy escasa, casi ausente con presencia de proeritroblastos aislados; serie mieloide presente con adecuada maduración; trombopoyesis presente, activa con megacariocitos en diversos estadíos de maduración y, serie linfoide presente a expensas de linfocitos maduros, acorde para la edad. Se concluye Aplasia medular congénita de serie roja posible Anemia de Diamond Blackfam en vista de hallazgos clínicos y hematológicos, pendiente resultado molecular.
Paciente que permanece hospitalizado durante 11 días, ameritando 4 transfusiones de concentrado globular para optimizar cifras de hemoglobina; así mismo se inicia tratamiento con Prednisolona a dosis de 20mg/Kg/día que se aumenta progresivamente a 30mg/Kg/día, se egresa con controles periódicos.
En vista de insuficiente respuesta al uso de esteroides se decide iniciar Eritropoyetina a 500 U/dosis semanal con disminución progresiva de corticoides hasta omitir. Se realiza ajuste progresivo de Eritropoyetina hasta cumplir actualmente 2000 U/dosis semanal.
Paciente que se mantiene en tratamiento con eritropoyetina a la dosis antes mencionada y quelantes de hierro, ameritando hasta la actualidad 16 transfusiones de concentrado globular durante 22 meses. Presenta discreta malformación craneofacial dado por macrocefalia, epicanto bilateral y protuberancia frontal; (Figura 1) (Figura 2) (Figura 3), así mismo se evidencia riesgo de talla baja, se plantea trasplante alogénico de células madre, realizándose estudios de compatibilidad a familiares de primer grado con resultado positivo.
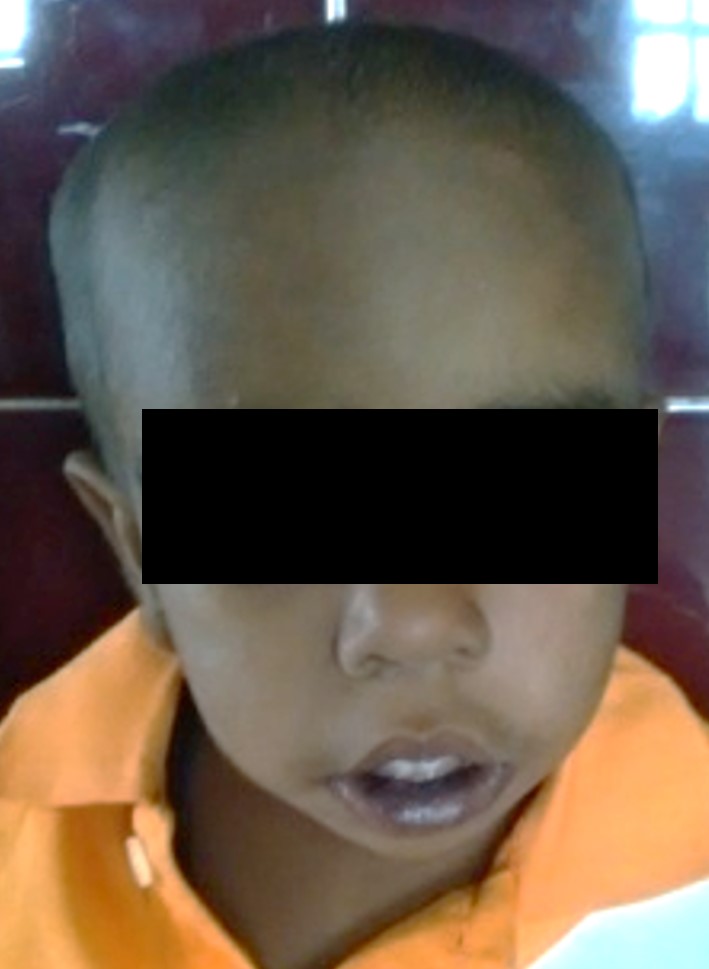 Figura 1
Presenta discreta
malformación craneofacial dado por macrocefalia, epicanto bilateral y
protuberancia frontal
Figura 1
Presenta discreta
malformación craneofacial dado por macrocefalia, epicanto bilateral y
protuberancia frontal
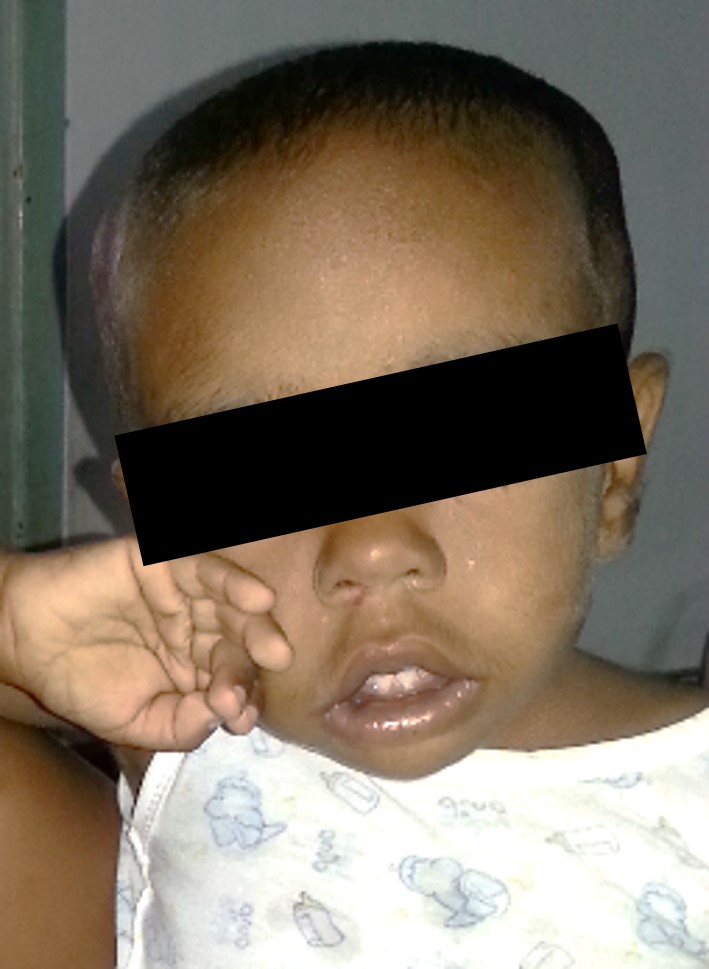 Figura
2
Presenta discreta malformación
craneofacial dado por macrocefalia, epicanto bilateral y protuberancia frontal
Figura
2
Presenta discreta malformación
craneofacial dado por macrocefalia, epicanto bilateral y protuberancia frontal
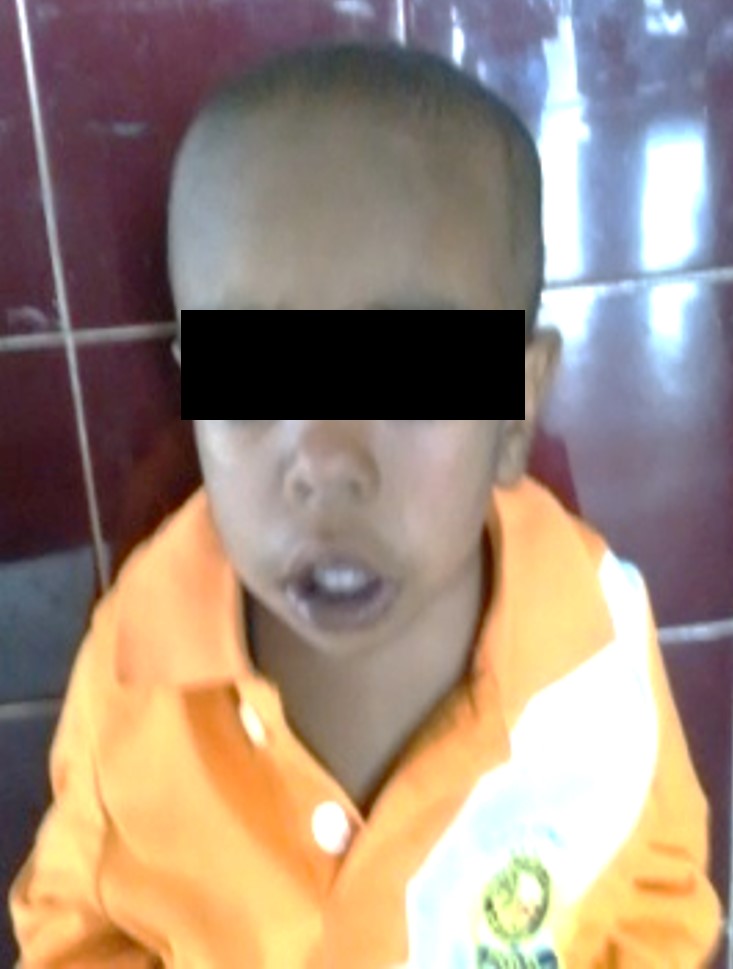 Figura
3
Presenta discreta malformación
craneofacial dado por macrocefalia, epicanto bilateral y protuberancia frontal
Figura
3
Presenta discreta malformación
craneofacial dado por macrocefalia, epicanto bilateral y protuberancia frontal
DISCUSIÓN
La anemia de Diamond-Blackfan (DBA) es un síndrome congénito representado por insuficiencia de la médula ósea, que se manifiesta por aplasia de células rojas de la sangre. La anemia macrocítica es una propiedad destacada de DBA. La enfermedad se caracteriza por retraso del crecimiento con presencia de diversas anomalías congénitas en aproximadamente el 40% de los pacientes, tales como malformación craneofacial, pulgar, riñón y corazón.(4,5)
Afecta alrededor de siete personas por cada millón de nacimientos vivos y por lo general se hace evidente en el primer año de vida.(5) Smetanina NS et al. evaluaron retrospectivamente los datos clínicos de 77 pacientes con DBA nacidos en la Federación Rusa desde 1993 a 2014; encontraron el ADN genómico de 57 pacientes con DBA en sus familiares de primer grado y concluyeron retrospectivamente que la anemia grave se presentó antes de los 8 meses de edad en los 77 pacientes (100%), antes de los 2 meses en 61 pacientes (78,2%) y antes de los 4 meses en 71 pacientes (92,2%).(6)
Inicialmente se estableció la hipótesis que la anemia podría ser debido a auto-anticuerpos, sin embargo en 1999, se demostró que las mutaciones en la proteína ribosómica S19 (RPS19) son la causa subyacente de DBA en el 25% de los pacientes. Desde entonces, la haploinsuficiencia de al menos 10 proteínas ribosomales diferentes se ha detectado en estos pacientes.(7)
La enfermedad se ha asociado con mutaciones o deleciones grandes en 11 genes de la proteína ribosomal, incluyendo rps7, RPS10, RPS17, RPS19, RPS24, RPS26, RPS29, RPL5, Rpl11, Rpl26 y RPL35A así como GATA1 en más del 50% de los pacientes. Sin embargo, la etiología molecular de muchos casos de DBA aún no se ha descubierto.(8)
Wang y Toki et al. realizaron todo el análisis de secuenciación del exoma de 48 pacientes documentados sin mutaciones/deleciones e identificaron una mutación de novo en RPL27 con error de empalme y eliminación del marco de lectura en RPS27(8); lo que traduce que su etiología molecular permanece en investigación.
Los corticosteroides y transfusiones de glóbulos rojos son los pilares de la terapia. Aproximadamente el 60-70% de los pacientes inicialmente responden a los corticosteroides, pero muchos pacientes desarrollan resistencia al tratamiento y requieren transfusiones a largo plazo o trasplante alogénico de células madres.(9)
Inicialmente, la respuesta a glucocorticoides sugirió que DBA era una enfermedad autoinmune, sin embargo investigaciones progresivas demuestran que los glucocorticoides pueden mejorar directamente el recuento de progenitores eritroides. Las hormonas glucocorticoides aumentan la proliferación de eritroblastos y mejoran el retardo de diferenciación en presencia de factor de células madres.(10,11)
Actualmente no hay manera confiable de predecir la capacidad de respuesta al uso de esteroides. Una vez que se inicia la terapia esteroidea, el aumento de la hemoglobina se observa en dos a cuatro semanas. La dosis se reduce progresivamente para determinar la dosis mínima necesaria para continuar la independencia de transfusión.(12)
De igual forma, el uso de eritropoyetina (EPO) fue el tratamiento lógico en el primer lugar, sin embargo se mantiene en estudio su efectividad, ya que los niveles séricos se mantienen normales en pacientes con diagnóstico de DBA;(12) este planteamiento se demostró en nuestro paciente, quien a pesar del uso de EPO, ameritando transfusiones sanguíneas con cierta frecuencia para optimizar los niveles de hemoglobina.
En los últimos años se han documentado nuevos conocimientos sobre el tratamiento y efectos secundarios a largo plazo en pacientes dependientes de transfusiones, siendo la hemocromatosis secundaria un importante problema médico.(9,10)
La supervivencia actual global para mayores de 40 años de edad es del 75%; 100% para los que están en remisión sostenida, el 86% para los pacientes en tratamiento con esteroides y 57% para pacientes dependientes de transfusiones. Existe una supervivencia estadísticamente significativa para los pacientes en tratamiento de mantenimiento con esteroides en comparación con los pacientes dependientes de transfusiones. Alrededor del 23% de todas las muertes por DBA reportadas en el Registro Americano están relacionadas con complicaciones debido a la sobrecarga de hierro.(10,11)
Los daños debidos a sobrecarga de hierro pueden ser importantes en anemias crónicas por lo que el uso apropiado y oportuno de quelantes de hierro es fundamental para evitar complicaciones. Contemplar el inicio de la terapia de quelación oportuna mejora sustancialmente la calidad de vida del paciente, además de que atenúa el riesgo de las probables complicaciones, motivos por los que es importante mantenerse alerta para identificar a los pacientes en los que, por su diagnóstico de base, es de esperarse la sobrecarga de hierro.(13)
Finalmente, el trasplante de médula ósea es la única cura definitiva en la DBA, pero este tratamiento sigue siendo asociado con riesgos y no siempre están disponibles donantes compatibles; en el caso de nuestro paciente se mantiene en espera de la realización del mismo ya que posterior a estudios se evidenció compatibilidad con hermano.
CONCLUSIONES
A pesar que la anemia de Diamond-Blackfan es un síndrome poco frecuente, debe plantearse ante lactante menor que presenta de forma progresiva, cifras bajas de hemoglobina ante ausencia de otras causas como infecciosas, linfoproliferativas o hemoglobinopatías.
El inicio oportuno de tratamiento con esteroides es fundamental para evitar en lo posible, la necesidad de transfusiones sanguíneas, pues los datos ponen de relieve el hecho que la sobrecarga de hierro en forma regular constituye una complicación grave.
Es imprescindible la realización de más estudios que evalúen la efectividad de otras opciones terapéuticas como el uso de EPO, para pacientes en cuyo caso es imposible realizar el trasplante alogénico de médula ósea.
Es importante el manejo integral por parte del médico pediatra pues por tratarse de trastornos poco frecuente no existe un protocolo claro y organizado para su estudio.
REFERENCIAS
1. Paul F. Review Pure red cell aplasia. British Journal of Haematology. 2008; 111: 1010-1022.
2. González P. Aplasia pura de serie roja. Rev Hematol. 2006; 7(3): 127-13.
3. Trautmann K. Eltrombopag fails to improve severe thrombocytopenia in late-stage dyskeratosis congenita and Diamond – Blackfa Anemia. Thromb Haemost. 2012; 108(2): 397-8.
4. Toki T, Ito E. Molecular mechanisms underlying the pathology of Diamond-Blackfan anemia. Rinsho Ketsueki – The Japanese Journal of Clinical Hematology. 2015; 56(7): 867-76.
5. Willig TN, et al. Diamond-Blackfan anemia. Current Opinion in Hematology. 2000; 7:85-94.
6. Smetanina N, Mersiyanova I, et al. Clinical and genomic heterogeneity of Diamond Blackfan anemia in the Russian Federation. Pediatr Blood Cancer. 2015; 62(9): 1597-600.
7. Gazda HT, et al. Frameshift mutation in p53 regulator RPL26 is associated with multiple physical abnormalities and a specific pre-rRNA processing defect in Diamond-Blackfan anemia. Human Mutation. 2012; 33:1037–1044.
8. Wang R, Yoshida K, Toki T, Shiraishi Y, Chiba K, et al. Loss of function mutations in RPL27 and RPS27 identified by whole-exome sequencing in Diamond-Blackfan anaemia. Br J Haematol. 2015; 168(6): 854-64.
9. Campagnoli M, Garelli E, Quarello P, et al. Molecular basis of Diamond-Blackfan anemia: New findings from the Italian registry and a review of the literature. Haematologica. 2004; 89:480–489.
10. Lipton J, Atsidaftos E, Zyskind I, Vlachos A. Improving clinical care and elucidating the pathophysiology of Diamond Blackfan anemia: An update from the Diamond Blackfan Anemia Registry. Pediatr Blood Cancer. 2006; 46: 558–564.
11. Roggero S, Quarello P, et al. Severe iron overload in Blackfan-Diamond anemia: A case-control study. Am J Hematol. 2009; 84:729–732.
12. Rastislav H, von Lindern M. Molecular mechanisms of pathology and treatment in Diamond Blackfan Anaemia. British Journal of Haematology. 2012; 159:514–527.
13. Domínguez-Rodríguez K, De la Vega L, Rodríguez-Alcocer A. Aplasia pura de serie roja en niña de la etnia mexicana rarámuri. Rev Hematol Mex. 2016; 17(3):225-228.
Información adicional
Cómo
citar: Planchet
J, Tovar M, Espinoza A, Díaz A. Aplasia medular congénita
de serie roja: Anemia de Diamond Blackfan. A propósito de un caso. Rev Digit Postgrado. 2022; 11(1): e327. doi: 10.37910/RDP.2022.11.1.e327
Conflicto
de interés: los
autores declaran no tener conflicto de interés.








