Evaluación de alternativas al Clorotalonil para el control de viruela del maní
Evaluation of alternatives to Clorothalonil for peanut leaf spot control
Ab intus FAV-UNRC, vol. 7, núm. 14, e0160, 2024
Universidad Nacional de Río Cuarto
Artículos
Recepción: 07 agosto 2024
Aprobación: 02 diciembre 2024

Resumen: Argentina es el principal exportador mundial de maní (Arachis hypogaea). La viruela (Passalora arachidicola-Nothopassalora personata) es la enfermedad foliar más importante en todo el mundo. El manejo, se realiza principalmente a través del control químico; siendo clorotalonil el fungicida más utilizado. Si bien su eficiencia es muy buena, en los últimos años ha sido prohibido en numerosos países, por lo que se planteó como objetivo, evaluar la eficacia de fungicidas multisitio en el control de viruela y el rendimiento de maní. En 2023/24, se realizaron dos ensayos, General Cabrera y Tosquita (Córdoba). En un DBCA con 4 repeticiones, se plantearon los tratamientos, 1- Testigo, 2- Clorotalonil(1500 cc ha-1), 4 aplicaciones (apl.); 3- Fluazinam(1000 cc ha-1), 4 apl.; 4- Cobre(2000 cc ha-1), 4apl., 5- Azoxistrobina+ciproconazole(500 cc ha-1)(1ºapl.) - clorotalonil(1500 cc ha-1)(2ºapl.) – pydiflumetofen+difenoconazole(700 cc ha-1)(3ºapl.), 6- Azoxistrobina+ciproconazole(500 cc ha-1)(1ºapl.) - fluazinam(2000 cc ha-1)(2ºapl.) - pydiflumetofen+difenoconazole(700 cc ha-1)(3ºapl.) y 7- Azoxistrobina+ciproconazole(500 cc ha-1)(1ºapl.) - cobre (2000 cc ha-1)(2ºapl.) - pydiflumetofen+difenoconazole(700 cc ha-1)(3ºapl.). La evaluación de viruela se realizó a través de incidencia ( y severidad (); y el rendimiento se estimó cosechando 2 m. por parcela; comparándose por ANAVA y test de Duncan (.<0,05). Los tratamientos con cobre y fluazinam, solos o en secuencias con fungicidas triazoles, estrobilurinas y carboxamidas, presentaron una performance similar a clorotalonil en el control de viruela y el rendimiento. Estos resultados muestran que estos fungicidas multisitio constituyen una excelente alternativa como reemplazo en caso de prohibirse este fungicida en nuestro país.
Palabras clave: Maní, Viruela, control, fungicidas, eficiencia, resistencia.
Abstract: Argentina is the leading exporter of peanut (Arachis hypogaea). Leaf spot ( Passaloraarachidícola-Nothopassalora personata), is the most important peanut disease worldwide. Management of this disease primarily relies on chemical control, with chlorothalonil being the most widely used fungicide. Although chlorothalonil has shown high efficacy, its use has been restricted in recent years. Therefore, the objective of this study was to evaluate the efficacy of alternative multisite fungicides for leaf spot control and peanut yield. During the 2023/24 growing season, two field trials were conducted in General Cabrera and Tosquita, Córdoba. It was followed a RCBD with four replicates. The treatments applied were: 1- Untreated control; 2- Chlorothalonil(1500 cc ha-1), 4 applications (app.); 3- Fluazinam(1000 cc ha-1), 4app.; 4- Copper(2000 cc ha-1), 4app.; 5- Azoxystrobin+cyproconazole (500 cc ha-1)(1stapp.) – chlorothalonil (1500 cc ha-1)(2ndapp.) – pydiflumetofen+difenoconazole(700 cc ha-1)(3thapp.); 6- Azoxystrobin+cyproconazole(500 cc ha-1)(1st app.) - fluazinam(2000 cc ha-1) (2ndapp.) - pydiflumetofen+difenoconazole(700 cc ha-1)(3thapp.) and 7- Azoxystrobin+cyproconazole(500 cc ha-1)(1stapp.) - copper(2000 cc ha-1) (2ndapp.) - pydiflumetofen+difenoconazole(700 cc ha-1)(3stapp.). Leaf spot was evaluated by measuring the incidence () and severity (). Moreover, peanut yield was estimated by harvesting 2 m² from each plot. Data were analyzed using ANOVA and compared by Duncan's test (p<0.05). Treatments with copper and fluazinam, both alone and in sequences with fungicides triazole, strobilurin, and carboxamide, showed similar performance to chlorothalonil in terms of leaf spot control and crop yield. These results suggest that such multisite fungicides could serve as effective substitutes in case chlorothalonil is restricted in Argentina.
Keywords: peanut, late leaf spot, control, fungicides, efficiency, resistance.
Introducción
El maní (Arachis hypogaea L.), es uno de los principales cultivos oleaginosos del mundo, con una producción global de 45,5 millones de toneladas (Arya et al., 2016; USDA, 2023). Los principales países productores son China, India y EE.UU.; sin embargo, como Argentina exporta casi la totalidad del maní producido, se ha consolidado como el principal exportador a nivel mundial para consumo directo o “maní confitería”, y aceite (Agüero, 2017). En el contexto nacional, Córdoba es la principal provincia productora, concentrando más del 74% de las explotaciones agropecuarias y, más del 90% de las empresas que componen el Sector Agroindustrial Manisero (SAGPyA, 2023).
La principal limitante de la producción de maní en Argentina son las enfermedades fúngicas (Andrés et al., 2016; Marinelli et al., 2017), siendo viruela causada por Passalora arachidicola (Hori) U. Braun (syn. Cercospora arachidicola Hori) y Nothopassalora personata (Berk. & M.A. Curtis) U. Braun, C. Nakash, Videira & Crous (syn. Cercosporidium personatum (Berk & M.A. Curtis) Deighton) la principal enfermedad foliar (Marinelli et al., 2017; Culbreath et al., 2019; Fulmer et al., 2019; Little, 2019). Su intensidad es muy variable de acuerdo a la localidad y campaña agrícola (Marinelli y March, 2005; Fulmer et al., 2019).
Los síntomas de esta enfermedad son manchas redondeadas de color marrón principalmente en los foliolos, aunque también se pueden observar en pecíolos, tallos y ginecóforos (Marinelli et al., 2017). La defoliación que se observa, posterior a la aparición de las manchas, es el síntoma que más se relaciona con la pérdida de rendimiento (Carley et al., 2009;Jordan et al., 2016). En Argentina, N. personata, es la especie de mayor presencia en las últimas campañas agrícolas (García et al., 2014; Woelke et al., 2015; Oddino et al., 2018; Giordano et al., 2021). El nivel de daño económico final de esta enfermedad es entre 10-13% de severidad (Cappiello et al., 2012), aunque puede ocasionar pèrdidas de cosecha superiores al 50% (Carley et al., 2009; Anco et al, 2019;).
La principal herramienta de manejo de la viruela en todo el mundo es el control químico (Woodward et al., 2013; Jordan et al., 2017; Marinelli et al., 2017). Desde la década de 1970 hasta 1990, el control químico se realizó principalmente con fungicidas protectores, siendo clorotalonil (FRAC, code M05) el producto más utilizado (Culbreath et al., 2019); y a partir de esa década se inicio el uso de los fungicidas triazoles (FRAC, code 3) (Culbreath et al., 2005). Luego de 10 años, se comenzaron a registrar pérdidas de eficacia delos fungicidas triazoles de mayor uso en este cultivo (Chapin y Thomas, 2006; Culbreath et al., 2018), reportándose en Argentina la misma pérdida de eficacia de estos productos (Oddino et al., 2016). Los fungicidas mesostémicos, como estrobilurinas (FRAC, code 11) y carboxamidas (FRAC, code 7), son los de más reciente introducción, mostrando muy buena eficiencia en el control de la enfermedad (Johnson y Cantonwine, 2013; Culbreath et al., 2016; 2018; Oddino et al., 2018).
Si bien hasta el momento se mantiene la eficacia de control de las estrobilurinas y las carboxamidas, al ser fungicidas específicos y de alto riesgo de resistencia (Bartlett et al., 2002; FRAC, 2021), existen elevadas probabilidades de aparición de subpoblaciones resistentes de P. arahidìcola y N. personata. Por esta razón, el clorotalonil, por sus propiedades de múltiples sitios de acción, sigue utilizándose con buena performance en todos los países productores de maní, en aplicaciones solo o combinado con fungicidas específicos (Hagan et al., 2007; Culbreath et al. 2012; Oddino et al., 2018).
Pese a la elevada eficacia de clorotalonil, desde que este fungicida se considera como probablemente cancerígeno (IARC, 1999; Costa y Aschner, 2014; Castro et al., 2022), se ha prohibido en muchos países del mundo (EFSA, 2017; European Commision, 2019; MAG, 2023), por lo que esimportante evaluar a otros fungicidas multisitio que puedan reemplazar este fungicida con la misma eficacia. Rossi et al. (2023) recientemente realizaron estudios con dodine, para reemplazar a clorotalonil; mientras que el fluazinam y el cobre, han sido señalados como fungicidas de buena eficiencia en el control de enfermedades foliares y por patógenos de suelo (Culbreath et al., 1992; Smith et al., 1992; Woodward et al., 2013; Woodward and Russell. 2015;). El fluazinam es un fungicida protector con actividad en múltiples sitios de acción de los patógenos (FRAC, code 29), y es utilizado en el control de enfermedades de maní, principalmente por patógenos de suelo como Sclerotinia sclerotiorum y Sclerotium rolfsii (Smith et al., 1992; Damicone and Jackson, 2001; Grichar and Woodward, 2016).
El cobre, es un fungicida de amplio espectro de control de patógenos, clasificado como protector en su relación con el vegetal y con múltiples sitios de acción sobre los patógenos (FRAC, code M01), siendo citado en otros países en el control de enfermedades foliares en maní (Culbreath et al., 1992; Cantonwine et al., 2008).
Considerando la importancia de contar con fungicidas de múltiples sitios de acción para el control de viruela del maní, se planteó como objetivo de este trabajo, evaluar alternativas al clorotalonil para el control de la viruela del maní y su efecto en el rendimiento.
Materiales y Métodos
En la campaña 2023/24, se realizaron dos ensayos en el área manisera de la provincia de Córdoba, uno en el área rural de General Cabrera (32º 49.00 S, 63º 51.24 O), y otro en un lote en el área rural de Tosquita (33º 44.04 S, 64º 24.19 O).
En cada localidad, se planteó el ensayo en un diseño en bloques completamente aleatorizados con 4 repeticiones. En la tabla 1 se muestran los tratamientos fungicidas realizados con sus dosis y aplicaciones en los ensayos.
El tamaño de cada parcela fue de 28 m2 (4 surcos de 10 m sembrados a 0,7 m entre hileras).La primera aplicación se realizó con la aparición de los primeros síntomas de la enfermedad, y las siguientes, separadas a diferentes intervalos según la residualidad de los fungicidas utilizados (14 días para clorotalonil, fluazinam y cobre, 21 días para azoxistrobina + ciproconazole y 30 días para pydiflumetofen + difenoconazole).
Las pulverizaciones se efectuaron con una mochila de gas carbónico con 6 picos a 35 cm de distancia, utilizando pastillas tipo cono hueco y con un volumen de 180 l/ha.
La evaluación de viruela del maní se realizó cada 15 días a partir de la aparición de los primeros síntomas de la enfermedad, identificando a través de la presencia del signo, el patógeno más prevalente (P.. N. personata). De cada tratamiento y repetición, se sacaron 5 ramas laterales donde se cuantificó la intensidad de la enfermedad. La misma se determinó a partir de los parámetros de incidencia (% de folíolos afectados), y severidad total (% de área foliar pérdida). Este último parámetro se calculó a partir de la siguiente fórmula; ST = ((1-D) * Sx) + D; donde ST: severidad total, D: defoliación y Sx: severidad promedio calculada a partir de una escala diagramática de severidad propuesta por Plaut y Berger (1980).
Para la evaluación de la producción, se efectuó la cosecha manual de 2 m. de cada tratamiento y repetición, separando las vainas del resto de la planta y al llegar a la humedad de cosecha, fueron trilladas para cuantificar rendimiento (kg/ha) y calidad según relación grano/caja (%) y granos tamaño confitería (%).
Para la comparación entre tratamientos, se consideraron los valores de incidencia final (%), severidad final (%), tasa de incremento (%), área bajo la curva de progreso de la enfermedad (ABCPE), rendimiento en vainas (kg ha-1), rendimiento en granos (kg ha-1), rendimiento en granos calidad confitería (kg ha-1), relación grano/caja (%) y granos tamaño confitería (%), a través de ANAVA y test de comparación de medias de Duncan (p<0,05) utilizando el programa Infostat (Di Rienzo et al., 2020),
Resultados
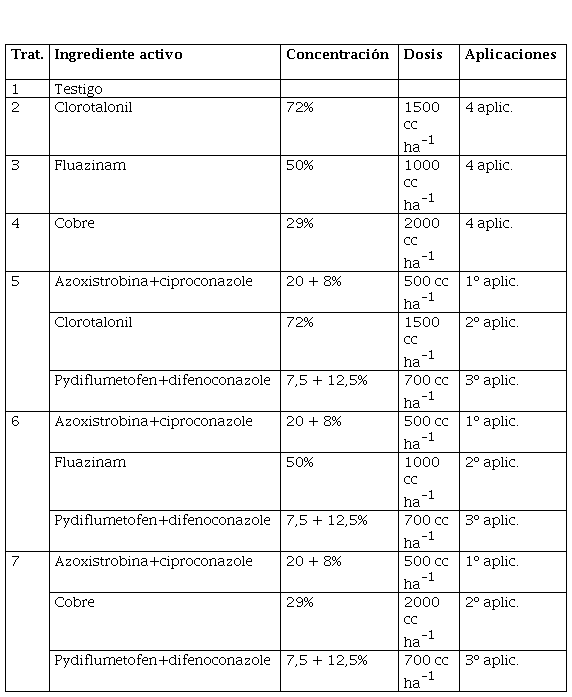
La enfermedad se presentó con elevada intensidad llegando a valores del 96% de incidencia y casi 80% de severidad en General Cabrera; mientras que en Tosquita los valores fueron de 92 y 57%, respectivamente.
En General Cabrera, todos los tratamientos fungicidas disminuyeron significativamente la incidencia final, severidad final y área bajo la curva de progreso de viruela con respecto al testigo, sin diferencias significativas entre ellos (Tabla 2). Los tratamientos de secuencias de fungicidas presentaron los menores valores de tasa de incremento de la enfermedad.
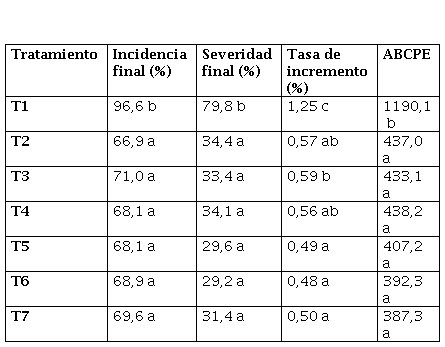
En la Tabla 3 se observa que en Tosquita, todos los tratamientos fungicidas disminuyeron la incidencia final y área bajo la curva de progreso de viruela con respecto al testigo, sin observarse diferencias significativas entre ellos. Los tratamientos de secuencias de fungicidas y el tratamiento de cobre presentaron los menores valores de severidad final y tasa de incremento de la enfermedad.
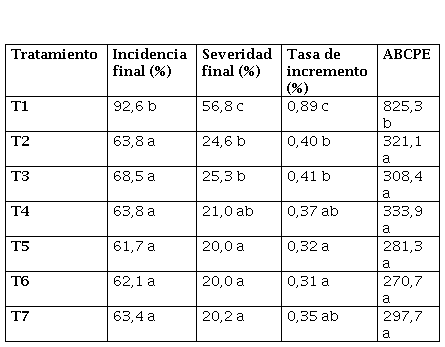
Debido a las condiciones climáticas del año, en ambos ensayos se registraron buenos valores de producción, llegando a valores superiores a los 3700 kg ha-1 de maní en vainas.
En la Figura 1 se observa que en General Cabrera, el testigo sin fungicidas presentó rendimientos más bajos que el resto de los tratamientos para los tres parámetros evaluados (Rendimiento en vainas, en granos y en granos tamaño confitería), pero sin registrarse diferencias significativas entre ellos.
Letras iguale sindican diferencias no significativas (p<0,05).
Por otro lado, no se registraron diferencias estadísticamente significativas entre tratamientos en los valores de relación grano/vaina y porcentaje de granos tamaño confitería (Figura 2).
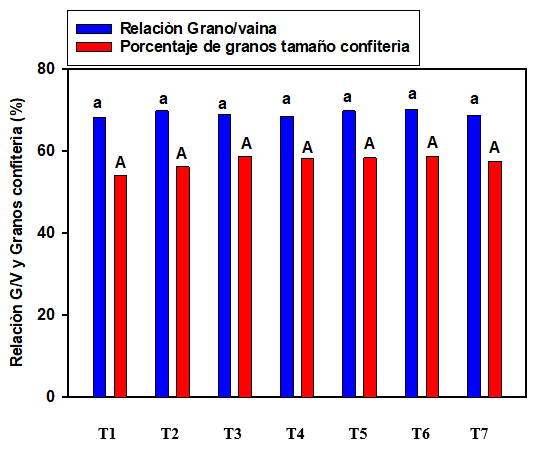
Letras iguales indican diferencias no significativas (p<0,05)
En el ensayo en Tosquita, la producción fue levemente superior a General Cabrera, con un rendimiento en vainas entre 3100 y 3750 kg ha-1, el rendimiento en granos entre 2100 y 2650 kg ha-1 y en la producción de granos tamaño confitería, los valores tuvieron un rango entre 1200 y 1550 kg ha-1.
Los tratamientos T2 y T5, presentaron los mayores valores de rendimiento en vainas, sin observarse diferencias estadísticas en los valores de rendimiento en granos y en granos tamaño confitería (Figura 3).
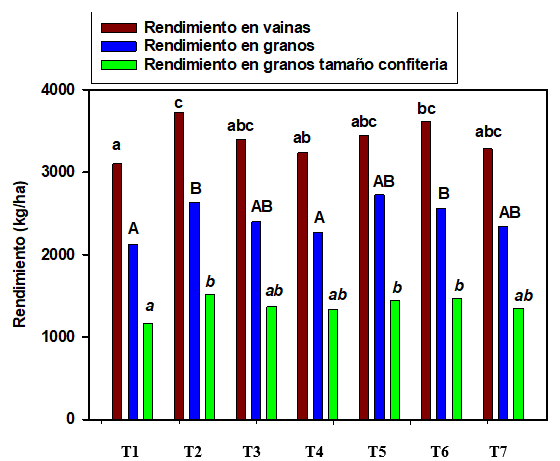
Letras iguales indican diferencias no significativas (p<0,05).
Al igual que lo observado en el ensayo de General Cabrera, en Tosquita no se registraron diferencias significativas entre tratamientos en los valores de relación grano/vaina; mientras que en el porcentaje de granos confitería, solo el tratamiento T5 se diferenció estadísticamente del Testigo (Figura 4).
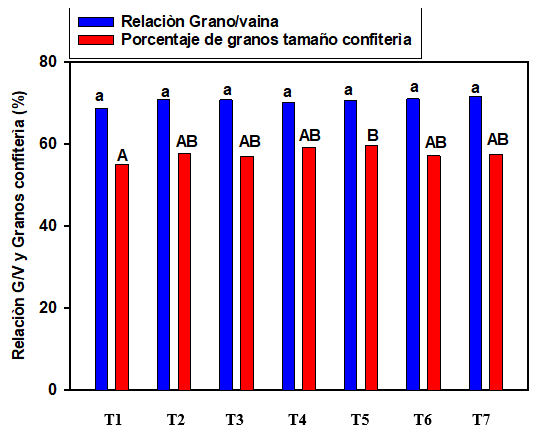
Letras iguales indican diferencias no significativas (p<0,05).
Discusión
En ambos ensayos la viruela del maní se presentó con alta intensidad, lo cual sucede normalmente en todas las regiones donde esta enfermedad se considera endémica (Gremillion et al., 2011; Andres et al., 2016; Marinelli et al., 2017; Culbreath et al., 2019; Fulmer et al., 2019; Little, 2019). Durante la última década, en varias campañas, esta enfermedad se presentó con elevada intensidad en muchos lotes de toda el área manisera (García et al., 2014; Woelke et al., 2015; Oddino et al., 2018), llegando a valores por encima del nivel de daño económico de la enfermedad, estimado entre 8 y 13% de severidad final (Cappiello et al., 2012). Este incremento también ha sido señalado en otros países productores (Fulmer et al., 2019; Little, 2019), llegando a producir importantes pérdidas de producción (Carley et al., 2009; Jordan et al., 2016; Anco et al., 2019). El agente causal que se presentó fue Nothopassalora personata; siendo esta especie, la de mayor presencia en Argentina en los últimos 20 años (Woelke et al., 2015; Oddino et al.; 2016; 2018; Giordano et al., 2021).
La intensidad de la enfermedad, en ambos ensayos, llegó al 90% de incidencia en el testigo sin tratar, lo que permite sacar conclusiones contundentes del efecto de los fungicidas en condiciones muy predisponentes para viruela (Marinelli et al., 2017; Oddino et al., 2018).
Todos los tratamientos disminuyeron la incidencia final, severidad final, tasa de incremento y área bajo la curva de progreso de viruela del maní con respecto al testigo sin tratar. Respecto a los tratamientos fungicidas, la aplicación de cobre y fluazinam, en aplicaciones solos o interviniendo en la secuencia con azoxistrobina+ciproconazole y pydiflumetofen+difenoconazole, mostraron una performance similar a clorotalonil en ambos ensayos. Este efecto puede deberse, a que estos fungicidas, al igual que clorotalonil, poseen múltiples sitios de acción sobre el patógeno, presentando escaso riesgo de resistencia y/o pérdida de eficiencia de control (FRAC, 2021). Además, es importante señalar que ambos productos tienen una residualidad de 14 días, lo que lleva a aplicaciones que van protegiendo las hojas nuevas a medida que se desarrolla el cultivo, condición indispensable debido a la falta de movimiento floemático que tienen los fungicidas (Siqueira de Acevedo, 2007). Este efecto ha sido mencionado en el área manisera por diferentes autores que observaron mayor eficiencia de control de la enfermedad con 4 o más aplicaciones de fungicidas para la viruela del maní (Lopez et al., 2014; Palacios et al., 2016; Oddino et al., 2018; Culbreath et al., 2019; Giordano et al., 2021).
Además de los fungicidas multisitio, también se observó una buena performance de aquellos tratamientos con secuencias de aplicaciones con fungicidas a base de triazoles, carboxamidas y estrobilurinas, lo cual ha sido señalado por diferentes autores a nivel mundial (Johnson y Cantonwine, 2013; Culbreath et al. 2016; 2018;) como también en la región manisera de Córdoba (Woelke et al., 2015; Oddino et al., 2018).
Estas mezclas tienen como objetivo, aprovechar el efecto curativo de los triazoles (Labrinos y Nutter, 1993), y la residualidad que otorgan las estrobilurinas y carboxamidas, con acción traslaminar (Barlett et al., 2002; Culbreath et al., 2016).
Si bien estos fungicidas demostraron muy buen comportamiento en el control de la enfermedad, el surgimiento de resistencias y/o pérdidas de eficacia, en bencimidazoles y triazoles (Chapin y Thomas 2006; Culbreath et al. 2018; Oddino et al., 2016), y las estrobilurinas y carboxamidas, ; es importante la rotación de fungicidas con distintos sitios de acción (Brent and Hollomon, 2007; Rotteveel et al., 2011; Klappach and Stammler, 2019); aunque en Argentina hasta el momento no hay evidencias de resistencias (Oddino et al., 2017; Monguillot et al., 2021)
El clorotalonil es el fungicida multisitio que más se utiliza en todos los países de producción de maní (Hagan et al., 2007; Culbreath et al., 2012, sin embargo, por su riesgo de prohibición, como ocurrió recientemente en Europa y países de América (EFSA, 2017; European Commision, 2019; MAG, 2023), es importante probar y desarrollar otros fungicidas con características similares (Rossi et al., 2023).
Los fungicidas, cobre y fluazinam, son utilizados en el control de enfermedades de maní en otros países (Culbreath et al., 1992; Smith et al., 1992; Damicone y Jackson, 2001; Cantonwine et al., 2008; Woodward et al., 2013; Woodward y Russell. 2015; Grichar y Woodward, 2016), demostrando en este trabajo una eficiencia similar a clorotalonil, por lo que constituyen una excelente alternativa como reemplazo en caso de prohibirse este fungicida en nuestro país.
Conclusiones
La viruela del maní se presentó con elevada intensidad en ambos ensayos lo que permite determinar correctamente la eficacia de los tratamientos fungicidas.
Los tratamientos con fluazinam y cobre presentaron eficiencia similar a clorotalonil, tanto en aplicaciones solos en todo el ciclo, como en la secuencia de tratamientos con otros fungicidas.
Estos fungicidas constituyen una alternativa para el reemplazo de clorotalonil en el control de viruela del maní.
Referencias bibliográficas
Agüero, D. (2017). Mercado internacional y nacional del maní. En: Fernandez, E.; Giayetto, O (eds). El cultivo de maní en Córdoba. Argentina, Ediciones Universidad Nacional de Río Cuarto, Córdoba, pp 411–433
Andrés J., Pastor N., Ganuza M., Rovera M., Reynoso M.M. and Torres A.M. (2016). Biopesticides: an eco- friendly approach for the control of soilborne pathogens in peanut. In: Singh DP, Singh HB, Prabha R (eds) Microbial inoculants in sustainable agricultural productivity. India: springer. Vol. 1: research perspectives. Springer, India, pp 161–179
Arya, S. S., Salve, A. R. and S. Chauhan. (2016). Peanuts as functional food: A review. Journal of Food Science and Technology. 53(1), 31– 41. https://doi.org/10.1007/s13197-015-2007-9
Bartlett, D.W., Clough, J.M.,Godwin, J.R., Hall, A.A.,Hamer, M. and R. Parr-Dobrzanski. (2002). The strobilurin fungicides. Pest Management Science. 58:649-662.
Brent, K.J. and D.W. Hollomon. (2007). Fungicide Resistance in Crop Pathogens: How Can it Be Managed? Fungicide Resistance Action Committee Monograph No. 1, 2nd revised ed. Croplife International, Brussels, p. 60.
Cantonwine, E., Culbreath, A., Shew, B.B. and M. Boudreau. (2008). Efficacy of organically aceptable fungicides for management of early and late leaf spot diseases in partially resistant peanut cultivars. Online. Plant Health Progress. doi: 10.194/PHP-2008-317-03-RS
Cappiello, F., March, G., Marinelli, A., García, J., Tarditi, L., D´Eramo, L., Ferrari, S., Rago, A. y C. Oddino. (2012). Producción de maní según intensidad de viruela (Cercosporidium personatum). Revista de Cultivos Industriales. Maní. Año 1. Nº3: 281-286. ISSN 1853-7677.
Carley, D., Jordan, D., Shew, B., Sutton, T., Dhamasri, C. and R. Branderburg. (2009). Influence of dipping date and fungicide program on canopy defoliation and pod yield of peanut (Arachis hypogaea). Peanut Science 6:77-84.
Castro M.S., Penha L.C., Torres T.A., Jorge, M.B., Carvalho-Costa, L.F. and G. Fillmann. (2022). Genotoxic and mutagenic effects of chlorothalonil on the estuarine fish Micropogonias furnieri (Desmarest, 1823). Environ Science Pollut Res. 29:23504–11. doi: 10.1007/s11356-021-17328-2
Chapin, J.W. and J.S. Thomas. (2006). Late leaf spot resistance to tebuconazole: responding to control failures, and implications for peanut disease management programs in South Carolina. Proc. Am. Peanut Res. Ed. Soc. 38, 54 (abstr.).
Costa L.G. and M. Aschner. (2014). Toxicology of Pesticides. Reference Module in Biomedical Sciences. Elsevier doi: 10.1016/B978-0-12-801238-3.00208-7
Culbreath, A.K., Brenneman, T. and C.K. Kvien. (1992). Use of a resistant peanut cultivar with copper fungicides and reduce fungicide applications for control of late leaf spot. Crop Protection 11: 361-365.
Culbreath A.K., Brenneman T.B., Kemerait R.C. and K.L. Stevenson. (2005). Relative performance of tebuconazole and chlorothalonil for control of peanut leaf spot from 1994 through 2004 (abstr.). Proceedings of American Peanut Research and Education Society 37:54–55
Culbreath, A.K., Brenneman, T.B., Kemerait, R.C. and K.L. Stevenson. (2012). Utility of tebuconazole for leaf spot management in fields with resistant populations of Cercospora arachidicolaor Cercosporidiumpersonatum. Proc. Am. Peanut Res. Educ. Soc. 44: 51–52 (abstr.).
Culbreath, A.K., Gevens, A.J. and K.L. Stevenson. (2018). Relative effects of demethylationinhibiting fungicides on late leaf spot of peanut. Plant Health Progress. 19: 23–26.
Culbreath, A.K., Brenneman, T.B., Kemerait, R.,C. Stevenson, K.L. and D. Anco. (2019). Combinations of elemental sulfur with demethylation inhibitor fungicides for management of late leaf spot (Nothopassalora personata) of peanut. Crop Protection 125. 104911. https://doi.org/10.1016/j.cropro.2019.104911.
Damicone, J.P. and K.E. Jackson. (2001). Effects of application methodand rate on control of Sclerotinia blight of peanut with iprodioneand fluazinam, Peanut Science. 28 (1): 28–33.
Di Rienzo J.A., Casanoves F., Balzarini M.G., Gonzalez L., Tablada M. y C.W. Robledo. (2020). InfoStat versión 2020. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina
EFSA. (2017). Peer review of the pesticide risk assessment of the active substance chlorothalonil. EFSA Journal. doi: 10.2903/j.efsa.2018.5126
European Commision. (2019). Commission Implementing Regulation (EU) 2019/677 of 29 April 2019 concerning the non-renewal of the approval of the active substance chlorothalonil, in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market, and amending Commission Implementing Regulation (EU) No 40/2011. Off. J. Eur. Union, 114: 15-17.
FRAC. (2021). Fungicide Resistance Action Committee. (Citado: 05/08/2021). Disponible en www.frac.info.
Fulmer, A.M., Mehra, L.K., Kemerait, R.C., Brenneman, T.B., Culbreath, A.K., Stevenson, K.L. and E.G. Cantonwine. (2019). Relating Peanut Rx risk factors to epidemics of early and late leaf spot of peanut. Plant Disease. 103: 3226–3233
García, J., Oddino, C., Ferrari, S., Déramo, L., Rago, A. y G. March. (2014). Estimación de producción en maní (Arachis hypogaea) según intensidad de la viruela (Cercosporidium personatum). Pag.Ep.- HyS 11, en Actas de Resúmenes 3° Congreso Argentino de Fitopatología. Tucumán. ISBN 978-987-24373-1-2
Giordano, D.F., Pastor, N., Palacios, S, Oddino C., and A. Torres. (2021). Peanut leaf spot caused by Nothopassalora personata. Tropical plant pathology. 46, 139–151. https://doi.org/10.1007/s40858-020-00411-3
Grichar, W. and J. Woodward. (2016). Fungicides and Application Timing for Control of Early Leafspot, Southern Blight, and Sclerotinia Blight of Peanut. International Journal of Agronomy. V2016:1-7. http://dx.doi.org/10.1155/2016/1848723
Hagan, A.K., Bowen, K.L., Campbell, H.L. and L. Wells. (2007). Calendar-based and AU-Pnuts advisory programs with pyraclostrobin and chlorothalonil for the control of early leaf spot and stem rot on peanut. Peanut Science. 34: 114-121.
IARC. (1999). Some chemicals that cause tumors of the kidney or urinary bladder in rodents and some other substances. ARC Monogr Eval Carcinog Risks Hum. 73:183–93.
Jonhson, R. and E. Cantowine. (2013). Post-infections activities of fungicides Cercospora arachidicola of peanut (Arachis hypogaea). Pest Management Science. 70(8): 1202-1206. doi: 10.1002/ps.3671.
Jordan, D., Shew, B. and P. Johnson. (2016). Response of the peanut (Arachis hypogaea) cultivar Gregory to interactions of dipping date and management disease. Advance Agriculture. 2016: 1-9.
Klappach, K. and G. Stammler. (2019). Resistance of plant pathogens to succinate dehydrogenase inhibitor (SDHI) fungicides (FRAC Code 7). In: Stevenson, K.L., McGrath, M.T., Wyenandt, C.A. (Eds.), Fungicide Resistance in North America, second ed. APS Press, St. Paul, MN, pp. 85–95
Labrinos, J.L. and F.W. Nutter. (1993) Effects of protectant versus systemic fungicide on disease components of peanut leaf spot. Plant Disease 77: 837-845.
Little, E.L. (2019). Georgia Plant Disease Loss. Annual Publication 102-10, Athens, GA, p. 21
MAG. (2023). Prohibición de clorotalonil en Costa Rica. Decreto 44280-S-MAG-MINAE. Ministerio de Agricultura y Ganaderia de Costa Rica.
Marinelli, A. y G.J. March. (2005). Viruela. En: March, G.J.; Marinelli, A. (eds) Enfermedades del maní en Argentina. Biblia impresores. 13-39.
Marinelli, A., Oddino C.M. y G. J. March. (2017). Enfermedades fúngicas del maní. En: Fernandez E, Giayetto O (eds). El cultivo de maní en Argentina. 2° Edición. Ediciónes UNRC. Córdoba, Argentina, pp 285-311. ISBN 978-987-42-3736-1
Monguillot, J.H, Lima, N.B., Paredes, J.A., Giordano, F., Oddino, C., Carmona, M. y C. Conforto. (2021). Inhibición de la biomasa: un método para evaluar la sensibilidad a fungicidas en aislamientos de Nothopassalorapersonata. Pág. C2-016. En Actas de Resúmenes V Congreso Argentino de Fitopatología y 59th Meeting of the Aps Caribbean Division. ISBN 978-987-24373-3-6
Oddino, C., Paredes, J., Faggio, P., Cazón, I., Bisonard, M., Rago, A. y J. Giuggia. (2016). Resistencia de Cercosporidium personatum: Avances en la evaluación in vitro de la eficiencia de diferentes grupos químicos en poblaciones del patógeno de distintos orígenes. Págs. 45-46, en Actas de resúmenes XXXI Jornada Nacional del Maní. Gral. Cabrera, Córdoba
Oddino, C., Giordano, F., Paredes, J., Cazón, L., Giuggia, J. y A. Rago. (2018). Efecto de nuevos fungicidas en el control de viruela del maní y el rendimiento del cultivo. Ab Intus (1):9-17. ISSN 2618-2734.
Plaut, J. and R. Berger. (1980). Development of Cercosporidium personatum in Three Peanut Canopy Layers. Peanut Science 7:1-11. doi: https://doi.org/10.3146/i0095-3679-7-1-11
Rossi, C., Culbreath, A., Brenneman, T., Tubbs, R., Anco, D., Vellidis G. and C. Pilon. (2023). Dodine as an alternative to chlorothalonil in the control of leaf spot diseases in peanut. Agronomy Journal. 116:202–216. DOI: 10.1002/agj2.21508
Rotteveel, T., Jorgensen, L.N. and U. Heimbach. (2011). Resistance management in Europe: a preliminary proposal for the determination of minimum number of active substances necessary to manage resistance. Bull OEPP/EPPO Bull 41: 432–438
SAGPYA. (2023). Secretaria de Agricultura, Ganaderia, Pesca y Alimentos. En: http://www.cba.gov.ar/reparticion/ministerio-de-agricultura-ganaderia-y-alimentos/ Consultado: 12-03-2024.
Siqueira de Azevedo, L. (2007). Fungicidas sistémicos, Teoría e Practica. 1º ed. Campinas: EMOPI. 284pp.
Smith, D., Phipps, P.M. and R. J. Stipes. (1992). Fluazinam: a new fungicide for control of Sclerotinia blight and other soilborne pathogens of peanut, Peanut Science, 19: 115–120.
Stevenson, K.L. and A.K. Culbreath.. (2006). Evidence for reduced sensitivity to tebuconazole in leaf spot pathogens. Proc. Am. Peanut Res. Ed. Soc. 38: 62 (abstr.).
USDA. (2023). United States Department of Agriculture. Peanut explorer. En: https://ipad.fas.usda.gov/cropexplorer/cropview/commodityView.aspx?cropid=2221000 Consultado el 10/05/2024.
Woelke, L., Bermudez , J., Castillo, M. y E. Romero. (2015). Carboxamidas. Rotación de principios activos en el control de la viruela del mani (Cercosporaarachidicola y Cercosporidium personatum). Págs. 87-88 en Actas de Resúmenes XXX Jornada Nacional del Maní. General Cabrera, Córdoba.
Woodward, J. and S. Russell. (2015). Managing sclerotinia blight in peanut: evaluation of a weather-based forecasting model to time fungicide applications in texas,” American Journal of Experimental Agriculture, vol. 9, no. 3, pp. 1–9.
Woodward, J., Brenneman, T.B. and R.K. Kemereit. (2013). Chemical control and peanut diseases: Targeting leaves, stems, roots, and pods foliar-applied fungicides. Chapter 3. In Fungicides: Showcase of integrated plant disease management from around the world (Mizuho Nita, ed.). pp. 55-76.

