INTRODUCCIÓN
La calidad del suelo es definida por su capacidad para funcionar en un marco de ecosistema natural o modificado, sostener la productividad vegetal y animal, mantener o mejorar la calidad de agua y aire, y contribuir a la salud humana y habitabilidad. La calidad del suelo está fuertemente influenciada por los procesos microbianos que en él ocurren, y éstos, relacionados con la diversidad; por tanto, es muy probable que el mantenimiento de la estructura de la comunidad microbiana tenga la capacidad de servir como indicador temprano y de gran sensibilidad de la degradación o empobrecimiento del suelo (Sudha et al., 2020; Kumar et al., 2019).
Por otro lado, los microorganismos aislados en laboratorio se obtienen directamente del ambiente natural y luego se cultivan en condiciones controladas en el laboratorio. Estos microorganismos pueden no estar tan adaptados como los comerciales para aplicaciones específicas, pero representan mejor la diversidad natural y pueden tener un potencial más amplio de degradación de diferentes tipos de materia orgánica debido a su diversidad genética inherente (Kumar et al., 2019).
Para demostrar cual es la eficiencia de los biofertilizantes, micorrizas nativas y comerciales en el desarrollo fenológico y en el rendimiento del cultivo de frijol y evaluar el grado de colonización de hongos micorrízicos en las raíces para comparar su relación con el de rendimiento del cultivo y determinar si la aplicación de biofertilizantes micorrízicos mejora el rendimiento y el desarrollo fenológico del cultivo, Urgiles & Aguilar (2023) realizó un proyecto de investigación en Loja, Provincia de Loja, Cantón Loja. Dónde obtuvo como resultado que la aplicación de biofertilizantes micorrízicos aumentó el rendimiento del cultivo en un 29 % en comparación al testigo y se observaron arbúsculos, vesículas, esporas e hifas en las raíces del cultivo (Urgiles & Aguilar, 2023).
Existen problemáticas para la recuperación de suelos y la mejora en la productividad de los cultivos con el uso de los microorganismos. Esta solución es posible si se planea con criterios de sostenibilidad, que involucren soluciones microbiológicas, con nuevos productos de menor o nulo impacto sobre el ambiente. La utilización adecuada de los microorganismos en la agricultura sostenible se ha descuidado debido a la falta de regulación y el uso indiscriminado de los mismos, por lo que es necesario conectar el uso de estos inoculantes microbianos con la mejora en la producción de alimentos, mediante la toma de acciones para utilizar, restaurar y preservar a los microorganismos como recurso genético (Cruz-Cárdenas et al., 2021).
Es importante evaluar el uso alternativo de microorganismos eficientes en la degradación y captación de nutrientes del suelo, ya que en la actualidad la contaminación del suelo es muy alta debido al uso indiscriminado de químicos inorgánicos que causar daños irreparables al medio ambiente y efectos negativos en la salud de las personas (Romero López & Vargas Mato, 2017). Se sabe que la simbiosis entre plantas, hongos y bacterias son importantes en la naturaleza, ya que se da el intercambio de nutrientes, agua, macro y micro elementos (Cruz-Cárdenas et al., 2021).
Este estudio se llevó a cabo con el objetivo de comparar la eficiencia de microorganismos comerciales y microorganismos aislados en laboratorio en la degradación de materia orgánica y su impacto en el crecimiento del cultivo de Phaseolus vulgaris (frijol común). Se evaluó específicamente la capacidad de estos microorganismos para promover el desarrollo del follaje y se analizó su importancia en la ecología del suelo. La pregunta central de esta investigación fue: ¿Cuál es la diferencia en la eficacia entre los microorganismos comerciales y los aislados en laboratorio en cuanto a la degradación de materia orgánica y la promoción del crecimiento en cultivos de Phaseolus vulgaris?
MATERIAL Y MÉTODOS
Área de estudio
La investigación se llevó a cabo durante el segundo semestre de 2023 en diversos semilleros ubicados en las comunidades de Boca Parita, Monagrillo y Chitré, en la provincia de Herrera, Panamá. Esta región es reconocida por su importancia agrícola, caracterizada por una variedad de cultivos y suelos fértiles (González et al., 2020). Según un estudio realizado por el Ministerio de Desarrollo Agropecuario de Panamá (MIDA, 2022), los suelos de esta zona presentan una alta concentración de nutrientes esenciales, lo que los convierte en un entorno ideal para la investigación agrícola. Además, Rodríguez y Martínez (2021) destacan que la diversidad edáfica de la región de Herrera ofrece condiciones óptimas para el estudio de interacciones entre microorganismos del suelo y cultivos diversos.
Método de análisis en laboratorio
El aislamiento de microorganismos se realizó a partir de muestras de suelo recolectadas en un cuadrante de 12 m² (3x4) en el Centro Regional Universitario de Azuero (CRUA). Para la obtención de las cepas, se utilizó la técnica de dilución seriada. Se tomó 1 g de suelo y se diluyó en 9 mL de agua destilada estéril. Luego, se realizaron dos diluciones para alcanzar una concentración final de 10-3. Se llevó a cabo la siembra selectiva de microorganismos específicos, incluyendo Rhizobium sp., Trichoderma sp. y hongos micorrízicos arbusculares (HMA), en medios de cultivo preparados con agar tripticasa de soya. Las placas se incubaron durante 24 horas a una temperatura constante de 32 °C. Tras el período de incubación, se tomaron muestras de las colonias de cada tipo de microorganismo y se realizó una dilución inicial en 50 mL de agua destilada estéril. Después de 24 horas, al observar turbidez indicativa de crecimiento microbiano, se añadieron 450 mL adicionales de agua destilada estéril a cada tratamiento, alcanzando un volumen final de 500 mL por muestra.
La Figura 1 presenta tres paneles relacionados con el proceso científico de manejo de muestras. Este procedimiento se ha replicado siguiendo protocolos estándar descritos en la literatura científica vigente para garantizar la reproducibilidad y fiabilidad de los resultados obtenidos.
 Figura 1
Proceso metodológico para el estudio microbiológico del suelo
Figura 1
Proceso metodológico para el estudio microbiológico del suelo
(A) recolección de muestras, (B) siembra de microorganismos y (C) preparación de tratamientos en condiciones estériles.
Aplicación de tratamientos
Una vez preparados los tratamientos, se aplicaron mediante aspersores específicos para cada tipo de microorganismo, incluyendo un control y una mezcla combinada (mix). El mix se compuso de partes iguales de cada microorganismo, es decir, 33,33 % de cada uno de los tres tipos estudiados (Rhizobium sp., Trichoderma sp. y hongos micorrízicos arbusculares).
La inoculación de las semillas se realizó mediante un régimen de riego intermitente, que consistió en dos días de aplicación del tratamiento seguidos por un día de descanso. Durante los días de descanso, se mantuvo una hidratación mínima con agua destilada para evitar la desecación del sustrato. Este protocolo se diseñó para optimizar la absorción y fijación de los microorganismos tanto al sustrato como al sistema radicular en desarrollo de las plantas.
La aplicación de los tratamientos comenzó 8 días después de la siembra, permitiendo que las semillas germinaran y se establecieran adecuadamente en el sustrato. Inicialmente, el riego con los tratamientos se realizó cada 3 días, ajustándose según las necesidades de las plantas.
A los 13 días post-siembra, debido al incremento en los requerimientos hídricos y nutricionales de las plantas, se realizó el trasplante de las bandejas a vasos de espuma de poliestireno de 12 onzas. En esta etapa, se implementó un régimen de riego diario. Cada tratamiento se aplicó a un total de 30 plantas, distribuidas en tres siembras de 10 plantas cada una, asegurando una muestra representativa para el estudio.
En la Figura 2, se muestra las diferentes etapas del proceso experimental, desde la siembra de las semillas hasta la evaluación final del crecimiento y desarrollo de las plantas de Phaseolus vulgaris comúnmente conocida como frijol, bajo los diferentes tratamientos microbianos.
 Figura 2
Etapas del proceso experimental con Phaseolus vulgaris
Figura 2
Etapas del proceso experimental con Phaseolus vulgaris
(2A) siembra de los porotos, (2B) germinación de las semillas, (2C) transporte de las bandejas a vasos, (2D) aplicación de los tratamientos, (2E) peso húmedo y (2F) medición del peso seco de las plantas.
En la Figura 3, se muestra las etapas finales del proceso experimental con Phaseolus vulgaris comúnmente conocida como frijol., donde se observa la floración de una planta tratada con la mezcla de microorganismos y el trasplante de las plántulas a parcelas experimentales para evaluar su crecimiento en condiciones más cercanas a las del campo.
 Figura 3
Etapas finales del proceso experimental con Phaseolus vulgaris
Figura 3
Etapas finales del proceso experimental con Phaseolus vulgaris
(3A) floración de Phaseolus vulgaris con la aplicación del mix de microorganismos y (3B) transplante a parcelas de Phaseolus vulgaris.
Análisis estadístico
Se comprobó la normalidad de los datos utilizando el método de Shapiro-Wilk. Para el análisis estadístico, se realizó la prueba de Kruskal-Wallis, que es una prueba no paramétrica basada en el rango. Esta prueba se utiliza para corroborar si existen diferencias estadísticamente significativas entre 2 o más grupos de una variable independiente en una variable dependiente ordinal o continua. La elección de esta prueba se debe a que no se asume una distribución normal de los datos, lo que la hace adecuada para este tipo de análisis. Todos estos análisis se realizaron con el software BioEstat versión 5.0 (Ayres et al., 2007).
Para determinar qué microorganismos eran más eficientes en promover el crecimiento del cultivo de Phaseolus vulgaris, se realizaron mediciones del largo del tallo. Estas mediciones se llevaron a cabo a los 30, 37 y 45 días después de la siembra, correspondientes a las semanas 5, 6 y 7 del ciclo de cultivo. Este período representa la fase de crecimiento vegetativo activo del frijol común, permitiendo una evaluación precisa del efecto de los diferentes tratamientos microbianos sobre el desarrollo de la planta.
RESULTADOS
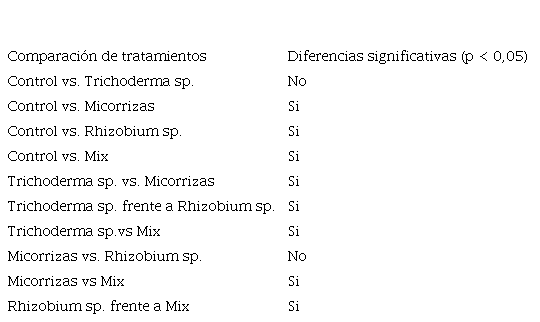
La comparación se realizó para determinar qué tratamiento conduce a un aumento significativo en la cantidad de hojas y el tamaño del tallo en plantas de Phaseolus vulgaris. La Tabla 1 presenta una comparación de diferentes tratamientos con microorganismos en términos de su impacto en la cantidad de hojas de las plantas. Los tratamientos incluyeron microrganismos Trichoderma sp, micorriza, Rhizobium sp y una mezcla de estos. La tabla indica si las diferencias entre los tratamientos son estadísticamente significativas (p < 0,05).
Tabla 1
Diferencias significativas en la cantidad de hojas entre tratamientos con microorganismos. La significancia estadística se evaluó mediante pruebas de comparación de medios (p. ej., ANOVA, prueba t) con un nivel de confianza del 95 % (p < 0, 05)
|
Comparación de tratamientos
|
Diferencias significativas (p < 0,05)
|
|
Control vs. Trichoderma sp.
|
No
|
|
Control vs. Micorrizas
|
Si
|
|
Control vs. Rhizobium sp.
|
Si
|
|
Control vs. Mix
|
Si
|
|
Trichoderma sp. vs. Micorrizas
|
Si
|
|
Trichoderma sp. frente a Rhizobium sp.
|
Si
|
|
Trichoderma sp.vs Mix
|
Si
|
|
Micorrizas vs. Rhizobium sp.
|
No
|
|
Micorrizas vs Mix
|
Si
|
|
Rhizobium sp. frente a Mix
|
Si
|
Se pudo apreciar que los tratamientos con Rhizobium sp. y Mix presentaron diferencias significativas. Esto está respaldado por estudios recientes que han demostrado que la inoculación con Rhizobium sp. puede tener un impacto significativo en el crecimiento de las plantas, incluyendo un aumento en la cantidad de hojas (Zhant et al., 2023). Además, se ha encontrado que la utilización de una mezcla de microorganismos puede tener un efecto sinérgico, resultando en un mayor crecimiento de las plantas en comparación con el uso de un solo tipo de microorganismo (Santos et al., 2022).
La Tabla 2 presenta una comparación de diferentes tratamientos con microorganismos en términos de su impacto en el crecimiento de las plantas. Los tratamientos incluyen control, Trichoderma sp, micorrizas, Rhizobium sp y una mezcla de estos. La tabla indica si las diferencias entre los tratamientos son estadísticamente significativas (p < 0,05).
Tabla 2
Diferencias significativas en el crecimiento de las plantas entre tratamientos con microorganismos. La significancia estadística se evaluó mediante pruebas de comparación de medios (p. ej., ANOVA, prueba t) con un nivel de confianza del 95% (p < 0, 05).

|
Comparación de tratamientos
|
Diferencias significativas (p < 0,05)
|
|
Control vs. Trichoderma sp
|
No
|
|
Control vs. Micorrizas
|
Si
|
|
Control vs. Rhizobium sp.
|
Si
|
|
Control vs. Mix
|
Si
|
|
Trichoderma sp vs. Micorrizas
|
Si
|
|
Trichoderma sp frente a Rhizobium sp.
|
Si
|
|
Trichoderma sp versus Mix
|
Si
|
|
Micorrizas vs. Rhizobium sp.
|
No
|
|
Micorrizas vs Mix
|
Si
|
|
Rhizobium sp. frente a Mix
|
Si
|
Se puede apreciar que los tratamientos con Rhizobium sp y Mix presentan diferencias significativas. Esto está respaldado por estudios recientes que han demostrado que la inoculación con Rhizobium sp puede tener un impacto significativo en el crecimiento de las plantas, incluyendo un aumento en la cantidad de hojas (Santos et al., 2022). Además, se ha encontrado que la utilización de una mezcla de microorganismos puede tener un efecto sinérgico, resultando en un mayor crecimiento de las plantas en comparación con el uso de un solo tipo de microorganismo (Korir et al., 2017).
La Tabla 3 muestra los resultados de peso húmedo y seco de las plantas de Phaseolus vulgaris sometidas a diferentes tratamientos microbianos. Aunque el peso seco no varió significativamente entre los tratamientos, el tratamiento con la mezcla de microorganismos (Mix) mostró el mayor peso húmedo, lo que sugiere un mayor contenido de agua en los tejidos de las plantas.
Tabla 3. Peso húmedo y seco de plantas de Phaseolus vulgaris bajo diferentes tratamientos microbianos.
Tabla 3
Peso húmedo y seco de plantas de Phaseolus vulgaris bajo diferentes tratamientos microbianos.

|
Microorganismo
|
Peso húmedo (g)
|
Peso seco (g)
|
|
Control
|
4
|
2
|
|
Rhizobium sp.
|
8
|
2
|
|
Micorrizas
|
6
|
2
|
|
Trichoderma sp
|
8
|
2
|
|
Mix
|
9
|
2
|
DISCUSIÓN
En el estudio realizado, se observó que el tratamiento con una mezcla de microorganismos fue el más efectivo para el crecimiento de las plantas, evidenciando diferencias significativas en comparación con otros tratamientos. Este hallazgo es consistente con la investigación de Babu et al. (2015), que indica que los biofertilizantes mixtos mejoran la biomasa de las plantas y la absorción de nutrientes, especialmente cuando se aplican en combinación.
El tratamiento con Rhizobium sp. también demostró ser efectivo, sin diferencias significativas en comparación con la mezcla de microorganismos. Verma et al. (2010) reconocen a Rhizobium sp. como un agente promotor del crecimiento vegetal. Moreno et al. (2018) destacan que el uso de PGPR como inoculante es una estrategia sostenible para incrementar la producción agrícola, dependiendo de su producción, formulación y almacenamiento adecuados.
La aplicación de micorrizas resultó ser efectiva, en línea con lo reportado por Wolfe (2021), quien señala que las leguminosas se asocian con Micorrizas para la fijación de fósforo. Los cultivos tratados con Rhizobium sp, micorrizas, Trichoderma sp y la mezcla de microorganismos crecieron sanos y libres de plagas, lo cual concuerda con Madhaiyan et al. (2013), que describen los beneficios de los microorganismos eficientes en la estimulación del desarrollo radicular y la mejora en la nutrición debido a la solubilización de nutrientes como el fósforo (P) y el potasio (K), así como la fijación de nitrógeno atmosférico (N₂).
En cuanto al tratamiento con Trichoderma sp, aunque no fue el más efectivo en este estudio, Puyam (2016) sugieren que es más efectivo en cultivos como el tomate, algodón, trigo, tabaco, caña de azúcar, plátano, chiles, papa, cítricos, coliflor, cebolla y girasol.
CONCLUSIONES
Este estudio demostró que la aplicación de microorganismos como biofertilizantes tiene un impacto significativo en el crecimiento y peso húmedo de Phaseolus vulgaris. El tratamiento más efectivo fue la mezcla de microorganismos (incluyendo Rhizobium sp y micorrizas), que promovió un mayor crecimiento y peso húmedo en comparación con los tratamientos individualesl. Este resultado sugiere un efecto sinérgico entre los diferentes microorganismos, mejorando la absorción y retención de agua, así como la nutrición de las plantas.
Aunque el tratamiento con Rhizobium sp. no mostró diferencias significativas con la mezcla, sus resultados sugieren que puede ser una alternativa viable para mejorar el crecimiento de Phaseolus vulgaris en condiciones específicas. Por otro lado, aunque Trichoderma sp. no fue el más efectivo en este estudio, su potencial para mejorar el crecimiento en otros cultivos ha sido documentado, indicando que su eficacia puede variar según la especie vegetal y las condiciones ambientales.
Estos hallazgos resaltan la importancia de considerar el uso de microorganismos como una estrategia sostenible para mejorar la productividad agrícola y reducir el impacto ambiental de los fertilizantes químicos. No obstante, se requiere más investigación para comprender las interacciones entre microorganismos y plantas, y optimizar las condiciones de aplicación de los biofertilizantes.
LITERATURA CITADA
Ayres, M., & Junior Ayres, M. (2000). BioEstat 2.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. In BioEstat 2.0: aplicações estatísticas nas áreas das ciências biológicas e médicas (pp. xii-259).
Babu, S., Prasanna, R., Bidyarani, N., Nain, L., & Shivay, Y. S. (2015). Synergistic action of PGP agents and Rhizobium spp. for improved plant growth, nutrient mobilization and yields in different leguminous crops. Biocatalysis and Agricultural Biotechnology, 4(4), 456-464.
Cruz-Cárdenas, C. I., Zelaya Molina, L. X., Sandoval Cancino, G., de los Santos Villalobos, S., Rojas Anaya, E., Chávez Díaz, I. F., & Ruíz Ramírez, S. (2021). Utilización de microorganismos para una agricultura sostenible en México: consideraciones y retos. Revista mexicana de ciencias agrícolas, 12(5)1.
González, A., Pérez, M., & Sánchez, L. (2020). Caracterización agrícola de la provincia de Herrera, Panamá. Revista Panameña de Agronomía, 15(3), 78-95.
Korir, H., Mungai, N. W., Thuita, M., Hamba, Y., & Masso, C. (2017). Co-inoculation effect of rhizobia and plant growth promoting rhizobacteria on common bean growth in a low phosphorus soil. Frontiers in plant science, 8, 141.
Kumar, M., Leo, J., Parsia, B., Sattler, U., & Al-Emari, S. (2019). A Systematic Review of Automatic Question Generation for Educational Purposes. International Journal of Artificial Intelligence in Education, 30, 121–204.
Madhaiyan, M., Peng, N., Te, N. S., Hsin I, C., Lin, C., Lin, F., & Ji, L. (2013). Improvement of plant growth and seed yield in Jatropha curcas by a novel nitrogen-fixing root associated Enterobacter species. Biotechnology for biofuels, 6, 1-13.
Ministerio de Desarrollo Agropecuario de Panamá [MIDA]. (2022). Informe técnico sobre la calidad de suelos agrícolas en la provincia de Herrera. Gobierno de Panamá.
Moreno Reséndez, A., Carda Mendoza, V., Reyes Carrillo, J. L., Vásquez Arroyo, J., & Cano Ríos, P. (2018). Rizobacterias promotoras del crecimiento vegetal: una alternativa de biofertilización para la agricultura sustentable. Revista Colombiana de Biotecnología, 20(1), 68-83.
Puyam, A. (2016). Advent of Trichoderma as a bio-control agent-a review. Journal of Applied and Natural Science, 8(2), 1100-1109.
Romero López, T. de J., & Vargas Mato, D. (2017). Uso de microorganismos eficientes para tratar aguas contaminadas. Ingeniería Hidráulica y Ambiental, 38(3), 88-1002.
Rodríguez, J., & Martínez, E. (2021). Diversidad edáfica y su impacto en la investigación agrícola: caso de estudio en la región de Herrera. Suelos y Ecosistemas, 8(2), 112-130
Santos Sousa, W., Soratto, R. P., Peixoto, D. S., Campos, T. S., da Silva, M. B., Souza, A. G. V., ... & Gitari, H. I. (2022). Effects of Rhizobium inoculum compared with mineral nitrogen fertilizer on nodulation and seed yield of common bean. A meta-analysis. Agronomy for Sustainable Development, 42(3), 52.
Sudha, G., Barik, A., Sen, S. K., & Raut, S. (2020). Degradation of dyes by fungi: an insight into mycoremediation. Journal of Biotechnology, Computational Biology and Bionanotechnology, 102(4), 445–455.
Urgiles Gómez, N. de J., & Aguilar Asanza, J. C. (2023). Evaluación de biofertilizantes de micorrizas nativas y comerciales en el cultivo de fréjol (Phaseolus vulgaris L.), en la quinta experimental la Argelia. Loja, Ecuador. Universidad Nacional de Loja.
Verma, J. P., Yadav, J., Tiwari, K. N., & Lavakush Singh, V. (2010). Impact of plant growth promoting rhizobacteria on crop production. International Journal of Agricultural Research, 5(11), 954-983.
Wolfe, E. R. (2021). Microbes on the Mountain: Plant–Microbe Associations and Interactions on Mount St. Helens (Doctoral dissertation, Portland State University).
Zhang, J., Wang, N., Li, S., Wang, J., Feng, Y., Wang, E., ... & Chen, W. (2023). The effect of different rhizobial symbionts on the composition and diversity of rhizosphere microorganisms of chickpea in different soils. Plants, 12(19), 3421











