INTRODUCCIÓN
La evaluación del crecimiento de Phaseolus sp. utilizando bioestimulantes es esencial debido a la creciente demanda de métodos agrícolas sostenibles (Rouphael & Colla, 2020). El uso de microorganismos como Trichoderma sp. y microorganismos de montaña ha mostrado resultados prometedores en la mejora del crecimiento de plantas, la fertilidad del suelo y la productividad de los cultivos (Backer et al., 2018). Es importante destacar que estos microorganismos no actúan como fertilizantes tradicionales, sino como bioestimulantes (Du Jardin, 2015).
A diferencia de los fertilizantes, que aportan directamente nutrientes asimilables por las plantas, los bioestimulantes microbianos actúan mejorando la capacidad de la planta para absorber y utilizar los nutrientes ya presentes en el suelo (Yakhin et al., 2017). Los mecanismos de acción de estos bioestimulantes incluyen: a) solubilización de nutrientes, los microorganismos secretan ácidos orgánicos y enzimas que ayudan a liberar nutrientes fijados en el suelo, haciéndolos más accesibles para las plantas (Alori et al., 2017); b) mejora de la arquitectura radicular al estimular el desarrollo de raíces más extensas y ramificadas, aumentando la superficie de absorción de nutrientes y agua (López-Bucio et al., 2015); c) producción de fitohormonas, las cuales promueven el crecimiento vegetal, como auxinas, citoquininas y giberelinas (Gouda et al., 2018); d) inducción de resistencia sistémica, al activar los mecanismos de defensa naturales de las plantas contra patógenos y estrés abiótico (Pieterse et al., 2014); y e) mejora la estructura del suelo, contribuyendo a la formación de agregados del suelo, mejorando su aireación y retención de agua (Rillig et al., 2015). Estos mecanismos convierten a los bioestimulantes microbianos en herramientas valiosas para la agricultura sostenible, optimizando el uso de recursos y reduciendo la dependencia de insumos químicos (Calvo et al., 2014; Campos et al., 2019).
El frijol o poroto (Phaseolus sp.), es un cultivo de gran importancia económica, social y cultural en todo el mundo, especialmente en regiones como Panamá, donde se cultiva a elevaciones entre 500 y 1.150 metros sobre el nivel del mar. Las temperaturas óptimas para su crecimiento oscilan entre 13 °C y 25 °C; con temperaturas más altas se presenta mayor crecimiento vegetativo y aborto de flores, afectando negativamente el rendimiento. Además, requiere suelos con alto contenido de materia orgánica, buena permeabilidad y drenaje adecuado para prosperar (Rodríguez et al., 1997; Döbereiner, 1997). Este estudio evalúa el efecto de la aplicación de Trichoderma sp., microorganismos de montaña y su combinación en la mejora del crecimiento y la salud de las plantas de Phaseolus sp. en condiciones controladas. Al comprender estos efectos, podemos desarrollar prácticas agrícolas más efectivas y sostenibles que promuevan mayores rendimientos y reduzcan el impacto ambiental.
MATERIALES Y MÉTODOS
Aislamiento de microorganismos de montaña (MM)
Los microorganismos de montaña (MM) se obtuvieron de una muestra de suelo recolectada en la región de los Andes en Panamá a una altitud de 2.500 msnm. La muestra fue colectada utilizando herramientas estériles y almacenada en bolsas de polietileno selladas para evitar la contaminación. Posteriormente, las muestras fueron mantenidas a 4 °C hasta su procesamiento en el laboratorio.
Para la obtención de las cepas, se utilizó la técnica de dilución seriada. Se tomó 1 g de suelo y se diluyó en 9 mL de agua destilada estéril. Luego, se realizaron dos diluciones para alcanzar una concentración final de 10-3. La suspensión se sembró en placas con agar Antibiotic medium 2 (Difco, BD) seleccionado por su especificidad, lo que permite la selección y caracterización de bacterias resistentes a antibióticos (Cappuccino & Sherman, 2014). Las placas se incubaron durante tres días a temperatura ambiente.
Para la caracterización y cuantificación de las colonias, se utilizó la tinción de Gram. Se observaron cocos Gram+ en disposiciones de cadenas cortas, posiblemente una cepa de Micrococcus, aunque es probable que existan múltiples cepas dentro de los MM debido a la diversidad microbiana del suelo de montaña (Atlas & Bartha, 1998). En la Figura 1 se muestran las diferentes etapas del proceso de aislamiento y caracterización de las cepas microbianas utilizadas en el estudio.
 Figura 1
Proceso de aislamiento y tinción de las cepas microbianas
Figura 1
Proceso de aislamiento y tinción de las cepas microbianas
(A) Preparación del área de trabajo para el aislamiento de microorganismos. (B) Placa de agar con Trichoderma sp. (C) Tubos con muestras de microorganismos de montaña. (D) Observación microscópica de una lámina teñida.
Aislamiento de Trichoderma sp.
La cepa de Trichoderma sp. se obtuvo de una muestra esporulada recolectada de suelos agrícolas en la región central de Panamá. La muestra madre fue diluida utilizando la técnica de dilución seriada para alcanzar una concentración de 10-3. La suspensión se sembró en placas con agar TSA (Tryptic Soy Agar) acidificadas con ácido tartárico a pH 5,5, lo que favorece el crecimiento rápido de hongos.
Las placas se incubaron durante tres días a temperatura ambiente, tras lo cual se cuantificaron las colonias. Para la caracterización de Trichoderma sp., se utilizó la tinción con azul de metileno, permitiendo una mejor visualización de las estructuras esporuladas (Gams & Bissett, 1998).
Siembra de semillas
Se utilizaron bandejas de germinación de 24 pocillos, con sustrato de coco, en las cuales se sembraron 2 granos de Phaseolus sp. por pocillo, dando un total de 144 semillas por cada tratamiento (Figura 2). Se utilizó un control (solo regado con agua destilada estéril) y 3 bandejas réplicas para cada grupo: Trichoderma sp., microorganismos de montaña y una mezcla de ambos (Trichoderma sp. + microorganismos de montaña).
 Figura 2
Sustratos y bandejas utilizadas en el experimento de crecimiento de plántulas de Phaseolus sp
Figura 2
Sustratos y bandejas utilizadas en el experimento de crecimiento de plántulas de Phaseolus sp
(A) Bolsas de sustrato de coco marca "Aboquete". (B) Bandejas de germinación de 24 pocillos.
La concentración de los microorganismos se estableció previamente, basándose en estudios reportados en la literatura que recomiendan una concentración de 10-6 esporas*mL-1 para Trichoderma sp. y 10. UFC/mL para microorganismos de montaña (Harman, 2000; Bashan et al., 2014). El mix se preparó añadiendo partes iguales de cada tratamiento, se mezclaron 50 mL de la solución de Trichoderma sp. con 50 mL de la solución de microorganismos de montaña, ambas en las concentraciones descritas anteriormente, resultando en una proporción 1:1 con respecto a los otros dos tratamientos individuales.
La inoculación de las semillas se realizó mediante un régimen de riego intermitente, que consistió en dos días de aplicación del tratamiento seguidos por un día de descanso. Durante los días de descanso, se mantuvo una hidratación mínima con agua destilada para evitar la desecación del sustrato. Este protocolo se diseñó para optimizar la absorción y fijación de los microorganismos tanto al sustrato como al sistema radicular en desarrollo de las plantas.
Los primeros brotes emergieron a los 7 días post-siembra, momento en el cual se inició un protocolo de medición diaria. Este incluía la evaluación de múltiples parámetros de crecimiento: altura de la planta, diámetro del tallo, número de hojas y cantidad de semillas germinadas por pocillo.
RESULTADOS Y DISCUSIÓN
Tras 30 días de experimentación, se evaluó la altura de las plantas. Los resultados mostraron que el tratamiento mixto produjo el mayor crecimiento promedio, con plantas alcanzando 28 cm de altura. Le siguieron en eficacia los microorganismos de montaña, con plantas de 26,5 cm en promedio. Las plantas del grupo control alcanzaron una altura media de 25,5 cm. finalmente, el tratamiento con Trichoderma sp. resultó en el menor crecimiento, con plantas que promediaron solo 18,7 cm de altura (Figura 3).
 Figura 3
Crecimiento de las plántulas de Phaseolus sp. en las bandejas de germinación después de 7 días
Figura 3
Crecimiento de las plántulas de Phaseolus sp. en las bandejas de germinación después de 7 días
(A) Plántulas tratadas con la mezcla de Trichoderma sp. y microorganismos de montaña (Mix). (B) Plántulas del grupo control (regadas con agua destilada estéril).
Los resultados mostraron variaciones significativas entre los tratamientos. El tratamiento combinado (mix) demostró el mayor impacto positivo en el crecimiento de Phaseolus sp., con una altura promedio de 28 cm; seguido del tratamiento con microrganismos de montaña (26,5); y los tratamientos control que superó al tratamiento de Trichoderma sp., con alturas promedio de 25,5 cm y 21 cm respectivamente (Figura 4). Esta discrepancia con los resultados esperados para Trichoderma sp. podría atribuirse a varios factores, como la concentración aplicada o las condiciones específicas de aplicación (Harman et al., 2004; Contreras-Cornejo et al., 2014).
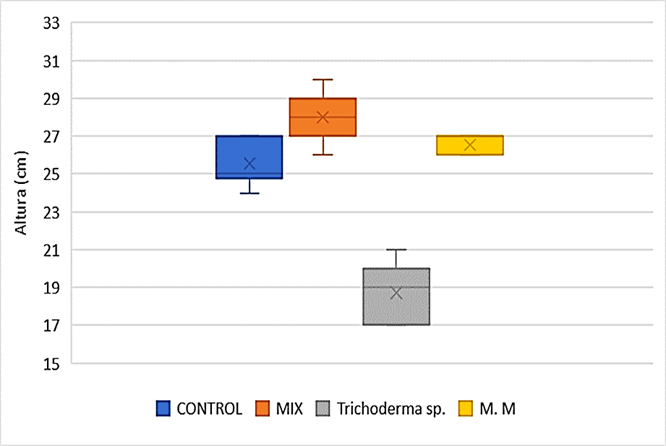 Figura 4
Altura de los diferentes tratamientos
Figura 4
Altura de los diferentes tratamientos
La significancia estadística se evaluó mediante pruebas de comparación de medias (ANOVA, prueba t) con un nivel de confianza del 95% (p < 0, 05).
En cuanto a la germinación, el tratamiento mix mostró la mayor eficacia con 90 semillas germinadas (62,5%), seguido por los microorganismos de montaña con 78 semillas (54,2%), el control con 68 semillas (47,2%), y finalmente Trichoderma sp. con 61 semillas (42,4%).
La superioridad del tratamiento combinado sugiere un efecto sinérgico entre los diferentes microorganismos, como ha sido reportado en Castro-Barquero et al. (2020); Muñoz et al. (2024). Este fenómeno podría explicarse por la complementariedad de los mecanismos de acción de los diferentes microorganismos, que en conjunto promueven múltiples aspectos del crecimiento vegetal (Rouphael y Colla, 2020).
El rendimiento inferior de Trichoderma sp. en comparación con otros tratamientos y el control merece una investigación más profunda. Factores como la especificidad de la cepa, las condiciones ambientales, o posibles interacciones antagonistas podrían haber influido en su eficacia (Brotman et al., 2013). Se recomienda realizar estudios adicionales para optimizar la aplicación de Trichoderma sp. en este contexto específico.
En cuanto al diámetro de los tallos, medido con un calibrador digital en el punto medio del tallo principal, no se observaron diferencias significativas entre los tratamientos, manteniéndose en un promedio de 0,5 ± 0,1 mm (media ± desviación estándar) para todos los grupos. Este resultado concuerda con lo reportado por Cargua et al. (2019), quienes también observaron cambios mínimos en el diámetro del tallo en respuesta a diferentes bioestimulantes en etapas tempranas de crecimiento.
Para el seguimiento del desarrollo foliar, se seleccionaron aleatoriamente 20 plántulas por tratamiento encontrando que el número de hojas mostró variaciones, las plantas del control presentaron el mayor número de hojas con un promedio de 6,0 ± 1,2 hojas, seguidas por las tratadas con microorganismos de montaña (5,2 ± 0,9 hojas), el tratamiento mix (4,3 ± 0,7 hojas) y, finalmente, las tratadas con Trichoderma sp. (3,5 ± 0,6 hojas).
Estos resultados, comparados con los datos de altura previamente mencionados, sugieren que la eficacia de los tratamientos varía según el parámetro evaluado, lo cual es consistente con los hallazgos de Rouphael et al. (2018). Mientras que el tratamiento mix destacó en el crecimiento en altura, no fue superior en la producción de hojas. Esta discrepancia subraya la complejidad de la respuesta de Phaseolus sp. a los bioestimulantes y sugiere que la evaluación de la eficacia debe considerar múltiples criterios, incluyendo biomasa seca, contenido de clorofila, longitud y densidad de raíces, análisis nutricional de las hojas, entre otros. Muñoz-Díaz (2020) enfatiza la importancia de estos análisis complementarios para comprender plenamente el impacto de los bioestimulantes y proporcionar una imagen más completa de cómo los tratamientos afectan el desarrollo y la fisiología de las plantas.
La variabilidad en la respuesta a los diferentes tratamientos puede explicarse por los mecanismos de acción específicos de cada bioestimulante. Por ejemplo, Harman (2011) demostró que Trichoderma spp. pueden favorecer el crecimiento longitudinal a través de la producción de auxinas, mientras que los microorganismos de montaña podrían promover la expansión foliar mediante la mejora en la absorción de nutrientes (Pii et al., 2015). La combinación de estos efectos en el tratamiento mix podría explicar su eficacia general, aunque no necesariamente superior en todos los parámetros.
Los resultados observados con el tratamiento mix sugieren un efecto sinérgico entre los componentes, lo cual es consistente con estudios previos. Por ejemplo, Colla et al. (2017) demostraron que Trichoderma sp., cuando se aplica individualmente, promueve principalmente el crecimiento de las raíces y la elongación del tallo a través de la producción de auxinas y giberelinas. Por otro lado, Bona et al. (2018) reportaron que los microorganismos de montaña, ricos en bacterias fijadoras de nitrógeno y hongos micorrízicos, mejoran la absorción de nutrientes y pueden favorecer el desarrollo foliar.
La combinación de estos microorganismos en el tratamiento mix de Trichoderma sp. y microorganismos de montaña mostró la mayor eficacia en términos de crecimiento en altura, como un desarrollo más robusto, sugiriendo un efecto sinérgico que promueve el desarrollo vertical de las plantas. Este resultado concuerda con lo reportado por Medina-Flores et al. (2014), quienes observaron que el uso de microorganismos de montaña incrementa tanto el crecimiento como la productividad del cultivo, podría explicar el crecimiento más equilibrado observado. Este fenómeno ha sido documentado por Rouphael et al. (2018), quienes encontraron que las mezclas de bioestimulantes a menudo producen efectos más robustos y consistentes que los componentes individuales. En este caso, aunque las plantas del tratamiento mix presentaron una altura superior, tuvieron menos hojas y un diámetro del tallo similar al control, lo que indica un patrón de crecimiento diferenciado. Sin embargo, para determinar la eficacia global del tratamiento mix, sería necesario considerar parámetros adicionales. Yakhin et al. (2017) sugieren evaluar la biomasa total, la eficiencia fotosintética y el rendimiento final del cultivo para obtener una imagen completa de los beneficios de los bioestimulantes. Además, Du Jardin (2015) enfatiza la importancia de estudiar los efectos a largo plazo y bajo diferentes condiciones de estrés para comprender completamente el potencial de estos tratamientos combinados.
El segundo tratamiento más efectivo fue el de microorganismos de montaña (MM), favoreciendo principalmente el crecimiento longitudinal, lo cual se alinea con los hallazgos de Torres-Pérez et al. (2022), quienes notaron un incremento en la altura de las plantas tratadas con estos microorganismos. Por otra parte, Noda (2009), sostiene que las plantas tratadas con estos microorganismos presentan buena altura y vigor, mejorando el rendimiento en un 15-50% y protegiendo las raíces contra ciertos hongos y patógenos. En este estudio, las plantas tratadas con MM mostraron un crecimiento considerable, aunque menor que el del mix.
Es importante señalar que durante el experimento se observó la presencia de hongos de color blanco en las bandejas del control, a pesar de que el medio inicialmente era estéril. Esta contaminación inesperada plantea varias consideraciones importantes para la interpretación de los resultados y subraya la necesidad de implementar protocolos de esterilización más rigurosos en futuros experimentos (Hardoim et al., 2015), por lo que es importante notar que los efectos de los hongos en el crecimiento de las plantas pueden ser diversos y específicos. Mientras que especies de Trichoderma, pueden promover el crecimiento general de la planta (Harman et al., 2004), otros hongos pueden tener efectos más localizados. Por ejemplo, Behie y Bidochka (2014) observaron que algunos hongos endofíticos pueden favorecer específicamente el desarrollo foliar a través de la producción de fitohormonas como las citoquininas. Autores como Frac et al. (2018) demostraron que ciertos hongos del suelo pueden formar asociaciones beneficiosas con las raíces de las plantas, mejorando la absorción de nutrientes y promoviendo el crecimiento foliar. Por otra parte, no todos los hongos tienen efectos positivos. Algunos pueden retrasar el crecimiento o incluso ser patógenos. Según Pieterse et al. (2014), la respuesta de la planta a los microorganismos depende de complejas interacciones moleculares y puede variar según las condiciones ambientales y el estado fisiológico de la planta. Esta observación subraya la complejidad de las interacciones planta-microorganismo y la importancia de considerar factores no controlados al interpretar los resultados de experimentos. Para futuros estudios, sería recomendable incluir análisis microbiológicos del suelo y de las raíces para identificar y cuantificar las poblaciones microbianas presentes, como sugieren Raaijmakers et al. (2009).
Las plantas tratadas con Trichoderma sp., aunque presentaron menor altura y número de hojas, mostraron características que sugieren un desarrollo más robusto, con tallos ligeramente más gruesos y un sistema radicular más extenso. Este patrón de crecimiento concuerda con lo reportado por Harman et al. (2004), quienes observaron que Trichoderma sp. puede promover el desarrollo radicular y fortalecer la resistencia a patógenos. La ausencia de datos sobre el desarrollo radicular representa una omisión importante, dado que muchos bioestimulantes, especialmente Trichoderma sp., son conocidos por su influencia en la arquitectura de las raíces (Harman, 2006).
Finalmente, la bibliografía sugiere que el diámetro y la estructura de algunas plantas dependen parcialmente del tipo de suelo y la frecuencia de riego (Callejas et al., 2012). Sin embargo, en este estudio no se utilizaron suelos diferentes ni se utilizaron variaciones en los patrones de riego. Los cambios en la estructura del suelo inducidos por los microorganismos podrían haber tenido un impacto limitado en el diámetro del tallo bajo las condiciones experimentales empleadas.
CONCLUSIONES
Este estudio demuestra que el uso de biofertilizantes, particularmente la combinación de Trichoderma sp. y microorganismos de montaña, es efectivo para mejorar el crecimiento de Phaseolus sp. Este tratamiento mixto no solo promovió el mayor crecimiento en altura, sino que también resultó en el mayor número de semillas germinadas, superando tanto a los tratamientos individuales como al control.
Los microorganismos de montaña, por sí solos, también demostraron un efecto positivo en el crecimiento, aunque en menor medida que el tratamiento mixto. Esto subraya el potencial de los microorganismos nativos como bioestimulantes eficaces en la agricultura.
Los resultados de este estudio sugieren que los bioestimulantes tienen potencial para influir en el crecimiento de Phaseolus sp., aunque es crucial interpretar estos hallazgos con cautela e integrar un mayor conjunto de mediciones, para establecer el efecto diferenciado y comprender el mecanismo de acción. La eficacia de los tratamientos mostró variabilidad en diferentes parámetros de crecimiento, lo que subraya la complejidad de las interacciones planta-microorganismo.
LITERATURA CITADA
Alori, E. T., Glick, B. R. & Babalola, O. O. (2017). Microbial phosphorus solubilization and its potential for use in sustainable agriculture. Frontiers in Microbiology, 8, 971. https://doi.org/10.3389/fmicb.2017.00971
Atlas, R. M. & Bartha, R. (1998). Microbial Ecology. Fundamentals and applications. Editorial Benjamin / Cummings Publishing Company, Inc., Menlo Park, California, U.S.A.
Backer, R., Rokem, J. S., Ilangumaran, G., Lamont, J., Praslickova, D., Ricci, E., Subramanian, S. & Smith, D. L. (2018). Plant growth-promoting rhizobacteria: context, mechanisms of action, and roadmap to commercialization of biostimulants for sustainable agriculture. Frontiers in Plant Science, 9, 1473. https://doi.org/10.3389/fpls.2018.01473
Bashan, Y., de-Bashan, L. E., Prabhu, S. R. & Hernandez, J. P. (2014). Advances in plant growth-promoting bacterial inoculant technology: formulations and practical perspectives (1998-2013). Plant and Soil, 378(1-2), 1-33. https://doi.org/10.1007/s11104-013-1956-x
Behie, S. W. & Bidochka, M. J. (2014). Nutrient transfer in plant–fungal symbioses. Trends in Plant Science, 19(11), 734-740. https://doi.org/10.1016/j.tplants.2014.06.007
Bona, E., Todeschini, V., Cantamessa, S., Cesaro, P., Copetta, A., Lingua, G., Gamalero, E., Berta, G. & Massa, N. (2018). Combined bacterial and mycorrhizal inocula improve tomato quality at reduced fertilization, Scientia Horticulturae 234:160-165. https://doi.org/10.1016/j.scienta.2018.02.026
Brotman, Y., Landau, U., Cuadros-Inostroza, Á., Takayuki, T., Fernie, A. R., Chet, I. (2013). Trichoderma-plant root colonization: escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance. PLOS Pathogens 9(4): https://doi.org/10.1371/annotation/8b818c15-3fe0-4e56-9be2-e44fd1ed3fae
Callejas, R., Rojo, E., Benavidez, C. & Kania, E. (2012). Crecimiento y distribución de raíces y su relación con el potencial productivo de parrales de vides de mesa. Agrociencia, 46(1), 23- 35 http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952012000100003&lng=es&nrm=iso
Calvo, P., Nelson, L. & Kloepper, J. W. (2014). Usos agrícolas de bioestimulantes de plantas. Plant and Soil, 383(1-2), 3-41. https://doi.org/10.1007/s11104-014-2131-8
Campos, E. V. R., Proença, P. L. F., Oliveira, J. L., Bakshi, M., Abhilash, P. C. & Fraceto, L. F. (2019). Uso de insecticidas botánicos para la agricultura sostenible: Perspectivas futuras. Ecological Indicators, 105, 483-495. https://doi.org/10.1016/j.ecolind.2018.04.038
Cappuccino, J. G. & Sherman, N. (2014). Microbiology: A Laboratory Manual. Pearson.
Cargua, J. E., Orellana, G. L., Cuenca, A. del C.& Cedeño, G. A. (2019). Eficacia de bioestimulantes sobre el crecimiento inicial de plantas de fréjol común (Phaseolus vulgaris L.).10 (1):14-22. https://revistasespam.espam.edu.ec/index.php/Revista_ESPAMCIENCIA/article/view/184/179
Castro-Barquero, L., Martínez Vargas, V., Castro Zúñiga, O & Blanco Meneses, M. (2020). Abono orgánico, microorganismos de montaña (MM) y fertibiol para el control biológico de la hernia de las crucíferas (Plasmodiophora brassicae wor.) en el cultivo de mostaza china (Brassica rapa sp. pekinensis var. Taranko F1). Agronomía Costarricense, 44(2). https://doi.org/10.15517/rac.v44i2.43088
Colla, G., Hoagland, L., Ruzzi, M., Cardarelli, M., Bonini, P., Canaguier, R. & Rouphael Y. (2017). Biostimulant Action of Protein Hydrolysates: Unraveling Their Effects on Plant Physiology and Microbiome. Front Plant Sci. 22(8):2202. https://doi.org/10.3389/fpls.2017.02202
Contreras-Cornejo, H. A., Macías-Rodríguez, L., Alfaro-Cuevas, R. & López-Bucio, J. (2014). Trichoderma spp. Improve growth of Arabidopsis seedlings under salt stress through enhanced root development, osmolite production, and Na⁺ elimination through root exudates. Mol Plant Microbe Interact, 27(6):503-514. https://doi:10.1094/MPMI-09-13-0265-R
Döbereiner, J. A. (1997). Importância da fixação biológica de nitrogênio para a agricultura sustentável. Biotecnologia Ciência & Desenvolvimento, 1(1), 2-3.
Du Jardin, P. (2015). Plant biostimulants: Definition, concept, main categories and regulation. Scientia Horticulturae, 196, 3-14. https://doi.org/10.1016/j.scienta.2015.09.021
Frac, M., Hannula, S. E., Belka, M. & Jędryczka, M. (2018). Fungal biodiversity and their role in soil health. Frontiers in Microbiology. https://doi.org/10.3389/fmicb.2018.00707
Gams, W. & Bissett, J. (1998). Morphology and identification of Trichoderma. In: Trichoderma and Gliocladium (1998) Kuricek, C. & Harman, G. E. Editores. (pp. 3-34). CRC Press.
Gouda, S., Kerry, R. G., Das, G., Paramithiotis, S., Shin, H. S. & Patra, J. K. (2018). Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture. Microbiological Research, 206, 131-140. https://doi.org/10.1016/j.micres.2017.08.016
Hardoim, P. R., van Overbeek, L. S., Berg, G, Pirttilä, A. M., Compant, S., Campisano, A., Döring, M. & Sessitsch, A. (2015). The hidden world within plants: ecological and evolutionary considerations for defining functioning of microbial endophytes. Microbiology and Molecular Biology Reviews, 79(3), 293-320. https://doi.org/10.1128/mmbr.00050-14
Harman, G. E. (2000). Myths and dogmas of biocontrol: changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease, 84(4), 377-393. https://doi.org/10.1094/PDIS.2000.84.4.377
Harman, G. E. (2006). Overview of mechanisms and uses of Trichoderma spp. Phytopathology, 96(2), 190-194. https://doi.org/10.1094/PHYTO-96-0190
Harman, G. E., Howell, C. R., Viterbo, A., Chet, I., & Lorito, M. (2004). Trichoderma species—opportunistic, avirulent plant symbionts. Nature Reviews Microbiology, 2(1), 43-56. https://doi.org/10.1038/nrmicro797.
Harman, G. E. (2011). Multifunctional fungal plant symbionts: new tools to enhance plant growth and productivity. New Phytol, 189(3), 647-649. https://doi.org/10.1111/j.1469-8137.2010.03614.x
López-Bucio, J., Pelagio-Flores, R., & Herrera-Estrella, A. (2015). Trichoderma as biostimulant: exploiting the multilevel properties of a plant beneficial fungus. Scientia Horticulturae, 196, 109-123. https://doi.org/10.1016/j.scienta.2015.08.043
Medina-Flores, C. M., Talavera-Loza, J. A., Rostrán-Molina, J. L. & Bárcenas-Lanzas, M. J. (2014). Efecto de dosis y aplicaciones edáficas y foliar de microorganismos de montaña con y sin sales minerales en el rendimiento del cacao (Theobroma cacao L.) variedad criolla. Nicaragua: Universidad Nacional Autónoma de Nicaragua. http://hdl.handle.net/123456789/4300
Muñoz-Díaz, A. J. (2020). Ventajas de los biopreparados para controlar enfermedades, como alternativa de la agricultura orgánica. Babahoyo: Universidad Técnica de Babahoyo. http://dspace.utb.edu.ec/handle/49000/8511
Muñoz Quintana, M., Alcívar Torres, L., Ruiz Parrales, Y., Álvarez Contreras, C. & Vásquez Contreras, S. (2024). Efecto de la aplicación de ácido giberélico, microorganismos nativos, Trichoderma sp. y melaza en el cultivo de banano (Musa x paradisiaca L). Conocimiento Global, 9(2), 270-287. https://conocimientoglobal.org/revista/index.php/cglobal/article/view/414
Noda, Y. (2009). Las micorrizas: Una alternativa de fertilización ecológica en los pastos. Pastos y Forrajes, 32(2). http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942009000200001&lng=es&tlng=es
Pieterse, C. M., Zamioudis, C., Berendsen, R. L., Weller, D. M., Van Wees, S. C., & Bakker, P. A. (2014). Induced systemic resistance by beneficial microbes. Annual Review of Phytopathology, 52, 347-375. https://doi.org/10.1146/annurev-phyto-082712-102340
Pii, Y., Mimmo, T., Tomasi, N., Terzano, R., Cesco, S. & Crecchio C. (2015). Microbial interactions in the rhizosphere: beneficial influences of plant growth-promoting rhizobacteria on nutrient acquisition process. A review. Biol Fertil Soils, 51(4), 403-415. https://doi.org/10.1007/s00374-015-0996-1
Raaijmakers, J. M., Paulitz, T. C., Steinberg, C., Alabouvette, C. & Moënne-Loccoz, Y. (2009). The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms. Plant and Soil, 321(1), 341-361. https://doi.org/10.1007/s11104-008-9568-6
Rillig, M. C., Aguilar‐Trigueros, C. A., Bergmann, J., Verbruggen, E., Veresoglou, S. D., & Lehmann, A. (2015). Plant root and mycorrhizal fungal traits for understanding soil aggregation. New Phytologist, 205(4), 1385-1388. https://doi.org/10.1111/nph.13045
Rodríguez, E., Lorenzo, E., De Gracia, R., González, G. y González, F. (1997). Manual técnico del manejo integrado del frijol común o poroto (Phaseolus vulgaris L.) en el sistema de mínima labranza de Panamá. IDIAP. pp 75.
Rouphael, Y., & Colla, G. (2020). Editorial: Biostimulants in agriculture. Frontiers in Plant Science, 11, 40. https://doi.org/10.3389/fpls.2020.00040
Rouphael, Y., Spíchal, L., Panzarová, K., Casa, R., & Colla, G. (2018). High-throughput plant phenotyping for developing novel biostimulants: from lab to field or from field to lab? Frontiers in Plant Science, 9, 1197. https://doi.org/10.3389/fpls.2018.01197
Torres-Pérez, J. C., Aguilar Jiménez, C. E., Vázquez Solís, H., Solís López, M., Gómez Padilla, E. & Aguilar Jiménez, J. R. (2022). Evaluación del uso de microorganismos de montaña activados en el cultivo de rosas, Zinacantán, Chiapas, México. Siembra, 9(1), e3500. https://doi.org/10.29166/siembra.v9i1.3500
Yakhin, O. I., Lubyanov, A. A., Yakhin, I. A., & Brown, P. H. (2017). Biostimulants in plant science: a global perspective. Frontiers in Plant Science, 7, 2049. https://doi.org/10.3389/fpls.2016.02049









