En las ciencias biológicas, los murciélagos son bien conocidos por su importancia económica y ecológica, entre los beneficios que ofrece al ser humano están: el control de plagas, la polinización y la dispersión de semillas de plantas económicamente importantes, medicina, biotecnología, fertilizante; sumado un papel clave en la evolución, estabilidad y funcionamiento de los ecosistemas (Zárate et al., 2012). Sin embargo, la pérdida de hábitats, representada principalmente por la cobertura vegetal, está poniendo en riesgo su diversidad biológica. La fragmentación de hábitat puede reducir la abundancia, riqueza y diversidad de estos organismos (Galindo-González y Sosa, 2003; Krauss et al., 2010), interrumpiendo la dispersión, movimientos y flujo genético entre fragmentos (Galindo-González, 2007) y amenazan con la viabilidad de sus poblaciones (Kareiva, 1987). Sus requerimientos especializados les hacen susceptible a las alteraciones de sus hábitats (Zárate et al., 2012).
En un escenario ambiental real en donde el proceso de cambio de uso de suelo y la fragmentación de hábitats se dan a una velocidad vertiginosa, es necesario determinar y documentar la mayor cantidad de información posible, con la finalidad de aportar a la conservación, no solamente de la biodiversidad de los murciélagos, sino a la basta diversidad biológica de organismos que los acompañan en el entorno en el que estos viven. La determinación de la diversidad biológica es relevante en términos de riqueza, diversidad, especies más abundantes, familias más representadas y nos permite comparar entre los hábitat cerrados y abiertos dentro del bosque seco tropical de los sitios de estudio, en este caso las Reservas Silvestres Privadas; así como identificar grupos de especies según el gremio alimenticio y la preferencia de hábitat; y determinar el estado de conservación y potencial de indicación de las especies mediante revisión bibliográfica.
Con los resultados de este estudio se establecen las bases para utilizar a los murciélagos como indicadores biológicos, con los cuales se pueda evaluar el estado de conservación en los sitios de estudio y así tener criterios para tomar decisiones en pro del fortalecimiento de los esfuerzos de conservación biológica en el bosque seco tropical de la zona Pacífico Central de Nicaragua. Existe amplia documentación del uso potencial de los murciélagos para llevar a cabo esta tarea (Galindo-González, 2007; Pérez et al., 2012; Zárate et al., 2012; Estella et al., 2014).
MATERIALES Y MÉTODOS
Ubicación y descripción del área de estudio
El estudio se realizó en seis Reservas Silvestres Privadas (RSP) ubicadas en los departamentos de Managua y Carazo, Nicaragua; estas fueron RSP Quelantaro (latitud 11°56’34.60’’ Norte, longitud 86°29’22.60’’ Oeste), RSP Concepción de María (latitud 11°51’41.34’’ N, longitud 86°12’49.91’’ O), RSP Egon Borucki in Memoriam (latitud 11°45’ 34.61’’ N, longitud 86°21’19.30’’ O), RSP Celocuague (latitud 11°44’33.2’’ N, longitud 86°12’50.6’’ O), RSP Montibelli (latitud 12°1’17.48’’ N, longitud 86°13’54.41’’ O) y RSP La Mákina (latitud 11°44’27.91’’ N, longitud 86°19’32.81’’ O) (Figura 1); ubicadas entre 20 km y 60 km de la ciudad de Managua. Todas las reservas se caracterizan por tener bosques conservados y representativos del bosque seco tropical de la zona del pacífico en un paisaje rodeado por centros poblados y áreas de uso agrícola y ganadero. Esta información se tomó en los meses de agosto a noviembre del año 2019.
 Figura 1.
Ubicación de las Reservas Silvestres Privadas en Managua y Carazo, Nicaragua.
Figura 1.
Ubicación de las Reservas Silvestres Privadas en Managua y Carazo, Nicaragua.
El bosque seco tropical se caracteriza por tener una estación seca entre 4 y 8 meses y un período lluvioso impredecible (González-Rivas, 2005), con precipitaciones anuales que oscilan entre 700 mm y 1 000 mm (Zamora, 2010). El bosque seco tropical del pacífico de Nicaragua está compuesto por varios tipos de ecosistemas, entre ellos sobresalen el bosque caducifolio, caracterizado por la abscisión que sufren las hojas de la mayoría de las especies arbóreas; el bosque de galería, representado por una mayoría de árboles siempreverdes; y la sabana, cuya estructura está dominada por plantas herbáceas y pocos árboles dispersos.
Mediante una caracterización rápida de la vegetación arbórea (≥10 cm de Diámetro a la Altura del Pecho [DAP]) de los sitios de estudio, en donde se establecieron 27 parcelas rectangulares de 20 m x 50 m, se contabilizaron 158 individuos agrupados en 42 especies. Las especies arbóreas predominantes fueron: Lagarto (Zanthoxylum sp.) (80 individuos ha-1) y papaturro (Coccoloba caracasana) (70), seguidos de aguacate de monte (Persea sp.) (40), chaperno blanco (Caesalpinia velutina) (30), sardinillo (Tecoma stans) (30), caoba (Swietenia humilis) (25), madero negro (Gliricidia sepium) (25) y quebracho (Lysiloma auritum) (25). La altura promedio de las especies fue de 25.21±1.65 (promedio±error estándar), siendo las especies con mayores promedios de altura: Hoja tostada (Licania arborea) (32), carboncillo (Vachellia pennatula) (26.7), tempisque (Sideroxylon capirii) (26.5±4.5), talalata (Gyrocarpus americanus) (23), guanacaste negro (Enterolobium cyclocarpum) (21.23±3.11), níspero (Manilkara chicle) (21) y falso roble (Tabebuia rosea) (20.7); el diámetro promedio de las especies arbóreas fue de 12.32±0.4, siendo las especies con mayores diámetros: Tempisque (Sideroxylon capirii) (116.25±8.25 cm), hoja tostada (Licania arborea) (94), guanacaste negro (Enterolobium cyclocarpum) (84.63±23.05) y níspero (Manilkara chicle) (52).
Proceso metodológico
Se establecieron cinco redes de neblinas con dimensiones de 3 m x 6 m en cada uno de los tipos de bosques, los sitios con bosque de dosel abierto (denominados simplemente abierto) y los sitios con bosque de dosel cerrado (denominados simplemente cerrado). En el área de bosque abierto la densidad de árboles era de 54 individuos ha-1; mientras en el área de bosque cerrado la densidad de árboles fue de 69 individuos ha-1, la composición de especies según el coeficiente de similaridad de Jaccard fue de 38 %, considerándose poco similares. Visualmente, en campo se determinó que ambos sitios se diferenciaran por una mayor presencia y tamaños de claros en el dosel del bosque del hábitat Abierto.
Registro de datos
Se realizó una visita de dos noches a cada reserva para la toma de datos, una noche para el área de bosque Abierto y otra para el área de bosque Cerrado. Después de establecer las redes de neblina, estas se desplegaron en horarios de 18:30 a 23:00 y se revisaron en intervalos de 10 a 20 minutos, en dependencia de la frecuencia de captura. Los individuos fueron manipulados con guantes de cuero por un lapso no mayor a 10 minutos, tiempo en el cual fueron identificados con el uso de las guías ilustradas de Emmons (1997), LaVal y Rodríguez-H (2002) y Medina-Fitoria (2014). Los puntos específicos donde se establecieron las redes de neblinas fueron georreferenciados utilizando un GPS Garmin GPSMAP 62, dichos puntos estaban distanciados a más de 200 metros.
Análisis de la información
Se contó el número de individuos que eran capturados en las redes como abundancia absoluta, dividiendo esta abundancia entre el número de horas redes por punto de muestreo; se calculó la abundancia relativa (individuos por horas red) y se estandarizó el resultado final a 100 horas red multiplicando la abundancia relativa por 100/100. Se realizó una descripción general de la diversidad biológica de murciélagos determinando valores de abundancia, riqueza, especies más abundantes, y familias y géneros más representativos según el número de especies. A la vez, se comparó la riqueza (Bootstrap), la abundancia (Prueba t) y la diversidad con el Índice de Diversidad de Simpson (Bootstrap) entre los sitios.
Seguidamente se agruparon las especies utilizando un Análisis de Conglomerados con Encadenamiento Simple y el Coeficiente de Jaccard, en base a los gremios alimenticios y preferencia de hábitat de las especies. Finalmente, se determinó el estado de conservación y el valor de indicación (bioindicador ambiental) de las especies. Tanto esto último, como los hábitos alimenticios y la preferencia de hábitat se determinaron mediante el uso de referencias bibliográficas como (LaVal y Rodríguez-H, 2002; Medina-Fitoria, 2014). Los programas computacionales utilizados fueron: PAST (Hammer et al., 2001) y R (R Core Team, 2015).
RESULTADOS Y DISCUSIÓN
Diversidad biológica de murciélagos
En las 209.58 horas que las redes estuvieron expuestas, se capturaron un total de 217 individuos, los que estaban distribuidos en 15 especies, 10 géneros y tres familias (Mormoopidae, Phyllostomidae y Vespertilionidae). El número de especies observadas fue similar al de otros estudios, en el que se determinaron entre 11 y 13 especies (Williams-Guillén y Medina, 2016; Rivas et al., 2015); sin embargo, en otras investigaciones con mayor esfuerzo de muestreo, se determinaron entre 22 y 39 especies (González, 2020; Martínez Gómez et al., 2020). Para incrementar la lista de especies será necesario aumentar el número de horas de captura e implementar otros métodos de captura, incluyendo redes de subdosel y trampas arpa; incluso se recomienda el uso de detectores ultrasónicos para permitir la detección de más especies (Estella et al., 2014).
Las especies que fueron atrapadas con más frecuencia en un tiempo estandarizado de 100 horas de exposición de las redes fueron en orden descendiente: Artibeus jamaicensis (51 individuos por 100 horas red), Desmodus rotundus (23), Carollia subrufa (22), Carollia perspicillata (17) y Glossophaga commissarisi (17). El resto de las especies fueron capturadas menos de 16 veces en 100 horas. Las especies capturadas solamente una vez fueron: Chiroderma villosum, Diphylla ecaudata, Eptesicus furinalis, Pteronotus davyi y Vampyrum spectrum.
Los géneros más representados según el número de especie fueron Carollia (tres especies), Glossophaga (tres) y Artibeus (dos), el resto de los géneros estuvo representado por una especie. La familia más representada, según el número de especies, fue Phyllostomidae con 12 especies; las familias Vespertilionidae con dos especies y Mormopidae representada por una especie.
Comparación de la diversidad biológica y composición de especie por tipo de ecosistema
De las 15 especies reportadas en este estudio, 11 se encontraron en el área de bosque abierto y 13 en el área de bosque cerrado; sin embargo, las diferencias no fueron significativas (p = 0.65); la abundancia relativa fue de 141 individuos por 100 horas red en el área de bosque abierto y de 62 individuos por 100 horas red en el área de bosque cerrado, también sin diferencias estadísticas (p = 0.05). Aunque no se encontraron diferencias significativas en la diversidad (expresada con el índice de Simpson [λ]) (p = 0.40), se observó una tendencia a mayor diversidad en el bosque cerrado (λ = 0.11) respecto al bosque abierto (0.14). Esta diferencia podría explicarse por la alta dominancia de Artibeus jamaicensis en el bosque abierto, donde representa el 56 % de la abundancia total, reduciendo la diversidad efectiva (Magurran, 2004; Moreno, 2001).
En cuanto a la composición de especies, utilizando el Coeficiente de Similaridad de Jaccard, la similaridad entre los dos hábitats es relativamente baja con un 41 %, siento siete especies las que se comparten en los dos sitios, entre ellas: Artibeus jamaicensis, Artibeus lituratus, Carollia perspicillata, Carollia subrufa, Platyrrhinus helleri, Desmodus rotundus y Carollia sp. Las especies que solamente se encontraron en el área de bosque Abierto fueron: Eptesicus furinalis, Glossophaga commissarisi y Rhogeessa bickhami; y las especies que solamente se contabilizaron en el área de bosque cerrado fueron: Carollia sp, Chiroderma villosum, Diphylla ecaudata, Glossophaga sp, Pteronotus davyi y Vampyrum spectrum.
El hecho de que estas especies se hayan encontrado solamente en una de las dos áreas de bosques no denota exclusividad de hábitat, ya que, a excepción de Rhogeessa bickhami que fue determinada seis veces en el bosque abierto, del resto de las especies, la mayoría (56 %) solamente fue determinado una vez, 22 % de ellos solamente dos veces y 22 % de ellos solamente tres veces, por lo que no hay evidencias numéricas suficientes para asociarlos significativamente a alguno de los dos hábitats. De todas estas especies Vampyrum spectrum es considerada muy rara (Medina-Fitoria, 2014).
Las especies más abundantes en el área de bosque abierto fueron: Artibeus jamaicensis (39 individuos por 100 horas red), seguido de Glossophaga commissarisi (17), Desmodus rotundus (14), Carollia perspicillata (13), Carollia subrufa (12) y Artibeus lituratus (11); mientras que las especies más abundantes en el área de bosque Cerrado fueron: Artibeus jamaicensis (12), Carollia subrufa (10) y Desmodus rotundus (9). Es evidente que en el área de bosque abierto y en bosque cerrado estuvieron dominados por especies que fueron abundantes de manera general en todos los sitios de estudios, además Artibeus jamaicensis, Carollia perspicillata y Carollia subrufa pueden ser encontrado en cualquier lugar (Medina-Fitoria, 2014); Desmodus rotundus es también abundante, principalmente en sitios cercanos a actividades pecuarias por su hábito alimenticio hematófago (Pérez et al., 2012) y Artibeus lituratus generalmente abundante en las áreas de bosque (LaVal y Rodríguez-H, 2002).
Agrupación de las especies según gremios alimenticios y preferencia de hábitat
Basado en (Medina-Fitoria, 2014), se determinaron los gremios alimenticios a los que pertenecen las 15 especies determinadas, entre las categorías de los gremios se incluyen: frugívoro, insectívoro, carnívoro, nectarívoro y hematófago. En la misma literatura se determinó también la preferencia de hábitat de cada especie, siendo las categorías las siguientes: bosque, áreas perturbadas, áreas abiertas y todos los hábitats.
En términos de gremios alimenticios, la mayoría de las especies eran frugívoras (siete especies equivalente al 47 %), entre las especies más abundantes determinadas en este estudio: Artibeus jamaicensis, Carollia subrufa, y Artibeus lituratus, son especies frugívoras (LaVal y Rodríguez-H, 2002), que en conjunto con otras especies son los mamíferos más importantes en la dispersión de semillas en los trópicos (Tórres-Flores, 2005). Estimaciones evidencian que los murciélagos dispersan entre dos y ocho veces más semillas que las aves, y que entre 80 % y 100 % de las semillas que caen al suelo en la estación seca, es debido a la actividad de los murciélagos (MacSwiney, 2010), estos incluyen árboles frutales y de importancia comercial (Romero-Almaraz et al. 2006). De manera general, las frutas dispersadas principalmente por murciélagos tienen colores y olores característicos (Zárate et al., 2012).
El resto de las especies pertenecían a los gremios insectívoras (tres especies, equivalentes al 20 %), carnívoros (uno, equivalente al 7 %) nectarívoras (dos, equivalentes al 13 %) y hematófagas (dos, equivalentes al 13 %), solamente se determinó una especie del gremio carnívora (Vampyrum spectrum). Tanto los insectívoros, como los nectarívoros, también ofrecen un importante servicio ecosistémico, ya que participan activamente en el control de poblaciones de insectos y en la polinización (McNab, 1982; Jones et al., 2009; Zárate et al., 2012).
A pesar de que los muestreos se realizaron a lo largo de la estación lluviosa, la diversidad de especies insectívoras no fue considerable, tomando en cuenta que los insectos son más abundantes a comienzo de esa estación (Janzen, 1991), esto puede que se deba a que la mayoría de los muestreos no se realizaron cerca de cuerpos de agua, pues según MacSwiney et al. (2009), estos son lugares esenciales para el forrajeo de las especies insectívoras. En algunas plantas, las flores están adaptadas a la polinización por murciélagos, lo que incluye apertura nocturna, resistentes y de tamaño relativamente grandes, de colores poco llamativos, con olores fuertes y con alta producción de néctar y polen (Zárate et al., 2012).
Uno de los murciélagos hematófagos más comunes, Desmodus rotundus, resultó ser abundante durante el periodo de esta investigación, presuntamente vinculado a zonas pecuarias en los alrededores del área de estudio. Este ha sido reconocido en ocasiones como plaga (Pérez et al., 2012).
Vampyrum spectrum, el único murciélago estrictamente carnívoro determinado en este estudio, seguramente también ejerce su papel ecológicamente importante en el control de poblaciones con alta reproducción (aves, roedores, marsupiales pequeños y otros murciélagos), pero lo más notorio de esta especie es que tiene requerimientos específicos de hábitat y está restringido a lugares poco alterados (Emmons, 1997; LaVal y Rodríguez, 2002), por lo que su presencia podría servir como indicador de sitios conservados. De las 15 especies, 12 se reportan en un solo tipo de hábitat según la literatura, las cuales pertenecen a las categorías bosque (siete especies, equivalentes al 46.6 %) y a todos los hábitats (cinco especies, equivalentes al 33.3 %). Cinco especies se reportan en dos categorías de hábitats, bosque y áreas perturbadas y una especie (Desmodus rotundus) se encuentra en tres hábitats, los cuales son bosque, áreas perturbadas y áreas abiertas.
En la Figura 2 se presenta un análisis de conglomerados utilizando encadenamiento simple y la distancia de Jaccard para agrupar a las especies en base al gremio alimenticio y la preferencia de hábitats. El análisis presenta a las 15 especies en cinco grupos y dos especies separadas. El grupo con más especies está compuesto por ARTILITU, ARTIJAMA, CAROPERS, CAROSP Y CAROSUBR, caracterizados conjuntamente por tener una preferencia alimenticia frugívora y por encontrarse en todos los hábitats; luego está el grupo conformado por GLOSCOMM y GLOSSP caracterizados por ser nectarívoros y encontrarse en bosques y áreas perturbadas; otro grupo lo conforman las especies CHIRVILL y PLATHELL, que son frugívoros y solamente se encuentran en bosques; el último está compuesto por RHOGBICK y PTERDAVY que son murciélagos insectívoros y se encuentran en bosques.
 Figura 2.
Análisis de conglomerado utilizando encadenamiento simple y la distancia de Jaccard, en donde se agrupan las especies en base al gremio alimenticio y la preferencia de hábitats. La clave de los códigos de las especies es la siguientes: ARTIJAMA = Artibeus jamaicensis; CAROPERS = Carollia perspicillata; CAROSP = Carollia sp; CAROSUBR = Carollia subrufa; GLOSCOMM = Glossophaga commissarisi; GLOSSP = Glossophaga sp; ARTILITU = Artibeus lituratus; CHIRVILL = Chiroderma villosum; PLATHELL = Platyrrhinus helleri; DESMROTU = Desmodus rotundus; DIPHECAU = Diphylla ecaudata; EPTEFURI = Eptesicus furinalis; PTERDAVY = Pteronotus davyi; VAMPSPEC = Vampyrum spectrum; RHOGBICK = Rhogeessa bickhami.
Figura 2.
Análisis de conglomerado utilizando encadenamiento simple y la distancia de Jaccard, en donde se agrupan las especies en base al gremio alimenticio y la preferencia de hábitats. La clave de los códigos de las especies es la siguientes: ARTIJAMA = Artibeus jamaicensis; CAROPERS = Carollia perspicillata; CAROSP = Carollia sp; CAROSUBR = Carollia subrufa; GLOSCOMM = Glossophaga commissarisi; GLOSSP = Glossophaga sp; ARTILITU = Artibeus lituratus; CHIRVILL = Chiroderma villosum; PLATHELL = Platyrrhinus helleri; DESMROTU = Desmodus rotundus; DIPHECAU = Diphylla ecaudata; EPTEFURI = Eptesicus furinalis; PTERDAVY = Pteronotus davyi; VAMPSPEC = Vampyrum spectrum; RHOGBICK = Rhogeessa bickhami.
Separadas del resto, se observan las especies hematófagas DESMROTU y DIPHECAU, también la especie insectívora de bosques EPTEFURI y la especie carnívora VAMPSPEC, dada las particularidades de las combinaciones de características que les diferencian del resto.
Para la mayoría de las especies del orden Quiróptera, la vegetación es sumamente importante, ya que, de manera general, esta les provee de alimento, percha/refugio dos factores importantes (MacSwiney et al., 2007; Pérez et al., 2012); promoviendo una mayor diversidad de especies (Bernard, 2001). Muchos murciélagos ocurren en bosques siempreverdes, caducifolios, matorrales xerofíticos, bosques de galería, bosques primarios o en regeneración, pastizales, huertos caseros (Hutson et al., 2001; García-García y Santos-Moreno, 2008; Pérez et al., 2012). Evidentemente, el resto ocupa hábitats diferentes al vegetal, como infraestructuras abandonadas, cuevas, grietas, minas, entre otros; pero de una forma u otra, en algún momento necesitan visitar los sitios con cobertura vegetal.
Pérez et al. (2012), reportan menor riqueza de especies de murciélagos en el bosque de roble (Quercus segoiensis), posiblemente porque la variedad de especies que constituyen diferentes estratos y que proveen diferentes tipos de alimento, no es tan alta como en los bosques diversos. La vegetación ripariana, en particular, es muy importante, ya que los murciélagos la utilizan como corredores y conectores en el paisaje (De Jong, 1995), probablemente esta importancia sea aún mayor en el bosque seco y en la estación seca, cuando la vegetación ribereña se conserva verde.
Conservación y valor de indicación de las especies
En términos de conservación, de las 15 especies, 14 (93.3 %) se encontraban en la categoría Baja preocupación. Solamente una de ellas está en la Lista Roja nacional: Vampyrum spectrum, capturado solamente una vez en el área de bosque cerrado de la Reserva Silvestre Privada Quelantaro.
La especie Vampyrum spectrum (Familia Phyllostomidae, Subfamilia Vampyrinae), también conocido como “falso vampiro” o “murciélago espectral”, se encuentra en la Lista Roja de la UICN con categoría de “Casi Amenazado”, también es indicador de bosques maduros (Cuadro 1). Es una especie de tamaño grande, entre 125 y 200 g los adultos y un metro de envergadura (Emmons, 1997; Esquivel y Rodríguez-Bolaños, 2018), netamente carnívoro y solitario, cuya dieta incluye aves, otros murciélagos, ratones e insectos, el peso de sus presas varía entre 3 g y 50 g (Bonato et al., 2004; Altringham, 2011). La destrucción de sus hábitats y el desconocimiento de esta especie rara, forman parte de su amenaza (Aguirre et al., 2009). Los individuos de esta especie evitan volar en espacios abiertos o fuera de la cobertura vegetal y son especialistas en términos de alimentación y requerimientos de hábitat (Galindo-González, 2007).
Una de las especies que tuvo alta representación en cuanto al gremio alimenticio hematófago fue Desmodus rotundus (una especie de importancia económico-sanitaria) conocido como “vampiro común” por su abundancia, es gregario y habita en zonas cálidas y silvestres, se guarece en todo tipo de refugio, los que incluyen huecos de árboles, grutas, túneles, minas, ruinas arqueológicas o casas abandonadas. En áreas naturales se alimenta de fauna silvestre, incluyendo animales como tapires (Tapirus sp.), pecaríes (Tayassu sp.) y corzuelas o venado cachito (Mazama americana), pero su dieta se ha visto modificada por la disponibilidad alimenticia que le ofrece el ganado (vacas, caballos, cabras, ovejas, cerdos), las aves de corral, y algunas veces, el ser humano (Voigt y Kelm, 2006). Diphylla ecaudata, conocido como “vampiro de patas peludas”, es más pequeño y no es gregario (vive solitario), prefiriendo atacar aves de corral (Quintana y Pacheco, 2007). Estos se encontraron tanto en hábitats abiertos como cerrados en las Reservas Silvestres Celocuague, Egon Borucki in Memoriam, La Mákina y Quelantaro.
De las 15 especies registradas, dos de estas (13.3 %) son indicadores de áreas conservadas según la literatura (Cuadro 1), entre ellas Artibeus lituratus indicador de áreas no alteradas y Vampyrum spectrum indicadores de bosques maduros. De los dos, el que fue capturado con mayor frecuencia fue Artibeus lituratus (21 individuos), en las reservas Celocuague, Concepción de María, Egon Borucki in Memoriam, Montibelli y Quelantaro; y Vampyrum spectrum solamente fue encontrado una vez en la reserva Quelantaro.
Cuadro 1.
Especies de murciélagos como bioindicador ambiental por reserva (RSP) y capturas absolutas
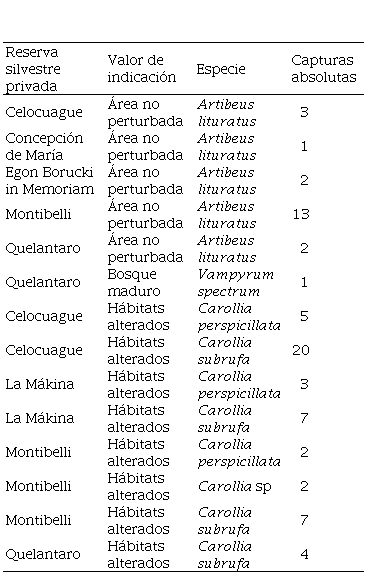
La información del valor de indicación se tomó de Medina-Fitoria (2014).
| Reserva silvestre privada | Valor de indicación | Especie | Capturas absolutas |
| Celocuague | Área no perturbada | Artibeus lituratus | 3 |
| Concepción de María | Área no perturbada | Artibeus lituratus | 1 |
| Egon Borucki in Memoriam | Área no perturbada | Artibeus lituratus | 2 |
| Montibelli | Área no perturbada | Artibeus lituratus | 13 |
| Quelantaro | Área no perturbada | Artibeus lituratus | 2 |
| Quelantaro | Bosque maduro | Vampyrum spectrum | 1 |
| Celocuague | Hábitats alterados | Carollia perspicillata | 5 |
| Celocuague | Hábitats alterados | Carollia subrufa | 20 |
| La Mákina | Hábitats alterados | Carollia perspicillata | 3 |
| La Mákina | Hábitats alterados | Carollia subrufa | 7 |
| Montibelli | Hábitats alterados | Carollia perspicillata | 2 |
| Montibelli | Hábitats alterados | Carollia sp | 2 |
| Montibelli | Hábitats alterados | Carollia subrufa | 7 |
| Quelantaro | Hábitats alterados | Carollia subrufa | 4 |
La especie Artibeus lituratus (Familia Phyllostomidae, Subfamilia Stenodermatinae) es una de las más grande del género, ocupando refugios en follaje denso, hojas de palmas y huecos en los árboles; este frugívoro puede cargar frutos que pesan casi su propio tamaño como el aguacate (71.7 g) (Duque-Márquez y Muñoz-Romo, 2015). Generalmente se alimentan de frutos de los géneros Brosimum sp., Cecropia sp., Diospyros sp., Ficus sp., Manilkara sp., Masticodendron sp., Piper sp., Pouteria sp., Solanum sp., Spondias sp., entre otros (Acosta y Aguanta, 2006), la mayoría bayas y drupas.
Las especies que se registraron del género Carollia (Familia Phyllostomidae, Subfamilia Carolliinae), son indicadoras de hábitats alterados según la literatura, de estas, en cuanto al número de individuos capturados, sobresale Carollia subrufa (38 individuos) determinadas en Celocuague, La Mákina, Montibelli y Quelantaro; seguida por Carollia perspicillata (10) observadas en las reservas Celocuague, La Mákina y Montibelli; finalizando con Carollia sp (dos) registrada en Montibelli.
CONCLUSIONES
Se determinaron 15 especies en las seis reservas silvestres privadas, de ellas Artibeus jamaicensis, Carollia subrufa, Artibeus lituratus y Desmodus rotundus fueron las más abundantes, siendo Phyllostomidae la familia más representada.
No se determinó diferencias en la diversidad biológica comparada entre los registros en el área de bosque abierto y el área de bosque cerrado.
Las especies forman cinco grupos según el gremio y las preferencias de hábitats, los murciélagos frugívoros que se encuentran en todo tipo de hábitat; los nectarívoros que se encuentran en bosques y áreas perturbadas; los frugívoros que solamente se encuentran en bosques; los hematófagos de hábitats variados y los insectívoros propios de bosques. Aparte de estos grupos, se ubicó separado a Vampyrum spectrum por tener un hábito exclusivamente carnívoro.
Dos especies fueron relevantes según su estado de conservación y su valor de indicación, entre ellas Vampyrum spectrum, especie en Lista Roja, indicador de bosques maduros, y Artibeus lituratus, indicador de áreas no alteradas por tener una preferencia de hábitat de bosques siempreverdes, semideciduos y al encontrarse ausente en áreas altamente perturbadas.
Agradecimientos
Este estudio no pudo haber sido posible sin el financiamiento de la Universidad Nacional Agraria. Se agradece a las Reservas Silvestres Privadas Celocuague, Concepción de María, Egon Borucki in Memoriam, La Mákina, Montibelli y Quelantaro por el apoyo brindado y por ser parte de este estudio. Se extiende nuestro agradecimiento al profesor Lic. Octavio Saldaña Tapia, experto en mastozoología con amplia experiencia en estudios de murciélagos en Nicaragua, por haber compartido sus conocimientos y experiencia.
REFERENCIAS BIBLIOGRÁFICAS
Acosta, L. y Aguanta, F. (2006). Un nuevo aporte en el conocimiento de la dieta de los murciélagos frugívoros Artibeus lituratus y A. jamaicensis. Kempffiana, 2(1), 127-133. https://museonoelkempff.org/sitio/Informacion/KEMPFFIANA/Kempffiana%202(1)/127-133.pdf
Aguirre, L. F., Acosta, L. y Vargas, A. (2009). Vampyrum spectrum. En Libro Rojo de la fauna silvestre de vertebrados de Bolivia. Ministerio de Medio Ambiente y Agua. http://repositorio.uasb.edu.bo:8080/handle/20.500.14624/1395
Altringham, J. D. (2011). Bats: From Evolution to Conservation. Oxford University Press. https://academic.oup.com/book/5634
Bernard, E. (2001). Vertical stratification of bat communities in primary forests of Central Amazon, Brazil. Journal of Tropical Ecology, 17, 115-126. https://www.researchgate.net/publication/231923491_Vertical_stratification_of_bat_communities_in_primary_forests_of_Central_Amazon_Brazil
Bonato, V., Gomes, F. K., & Uieda, W. (2004). Food habits of bats of Subfamily Vampyrinae in Brazil. Journal of Mammalogy, 85(4), 708-713. https://www.researchgate.net/publication/240775706_Food_Habits_Of_Bats_Of_Subfamily_Vampyrinae_in_Brazil
De Jong, J. (1995). Habitat uses and species richness of bats in a patchy landscape. Acta Theriologica, 40, 237-248. https://rcin.org.pl/Content/12348/PDF/BI002_2613_Cz-40-2_Acta-T40-nr20-237-248_o.pdf
Duque-Márquez, A. y Muñoz-Romo, M. (2015). Registro máximo de carga de fruto en murciélagos frugívoros: Artibeus lituratus (Chiroptera: Phyllostomidae). Revista Mexicana de Mastozoología, 5(1), 96-100. https://www.researchgate.net/publication/335008183_REGISTRO_MAXIMO_DE_CARGA_DE_FRUTO_EN_MURCIELAGOS_FRUGIVOROS_Artibeus_lituratus_CHIROPTERA_PHYLLOSTOMIDAE
Emmons, H. (1997). Neotropical Rainforest Mammals: A Field Guide (2nd ed.). The University of Chicago Press. https://press.uchicago.edu/ucp/books/book/chicago/N/bo3628148.html
Esquivel, D. A. y Rodríguez-Bolaños, A. (2018). Un nuevo registro de Vampyrum spectrum (Linnaeus, 1758) en el departamento de Meta, Colombia. Revista Biodiversidad Neotropical, 8(1), 43-48. https://www.revistas.utch.edu.co/ojs/index.php/Bioneotropical/article/view/645/pdf_50
Estella, E., Pach-Canché, J. M., Hernández-Betancourt, S. F., López-Castillo, D. L. y Moreno, C. E. (2014). Diversidad de murciélagos (Chiroptera: Mammalia) en dos zonas arqueológicas de Yucatán, México. Acta Zoológica Mexicana, 30(1), 188-200. https://azm.ojs.inecol.mx/index.php/azm/article/view/138
Galindo-González, J. (2007). Efectos de la fragmentación del paisaje sobre poblaciones de mamíferos: El caso de los murciélagos de Los Tuxtlas, Veracruz. En G. Sánchez-Rojas y A. Rojas-Martínez (Eds.), Tópicos en sistemática, biogeografía, ecología y conservación de mamíferos (pp. 97–114). Universidad Autónoma del Estado de Hidalgo. https://www.uaeh.edu.mx/investigacion/icbi/LI_EcoConserBiolo/gerardo_sanchez/2007LibroTopicos.pdf
Galindo-González, J., & Sosa, V. J. (2003). Bats species richness in man-made pastures in a fragmented tropical landscape. Southwestern Naturalist, 48(4), 579-589. https://www.academia.edu/3188580/FRUGIVOROUS_BATS_IN_ISOLATED_TREES_AND_RIPARIAN_VEGETATION_ASSOCIATED_WITH_HUMAN_MADE_PASTURES_IN_A_FRAGMENTED_TROPICAL_LANDSCAPE
García-García, J. y Santos-Moreno, J. A. (2008). Diversidad de cuatro ensamblajes de murciélagos en San Miguel Chimalapa, Oaxaca, México. En C. Lorenzo, E. Espinoza, y J. Ortega (Eds.), Avances en el estudio de los mamíferos de México II (pp. 411-426). Asociación Mexicana de Mastozoología. https://www.researchgate.net/publication/260425035_Diversidad_de_cuatro_ensambles_de_Murcielagos_en_San_Miguel_Chimalapa_Oaxaca_Mexico
González, M. (2020, junio 29). Murciélagos de la reserva silvestre El Bajo en Managua. Revista Naturalista. https://www.revistanaturalista.com/murcielagos-de-la-reserva-silvestre-el-bajo-en-managua/
González-Rivas, B. (2005). Tree species diversity and regeneration of tropical dry forest in Nicaragua [Doctoral dissertation, Swedish University of Agricultural Sciences]. SLU library. https://pub.epsilon.slu.se/id/file/1260
Hammer, Ø., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological Statistics software package for education and data analysis. Paleontologia Electronica, 4(1), 9. https://palaeo-electronica.org/2001_1/past/past.pdf
Hutson, A. M., Mickleburgh, S. P., & Racey, P. A. (2001). Microchiropteran bats: Global status survey and conservation action plan. IUCN/SSC Chiroptera Specialist Group. https://portals.iucn.org/library/efiles/documents/2001-008.pdf
Janzen, D. (1991). Historia natural de Costa Rica. Editorial de la Universidad de Costa Rica. https://www.acguanacaste.ac.cr/historia-natural-costa-rica/Historia-natural-de-Costa-Rica-Editado-por-Daniel-H-Janzen-1991.pdf
Jones, G., Jacobs, D. S., Kunz, T. H., Willig, M. R., & Racey, P. A. (2009). Carpe noctem: The importance of bats as bioindicators. Endangered Species Research, 8, 93-115. https://www.researchgate.net/publication/250221981_Carpe_noctem_The_importance_of_bats_as_bioindicators
Kareiva, P. (1987). Habitat fragmentation and the stability of predator-prey interactions. Nature, 326, 388-390. https://www.nature.com/articles/326388a0
Krauss, J., Bommarco, R., Guardiola, M., Heikkinen, RK., Helm, A., Kuussaari, M., Lindborg, R., Ockinger, E., Pärtel, M., Pino, J., Pöyry, J., Raatikainen, KM., Sang, A., Stefanescu, C., Teder, T., Zobel, M., Steffan-Dewenter, I. (2010). Habitat fragmentation causes immediate and time-delayed biodiversity loss at different trophic levels. Ecology Letters, 13, 597-605. https://pmc.ncbi.nlm.nih.gov/articles/PMC2871172/
LaVal, R. y Rodríguez-H., B. (2002). Murciélagos de Costa Rica. Editorial INBio.
MacSwiney, G. M. C. (2010). Murciélagos. En R. Durán y M. Méndez (Eds.), Biodiversidad y desarrollo humano en Yucatán. CICY. https://www.cicy.mx/Documentos/CICY/Sitios/Biodiversidad/pdfs/Cap4/56%20Murcielagos.pdf
MacSwiney, G. M. C., Bolivar, B., Clark, F. M., & Racey, P. A. (2009). Insectivorous bat activity at cenotes in the Yucatan Peninsula, México. Acta Chiropterologica, 11, 139-147. https://bioone.org/journals/acta-chiropterologica/volume-11/issue-1/150811009X465758/Insectivorous-Bat-Activity-at-Cenotes-in-the-Yucatan-Peninsula-Mexico/10.3161/150811009X465758.short
MacSwiney, G. M. C., Vilchis, P., Clarke, F. M., & Racey, P. A. (2007). The importance of cenotes in conserving bat assemblages in the Yucatan, Mexico. Biological Conservation, 136, 499-509. https://www.sciencedirect.com/science/article/abs/pii/S0006320707000274?utm_source=
Magurran, A. (2004). Measuring Biological Diversity. Blackwell Publishing. http://www.bio-nica.info/Biblioteca/Magurran2004MeasuringBiological.pdf
Martínez Gómez, D., González Lazo, D., Saldaña Tapia, O. y Flores-Pacheco, J. (2020). Estructura de comunidades de murciélagos como bioindicadores del hábitat en la Reserva Biológica Indio Maíz. Revista Científica Estelí, (34), 180–199. https://camjol.info/index.php/FAREM/article/view/10015
McNab, B. K. (1982). Evolutionary alternatives in the physiological ecology of bats. En T. H. Kunz (Ed.), Ecology of bats (pp. 151–196). Plenum Publishing Corporation. https://zenodo.org/records/13443270/files/McNab%20-%201982%20-%20Evolutionary%20Alternatives%20in%20the%20Physiological%20Eco.pdf?download=1
Medina-Fitoria, A. (2014). Murciélagos de Nicaragua: Guía de Campo. Dirección de Biodiversidad, MARENA.
Moreno, C. E. (2001). Métodos para medir la biodiversidad. https://www.researchgate.net/publication/304346666_Metodos_para_medir_la_biodiversidad
Pérez, T., López, C. y Guerrero, J. (2012). Evaluación de la diversidad de quirópteros en el paisaje terrestre protegido Mesas de Moropotente. Revista Científica-FAREM Estelí/Ciencias Ambientales, 1(1), 10-19. http://www.bio-nica.info/biblioteca/Perez2012murcielagos.pdf
Quintana, H. y Pacheco, V. (2007). Identificación y distribución de los murciélagos vampiros del Perú. Revista Peruana de Medicina Experimental y Salud Pública, 24(1), 81-88. http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1726-46342007000100011
R Core Team. (2015). R: A language and environment for statistical computing (Version 3.2.2) [Computer software]. R Foundation for Statistical Computing. https://www.r-project.org/
Rivas Pérez, D., Castillo Benavidez, I., y Rodríguez, J. (2015). Evaluación de la composición de murciélagos en ecosistemas presentes en la comunidad La Garnacha Reserva Natural Tisey – Estanzuela, Estelí Nicaragua, II semestre 2014 [Tesis de Licenciatura, Universidad Nacional Autónoma de Nicaragua, UNAN-Managua]. RIUMA. https://repositorio.unan.edu.ni/1971/
Romero-Almaraz, M. L., Aguilar–Setién, A., y Sánchez–Hernández, C. (2006). Murciélagos benéficos y vampiros: Características, importancia, rabia, control y conservación. AGT Editor, IMSS.
Torres-Flores, J. W. C. (2005). Estructura de una comunidad tropical de murciélagos presente en la cueva “El Salitre”, Colima, México (Tesis de maestría, Universidad Autónoma Metropolitana, Unidad Iztapalapa).
Voigt, C. C., & Kelm, D. H. (2006). Host preference of the common vampire bat (Desmodus rotundus; Chiroptera) assessed by stable isotopes. Journal of Mammalogy, 87, 1-6. https://www.researchgate.net/publication/240775719_Host_Preference_of_the_Common_Vampire_Bat_Desmodus_rotundus_Chiroptera_Assessed_by_Stable_Isotopes
Williams-Guillen, K. y Medina, A. (2016). Una guía breve de los Murciélagos del Volcán Masaya, Nicaragua.https://docplayer.es/10240404-Una-guia-breve-de-los-murcielagos-del-volcanmasaya-nicaragua.html
Zamora Ávila, M. (2010). Caracterización de la flora y estructura de un bosque transicional húmedo a seco, Miramar, Puntarenas, Costa Rica [Tesis de Licenciatura, Instituto Tecnológico de Costa Rica]. RepositorioTEC. https://repositoriotec.tec.ac.cr/handle/2238/3017
Zárate, D. G., Serrato, A., y López-Wilchis, R. (2012). Importancia ecológica de los murciélagos. Contactos, 85, 19-27. https://www.academia.edu/19627723/Importancia_ecologica
Notas de autor
1 Ingeniero en Recursos Naturales
2 MSc. Biología Ambiental y de Bosques – Ecología
3 Ingeniero en Recursos Naturales
4 Ingeniero en Recursos Naturales Renovables








