



Impacto de la aplicación de una metodología de marcación del cambium en la evaluación de vasos formados exclusivamente en el xilema bajo tratamiento de estrés hídrico
Impact of the application of a cambium marking methodology in the evaluation of vessels formed exclusively in the xylem under treatment of water stress
Revista de la Facultad de Agronomía
Universidad Nacional de La Plata, Argentina
ISSN: 1669-9513
Periodicidad: Semestral
vol. 120, núm. 1, 2021
Recepción: 31/03/2020
Aprobación: 05/08/2020
Resumen: La formación de xilema es un proceso cíclico a partir del cambium. La actividad estacional del cambium puede ser estudiada con diferentes metodologías (lesión mecánica en este trabajo). Identificar con exactitud el xilema formado durante un período de tratamiento de estrés abiótico permitiría realizar interpretaciones correctas en cuanto al efecto específico del estrés en la producción de xilema. Los objetivos fueron: 1- Evaluar si las mediciones de vasos realizadas sólo en el xilema formado durante el período de estrés hídrico tienen mayor sensibilidad que cuando se realizan en la totalidad del xilema; 2- Explicar los puntos más importantes de la técnica de marcación y los pasos metodológicos posteriores en el análisis morfométrico. Se trabajó sobre diez plantas de Salix matsudana ´NZ692´, a 5 plantas se las inundó por 35 días y las otras 5 fueron controles. Posteriormente crecieron por 28 días de recuperación. Las plantas fueron marcadas con una incisión de bisturí a nivel del cambium al inicio y al final del tratamiento. El análisis morfométrico de los vasos se realizó sobre 3 áreas en el xilema marcado: 1- sólo el área de tratamiento, 2- sólo el área de recuperación y 3- todo el crecimiento (suma de pre-tratamiento, tratamiento y recuperación). Los vasos producidos exclusivamente durante el período de estrés se diferenciaron de los vasos formados posteriormente y de los medidos en todo el tallo. Asimismo, la técnica de marcación del cambium permitió identificar el área específica de formación de xilema bajo estrés hídrico. La utilización de esta técnica relativamente sencilla, puede mejorar sustancialmente la interpretación de cambios anatómicos ocurridos en el xilema bajo estrés.
Palabras clave: cambium, marcación xilema, vasos, pinning, Salix.
Abstract: Xylem formation is a cyclical process developed from cambium. The seasonal activity of cambium can be studied with different methodologies (in this work a mechanical injury method). Accurately identifying the xylem formed during a period of abiotic stress treatment would allow correct interpretations of the specific effect of stress on xylem production. The objectives were: 1- To assess whether the measurements of the vessels made only in the xylem formed during the period of water stress are more sensitive than when they are made throughout the xylem; 2- Explain the most important points of the marking technique and the subsequent methodological steps in the morphometric analysis. Ten cuttings of Salix matsudana ´NZ692´ were planted in pots: 5 plants were flooded for 35 days and the other 5 plants were control (non-flooded). They subsequently grew for 28 days of recovery. The plants were marked with a scalpel incision at the level of the cambium at the beginning and at the end of the treatment. The vessel’s morphometric analysis was done at three measurement areas: 1- only the treatment area, 2- only the recovery area and 3- all growth (sum of pre-treatment, treatment and post-treatment areas). The vessels produced exclusively during the stress period differed from those formed later and from those measured throughout the stem. Likewise, the cambium marking technique allowed identifying the specific area of xylem formation under water stress. The use of this relatively simple technique can substantially improve the interpretation of anatomical changes that occurred in the xylem under stress.
Keywords: cambium, xylem marking, vessels, pinning, Salix.
INTRODUCCIÓN
La formación de xilema es un proceso cíclico y periódico. Su desarrollo comienza con la división de las células del meristema cambium, seguido de sucesivas fases de diferenciación celular, elongación, formación de pared secundaria, lignificación y muerte celular (Esau, 1977; Plomion et al., 2001). La morfología y funcionalidad de las células del xilema diferenciadas por el cambium pueden variar de acuerdo con diversos factores, como luz, temperatura, nutrientes y disponibilidad de agua (Savidge, 2000; Schweingruber, 2007). Existe un control genético sobre la producción cambial de nuevas células del xilema, pero su ritmo es determinado por factores limitantes del ambiente (Savidge, 1996; Kozlowsky & Pallardy, 1997). Uno de estos factores es el agua, la que debido a un exceso (inundación) o defecto (sequía), se plantea como uno de los principales factores abióticos de estrés en los cultivos forestales (Corcuera et al., 2004; Fernández de Uña et al., 2017; Choat et al., 2018).
La actividad estacional y dinámica del cambium puede ser estudiada con diferentes metodologías, como: método de pinchado (pinning), micro barrenado (micro-coring), dendrómetros, muestreo de bloques de tejidos que contienen el cambium (Mariaux window), métodos radiológicos (Wolter, 1968; Schmitt et al., 2000; Forster et al., 2000; Mäkinen et al., 2003; Gričar et al., 2007), entre otros. La elección del método de estudio dependerá del objetivo del trabajo, disponibilidad de equipamiento, tamaño de las plantas, entre otros factores.
Los métodos de lesión mecánica del cambium, como el pinchado (pinning) o de ventana (Mariaux window), se basan en la capacidad del cambium y sus células derivadas, de responder a lesiones mecánicas menores sin afectar la integridad fisiológica de la planta (Wolter, 1968). La inserción de pequeñas agujas, la realización de pequeños cortes en el cambium o la extracción de bloques de tejidos desde la zona exterior de la corteza, causan reacciones de cicatrización en el xilema que dejan marcas morfológicas identificables (Gričar et al., 2007). La aplicación de estos métodos de marcado del cambium se extiende a varias disciplinas, como dendrocronología, dendroecología, anatomía ecológica, etc. (Villalba, 1985; Worbes, 1995; Dünisch et al., 2003; Oliveira et al., 2007; Terrazas et al., 2011; Callado et al., 2013). Desde la perspectiva de la ecofisiología de plantas leñosas, sería de gran utilidad aplicar esta metodología en algunos ensayos en condiciones controladas o a campo, para identificar cuáles son las nuevas capas de xilema formadas durante el tratamiento que se está evaluando (estrés abiótico o biótico).
Existen muy pocos antecedentes del uso de este tipo de marcación en un ensayo de estrés abiótico para identificar con exactitud el xilema formado durante el período de tratamiento a evaluar (Eilmann et al., 2011; Van Camp et al., 2017). La alternativa utilizada para lograr este análisis diferencial en el xilema es la evaluación fraccionada de plantas en las distintas etapas de un ensayo (Arend & Fromm, 2007; Balducci et al., 2013; Copini et al., 2016). Esta estrategia redunda en un aumento considerable de la cantidad de repeticiones que deben instalarse al principio del ensayo. Sin embargo, la bibliografía de ecofisiología de leñosas muestra que, lo más usual, es no realizar ningún tipo de diferenciación entre el xilema formado exclusivamente durante el tratamiento, del xilema formado en la totalidad del periodo de ensayo (Lovisolo & Schubert, 1998; Doffo et al., 2017). La producción de xilema en un ensayo de estrés abiótico es relativamente menor que cuando no se produce el estrés. Por lo tanto, el análisis de los resultados de mediciones cuantitativas realizadas en el xilema sin identificar (xilema formado en la totalidad de un ensayo) puede no mostrar diferencias significativas. Esto conlleva la pérdida de sensibilidad en el análisis al promediar las variables de interés medidas en zonas sin tratamiento y a las medidas en zonas de tratamiento, por lo tanto pueden no detectarse diferencias significativas. A partir de esta falta de identificación del inicio y finalización de un tratamiento pueden realizarse interpretaciones erróneas en cuanto al efecto específico del estrés en la producción de xilema.
En el marco de una tesis de doctorado en la Facultad de Ciencias Agrarias y Forestales (UNLP), se realizó un ensayo de estrés hídrico por inundación en un clon de sauce (Mozo et al., 2018). La evaluación del diámetro y número de vasos del leño dentro del xilema formado durante la aplicación del tratamiento fue exitosa, debido a la marcación del cambium luego de una lesión mecánica previa y posterior al tratamiento. En este contexto, este trabajo muestra, a partir de los resultados cuantitativos del leño, la ventaja de la aplicación de este método de marcado, en comparación con los datos resultantes sin la marcación. Los objetivos particulares del presente trabajo fueron:
Hipótesis:
La formación de los vasos producida exclusivamente durante el período de estrés se diferencia en diámetro y/o número de los vasos formados en forma previa y posterior a la aplicación del tratamiento.
La técnica de marcación del cambium por lesión mecánica permite identificar en forma inequívoca el área específica de formación de xilema bajo estrés abiótico.
MATERIALES Y MÉTODOS
Se trabajó sobre material de Salix matsudana ´NZ692´. Diez estacas de este clon fueron plantadas en maceta dentro de un invernadero, una estaca por maceta. Por cada estaca brotada se seleccionó un único tallo eliminando los otros brotes. Sobre este tallo se realizaron todas las mediciones. El ensayo comenzó cuando las plantas superaron los dos meses de edad y se les realizó el siguiente tratamiento de estrés hídrico: a 5 plantas se las inundó 40 cm por encima de su nivel de suelo de tal forma que el 50 % del tallo quedó bajo agua (Figura 1 y Figura 2 B). Las otras 5 plantas se regaron a capacidad de campo (control). El período de inundación fue de 35 días, seguido por un período de 28 días de recuperación post-inundación (ver cronología del ensayo en Figura 1) (Mozo et al., 2018).
Marcación del cambium
Las 10 plantas fueron marcadas a nivel del cambium en dos oportunidades en forma diferencial (una vez al inicio del tratamiento y una vez al final de este, Figura 1). No todas las plantas recibieron las dos marcaciones para evitar un efecto debido a las heridas en plantas con tallos tan pequeños. De las 5 plantas inundadas, 2 plantas se marcaron solo al inicio del tratamiento (día 81, Figura 1), 2 plantas solo al finalizar el mismo (día 116) y 1 planta se marcó dos veces (inicio y final tratamiento). Lo mismo se realizó con las 5 plantas control. La marcación se realizó con el método de pinning (Gričar et al., 2007) que fue modificado utilizando un bisturí (en lugar de una aguja como es la técnica original) para cortar en forma puntual la corteza hasta llegar al xilema (metodología de lesión mecánica del tejido). La incisión se logró colocando el bisturí en forma horizontal y perpendicular al tallo, tratando que la lesión sea lineal (pero casi puntual) evitando así realizar una herida mayor a un cuarto del perímetro del tallo (Figura 2 A). La ventaja de realizar una marca con el bisturí es que resulta notoria a simple vista, cosa que no sucede cuando se realiza con una aguja. Una marcación con agujas conlleva la señalización de la posición de la herida durante todo el ensayo para poder hacer el muestreo y corte del tallo en la zona de estudio. El tratamiento de inundación que se practicó en el presente trabajo posicionó la herida realizada por debajo del nivel del agua, por lo tanto cualquier señalización de la misma podría perderse. Todas las marcas se realizaron en el mismo nivel del tallo (5 cm desde la base que sale de la estaca), del lado interno (cercano a la estaca), en la marcación del inicio del tratamiento (Figura 2 A) y del lado opuesto (y 5 mm hacia arriba), en la segunda marcación.
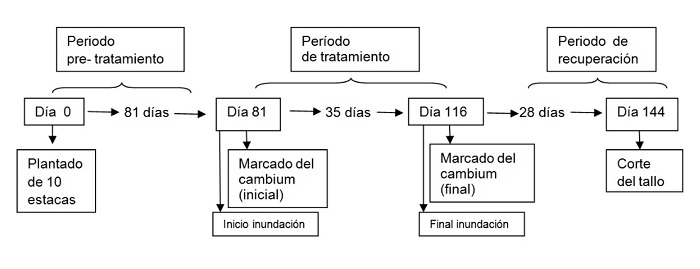
Diagrama de la cronología del ensayo
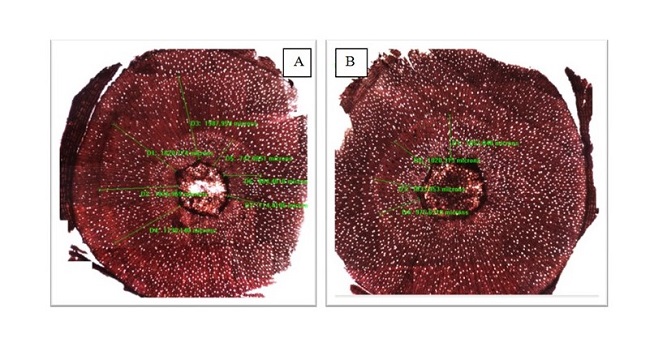
Al finalizar el ensayo (día 144) las plantas fueron removidas de las macetas, y se les seccionó una muestra del tallo de 10 cm de longitud, donde quedó incluida el área de marcación del cambium. Se localizó la zona donde se visualizaba la marca de corte en la corteza (cicatriz visible a simple vista, Figura 2 C) para poder realizar los cortes histológicos en la zona inmediata superior a ésta (a 7-10 mm). El desplazamiento de la zona de corte al xilema inmediato superior responde a la necesidad de visualizar la marca permitiendo a su vez observar la menor modificación del tejido a medir. En la zona exacta de marcación, el tejido cicatricial muestra una alteración en la organización del xilema con células indiferenciadas (Figura 3 A).

Metodología de marcación del cambium lesionando puntualmente el tallo con un bisturí (A), tratamiento de inundación con 40 cm agua por encima del suelo por inmersión de dos macetas en un tanque de 100 litros y plantas control sin inundar (B), muestra de tallo mostrando la cicatriz de la marcación del cambium (C, flecha)
Se realizaron cortes transversales de la totalidad de la sección en forma manual y se tiñeron con safranina al 1 % en agua. Los cortes se observaron montados en forma transitoria en agua. A partir de la observación con una magnificación de 4x en un microscopio de luz transmitida (Olympus CX31, Japón), se tomaron imágenes digitales individuales y con ellas se construyeron mosaicos para reconstruir toda la sección transversal del tallo. Sobre los mosaicos se identificó la zona marcada, como una leve cicatriz en sentido tangencial y poca alteración del tejido que la rodeaba (Figura 3 B).

Imágenes del tallo en corte transversal en dos plantas. A: corte histológico realizado en la zona de marcación del cambium (flecha blanca), nótese la alteración del tejido cicatricial que se forma hacia el exterior de la incisión; B: corte histológico realizado en la zona inmediata superior a la marcación del cambium, en una planta que recibió 2 marcaciones (al día 81 de inicio inundación y al día 116 de finalización de la inundación)
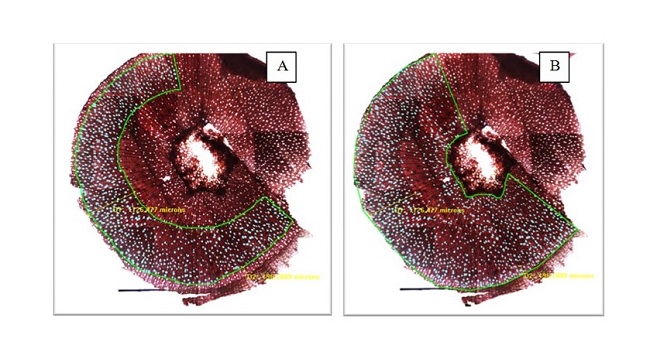
En cada grupo experimental (control e inundadas) se marcaron 5 plantas. Para identificar el final del tratamiento de las dos plantas que no lo presentaban, se utilizó como referencia la marca de final del período de inundación que presentaban las otras tres plantas del grupo experimental. El procedimiento inverso se realizó para identificar el inicio de tratamiento en aquellas dos plantas que no lo presentaban. Para referenciar las marcas, se midió la distancia lineal desde la médula hasta la primera marca y hasta la segunda, en 5 radios por muestra (Figura 4 A y Figura 4 B). En las 10 plantas (5 control y 5 inundadas) se midió el radio total del tallo desde la médula hasta la corteza (sobre 5 radios por muestra). Para cada una de las marcas se calculó la proporción que representaba respecto de la longitud total del radio, mediante el siguiente cálculo:
longitud radio marcado *100 / longitud radio total
De esta manera, se obtuvieron 3 valores (en %) para la marca de inicio y 3 valores para la de finalización, los que se promediaron. Así, la marca de inicio representó, en promedio, el 41 % de la longitud total del radio para las plantas control y el 43 % para las inundadas, mientras que la marca de finalización del tratamiento representó un 78 % y 67 % de la longitud del radio para las plantas control e inundadas, respectivamente. Con estas proporciones, se procedió a marcar la totalidad de los mosaicos, respetando los grupos experimentales.
A: planta control con 2 marcas (inicio y fin de tratamiento). B: planta inundada con una marca única al inicio del tratamiento. En verde se observan las mediciones radiales desde la médula hasta la marca respectiva
Medición de los vasos
Luego de la identificación de las marcas de inicio y finalización de tratamiento de todas las muestras, se procedió al trazado del área de medición mediante un programa específico para análisis de imágenes (ImagePro v6.0, Media Cybernetics, USA). Se trazaron tres áreas de medición sobre la mitad del tallo que involucraban: 1- sólo el área de tratamiento (entre las 2 marcaciones del cambium), 2- sólo el área de recuperación post-tratamiento (desde la marca de finalización del tratamiento hasta la corteza) y 3- tallo completo que involucra todo el crecimiento desde la médula hasta la corteza (período previo al tratamiento de 81 días + 35 días de tratamiento y 28 días de recuperación) (Figura 5).
Ejemplos de los trazados de áreas de medición (líneas verdes) y medición automática de vasos (puntos celestes), que involucraron sólo el área de tratamiento (A), y todo el crecimiento desde la médula hasta la corteza (período previo al tratamiento de 60 días + 30 días de tratamiento + 28 días de recuperación, B). En texto amarillo se señala el espesor del xilema formado luego de la primera y de la segunda marcación
La medición de las variables de interés, diámetro medio de vasos (DV, µm) y número de vasos (NV, n°/mm2), se realizó en forma automática luego de la segmentación de los espacios claros con determinadas características de diámetro (entre 10 µm y 70 µm), por medio del analizador de imágenes (Figura 5). Se midió el diámetro medio individual de todos los vasos incluidos en las tres áreas de medición.
El diseño experimental factorial contó con el siguiente esquema: 3 áreas de medición y 2 grupos experimentales dentro de cada área de medición (con 5 repeticiones cada una). El modelo de ANOVA factorial (1) verificó la interacción de ambos factores para el diámetro de vasos. Para abrir esa interacción se realizaron ANOVAs simples por cada factor (2 y 3) para testear el área de medición como fuente de variación en cada grupo experimental, y las diferencias entre las plantas control y tratadas (grupos experimentales) dentro de cada área de medición. Las comparaciones de medias fueron realizadas mediante la prueba de Tukey (p<0,05)
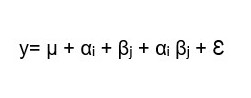 (1)
(1)y: Diámetro / Número de vasos
αi: Diámetro / Número de vasos correspondiente a la i-ésima área de medición
βj Diámetro / Número de vasos correspondiente al j-ésimo grupo experimental
αi βj: interacción entre áreas de medición y grupos experimentales
Ɛ: error experimental
i (áreas de medición): sólo tratamiento, sólo recuperación, tallo completo
j: (grupos experimentales): control, inundadas
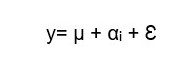 (2)
(2)yj: Diámetro / Número de vasos en cada grupo experimental por separado
αi: Diámetro / Número de vasos correspondiente a la i-ésima área de medición
Ɛ: error experimental
i (áreas de medición): sólo tratamiento, sólo recuperación, tallo completo
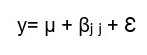 (3)
(3)y: Diámetro / Número de vasos en cada área de medición por separado
βj: Diámetro / Número de vasos correspondiente al j-ésimo grupo experimental
Ɛ: error experimental
j (grupos experimentales): control, inundadas
RESULTADOS y DISCUSION
Los resultados de las mediciones en las diferentes áreas de marcación y grupos experimentales se muestran en la Tabla 1.
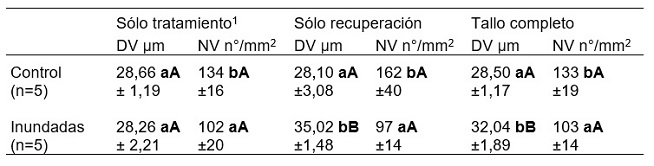
Según el ANOVA factorial, las áreas de medición fueron fuentes significativas de variación sólo para la variable diámetro de vasos (DV) en el tratamiento de inundación (interacción significativa entre área de medición x grupo experimental, p=0,0013). El número de vasos (NV) no presentó diferencias entre áreas de medición en las plantas control ni en las tratadas (p=0,184). El valor promedio del DV de las plantas inundadas fue significativamente menor en el área de tratamiento que en las otras dos áreas de medición (Tabla 1, letras mayúsculas de la prueba de Tukey, (ANOVA de un factor ecuación 2), mientras que el NV resultó similar en todas las áreas. Las plantas control no variaron significativamente el DV ni el NV entre las áreas de medición.
Si analizamos los datos dentro de cada área de medición entre los promedios de las plantas control vs. las plantas inundadas (ANOVA de un factor ecuación 3), se observó que, durante el tratamiento, las plantas inundadas formaron vasos de igual diámetro que los controles, pero en menor cantidad (Tabla 1, columna Sólo tratamiento, letras minúsculas de la prueba de Tukey). Durante el período de recuperación las plantas inundadas formaron menor cantidad de vasos y de mayor diámetro que el control. En la medición de la sección completa del tallo, sin discriminar las áreas de pre-tratamiento, inundación y recuperación, la tendencia se asemeja a los resultados medidos sólo en la zona de recuperación. Por lo tanto, de no tener ninguna marcación del xilema que indique cuándo se inicia y finaliza el tratamiento de inundación, se estaría registrando una diferencia que no se produjo en el momento del tratamiento (inundación), sino en el período inmediato posterior (recuperación), llevando a una interpretación confusa de los resultados. Esta marcación también resulta valiosa si se requiere evaluar sólo el período de recuperación de las plantas.
Van Camp et al. (2017) publicaron resultados para la especie arbórea Maesopsis eminii Engl. donde muestran la utilidad de la técnica de pinning en la evaluación de la formación de nuevo xilema bajo estrés abiótico (sequía). Estos autores demostraron que la metodología de lesión mecánica del cambium combinada con la variación de mediciones de flujo de savia (sap flow) pueden ser usadas como herramienta precisa para cuantificar el xilema formado en determinada ventana temporal bajo ciertas condiciones ambientales (ej. estrés por sequía). En este trabajo, los autores midieron la cantidad de xilema (en mm) formado bajo tratamiento de sequía como así también en el período previo y posterior al tratamiento; sin embargo, no se presentan detalles de mediciones anatómicas cuantitativas de los vasos formados. No se hallaron otros antecedentes, que incluyan marcación del cambium, publicados para angiospermas.
La bibliografía de ecofisiología que no utiliza marcación del cambium es numerosa (Lovisolo & Schubert, 1998; Arend & Fromm, 2007; Balducci et al., 2013; Pérez de Lis et al., 2017), sin embargo, los referidos a tratamientos de inundación son muy escasos (Copini et al., 2016; Doffo et al., 2017). Para el género Salix, se publicó un trabajo del efecto del estrés hídrico en el xilema en el cual no se utilizó ningún método para diferenciar los períodos de inicio y finalización de tratamiento a nivel del cambium. Doffo et al. (2017) analizaron los vasos formados bajo diferentes tratamientos de estrés hídrico (inundación y sequía) durante diferentes períodos de entre 14 a 60 días en dos clones de sauces. Los autores hallaron diferencias significativas en los vasos formados en las plantas que tuvieron el tratamiento de inundación, siendo de menor diámetro y en igual número que en los controles. Este resultado contradice los hallados en el presente trabajo. Esta diferencia de resultados podría haberse generado, entre otras causas, en el método de cuantificación de los vasos como promedio de todo el crecimiento del tallo incluyendo el período previo a la aplicación del tratamiento.
CONCLUSION
En el contexto del presente trabajo se pudieron aceptar las dos hipótesis formuladas. Los vasos producidos exclusivamente durante el período de estrés se diferenciaron de los vasos formados en el periodo posterior a la aplicación del tratamiento y de los medidos en todo el tallo. Asimismo, la técnica de marcación del cambium por lesión mecánica permitió identificar en forma inequívoca el área específica de formación de xilema bajo estrés abiótico.
La utilización de una técnica relativamente sencilla como lo es la marcación del cambium, puede mejorar sustancialmente la interpretación de cambios anatómicos ocurridos en el xilema del tallo, que suceden como resultado de la aplicación de estrés hídrico. Desde la perspectiva de la ecofisiología de plantas leñosas, sería de gran utilidad aplicar esta metodología, en algunos ensayos en condiciones controladas o a campo, para la cuantificación de las nuevas capas de xilema formadas durante el tratamiento que se está evaluando (estrés abiótico o biótico).
Agradecimientos
A la Dra. Corina Graciano y al Dr. Enrique Portiansky por la lectura crítica del manuscrito.
BIBLIOGRAFIA
Arend, M. & J. Fromm. 2007. Seasonal change in drought response of wood cell development in poplar. Tree Physiology 27: 985-992.
Balducci, L., A. Deslauriers, A. Giovannelli, S. Rossi & C.B.K. Rathgeber. 2013. Effects of temperature and water deficit on cambial activity and woody ring feature in Picea mariana saplings. Tree Physiology 33: 1006-1017.
Callado, C.A., F.A. Roig, M. Tomazello Filho & C. Franca Barros. 2013. Cambial growth periodicity studies of south american woody species – a review. IAWA Journal 34(3): 213-230.
Choat, B., T.J. Brodribb, C.R. Brodersen, R.A. Dursma, R. López & B.E. Medlyn. 2018. Triggers of tree mortality under drought. Nature 558: 531–539.
Copini, P., J. den Ouden, E.M.R. Robert, J.C. Tardif, W.A. Loesberg, L. Goudzwaard & U. Sass-Klaassen. 2016. Flood-Ring formation and root development in response to experimental flooding of young Quercus robur trees. Frontiers in Plant Science 7: 775.
Corcuera, L., J. J. Camarero & E. Gil-Pelegrín. 2004. Effects of a severe drought on Quercus ilex radial growth and xylem anatomy. Trees 18: 83–92.
Doffo, G.M., S.E. Monteoliva, M.E. Rodríguez & V.M.C. Luquez. 2017. Physiological responses to alternative flooding and drought stress episodes in two willows (Salix spp.) clones. Canadian Journal of Forest Research 47(2): 174-182.
Dünisch, O., V.R. Montóia & J. Bauch. 2003. Dendroecological investigations on Swietenia macrophylla King and Cedrela odorata L. (Meliaceae) in the central Amazon. Trees 17: 244–250.
Eilmann, B., R. Zweifel, N. Buchmann, E. Graf Pannatier & A. Rigling. 2011. Drought alters timing, quantity, and quality of wood formation in Scots pine. Journal of Experimental Botany 62: 2763-2771.
Esau, K. 1977. Anatomy of seed plants. Ed. 2. John Wiley & Sons, New York. 576 pp.
Fernández-de-Uña, L., S. Rossi, I. Aranda, P. Fonti, B.D. González-González, I. Cañellas & G. Gea-Izquierdo. 2017. Xylem and leaf functional adjustments to drought in Pinus sylvestris and Quercus pyrenaica at their elevational boundary. Frontiers in Plant Science 8: 1200.
Forster, T., F.H. Schweingruber & B. Denneler. 2000. Increment puncher – a tool for extracting small cores of wood and bark from living trees. IAWA Journal 21: 169-180.
Gričar, J., M. Zupancic, K. Čufar & P. Oven. 2007. Wood formation in Norway spruce -Picea abies- studied by pinning and intact tissue sampling method. Wood Research 52(2): 1-10.
Kozlowsky, T.T. & S.G. Pallardy. 1997. Growth control in woody plants. Academic Press Inc. San Diego. 641 pp.
Lovisolo, C. & A. Schubert. 1998. Effects of water stress on vessel size and xylem hydraulic conductivity in Vitis vinifera L. Journal of Experimental Botany 49: 693–700.
Mäkinen, H., P. Nöjd & P. Saranpää. 2003. Seasonal changes in stem radius and production of new tracheids in Norway spruce. Tree Physiology 23: 959-968.
Mozo, I., E. Rodríguez, S. Monteoliva & V. Luquez. 2018. Morphological and physiological responses during the post-flooding period of Salix matsudana Koidz. 7th International Poplar Symposium (IUFRO)- Buenos Aires, Argentina, resumen en actas.
Pérez-de-Lis, G., J.M. Olano, V. Rozas, S. Rossi, R.A. Vázquez-Ruiz & I. García-González. 2017. Environmental conditions and vascular cambium regulate carbon allocation to xylem growth in deciduous oaks. Functional Ecology 31: 592–603.
Oliveira, J.M., E. Santarosa, F.A. Roig & V.D. Pillar. 2007. Amostragem temporal de anéis de crescimento: Uma alternativa para determinar ritmo de atividade cambial. Revista Brasileria de Biociências 5: 616–617.
Plomion, C., G. Leprovost & A. Stokes. 2001. Wood formation in trees. Plant Physiology 127: 1513-1523.
Savidge, R.A. 1996. Xylogenesis, genetic and environmental regulation – a review. IAWA Journal 17: 269-310.
Savidge, R.A. 2001. Intrinsic regulation of cambial growth. Journal Plant Growth Regul 20: 52–77.
Schmitt, U., R. Möller & D. Eckstein. 2000. Seasonal wood formation dynamics of beech (Fagus sylvatica L.) and black locust (Robinia pseudoacacia L.) as determined by the “pinning” technique. Journal of Applied Botany 74: 10-16.
Schweingruber, F.H. 2007. Wood structure and environment. Ed. Springer. Berlin. 256 pp.
Terrazas, T, S. Aguilar-Rodríguez & C.T. Ojanguren. 2011. Development of successive cambia, cambial activity, and their relationship to physiological traits in Ipomoea arborescens (Convolvulaceae) seedlings. American Journal of Botany 98(5): 765–774.
Van Camp, J., M. Hubeau, J. Van den Bulcke, J. Van Acker & K. Steppe. 2017. Cambial pinning relates wood anatomy to ecophysiology in the African tropical tree Maesopsis eminii. Tree Physiology 38: 232-242.
Villalba, R. 1985. Xylem structure and cambial activity in Prosopis flexuosa DC. IAWA Bulletin n.s. 6: 119-130.
Wolter, K.E. 1968. A new method for marking xylem growth. Forest Science 14: 102-104.
Worbes, M. 1995. How to measure growth dynamics in tropical trees - a review. IAWA Journal 16: 337-351.

