Artículos de Revisión
Resistencia a isoniacida, un problema de salud pública: historia y tratamiento
Resistance to isoniacida, a public health problem: history and treatment
Resistencia a isoniacida, un problema de salud pública: historia y tratamiento
Revista Peruana de Investigación en Salud, vol. 3, núm. 2, 2019
Universidad Nacional Hermilio Valdizán
Recepción: 12 Febrero 2019
Aprobación: 13 Marzo 2019
Resumen: A pesar de ser una enfermedad prevenible y curable, la Tuberculosis continúa siendo un problema importante de salud global. A nivel mundial, según la OMS en el año 2017 se estimaron en 10 millones los nuevos casos de tuberculosis activa, cifra equivalente 133 casos x 100,000 personas; y cerca de 1.3 millones de muertes en pacientes no VIH y 300,000 muertes adicionales en pacientes VIH por esta causa, principalmente en países de recursos limitados. Por otro lado, lo que agudiza el problema es la emergencia de la resistencia a drogas anti tuberculosas, lo cual complica las posibilidades de tratamiento. La isoniacida es hoy en día una de las drogas de primera línea fundamentales para el manejo de la Tuberculosis, estando estrechamente relacionada con la rápida negativización de la baciloscopía del esputo, atribuido al potente efecto bactericida sobre las cepas de rápida multiplicación, siendo por ello de vital relevancia no solo en el control de la enfermedad, sino también en el control de la diseminación de la infección. La resistencia a isoniacida se viene incrementado en los últimos años, y su presencia predice no solo la mayor probabilidad de fracaso terapéutico, sino también la potencial emergencia de cepas multi-drogoresistentes. Sin embargo, las pruebas moleculares hoy en día recomendadas para el tamizaje y la rápida detección de resistencia de los casos sospechosos, no incluyen la evaluación de la isoniacida. Se enfatiza en la presente revisión la relevancia de la detección de la resistencia a isoniacida para su vigilancia y manejo posterior.
Palabras clave: Tuberculosis, Isoniacida, Perú.
Abstract: Despite being a preventable and curable disease, Tuberculosis continues to be a major global health problem. Worldwide, according to the WHO in 2017 were estimated at 10 million new cases of active tuberculosis, equivalent to 133 cases per 100,000 people; and about 1.3 million deaths in non-HIV patients and 300,000 additional deaths in HIV patients due to this cause, mainly in countries with limited resources. On the other hand, what exacerbates the problem is the emergence of resistance to anti-tuberculous drugs, which complicates the possibilities of treatment. Isoniazid is today one of the fundamental first-line drugs for the management of Tuberculosis, being closely related to the rapid negativization of sputum bacilloscopy, attributed to the potent bactericidal effect on rapidly multiplying strains. vital relevance not only in the control of the disease, but also in the control of the spread of the infection. The resistance to isoniazid has increased in recent years, and its presence predicts not only the greater probability of therapeutic failure, but also the potential emergence of multi-drug resistant strains. However, the molecular tests recommended today for screening and rapid detection of resistance of suspected cases do not include the evaluation of isoniazid. The relevance of the detection of isoniazid resistance for its surveillance and subsequent management is emphasized in the present review.
Keywords: Tuberculosis, Isoniazid, Perú.
Artículo
La Isoniacida (INH) fue sintetizada por primera vez en 1912 en Praga (1), como un profármaco de primera línea eficaz para el tratamiento de la Tuberculosis (TBC) activa. Este medicamento es activado en primera instancia por la catalasa peroxidasa KatG para posteriormente unirse a la proteína InhA del Mycobacterium tuberculosis, lo cual finalmente conlleva la inhibición de la síntesis del ácido micólico, componente importante de la pared celular micobacteriana. En las bacterias que se dividen rápidamente la INH es bactericida, mientras que en las bacterias de división más lenta es bacteriostático. Se cree que el fármaco genera una rápida y sustancial muerte de bacterias al comienzo del tratamiento y es el responsable de la rápida negativización de la baciloscopía de esputo del paciente (efecto bactericida temprano).
A partir de su primer uso como monoterapia para el manejo de la TBC en 1952 (2), se informó rápidamente del desarrollo de resistencia a INH (R-INH) (1). La R-INH se produce predominantemente por la mutación de los genes KatG e InhA, sin embargo también existen otras mutaciones reportadas con menor frecuencia. De 331 pacientes peruanos atendidos entre setiembre del 2017 a marzo del 2018 en la Unidad de Tuberculosis del Hospital Rebagliati-EsSalud, en 260 (78.54%) se contaba con resultados de al menos una Prueba de Sensibilidad a Drogas (PSD), de las cuales 226 (86.9%) correspondían a las realizadas por el método Genotype (plataforma o metodología PCR convencional que evalúa la sensibilidad a INH y Rifampicina). Los resultados mostraron que 180 (79.6%) presentaron R-INH primaria o inicial, donde a su vez el 64.4% de los casos fue por mutación única del Gen KatG, 34.4% por mutación en el gen InhA y sólo 2 (1.1%) muestras por mutación simultánea de ambos genes KatG/InhA (3).
Desde el año 1952, el uso de INH como monoterapia para el manejo de la TBC activa estaba contraindicado, puesto que desde ya se conocía que su administración como monoterapia desencadenaría al cabo de un mes resistencia en hasta el 11% de las bacterias, incrementando dicho porcentaje al 52% y 71% para el segundo y tercer mes respectivamente (4).
En 1959, John Crofton sostenía que la curación de la tuberculosis era posible en el 100% de los casos cuando se administraba un esquema terapéutico que incluyera la combinación de 3 medicamentos: Ácido paraminosalicílico (PAS), Estreptomicina (SM) e INH; evitando de esta manera la aparición de resistencia. Por otro lado, de tratarse de una bacteria con resistencia previa a una de las drogas mencionadas, las otras dos podrían lograr la curación del paciente (5,6). No obstante, a pesar de implementar los esquemas anti-TBC basados en la combinación de 3 drogas en el mundo occidental y en los países desarrollados, la necesidad de reducir costos en el tratamiento específico en los países en desarrollo (7), condujo a que la Organización Mundial de la Salud (OMS) en 1957 proponga el uso de monoterapia con INH para el tratamiento de la TBC activa incrementando la pandemia de cepas resistentes primarias a este medicamento (8).
La tendencia a infravalorar el serio problema de la R-INH ha continuado durante muchas décadas. En primera instancia con el advenimiento de los esquemas acortados modernos basados en tres o cuatro drogas, donde muchos expertos asumieron que la R-INH inicial o primaria dejaba de tener relevancia pues los otros tres medicamentos seguirían ejerciendo eficacia y garantizarían el éxito del tratamiento; y en segunda instancia, la emisión continua de recomendaciones inexactas por parte de autoridades mundiales en salud, citando por ejemplo una de ellas: “La Organización Mundial de la Salud no recomienda esfuerzos específicos para diagnosticar cepas de Tuberculosis mono y poli-resistentes en programas DOTs de rutina” (1).
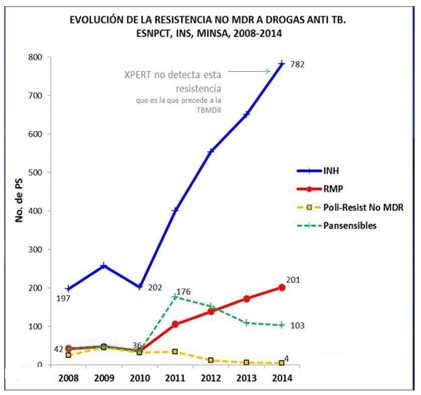
Es por este tipo de situaciones que la R-INH es actualmente un problema de salud global al igual que la TBC Multidrogorresistente/Extre-madamente resistente (MDR/XDR). En el Perú la R-INH se ha incrementado progresivamente a lo largo de los años (Figura N 1 y Tabla N 1).

al
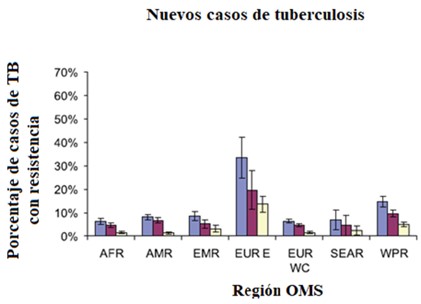
Desde el año 1994 hasta el año 2009, 106 países o territorios han enviado información a la OMS sobre la R-INH entre sus casos de tuberculosis. A nivel mundial, la región de Europa del este es la que reporta los índices de R-INH más altos, llegando al 33.5% (95% IC: 24.8% - 42.2%) entre los casos nuevos y al 61.4% (95% IC: 53.6% - 69.2%) entre los casos antes tratados. La Figura N 2 muestra la R-INH por regiones entre los casos nuevos (9,10).
El problema en mención se ve también afectado por los casos sub-diagnosticados, puesto que la OMS recomienda el Método GenXpert (Tecnología o plataforma en base a PCR en tiempo real) para el diagnóstico rápido de resistencia, sin embargo, este método únicamente detecta la presencia de resistencia a Rifampicina (RMP), no siendo capaz de evaluar la resistencia a INH.
El tratamiento ideal para manejar la R-INH ha sido siempre materia de controversia. A lo largo de los años, diferentes instituciones científicas, guías y expertos han recomendado esquemas de tratamiento para el manejo de la R-INH. En la tabla N 2 podemos apreciar un recuento de estos esquemas por años de publicación (3,11-25).

Las recomendaciones internacionales están basadas bajo el supuesto de que el patrón de resistencia no ha variado en el tiempo, al igual que dichas recomendaciones asumen que se está evaluando también la susceptibilidad a Pirazinamida (PZA) en todos los casos. Para ello, debe existir un alto nivel de confianza en el laboratorio y mejorar el tiempo de obtención de los resultados de la PSD, el empleo de métodos rápidos y la universalización de la PSD, a fin de detectar precozmente resistencias no MDR y evitar la ampliación de la resistencia inicial (26).
Es importante recordar que todas estas recomendaciones son para pacientes con PSD no MDR (no son sugerencias para los contactos necesariamente), no existiendo recomendaciones paras casos de resistencia no MDR en quienes ya terminaron un esquema primario, es decir cuando el resultado de la PSD se conoce luego del alta del paciente. Por tanto, en estos escenarios se debería realizar seguimiento post tratamiento con cultivos periódicos.
Tampoco existen consideraciones si los pacientes son antes tratados. En lo que coinciden las diferentes recomendaciones, es que la TBC R-INH no se debe tratar como la tuberculosis MDR, es decir que no debería incluir más drogas de las necesarias y no se justifica el uso de drogas de segunda y tercera línea de manera rutinaria, ni tampoco se menciona que el extender el tratamiento más allá del tiempo recomendado produzca mayor curación. Únicamente la Norma Técnica peruana del año 2006 (14) proponía el uso del “esquema II”: dos meses diarios de la combinación de Rifampicina, Isoniacida, Etambutol, Pirazinamida y Estreptomicina, más un mes diario de la combinación de Rifampicina, Isoniacida, Etambutol y Pirazinamida, seguido de 5 meses de tratamiento dos veces por semana con Rifampicina, Isoniacida y Etambutol (2RHEZS - 1RHEZ / 5R2H2E2) como tratamiento de la R-INH, pero es importante recordar que los esquemas primarios no fueron diseñados para tratar la tuberculosis producida por cepas con resistencias a cualquier fármaco.
El tratar la R-INH con esquema primarios lleva a resultados subóptimos como lo demuestra el estudio de Medea Gegia (27) quien en una revisión sistemática con metaanálisis de artículos publicados hasta el año 2015, con una población de 3744 pacientes con R-INH demostró que el fracaso, recaída o ambas; y la adquisición de resistencia fue de 15% y 3.6% respectivamente en pacientes con R-INH mientras que en pacientes sensibles a INH fue de 4% y 0.6% respectivamente. Es conocido también que la R-INH inicial o primaria es el principal factor de riesgo para la adquisición de resistencia a RMP durante el tratamiento y por lo tanto la progresión a tuberculosis MDR cuando se aplica un esquema primario.
El estudio multicéntrico retrospectivo de cohortes de Espinal entre 1994 a 1996 (28), encontró que el aplicar el esquema primario acortado habitual (Esquema I o categoría 1) en pacientes con R-INH inicial conllevaba un Riesgo Relativo (RR) de 2.21 (95% IC, 1.00 - 4.5; p=0.05) para fracasar comparado con los pacientes sensibles tratados con el mismo esquema, que aunque no son estadísticamente significativos, es necesario tener en cuenta esta posibilidad (los resultados de la cohorte de Perú se muestran en la Tabla N 3).

Odds
Por ende, queda por resolver la pregunta: ¿cuál sería el mejor tratamiento para la TBC R-INH? El grupo de Stagg (29) realizó una revisión sistemática al respecto encontrando que en el caso de la R-INH, los regímenes de tratamiento que incluyen un número efectivo de cuatro medicamentos, con un tiempo de uso de rifampicina de 6 meses, disminuyen el riesgo de un desenlace desfavorable (fracaso, falta de conversión, recaída, muerte) con un Odds Ratio (OR) de 0.31 (95% CI 0.12 - 0.81).

Estas recomendaciones de la OMS se ven corroboradas por un reciente metaanálisis publicado por el grupo de Federica Fregonese (30) en el que se incluyeron 8089 pacientes con R-INH. El primer resultado es que el esquema de 6 meses con RMP, EMB, PZA con o sin INH diario (6(INH)-RMP-EMB-PZA) tiene los mismos resultados que el esquema 8-9 meses con los mismos medicamentos, por lo que el esquema 6(INH)-RMP-EMB-PZA se usó en este metaanálisis para la comparación con otros esquemas de tratamiento. Un segundo resultado encontrado en este mismo estudio, es que el adicionar una fluoroquinolona (Levofloxacino, LFX) a dicho esquema de base durante los 6 meses se asoció con un elevado éxito (aOR 2.8, 95% CI 1.1–7.3), pero no tuvo relación o efecto con la mortalidad (aOR 0.7, 95% CI 0.4 – 1.1) o con la adquisición de resistencia a rifampicina en el curso del tratamiento (aOR 0.1, 95%CI 0.0 – 1.2). El esquema para antes tratados (esquema II o categoría 2) (2HREZS/1HREZ/5H2R2E2) comparado con el esquema de 6(INH)-RMP-ETB-PZA se asoció a un marcado efecto negativo en los resultados del tratamiento (aOR 0.4, 95% CI 0.2 – 0.7) para el esquema 6(INH)-RMP-EMB-PZA. Finalmente, el administrar INH al tratamiento en la R-INH no aportó ningún beneficio, por lo que no debería mantenerse INH en el tratamiento cuando se conoce que la bacteria es resistente a este medicamento.
En el año 2018 (24) se modificó la Norma Técnica de Salud del Perú N° 104 para la atención integral de las personas afectadas por tuberculosis, sin embargo a pesar de las recomendaciones de la OMS (25) y de la existencia de la revisión sistemática con meta-análisis del grupo de Federica Fregonese (30) no se actualizaron las sugerencias referentes al tratamiento de la R-INH, manteniendo las mismas recomendaciones del año 2011 y 2013 (20,21), las que se resumen en mantener el esquema de tratamiento con 2RMP-EMB-PZA-LFX/7RMP-EMB-LFX para los pacientes con TBC R-INH, un esquema que no se ha modificado ni se ha adecuado a la evidencia en casi 8 años, omisión que resulta en un riesgo de ampliación de resistencia y mala evolución.
Basados en lo expuesto, se puede concluir que es de suma importancia reconocer la R- INH como un serio problema de salud pública, por la evidencia contundente del incremento de dicha resistencia no controlado de manera continua, el cual es paso inicial para la ampliación de resistencia a MDR y el aumento del riesgo de fracaso al esquema sensible. Por ello, es necesario implementar las últimas recomendaciones de la OMS para el tratamiento de la R-INH empleando RMP, EMB, PZA, y LFX de manera diaria durante los 6 meses (para la gran mayoría de pacientes) y de manera supervisada. Al no existir evidencia de que la R-INH pueda tratarse con dosis normales de INH, no se considera apropiado el uso de DFC que contenga este medicamento para el manejo de este tipo de resistencia en particular ya que sólo aumentaría el riesgo de reacciones adversas sin ningún beneficio clínico (31).
Es importante mencionar que, estas recomendaciones se basan en una oportuna evaluación de los resultados de la PSD para cada paciente, siendo necesario conocer el resultado de la sensibilidad del Mycobacterium tuberculosis a los otros medicamentos. Adicionalmente, el término “mono-resistencia” debería reservarse para la clasificación final luego de conocerse los resultados de una PSD completa ya que la R-INH se acompaña generalmente de otras resistencias, como por ejemplo resistencia a estreptomicina, resistencia a etionamida y a otros medicamentos que no son evaluados con las pruebas GenXpert y Genotype.
Finalmente, es de suma relevancia optar y mantener tecnologías que evalúen rápida y oportunamente tanto la resistencia a INH como a RMP para el tratamiento específico oportuno.
Agradecimiento: Al Dr. Héctor Oswaldo Jave Castillo.
Referencias
1. Guidelines for the programmatic management of drug-resistant tuberculosis. WHO 2006
2. Timperi R, et al. Drug-resistance profiles of Mycobacterium tuberculosis isolates: five years' experience and insights into treatment strategies for MDR-TB in Lima, Perú. Int J Tuberc Lung Dis 9(2): 175-180, 2005
3. Join Tuberculosis Committee of the British Thoracic Society. Chemotherapy and management of Tuberculosis in the United Kingdom. Recommendation 1998. Thorax 1998, 53:536-548
4. JOINT MEETING No. 1. Section of Pathology with Section of Medicine. DISCUSSION ON CHEMOTHERAPY OF TUBERCULOSIS. Proceedings of the Royal Society of Medicine. December 10, 1952. Vol 46. 579-90
5. Crofton J. Chemotherapy of pulmonary tuberculosis. British Medical Journal. 1959. 1610-14
6. Crofton J. Drug treatment of tuberculosis: I. Standard chemotherapy. British Medical Journal. 1960. 370-73
7. Denis A. Mitchison. The Diagnosis and Therapy of Tuberculosis During the Past 100 Years. Am J Respir Crit Care Med Vol 171. pp 699–706, 2005
8. Chemotherapy and Chemoprophylaxis in tuberculosis control. Report of a Study Group. Copenhagen, 23-25 September 1957. Wld Hlth Org. Techn. Rep. Ser., 1957, 141
9. World Health Organization (2018) Global tuberculosis report 2018. http://www.who.int/tb/publications/global_report/en/
10. Jenkins HE, Zignol M, Cohen T (2011) Quantifying the Burden and Trends of Isoniazid Resistant Tuberculosis, 1994–2009. PLoS ONE 6(7): e22927. doi: 10.1371/journal.pone.0022927
11. Francis J. curry National Tuberculosis Center and California Department of Health Services, 2004: Drug-resistant Tuberculosis: A survival Guide for Clinicians.
12. Francis J. curry National Tuberculosis Center and California Department of Health Services, 2008: Drug-resistant Tuberculosis: A survival Guide for Clinicians.
13. Tuberculosis: Clinical diagnosis and management of TB, and measures for its prevention and control. National Institute for Health and Clinical Excellence. The national Collaborating Centre of Chronic Conditions. Royal College of Physicians, London 2006. Page102-103
14. Manual de Normas y Doctrinas ESN-PCT 2006, Ministerio de Salud
15. Clinical diagnosis and management of tuberculosis, and measures for its prevention and control. National Institute for Health and clinical Excellence – NHS 2006
16. Guías latinoamericanas de diagnóstico y tratamiento de la tuberculosis farmacorresistente. Asociación latinoamericana de Tórax (ALAT) 2006
17. Guidelines for the programmatic management of drug-resistant tuberculosis – WHO 2006.
18. Guidelines for the programmatic management of drug-resistant tuberculosis. Emergency update WHO 2008
19. Treatment of tuberculosis guidelines. Fourth Edition. WHO 2009
20. Raviglione MC. Tuberculosis Fourth Edition. The essentials. 2010
21. Actualización del Subnumeral 7. Tratamiento de la tuberculosis de la NTS N°041-MINSA/DGSP-V.01 “Norma Técnica de Salud para el control de la tuberculosis”. Aprobada por RM N° 383-2006/MINSA
22. Norma Técnica de Salud para la atención integral de las personas afectadas por tuberculosis. RM N° 715-2013/MINSA. NTS N° 104-MINSA/DGSP-V.01
23. Tuberculosis NICE Guideline. 13 January 2016
24. Modificatoria de la NTS N° 104-MINSA/DGSP V.01 Norma técnica de salud para la atención integral de las personas afectadas por tuberculosis: aprobada por RM N° 752-2018/MINSA
25. WHO treatment guidelines for isoniazid-resistant tuberculosis: Supplement to the WHO treatment guidelines for drug-resistant tuberculosis. Geneva: World Health Organization; 2018. Licence: CC BY-NC-SA 3.0 IGO
26. Pecho-Silva S. Epidemiología molecular y fenotípica del Mycobacterium tuberculosis en el PCT del Hospital Rebagliati del Seguro Social del Perú 2017-2018. Poster aceptado congreso ALAT 2018.
27. Gegia M, Winters N, Benedetti A, Soolingen DV, Menzies D. Treatment of isoniazid-resistant tuberculosis with first-line drugs: a systematic review and meta-analysis. www.thelancet.com/infection Published online November 16, 2016http://dx.doi.org/10.1016/S1473-3099(16)30407-8
28. Espinal M, Kim SJ, Suarez PG, Kam KM, Khomenko AG, Migliori G, et al. Standard Short-Course Chemotherapy for Drug-Resistant Tuberculosis. Treatment Outcome in 6 Countries. JAMA. 2000;283;2537-2545
29. Stagg HR, Harris RJ, Hatherell H-A, et al. What are the most efficacious treatment regimens for isoniazid-resistant tuberculosis? A systematic review and network meta-analysis. Thorax Published Online First: June 13, 2016 as 10.1136/thoraxjnl-2015-208262
30. Fregonese F, Ahuja SD, Akkerman OW, Arakaki-Sanchez D, Ayakaka I, Baghaei P et al. Comparison of different treatments for isoniazid-resistant tuberculosis: an individual patient data meta-analysis. Lancet Respir Med 2018;6: 265–75. DOI: 10.1016/S2213-2600(18)30078-X
31. Stagg HR, Lipman MC, McHugh TD, and Jenkins HE. Isoniazid resistant tuberculosis- a cause for concern? Int J Tuberc Lung Dis. 2017 February 01; 21(2): 129–139.
Información adicional
Revista Peruana de Investigación en Salud: ISSN: 2616 - 6097
Enlace alternativo
http://revistas.unheval.edu.pe/index.php/repis/article/view/264 (html)