INTRODUCCIÓN
Las microalgas son microorganismos fotosintéticos con un diámetro que oscila entre 1 y 50 µm y se pueden encontrar tanto en ambientes de agua dulce como salada. Este tipo de microorganismos se utiliza en actividades encaminadas al equilibrio ecológico y al control de la contaminación ambiental. Además, se utilizan en el tratamiento de aguas contaminadas y sirven como removedores de gases de efecto invernadero (Maity et al., 2014).
Como organismos fotosintéticos, las microalgas solo utilizan una fracción del espectro de luz visible. Se ha demostrado que su crecimiento es proporcional a la producción de pigmentos y a la intensidad de la luz recibida, siempre que se mantenga por debajo de un valor máximo conocido como fotolimitación. La intensidad excesiva de luz puede dañar los sistemas fotosintéticos e inhibir la fotosíntesis. Por lo tanto, factores como la intensidad de la luz, el fotoperíodo y la calidad espectral juegan un papel crucial en la actividad fotosintética que, a su vez, se refleja en el proceso de crecimiento. A través de la fotosíntesis, las microalgas catalizan la conversión de la energía luminosa capturada por las moléculas de clorofila en energía utilizable (Chávez et al., 2018).
Los pigmentos son compuestos esenciales en las microalgas y desempeñan un papel fundamental en los aspectos estructurales y funcionales de la fotosíntesis. También actúan como pigmentos accesorios capaces de captar energía luminosa entre 400 y 500 nm. Además, cumplen una función fotoprotectora al evitar la fotooxidación y desactivar las especies reactivas de oxígeno. La clorofila en su estado excitado es un ejemplo de tales pigmentos (Guerrero et al., 1999).
Los procesos metabólicos de las microalgas generan mecanismos para la adquisición de carbono a través de la fotosíntesis, así como la asimilación de fósforo (P) y nitrógeno (N) en la formación de metabolitos secundarios únicos utilizados en diversas aplicaciones biotecnológicas (Zhou, 2014).
El fotoperíodo es un factor importante para el cultivo de microalgas, ya que puede afectar positiva o negativamente este proceso. La duración, periodicidad y cambios en la iluminación que reciben las algas tienen una influencia significativa en la biomasa y el tiempo de crecimiento. La iluminación intensa y excesiva puede conducir a la fotooxidación, mientras que los niveles bajos de luz resultan en niveles mínimos o muy bajos de biomasa (Garzón & González, 2019).
Basado en los factores antes mencionados, el estudio de las microalgas tiene un gran potencial biotecnológico. La biomasa y los metabolitos resultantes se emplean en la industria alimentaria y farmacéutica, entre otras. En algunos países, estos organismos se cultivan como alimento tanto para animales como para humanos, lo que genera un amplio mercado internacional (Gómez, 2007). Además, las microalgas se pueden usar como suplementos dietéticos y como una fuente de alimento alternativa de bajo costo. A nivel mundial, varios cultivos de microalgas son reconocidos como fuentes de carbohidratos, proteínas, grasas y vitaminas (Brito et al., 2013). En consecuencia, comprender los aspectos potenciales en el crecimiento y producción de pigmentos de diferentes especies de microalgas es un paso crucial para sus aplicaciones industriales.
El cultivo masivo de microalgas como es el caso de Scenedesmus sp. tiene una gran importancia económica; contribuyen a la producción de energía de tercera generación y, por su alto contenido de compuestos orgánicos como carbohidratos y lípidos, brindan condiciones para la producción de bioetanol y biogás a través de procesos de fermentación de la biomasa bajo condiciones anaeróbicas (Verduga, 2020). En consecuencia, el aislamiento y cultivo de microalgas para procesos biotecnológicos han ganado interés en el mercado global, ya que pueden producir compuestos económicamente valiosos como enzimas, pigmentos y ácidos grasos. El género Scenedesmus sp. se emplea en el tratamiento de aguas residuales debido a su eficiente y rápida eliminación de nutrientes y metales pesados, lo que la convierte en una valiosa fuente de bioproductos (Martínez et al., 2005).
MATERIALES Y MÉTODOS
Microorganismos y diseño experimental
Se emplearon tres cepas de Scenedesmus sp identificadas como cepa N 7, cepa N 10 y cepa N 15, las cuales fueron aisladas del sistema de tratamiento de aguas residuales del municipio de Uribia, departamento de La Guajira, y que pertenecen al banco de cepas de microorganismos fotosintéticos de la Universidad de La Guajira. Se realizaron ensayos, para determinar la cinética de crecimiento y producción de pigmentos, creciendo las cepas en medio de cultivos in vitro en F/2 Guillard (González et al., 1995).
Sistemas de cultivo
Se realizaron cultivos discontinuos en frascos de vidrio estériles de aproximadamente 375 mL de capacidad y con 150 mL de medio de cultivo, realizando tres réplicas por cepa y tres repeticiones por ensayo. Cada frasco de cultivo contó con un sistema de flujo de aire conformado por tubos de vidrio de 12 cm de largo, unidos a mangueras de plástico, que fueron conectados a aireadores para acuarios de 2 salidas, con flujo de aire de 5 mL.s-1.
Se utilizó luz artificial con lámparas fluorescentes Philips Dayligth con tubos de 40 W a una intensidad de 50 µEm-2.-1. El periodo luz-oscuridad fue de 12:12 horas y se reguló con un temporizador modelo 4001-00 Td-1724-00. La temperatura estuvo entre los 25 °C y 28 °C. En todos los cultivos el pH se mantuvo aproximadamente a 7,8 y fue medido con un pHmetro marca HANNA instruments Hi 8417 diariamente, ajustándose los niveles cuando fue necesario con HCl o NaOH al 0,5% empleando un gotero.
Estimación de la densidad celular
Se evaluó la densidad celular por recuento utilizando una cámara de recuento celular Neübauer de 0,1mm de profundidad en microscopio marca Olympus CX31 cada tres días hasta alcanzar fase estacionaria. Se realizó el cálculo de la concentración (cel.mL-1) aplicando la ecuación 1 (Celeromics, 2012):
En donde:
= la suma de todas las células contadas en los cuatro cuadros grandes.
= al número total de cuadros grandes donde se ha hecho el recuento.
Los datos de cinética de crecimiento se calcularon a partir de los datos de densidad celular usando la fórmula propuesta por Guillard (1973) definida por la ecuación 2:
En donde:
μ = cinética de crecimiento
= concentración de la biomasa (número de cél.mL-1)
= tiempo en días
Determinación de pigmentos
La evaluación de los pigmentos liposolubles (clorofila a y carotenoides totales) e hidrosolubles (ficocianina, aloficocianina y ficoeritrina) se realizó para cada cepa a los 27 días de cultivo. Para los extractos liposolubles se empleó la extracción metanólica durante 12 horas; en este sentido, se extrajeron alícuotas de 2 mL de cada cepa las cuales se colocaron en tubos de ensayo que se centrifugaron a 3.200 rpm por 15 minutos y luego se descartó el sobrenadante, se añadió 1 mL de solución acetona: metanol (2:1), se agitó vigorosamente en vortex por 15 min, luego fueron mantenidas por debajo de los 4 °C en oscuridad durante 12 horas para finalmente ser centrifugadas a 3.200 rpm. por 15 minutos y colectado el sobrenadante. Se realizó un blanco con agua desionizada y destilada.
La determinación de clorofila a y carotenoides se realizó por espectrofotometría, midiendo los extractos y el blanco en un Spectronic 21D, a diferentes longitudes de onda y los cálculos se realizaron utilizando la ecuación 3 propuesta por Marker et al. (1980) para clorofila a y la ecuación 4 propuesta por Strickland & Parsons (1972) para carotenoides.
Dónde:
= volumen del extracto metanólico total
= volumen de muestra empleado
La extracción de los pigmentos hidrosolubles (ficobiliproteínas) se realizó por el método de ruptura celular por congelamiento y descongelamiento (Lawrenz et al., 2011). La concentración de ficocianina, aloficocianina y ficoeritrina se determinó de acuerdo con las ecuaciones 5, 6 y 7 propuestas por Bennet y Bogorad (1973).
Donde:
= volumen de la muestra de microalga utilizado
= volumen del extracto (solvente) utilizado
= Ficocianina
= Aloficocianina
Análisis estadístico
Se analizaron los datos obtenidos en los diferentes experimentos de crecimiento y composición bioquímica mediante análisis de varianza de una vía, para la determinación de grupos significativamente diferentes. En todos los casos donde la prueba F resultara significativa, se empleó la prueba de rangos múltiples de Scheffé a un nivel de significancia del 95%, mediante el programa SPSS 26.0 para Windows.
RESULTADOS Y DISCUSIÓN
Cinética de crecimiento
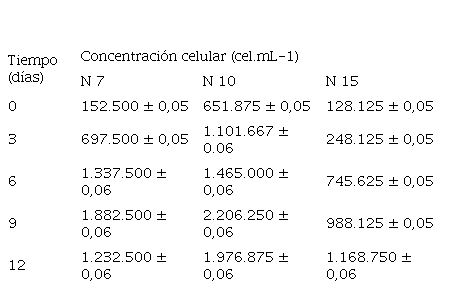
A partir de los recuentos de las células viables en los cultivos de las cepas N 7, N 10 y N 15 realizados bajo condiciones de laboratorio se determinó la concentración celular (cel.mL-1) hasta fase estacionaria, donde se muestra un crecimiento continuo de la biomasa microalgal, alcanzando concentraciones promedio entre 150.000 cel.mL-1 y 2.207.000 cel.mL-1. En los ensayos, los mayores recuentos se obtuvieron en las cepas N 10 y N 7; donde la cepa N 10 obtuvo un valor promedio de biomasa de 2.206.250 cel.mL-1 y la cepa N 7 registró un valor promedio de 1.882.500 cel.mL-1; en los 12 días del cultivo. Mientras tanto la cepa N 15 registro la menor producción de biomasa en los 12 días del cultivo con un recuento promedio de 1.168.750 cel.mL-1 mostrando diferencia significativa p>0,05 con respecto a las otras cepas (Tabla 1).
Tabla 1
Promedio de la concentración celular (cel.mL-1) de las cepas Scenedesmus sp. N 7, N 10 y N 15 durante el cultivo.
|
Tiempo (días)
|
Concentración celular (cel.mL-1)
|
|
N 7
|
N 10
|
N 15
|
|
0
|
152.500 ± 0,05
|
651.875 ± 0,05
|
128.125 ± 0,05
|
|
3
|
697.500 ± 0,05
|
1.101.667 ± 0.06
|
248.125 ± 0,05
|
|
6
|
1.337.500 ± 0,06
|
1.465.000 ± 0,06
|
745.625 ± 0,05
|
|
9
|
1.882.500 ± 0,06
|
2.206.250 ± 0,06
|
988.125 ± 0,05
|
|
12
|
1.232.500 ± 0,06
|
1.976.875 ± 0,06
|
1.168.750 ± 0,06
|
Por otra parte, Pérez Vázquez (2017) reportó para Scenedesmus obliquus una concentración celular de 6.000.000 células.mL-1 en el día 14, utilizando el medio de cultivo Bold Basal. Este medio favoreció la producción de biomasa en comparación con el medio Guillar F/2 utilizado en este estudio, lo que sugiere que la composición del medio afectó la concentración celular debido a la diferencia en la provisión de sales, lo cual a su vez también afectó el pH del medio. Así mismo, los valores de biomasa informados por Greque y Viera (2007) fueron similares a los encontrados en este estudio, donde se obtuvo una concentración de 1.800.000 células.mL-1 de Scenedesmus obliquus cultivado en medio Guillard f/2 en un fotobioreactor en serie con una capacidad de 2 L y suministro constante de CO..
Los resultados obtenidos en este estudio muestran concentraciones de biomasa relativamente bajas en comparación con los encontrados en otros estudios. Una posible explicación de esto podría ser las diferencias en las condiciones nutricionales y ambientales del cultivo. Estas variables deben tenerse en cuenta en futuras investigaciones que busquen obtener mayores concentraciones de biomasa en este género de microalgas.
En la mayoría de los cultivos convencionales, se utiliza la inyección de CO. como fuente alterna de carbono, suministrándolo mediante la aireación del cultivo. Además, la disponibilidad de nutrientes proporcionados por el medio de cultivo, como el fósforo y el nitrógeno, desempeña un papel crucial en el crecimiento de las microalgas ya que son importantes componentes de su biomasa (Tagliaferro et al., 2019).
Cinética de crecimiento de cultivos in vitro de Scenedesmus sp.
Las cepas microalgales mostraron desde el inicio del ensayo un crecimiento exponencial, indicando la rápida adaptación de estas al medio de cultivo. De igual manera, a partir de los datos obtenidos de la concentración celular se analizaron las curvas de crecimiento, los cuales, fueron evaluados cada 72 horas por 12 días hasta alcanzar fase estacionaria (Figura 1).
Figura 1. Curva de crecimiento celular de las cepas Scenedesmus sp. N 7, N 10 y N 15.
En la Figura 1, se observa que las cepas de Scenedesmus sp. N 7 y N 10 obtuvieron la mayor biomasa microalgal en el noveno día de cultivo (1,88 x 10. cel.mL-1 y 2,21 x 10. cel.mL-1) respectivamente y en el duodecimo día de cultivo Scenedesmus sp. N 15 obtuvo mayor biomasa microalgal (1,17 x 10. cel.mL-1); finalizando la fase exponencial en promedio alrededor del día 10 de cultivo para las cepas Scenedesmus sp. N 10 y N 7; y día 12 para la cepa Scenedesmus sp. N 15.
En el caso de las cepas Scenedesmus sp. N 7 y N 10, se puede inferir que ambas cepas se encuentran en condiciones metabólicas adecuadas, lo que les permite experimentar un crecimiento y alcanzar valores máximos en su concentración celular. Por otro lado, en el caso de la cepa Scenedesmus sp. N 15, se puede interpretar que su crecimiento está influenciado por sus propias condiciones metabólicas, es decir, su estado metabólico no es óptimo, lo que resulta en un retraso en su crecimiento y producción baja de biomasa en las condiciones establecidas del cultivo.
Las fases de crecimiento observadas en este estudio son diferentes de las reportadas por Quevedo y colaboradores (2008), quienes presentaron amplios rangos de duración de las fases en Scenedesmus sp. en tres medios de cultivo diferentes; además observaron una fase de latencia que culminó en el día cuatro, seguida de una fase exponencial que se prolongó hasta el día 19 y finalmente una fase estacionaria que ocurrió después del día 20.
Sin embargo, Pérez (2017) obtuvo un comportamiento de crecimiento similar al observado en este estudio utilizando la cepa Scenedesmus obliquus en medio Bold Basal; en este caso, se demostró una fase de latencia hasta el día tres, seguida de una fase exponencial desde el cuatro hasta el 14, y finalmente una fase estacionaria a partir del día 15. Estos estudios demuestran que la producción de biomasa no está estrictamente relacionada con la duración de las fases de crecimiento de las cepas.
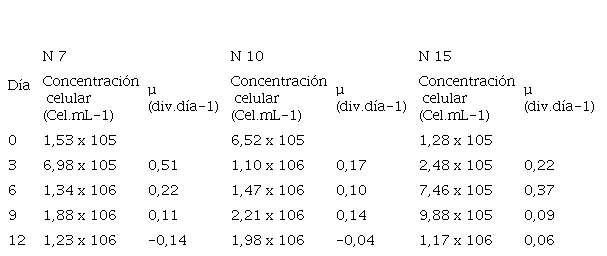
En la Tabla 2 se observan los valores estimados de la cinética de crecimiento (µ) con respecto a la concentración celular, a medida que pasa el tiempo en las tres cepas de Scenedesmus sp. (N 7, N 10 y N 15). Se muestra un incremento en los valores alcanzados en la cinética de crecimiento (divisiones por día) de la cepa N 7 con 0,51 div.día-1 a los tres días de cultivo, la cepa N 15 con 0,37 div.día-1 a los seis días de cultivo y la cepa N 10 con 0,17 div.día-1 a los tres días de cultivo, esto es, la constante de crecimiento de los tres cultivos de las cepas (N 7, N 10 y N 15) que se incrementó exponencialmente en un periodo de tiempo corto.
Tabla 2
Promedio de la concentración celular y cinética de crecimiento de las cepas Scenedesmus sp N 7 N 10 y N 15 en un sistema de cultivo discontinuo
|
Día
|
N 7
|
N 10
|
N 15
|
|
Concentración celular
(Cel.mL-1)
|
µ
(div.día-1)
|
Concentración celular
(Cel.mL-1)
|
µ
(div.día-1)
|
Concentración celular
(Cel.mL-1)
|
µ
(div.día-1)
|
|
0
|
1,53 x 105
| |
6,52 x 105
| |
1,28 x 105
| |
|
3
|
6,98 x 105
|
0,51
|
1,10 x 106
|
0,17
|
2,48 x 105
|
0,22
|
|
6
|
1,34 x 106
|
0,22
|
1,47 x 106
|
0,10
|
7,46 x 105
|
0,37
|
|
9
|
1,88 x 106
|
0,11
|
2,21 x 106
|
0,14
|
9,88 x 105
|
0,09
|
|
12
|
1,23 x 106
|
-0,14
|
1,98 x 106
|
-0,04
|
1,17 x 106
|
0,06
|
En el trabajo de Infante y colaboradores (2012), informaron resultados de cinética de crecimiento similares para Chlorella sp. durante los primeros cinco días de cultivo (µ= 0,12 – 0,38), aunque observaron la mayor tasa de crecimiento a los 15 días (µ= 1,18), la cual fue superior a cualquier valor obtenido en el presente estudio. En el estudio sobre la propagación de Scenedesmus sp, Verduga (2020) reportó valores de crecimiento superiores a los de este estudio, donde utilizaron dos medios de cultivo diferentes, BG11 (µ= 0,61) y DIWW (µ= 0,69), siendo este último, el que mostró el mayor crecimiento; esto se puede atribuir a la influencia del medio de cultivo y las condiciones del cultivo que influye en la producción de biomasa (Quevedo et al., 2008).
Pigmentos liposolubles
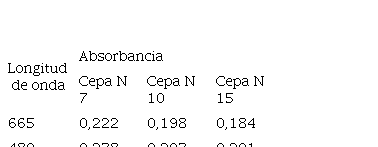
La Tabla 3 muestra las absorbancias de las cepas en las diferentes longitudes de onda luego de la extracción de los pigmentos liposolubles, destacando que la cepa N 7 presentó mayores valores en las dos longitudes de onda empleadas.
Tabla 3
Absorbancias de las cepas de Scenedesmus sp aisladas de aguas residuales del municipio de Uribia en La Guajira luego de la extracción de los pigmentos liposolubles
|
Longitud de onda
|
Absorbancia
|
|
Cepa N 7
|
Cepa N 10
|
Cepa N 15
|
|
665
|
0,222
|
0,198
|
0,184
|
|
480
|
0,238
|
0,203
|
0,201
|
En cuanto a la concentración de los pigmentos en la Figura 2 y en la Figura 3, se pueden observar las concentraciones de pigmentos liposolubles, donde la cepa N 7 evidencia una mayor concentración de clorofila a (29,17 µg.mL-1) y carotenoides (9,52 µg.mL-1); seguida de la cepa N 10 para el caso de la clorofila y de la N 15 para los carotenoides, en este último caso con un diferencia mínima.
Figura 2. Concentración de pigmentos liposolubles, clorofila a (µg.mL-1) en las cepas de Scenedesmus sp. aisladas de aguas residuales en el municipio de Uribia en La Guajira.
En un estudio similar realizado por García-Cañedo et al. (2009), en medio de cultivo EBBFCA a distintas concentraciones obtuvieron carotenoides a partir de la microalga Scenedesmus incrassatulus presentando valores promedio de concentraciones de clorofila a (10,6 mg.mL-1) y carotenoides (4,81 mg.mL-1), superiores a los reportados en este estudio Por otro lado, Pardo et al., (2017) en su investigación sobre el contenido de clorofila a y carotenoides totales de Tetraselmis suecica en medio de cultivo Guillard F/2 presentaron valores promedio de concentración de clorofila a de 6,31 µg.mL-1 y de carotenoides totales de 1,42 µg.mL-1 estos datos son inferiores a los reportados en el presente estudio (Tabla 3).
Figura 3. Concentración de pigmentos liposolubles, carotenoides (µg/mL-1) en las cepas de Scenedesmus sp. aisladas de aguas residuales en el municipio de Uribia en La Guajira.
Las diferencias en los valores de concentración obtenidos se pueden atribuir al uso de diferentes medios de cultivo, lo que puede influir en la producción de pigmentos y producción de biomasa (Quevedo et al., 2008). Además, Guillard F/2 proporciona menores concentraciones de nitrógeno que el medio de cultivo experimental (EBBFCA), lo cual puede indicar que la concentración de nitrógeno es un factor clave en la formación de estos pigmentos (Ponte & Ruiz, 2013). Por lo anterior, se presume que el metabolismo celular y, por consiguiente, la formación de bioproductos, estará influenciada por el medio de cultivo utilizado. Por lo tanto, se debe continuar estas investigaciones para avanzar en la búsqueda de medios alternativos que provean los nutrientes necesarios que induzcan a la bioconversión de estos compuestos.
También es importante tener en cuenta que los pigmentos de las microalgas exhiben variaciones que brindan información sobre los cambios que ocurren como respuesta al estrés ambiental y las condiciones fisiológicas. Por lo tanto, el contenido de pigmento se puede utilizar como bioindicador de las condiciones ambientales en que están expuestas estas comunidades microalgales (Casais, 2014).
Pigmentos hidrosolubles
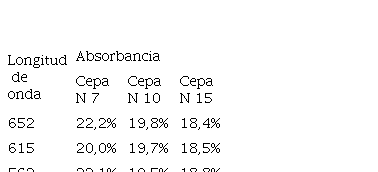
En la Tabla 4 se pueden observar los valores de absorbancia obtenidos para las mediciones realizadas con las cepas de Scenedesmus sp. (N 7, N 10, N 15) a distintas longitudes de onda luego de la extracción de los pigmentos hidrosolubles siendo la cepa N 7 la que presentó mayores valores.
Tabla 4
Absorbancia de las cepas de Scenedesmus sp N 7 N 10 N 15 aisladas de aguas residuales en el municipio de Uribia en La Guajira luego de la extracción de los pigmentos hidrosolubles
|
Longitud de onda
|
Absorbancia
|
|
Cepa N 7
|
Cepa N 10
|
Cepa N 15
|
|
652
|
22,2%
|
19,8%
|
18,4%
|
|
615
|
20,0%
|
19,7%
|
18,5%
|
|
562
|
22,1%
|
19,5%
|
18,8%
|
La Figura 4 muestra las concentraciones en µg/mL-1 de los pigmentos hidrosolubles (ficocianina, ficoeritrina y aloficocianina), destacandose la cepa N 7 con las mayores concentraciones en todos los pigmentos determinados. El pigmento con mayor concentración en todas las cepas de Scenedesmus sp. fue aloficocianina con valores entre 0,034 µg.mL-1, seguidamente de la ficoeritrina con 0,026 mg.mL-1 y la ficocianina con un valor máximo de 0,021 mg.mL-1.
Figura 4. Pigmentos hidrosolubles (ficocianina, ficoeritrina, aloficocianina) en cepas de Scenedesmus sp. (N 7, N 10, N 15), aisladas de aguas residuales del Municipio de Uribia en La Guajira.
La aloficocianina se encontró en mayor concentración en todas las cepas de Scenedesmus sp., siendo la cepa N 7 la que mostró el valor más alto (0,034 mg.mL-1). Garzón y González (2019) señalan en su investigación el efecto de la intermitencia de la luz en el crecimiento y la producción de metabolitos de Scenedesmus obliquus; reportaron que la ficoeritrina presentó la mayor concentración de los pigmentos hidrosolubles, seguida de la aloficocianina y la ficocianina. Estos resultados difieren un poco con los resultados obtenidos en este estudio, aunque coinciden con los resultados obtenidos de ficocianina que fue el pigmento de menor concentración.
Bermúdez-Sierra y colaboradores (2013) determinaron que el rompimiento celular en muestras liofilizadas de Scenedesmus sp. mostró el mayor porcentaje de aloficocianina (1,27 %), seguido de la ficoeritrina (0,58 %) y la ficocianina (0,47 %). Estos resultados son similares a los obtenidos en este estudio en cuanto a una mayor proporción de aloficocianina en comparación con los otros pigmentos hidrosolubles. Estos reslutados podrían atribuirse a que el método mecánico de rompimiento celular favorece en mayor medida la extracción de aloficocianina y en menor proporción a la extracción de los otros pigmentos hidrosolubles, aunque esto debe ser comprobado.
En conclusión, las cepas de Scenedesmus sp. evaluadas, de aislamientos de aguas residuales en el municipio de Uribia del departamento de La Guajira, mostraron diferencias y similitudes entre las cepas evaluadas en los parámetros de cinéticas de crecimiento y biomasa bajo las mismas condiciones ambientales y medio de cultivo Guillard F/2. Se determinaron los valores de concentración de clorofila a, de los pigmentos liposolubles y de los pigmentos hidrosolubles para todas las cepas evaluadas, encontrando diferencias con otros trabajos en cuanto a concentración, al igual que en el crecimiento y los tiempos de cultivo, probablemente por el medio de cultivo utilizado. Se sugiere seguir evaluando estas cepas nativas bajo diferentes condiciones y medio de cultivos, para evidenciar su potencial biotecnológico en la búsqueda de compuestos bioactivos.
AGRADECIMIENTOS
A la Universidad de La Guajira, específicamente al centro de Investigaciones y al sistema integral de laboratorios- SILAB, por permitir la ejecución de este proyecto de investigación.
Notas
LITERATURA CITADA Bennett, A., & Bogorad, L. (1973). Complementary chromatic adaptation in a filamentous blue-green alga. Journal of cell biology, 58(2), 419-435.
Bermúdez-Sierra, J. J., Oliveira-Leite, M., Reis-Coimbra, J. S., & Arêdes-Martins, M. (2013). Desempeño de dos técnicas de rompimiento celular en la caracterización de ficobiliproteínas en la microalga scenedesmus sp. Revista Tumbaga, 2(8), 65-79.
Brito, D., Castro, A., Colivet, J., Gómez, E., & Mora, R. (2013). Cinética de crecimiento de un cultivo mixto de las microalgas Hyaloraphidium contortum y Pseudokirchneriella subcapitata. Interciencia, 38(8), 604-608.
Casais, E. (2014). Efecto tóxico de un herbicida frecuente en Galicia sobre una microalga dulceacuícola. Universidad Da Coruña.
Celeromics (2012). Conteo Celular con Hematocitómetro. Uso Elemental del Hematocitómetro.http://www.celeromics.com/2012/es/resources/Technical%20Notes/Como-contar-celulas-con-camara-de-Neubauer-Definiciones.php
Chávez, W. G., Barreto, J. G., Orbegoso, J. L., & Sarmiento, J. T. (2018). Efecto del fotoperiodo y temperatura en el crecimiento poblacional y producción de biomasa, proteínas y lípidos de Scenedesmus acutus. Revista Caxamarca, 17(1-2).
García-Cañedo, J. C., Cristiani-Urbina, E., Flores-Ortiz, C. M., Ponce-Noyola, T., & Olivia, R. (2009). Obtención de carotenoides a partir de la microalga Scenedesmus incrassatulus.
Garzón, A., & Gonzalez, J. D. (2019). Efecto de la intermitencia de la luz led sobre el crecimiento y producción de metabolitos de Scenedesmus obliquus. Universidad de Bogotá Jorge Tadeo Lozano.
Gómez, L. (2007). Microalgas: Aspectos ecológicos y biotecnológicos. Revista cubana de química, 19(2), 3-20.
González, M., Parra, O., & Cifuentes, A. (1995). Técnicas de cultivo de microalgas en laboratorio. Manual de métodos ficológicos, 219-250.
Guerrero, M. G., Rodríguez, H., Vargas, M., García-González, M., Campo, J. A. del, Moreno, J., & Rivas, J. (1999). Las microalgas como productoras de pigmentos con interés comercial.
Guillard, R. (1973). Division rates. En J. Stein (Ed.), Handbook of phycological methods (pp. 289-311). Cambridge University Press.
Greque, M. y Vieira, J. Á. (2007). Biofijación de dióxido de carbono por Spirulina sp. y Scenedesmus obliquus cultivados en un fotobiorreactor tubular en serie de tres etapas. J Biotecnología. 129, 439 - 445.
Infante, C., Angulo, E., Zárate, A., Florez, J. Z., Barrios, F., & Zapata, C. (2012). Propagación de la microalga Chlorella sp. En cultivo por lote: Cinética del crecimiento celular. Avances en Ciencias e Ingeniería, 3(2), 159-164.
Lawrenz, E., Fedewa, E. J., & Richardson, T. L. (2011). Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology, 23(5), 865-871.
Maity, J. P., Bundschuh, J., Chen, C.-Y., & Bhattacharya, P. (2014). Microalgae for third generation biofuel production, mitigation of greenhouse gas emissions and wastewater treatment: Present and future perspectives–A mini review. Energy, 78, 104-113.
Marker, Nush, Rai, & Riemann. (1980). La medida de pigmentos fotosintéticos en agua dulce y estandarización de métodos: Conclusiones y recomendaciones. Archivos de Hidrobiología, 14, 91-106.
Martínez, V., Pellón, A., Pérez, E., Correa, O., Escobedo, R., Madruga, Y., Oña, A., & Arencibia, R. (2005). Producción de Biomasa de Scenedesmus obliquus en diferentes medios de cultivo. Revista CENIC. Ciencias Biológicas, 36(Especial).
Pardo, J. Y., Moya, F. M., Ramírez, G. O., & Espinoza, S. M. (2017). Efecto del ensilado Biológico de Biofouilng en el crecimiento poblacional, contenido de clorofila a y carotenoides totales de Tetraselmis suecica. Sagasteguiana, 5(1), 29-36.
Pérez Vázquez, C. G., (2017) Aislamiento, identificación y curva de crecimiento de la microalga Scenedesmus Obliquus con fines biotecnológicos. Extraído de: http://repositorio.ugto.mx/handle/20.500.12059/3399.
Ponte, G., & Ruiz, M. (2013). Efecto del extracto acuosos de harina de pescado en el crecimiento poblacional y contenido de β-caroteno en Dunaliella salina, en condiciones de laboratorio. Universidad Nacional del Santa. Chimbote.
Quevedo, C., Morales, S. P., & Acosta, A. (2008). Crecimiento de Scenedesmus sp en diferentes medios de cultivo para la producción de proteína microalgal. Vitae, 15(1), 25-31.
Strickland, & Parsons. (1972). Un manual práctico de análisis de agua de mar (Segunda).
Tagliaferro, G., Izário, H., Chandel, A., Silva, S., Silva, M. y Santos, J. (2019). Cultivo continuo de Chlorella minutissima en un fotobiorreactor de puente aéreo de bucle interno de cilindro tubular para apoyar biorrefinerías 3G. Energía renovable. 130, 439 - 445.
Verduga Vera, M. E. (2020). Cultivo en batch de Scenedesmus spp., en aguas residuales de industrias lácteas: Crecimiento, Productividad y Composición bioquímica [Pregrado]. Universidad de Guayaquil.
Zhou, W. (2014). Potential applications of microalgae in wastewater treatments. Recent advances in microalgal biotechnology, 1-9.









