Introducción
La ciénaga de Los Manatíes (CM) es una laguna costera de gran importancia física, ecológica y socioeconómica. En los últimos años ha soportado una alta presión antropogénica, debido a la ocupación de sus orillas para fines recreativos y turísticos. Asimismo, recibe una carga sedimentaria procedente del mar Caribe y sustancias químicas que pueden estar afectando la calidad de sus aguas y sedimento. Una de las principales sustancias que podrían estar afectando este ecosistema, serían los metales pesados (MP), quienes constituyen uno de los tipos de contaminación más peligrosas para los ecosistemas acuáticos y para las especies presentes en ellos, especialmente los peces (Boy, 2015); principalmente porque tienen dos fuentes claras de ingreso al medio ambiente: una fuente natural y otra antropogénica.
Los MP se incorporan por medio de actividades domésticas, industriales, escorrentías superficiales y arrastre (Guiñez et al., 2015; Fuentes et al., 2018). Los sedimentos presentan acumulación de estos elementos, siendo integradores y concentradores de MP. Dicha capacidad está relacionada con el tamaño de las partículas, la especiación química y la cantidad de materia orgánica sedimentaria (León & Padilla, 2008; Delgado, 2012; Pájaro & Sánchez, 2016; Cadavid et al., 2019).
Los MP son frecuentes e importantes contaminantes (Ansari et al., 2004), debido a la facilidad con la que pueden incorporarse a los tejidos y formas químicas del sedimento o en dilución en la columna de agua (León et al., 2004). Dentro de ellos, se encontró al Zn y al Cu que, aunque son metabolizados por los organismos, sí se encuentran en altas concentraciones, pueden ser tóxicos y provocarles anomalías (Ansari et al., 2004; Zorrilla 2011; Corrales, 2013).
Los peces han sido utilizados como bioindicadores, debido a que se encuentran en contacto permanente con el agua, están en el nivel más alto de la cadena alimentaria y sirven como base de alimento para las poblaciones humanas. Por ello, han sido usados en diversos estudios como buenos bioindicadores de MP (Mzimela et al., 2003; Marcovecchio, 2004; Fernandes et al., 2007; Suami et al., 2018).
El objetivo de este trabajo fue analizar el grado de bioacumulación de metales traza (Cu y Zn) en músculo, branquias e hígado del pez M. incilis presente en la ciénaga de Los Manatíes.
Materiales y métodos
Se realizaron cuatro muestreos, desde el mes de octubre del 2016 hasta el mes de enero del 2017. En cada uno de ellos se recolectaron las muestras de sedimentos y del pez M. incilis. las muestras de sedimento fueron colectadas en cuatro estaciones de muestreo (tabla 1).
Tabla 1
Estaciones de muestreo en la ciénaga de Los Manatíes con sus respectivas coordenadas

|
Estación
|
Latitud
|
Longitud
|
|
E1: Paralelo a la costa
|
11° 02' 25,1" N
|
74° 54' 41,3" W
|
|
E2: Zona de manglar
|
11° 02' 31,7" N
|
74° 54' 42,5" W
|
|
E3: Zona Centro
|
11° 02' 30,1" N
|
74° 54' 36,9" W
|
|
E4: Zona de intercambio
|
11° 02' 30,1" N
|
74° 54' 23,8" W
|
La determinación de los metales pesados se llevó a cabo mediante la técnica de medida directa en muestras sólidas, espectrómetro de fluorescencia de rayos X por reflexión total (TXRF) (“S2 PICOFOX”) de BRUKER por duplicado, utilizando calibración interna (estándar de itrio (Y)). La calibración interna consiste en utilizar un estándar de concentración conocida de un elemento que no se encuentre en la matriz (muestra), para este caso se utilizó el Itrio, puesto que es improbable que se encuentre en las muestras de sedimento y pescado, este elemento se utiliza para compensar los efectos de la matriz. La calibración de los canales de lectura o la longitud de onda de fluorescencia se determinaron con el análisis de una muestra de As. El arsénico se utiliza por la sensibilidad del equipo a este elemento. Puesto que dispone del factor de sensibilidad y número y posición de picos de fluorescencia adecuados. Esta técnica logró detectar distintos elementos químicos de los cuales se tomaron los metales pesados Cu y Zn.
Sedimento
Las muestras de sedimentos fueron secadas, tamizadas, y molidas. Para así asegurar el máximo contacto entre el reactivo y las partículas. A través del tamizado se obtuvo la fracción fina (< 0,63 μm) la cual, se utilizó para la determinación de los MP.
El primer paso para la determinación de los MP, fue pesar entre 20-30 mg de fango en una balanza analítica, luego se procedió adicionar en un tubo de ensayo la muestra y 2mL HNO. concentrado previamente lavado con agua desionizada. Posteriormente se llevaron las muestras al ultrasonido a 60°C durante 30 min, pasado este tiempo se vertió 10 microlitros de estándar de itrio, se colocó cada una de las muestras en un vortex (digital vortex mixer) durante un 1 min para su homogenización.
Para la lectura, se sembró 10 μL de la muestra en un portador de cuarzo, este se llevó a una plancha (AREC.X Heating magnetic stirrer) durante 10 segundos para su posterior lectura, en el espectrómetro de fluorescencia de rayos X por reflexión total.
Pez M incilis
En cada muestreo se trató de colectar como mínimo 10 individuos de M. incilis. Los peces se transportaron en una nevera de icopor con hielo seco, con la finalidad de ser refrigerados hasta su posterior tratamiento en el laboratorio. La disección de las muestras y su posterior tratamiento se llevó a cabo siguiendo la metodología de INVEMAR (2003) y Márquez et al. (2008).
Tratamiento estadístico de los datos
El análisis estadístico se llevó a cabo con la ayuda de tres programas informáticos: Excel, PAST Statistical Software versión 2. 17, SPSS Statistics 24 y las gráficas fueron realizadas por medio del programa Origin versión 8.
El software PAST, se empleó para determinar la estadística descriptiva. El software SPSS, se utilizó para determinar la correlación de los metales pesados en los sedimentos y en los tejidos de los individuos, utilizando el coeficiente de correlación de Pearson con un nivel de significancia de P ≥ 0,05.
Factor de Bioacumulación (FB)
Para relacionar los contenidos de MP en el sedimento con los presentes en los diferentes tejidos del organismo y con la finalidad de apreciar si los individuos son capaces de bioconcentrar los metales (Cu y Zn) y en que magnitud; se utilizó el factor de concentración o Bioacumulación, propuesto por Ahumada (1994); Mountouris et al. (2002). La fórmula para la obtención del FB es:
FB = Cbiota / Csedimento
Donde C corresponde a la media de la concentración del metal en el musculo, branquias e hígado del pez M incilis, y a la media de la concentración del metal en el sedimento.
RESULTADOS Y DISCUSIÓN
Metales en la fracción total del sedimento
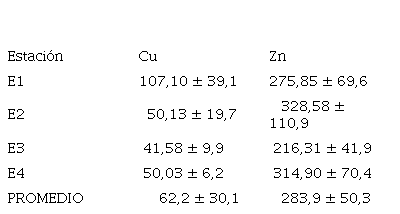
Las concentraciones medias globales de los MP (Cu y Zn), y las concentraciones por estación de muestreo se muestran en la tabla 2.
El cobre presentó un valor medio de 62,2 ± 34,22 mgkg-1, con valores máximos en la zona noroeste (107,10 mgkg-1) y mínimos en la zona centro (41,58 mgkg-1) (figura.1). Las concentraciones altas de Cu en la estación paralela a la costa, están relacionadas con los drenajes que se realizan en esta área. Las concentraciones de Zn oscilaron entre 328,58 mgkg-1 y 216,31 mgkg-1 (tabla 2), con un promedio global de 283,9 mgkg-1; siendo la zona noreste la de mayor valor, ya que esta zona es altamente influenciada por los desechos domésticos no tratados. Las concentraciones de Zn, estuvieron por encima de las encontradas para Cu en todas las estaciones de muestreo.
Tabla 2
Concentración de MP en mgkg1 Cu y Zn por estación de muestreo X ± DS promediodesviación estándar
|
Estación
|
Cu
|
Zn
|
|
E1
|
107,10 ± 39,1
|
275,85 ± 69,6
|
|
E2
|
50,13 ± 19,7
|
328,58 ± 110,9
|
|
E3
|
41,58 ± 9,9
|
216,31 ± 41,9
|
|
E4
|
50,03 ± 6,2
|
314,90 ± 70,4
|
|
PROMEDIO
|
62,2 ± 30,1
|
283,9 ± 50,3
|
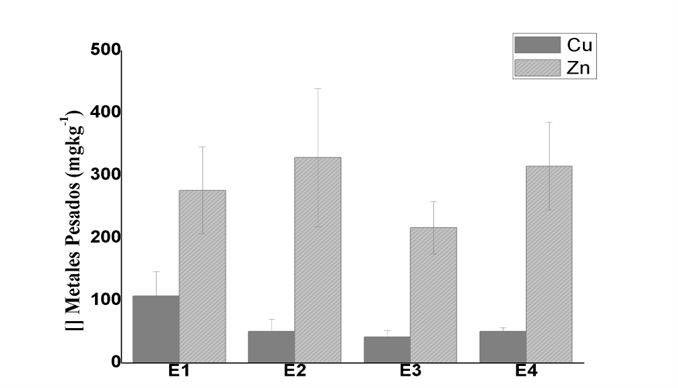 Figura 1
Concentración de MP (Cu y Zn) por estación de muestreo en la ciénaga de Los Manatíes.
Figura 1
Concentración de MP (Cu y Zn) por estación de muestreo en la ciénaga de Los Manatíes.
La distribución espacial de las concentraciones de metales en los sedimentos tiende a variar entre las estaciones, mostrando en algunas zonas (E1 y E2) niveles altos de MP (figura 1). Las variaciones encontradas pueden deberse a las diferencias en las fuentes de contaminación por metales y las condiciones físicas y químicas del sedimento (Fernandes et al., 2007). También con el tipo de partícula predominante en los sedimentos, puesto que determinan el contenido de MP. Así los sedimentos donde predominan las partículas finas, retendrán mayor humedad, materia orgánica y metales (Pérez et al., 2006; Calderón & Valdés 2012). Asimismo, la profundidad y la intensidad de las corrientes, son otra de las características que determinan la retención de metales en los sedimentos (León & Padilla, 2008).
El Zinc presentó concentraciones altas para todas las estaciones, indicando que existe un enriquecimiento de este metal en la ciénaga. Esto corrobora que es un buen indicador de las actividades humanas, ya sea domesticas o industriales (León et al., 2004). Unas de las causas que podrían estar aumentando su concentración es la poca circulación del material en suspensión y las deposiciones puntuales de aguas residuales.
Al comparar los valores de Cu y Zn de la CM con otros lugares encontramos que los supera a todos (tabla 3), excepto el Cu hallado por Fernándes et al. (2007). Es evidente que la ciénaga de Los Manatíes está recibiendo altas descargas de estos contaminantes, aunque las concentraciones no sugieren un riesgo para la biota según la guía de calidad de los sedimentos (Tabla 4). Estos elementos tienen un origen común según el índice de correlación de Pearson, puesto que presentaron una correlación positiva significativa (r=1,000**), lo que podría indicar una fuente común de ingreso al cuerpo de agua, debido a su utilización en la industria y en los fertilizantes utilizados para la actividad agrícola.
Tabla 3
Comparación de los MP Cu y Zn en sedimentos en este estudio y en otras investigaciones
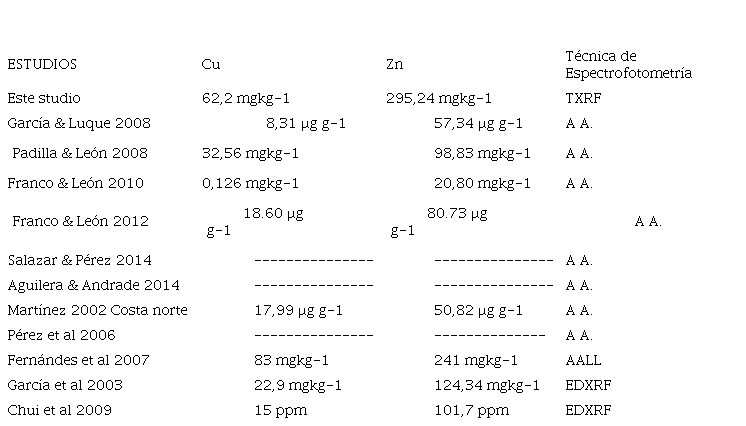
AA. absorción atómica; AALL. Absorción atómica de llama; TXRF: fluorescencia de rayos X por reflexión total. EDXRF: fluorescencia de rayos X de dispersión de energía.
|
ESTUDIOS
|
Cu
|
Zn
|
Técnica de Espectrofotometría
|
|
Este studio
|
62,2 mgkg-1
|
295,24 mgkg-1
|
TXRF
|
|
García & Luque 2008
|
8,31 μg g-1
|
57,34 μg g-1
|
A A.
|
|
Padilla & León 2008
|
32,56 mgkg-1
|
98,83 mgkg-1
|
A A.
|
|
Franco & León 2010
|
0,126 mgkg-1
|
20,80 mgkg-1
|
A A.
|
|
Franco & León 2012
|
18.60 μg g-1
|
80.73 μg g-1
|
A A.
|
|
Salazar & Pérez 2014
|
---------------
|
---------------
|
A A.
|
|
Aguilera & Andrade 2014
|
---------------
|
---------------
|
A A.
|
|
Martínez 2002 Costa norte
|
17,99 μg g-1
|
50,82 μg g-1
|
A A.
|
|
Pérez et al 2006
|
---------------
|
--------------
|
A A.
|
|
Fernándes et al 2007
|
83 mgkg-1
|
241 mgkg-1
|
AALL
|
|
García et al 2003
|
22,9 mgkg-1
|
124,34 mgkg-1
|
EDXRF
|
|
Chui et al 2009
|
15 ppm
|
101,7 ppm
|
EDXRF
|
Tabla 4
Concentración de metales totales en sedimento y comparación con la guía de calidad del sedimento.
 Long y MacDonald, 1998
Long y MacDonald, 1998
|
Analito
|
Este estudio
|
*Guía de calidad del sedimento
|
|
Bajo
|
Medio
|
|
Cu
|
62,2
|
34
|
270
|
|
Zn
|
283,9
|
150
|
410
|
Metales en el Pez Mugil incilis
Durante los 2 primeros muestreos en la CM no se encontró muestras para la especie M. incilis. Esto está relacionado con la migración reproductiva que realizan a finales de octubre, en la cual la especie sale a mar abierto a desovar (Zapata & Usma, 2013). Las concentraciones de MP en músculo, branquias e hígado se encuentran en la tabla 5. La acumulación en los tejidos siguió el siguiente orden: hígado > branquias > músculo en los dos muestreos.
Cobre (Cu)
El hígado presentó las mayores concentraciones de cobre para los dos meses de muestreo, con un valor promedio para el M3 de 4828 mgkg-1 y 547,5 mgkg-1 en el M4. Las branquias registraron un valor medio de 342 mgkg-1 en el muestreo 3 y 27,8 mgkg-1 en el M4. El contenido más alto de cobre registrado en el músculo se dio en el M4 (51,9 mgkg-1), mientras que las concentraciones en branquias e hígado fueron inferiores a las encontradas en el M3 (tabla 5, figura. 2). Esto puede estar sujeto a las diferencias de talla, siendo este factor importante, puesto que cuando se presenta una menor talla el músculo tiende acumular más metales, debido a que el radio de excreción es mucho más lento (Franco & León 2012; Al-Yousuf et al., 2000). Las altas concentraciones registradas en el tejido hepático están relacionadas con la función que tiene en el metabolismo de desintoxicar, pudiendo así acumular grandes cantidades de cobre en comparación con los demás órganos.
Zinc (Zn)
Se hallaron concentraciones de Zinc en las branquias superiores a los encontrados en hígado y músculo para los dos meses de muestreo, con una media de 1323 mgkg-1. No obstante, los individuos capturados en el cuarto muestreo registraron valores de zinc en músculo mayores a los encontrados en hígado y branquias, con un valor medio de 237 mgkg-1. Los altos valores en las branquias están sujetos a la capacidad de captación de sustancias en disolución que presenta este órgano (Fernandes 2007; Hauser-Davis et al., 2016) permitiendo inferir que las concentraciones en disolución en el agua puedan estar altas. Además, cabe resaltar que la especie M incilis, es una especie filtradora, que le permite tomar grandes cantidades de biomasa en cortos periodos de tiempo (Bond., 1996), también son considerados detritívoros e incorporan en su dieta diatomeas centrales y poliquetos (Jiménez., 2008). Los cuales han sido reportados como indicadores de MP, puesto que bioconcentran estos elementos (Siqueiros et al., 2014; Fernández., 2015 y Herrera y Méndez 2019).
Los datos del estudio indican que las concentraciones medias de los MP (Cu y Zn) en los tres tejidos son muy variables, proporcionando que las mayores concentraciones de cobre se encuentran en el hígado y las de zinc en las branquias. Schuhmacher et al. (1992) y Ribas. (2010), señalaron que el cobre es captado en el hígado para formar metalotioneína tetrahedral y especies del complejo metaloenzimas. Las cuales contienen un grupo tiol (-Sh) que facilita la unión al metal, lo que podría explicar las altas concentraciones halladas en este tejido. Las concentraciones de Zn en branquias se deben a la facilidad que presenta para atravesar las membranas celulares (Gaete-Olivares et al., 2014), además que tienden a formar complejos con el mucus de las lamelas branquiales, lo que favorecería su acumulación (Yilmaz et al., 2007). En el músculo se encontraron valores inferiores a los encontrados en las branquias e hígado; sin embargo, las concentraciones estuvieron por encima de la media reportadas en otras investigaciones (tabla 6). Las concentraciones de los metales en las branquias reflejan la disponibilidad de estos elementos en las aguas donde hábitan los peces, mientras que el hígado representa el almacenamiento de metales.
Las concentraciones de Cu (Tabla 5), superaron las concentraciones encontradas en Mugil curema, en los estudios realizados por Fuentes et al. (2018) y Corrales. (2013) y los valores de Zn superan los valores medios para Mugil cephalus (Dural et al., 2006). El músculo presentó las concentraciones más bajas, sin embargo, estos valores se encuentran por encima de los reportados por Franco & León. (2012) & Fuentes et al. (2018), y se encuentran por encima de los límites permisibles propuestos por las normas sanitarias internacionales (Tabla 7). Las concentraciones de Zn en el músculo son más altas que las encontradas para el Cu, esto se debe a que los requerimientos en la dieta para cobre son más bajos (Ribas, 2010). Las altas concentraciones registradas pueden deberse a la importancia que tiene el Zn en el metabolismo y que a menudo se regula por la actividad fisiológica de los organismos (Molina et al., 2012).
El hígado tiene la función de desintoxicación en el metabolismo del organismo y es un órgano altamente activo en la captación y almacenamiento de metales pesados (Zorrilla, 2011; Dural, 2006). Las branquias son la principal vía de transferencia del Cu y Zn al interior de los tejidos y es fundamental en la ingesta de cobre, debido a que interviene en la función del sistema nervioso, debido a que está involucrado en el metabolismo del hierro (Benedetti et al., 1989; Lemus et al., 1992; Argota et al., 2012). Asimismo, es el órgano principal para la absorción de compuestos en disolución (Lemus, 1992; Dural et al., 2006), por tanto, provee información de la disponibilidad de sustancias químicas en el medio
Los tres órganos muestran concentraciones altas para los dos metales lo cual puede estar sujeto a las altas concentraciones que se encuentran en el medio. Esto puede estar ocurriendo porque el hígado, que es el órgano encargado de la desintoxicación no pueda regular los valores hepáticos, produciéndose la acumulación en otros tejidos u órganos (Arellano, 1999; Benedetti et al., 1989).
Tabla 5
Concentración de MP en M. incilis en Músculo, Branquias e Hígado, por muestreo. Promedio ± desviación estándar.
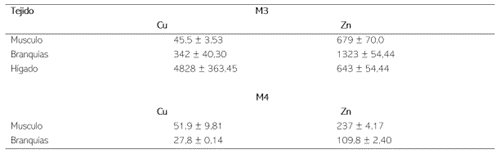
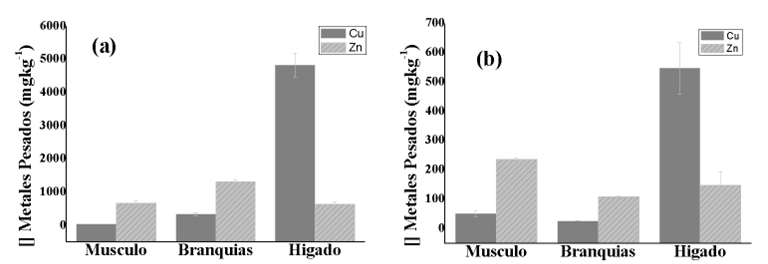 Figura 2
Concentración de MP en Músculo, Branquias e Hígado en la lisa M. incilis por muestreo, (a): muestreo 3, (b): muestreo 4.
Figura 2
Concentración de MP en Músculo, Branquias e Hígado en la lisa M. incilis por muestreo, (a): muestreo 3, (b): muestreo 4.
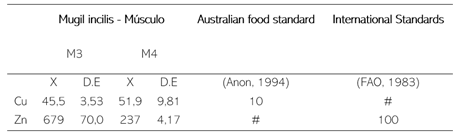 Tabla 7
Concentración de MP en tejidos de M incilis, comparación con normas sanitarias internacionales.
Tabla 7
Concentración de MP en tejidos de M incilis, comparación con normas sanitarias internacionales.
Valores dados en mg/kg, # Valor no disponible.
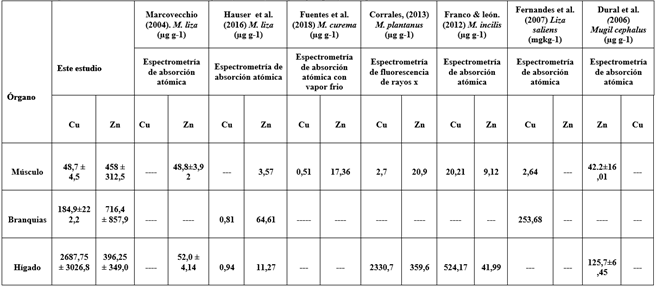 Tabla 6
Comparación de las concentraciones de MP en tejidos (Músculo, Branquias y Hígado) en Mugil incilis.
Tabla 6
Comparación de las concentraciones de MP en tejidos (Músculo, Branquias y Hígado) en Mugil incilis.
Tabla 7
Concentración de MP en tejidos de M incilis comparación con normas sanitarias internacionales
 Valores dados en mg/kg, # Valor no disponible.
Valores dados en mg/kg, # Valor no disponible.
|
Mugil incilis - Músculo
|
Australian food standard
|
International Standards
|
|
M3
|
M4
| | |
|
X
|
D.E
|
X
|
D.E
|
(Anon, 1994)
|
(FAO, 1983)
|
|
Cu
|
45,5
|
3,53
|
51,9
|
9,81
|
10
|
#
|
|
Zn
|
679
|
70,0
|
237
|
4,17
|
#
|
100
|
Factor de Bioacumulación (FB)
En la tabla 8 se observan los valores del Factor de Bioacumulación de MP en músculo, branquias e hígado del pez M incilis. El FB se realizó con relación al promedio de los metales (Cu y Zn) presentes en los 2 muestreos realizados. Teniendo en cuenta que el metal es bioconcentrado cuando el FB es igual o mayor a 1.
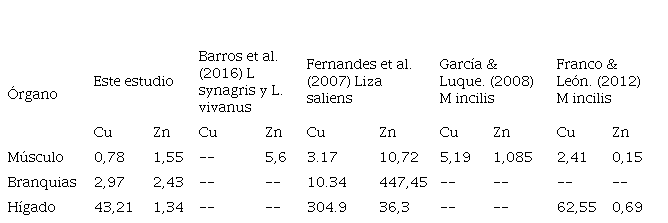
El FB evidencio que el cobre se bioacumula en el tejido hepático, tanto para las muestras recolectadas en el M3 como en M4 (figura.4), existiendo mayores niveles de bioconcentración para los individuos de mayor tamaño; asimismo las branquias también están acumulando este metal en el M3. El músculo por el contrario no presentó bioacumulación en ninguna de las muestras. Los altos valores para Cobre pueden estar asociados a la proteína metalotioneina, puesto que el 36% del cobre en el hígado está ligado a la metalotioneina (Ribas 2010). Estos resultados son similares a los reportados por Fernandes et al. (2007); Franco & León. (2012) (Tabla 9). Las concentraciones de Zinc, se deben a que este se asocia principalmente con la materia en suspensión antes de acumularse finalmente en el sedimento Márquez et al. (2008).
El Zinc por su parte se bioacumuló en los tres tejidos para los individuos recolectados en el M3, existiendo la mayor bioacumulación en el tejido branquial. Para el M4 no se presentó bioacumulación en ninguno de los tejidos, demostrando de esta forma que los individuos de mayor talla son los que mayor concentran MP (Vergara & Rodríguez., 2015; Bermeo & Célleri., 2016). Además, se encontró que el FB del Zn tiene una correlación positiva (r= 0,848*), con el Zn presente en el sedimento, lo cual indica que la fuente de bioacumulación de este metal sería los biodisponibles en el sedimento, por el contrario, el Cu no tiene una asociación significativa (r= 0,419), indicando que este metal podría estar siendo bioacumulado de una fuente alóctona. Concluyendo así que las concentraciones de metales trazas Cu y Zn, están siendo bioacumulados por el pez M. incilis. El Cu es bioacumulado en el tejido hepático y branquial y el Zn ha sido bioconcentrado por los tres tejidos.
Tabla 8
Factor de Bioacumulación (FB) de metales pesados en M. incilis en la ciénaga de Los Manatíes.
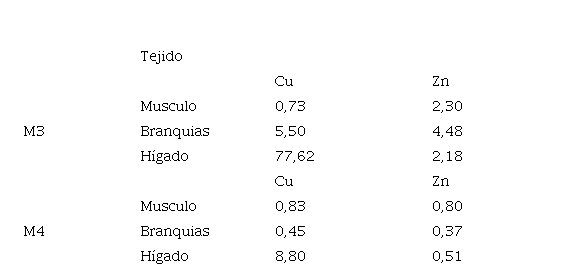
|
Tejido
| |
|
Cu
|
Zn
|
|
M3
|
Musculo
|
0,73
|
2,30
|
|
Branquias
|
5,50
|
4,48
|
|
Hígado
|
77,62
|
2,18
|
| |
Cu
|
Zn
|
|
M4
|
Musculo
|
0,83
|
0,80
|
|
Branquias
|
0,45
|
0,37
|
|
Hígado
|
8,80
|
0,51
|
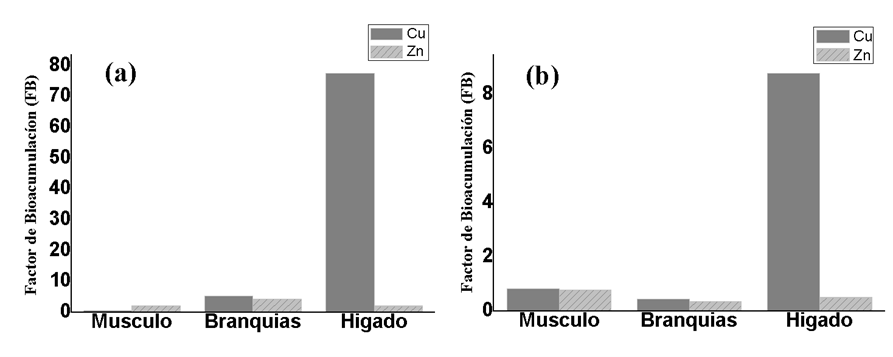 Figura 3
Factor de Bioacumulación del pez M. incilis en músculo, branquias e hígado, (a). muestreo 3; (b). muestreo 4.
Figura 3
Factor de Bioacumulación del pez M. incilis en músculo, branquias e hígado, (a). muestreo 3; (b). muestreo 4.
Tabla 9
Comparación del Factor de Bioacumulación con otros estudios
|
Órgano
|
Este estudio
|
Barros et al. (2016)
L synagris y L. vivanus
|
Fernandes et al. (2007)
Liza saliens
|
García & Luque. (2008)
M incilis
|
Franco & León. (2012)
M incilis
|
|
Cu
|
Zn
|
Cu
|
Zn
|
Cu
|
Zn
|
Cu
|
Zn
|
Cu
|
Zn
|
|
Músculo
|
0,78
|
1,55
|
--
|
5,6
|
3.17
|
10,72
|
5,19
|
1,085
|
2,41
|
0,15
|
|
Branquias
|
2,97
|
2,43
|
--
|
--
|
10.34
|
447,45
|
--
|
--
|
--
|
--
|
|
Hígado
|
43,21
|
1,34
|
--
|
--
|
304.9
|
36,3
|
--
|
--
|
62,55
|
0,69
|
Literatura citada
Alavarado C. 2013. Análisis multielemental de fertilizantes (mezclas físicas) por Fluorescencia de Rayos X por Reflexión Total, Guatemala, Informe de tesis, Universidad de san Carlos de Guatemala, Facultad de ciencias Químicas y Farmacia.
Al-Yousuf, M., El-Shahawi M, Al-Ghais S. (2000); Trace metals in liver, skin and muscle of Lethrinus lentjan fish species in relation to body length and sex. The science of the Total Environment, (256),87-94.
Anon. 1994. Food Standars Code. National Food Authority, Canberra - Australia.
Ansari, T. M., Marr, I. L., & Tariq, N. (2004). Heavy metals in marine pollution perspective-a mini review. Journal of Applied Sciences, 4(1), 1-20.
Arellano, J.M., Storch, V., & Sarasquete, C. (1999 rellano, J. M., Storch, V., & Sarasquete, C. (1999). Histological changes and copper accumulation in liver and gills of the Senegales sole, Solea senegalensis. Ecotoxicology and Environmental Safety, 44(1), 62-72.
Argota, G., Argota, H., Larramendi, D., Mora, Y., Fimia, R., & Iannacone, J. (2012). Histología y química umbral de metales pesados en hígado, branquias y cerebro de Gambusia punctata (Poeciliidae) del río Filé de Santiago de Cuba. REDVET. Revista Electrónica de Veterinaria, 13(5), 1-11.
Benedetti, J, G Albano, L Mola. (1989). Histomorphological changes in some organs of the brown bullhead, Zctalurus nebulosus LeSueur, following short- and long-term exposure to copper, J. Fish Bid. 1989, 34, 273-280.
Bond, C. (1996). Biology of Fishes. 2nd Edition. Thomson Learning, Inc. USA. 750 p.
Boy, A. (2015). Determinación de metales pesados en agua, peces, almejas e Hydrilla verticillata del lago Izabal. Trabajo de grado, Universidad de San Carlos Guatemala.
Cadavid, E., Socorro, N., & Marrugo, J. (2019). Contaminación por metales pesados en la bahía Cispata en Córdoba-Colombia y su bioacumulación en macromicetos. Gestión y Ambiente 22(1), 43-53
Calderón, C., & Valdés, J. (2012). Contenido de metales en sedimentos y organismos bentónicos de la bahía San Jorge, Antofagasta, Chile. Revista de biología marina y oceanografía, 47(1), 121-133.
Corporación Autónoma Regional del Atlántico(CRA) 2015. Monitoreo fisicoquímico, microbiológico e hidrobiológico sobre la calidad y estado de los cuerpos de agua, las fuentes hídricas del departamento del Atlántico y la caracterización de los humedales Sabanagrande, santo tomas y palmar de Varela en cumplimiento de lo establecido en el plan de acción institucional 2012 - 2015 informe final.
Corrales, D. Acuña A, Salhi M, Saona G, Odino R. Metales pesados en dos especies de peces de la zona costera de Montevideo. 2013, Universidad de la Republica Uruguay.
Delgado, J. (2012). Estudio de la contaminación por metales pesados en la cuenca baja del rio Guadiana. Tesis y trabajos fin de Master. Universidad de huelva. Pág. 3.
Dural, M., Lugal, M., Akif, A., Derici, B., (2006). Bioaccumulation of some heavy metals in different tissues of Dicentrarchus labrax L, 1758, Sparus aurata L,1758 and Mugil cephalus L, 1758 from the CamLik lagoon of the eastern cost of mediterranean (turkey). Environmental Monitoring and Assessment, 118(1), 65–74.
FAO (Food and Agriculture Organization). 1983. Compilation of legal limits for hazardous substances in fish and fishery products. Fishery Circular 464, 5-100.
Fernandes, C., Fontainhas-Fernandes, A., Peixoto, F., & Salgado, M. A. (2007). Bioaccumulation of heavy metals in Liza saliens from the Esmoriz–Paramos coastal lagoon, Portugal. Ecotoxicology and environmental safety, 66(3), 426-431.
Franco, A., & León, I. (2012). Bioacumulación de metales traza en Mugil incilis (Hancock,1830); una herramienta útil para el biomonitoreo de la contaminación metálica en el litoral costero del departamento del atlántico, Colombia. Costas 1(1), 98-106.
Fuentes. F., J. Pinedo, J. Marrugo. (2018). Metales pesados en especies ícticas de la ciénaga de mallorquín, Colombia. Revista espacios, 39(3).
Gaete-Olivares, H., Guerra Muñoz, R., Carvajal Vásquez, D., Mukarker Valladares, M., & Lobos Valenzuela, G. (2014). Evaluación de la genotoxicidad de las aguas costeras de Chile central sobre los peces Mugil cephalus y Odontesthes brevianalis. Hidrobiológica, 24(3), 271-279.
García, A, M Luque. Análisis de metales pesados (Cr, Fe, Zn, Cd y Pb) en el tejido muscular de la mojarra rayada Eugerres plumieri y en la Lisa Mugil incilis de la ciénaga de Mallorquín, Atlántico. 2008, Trabajo de grado. Universidad del Atlántico, Barranquilla.
Guiñez, M., Valdés, J., & Castillo, A. (2015). Contenido de metales en sedimentos y en Emerita analoga (Stimpson, 1857), en bahía Mejillones del Sur, Chile. Latin american journal of aquatic research, 43(1), 94-106.
Hauser-Davis, R. A., Bordon, I. C., Oliveira, T. F., & Ziolli, R. L. (2016). Metal bioaccumulation in edible target tissues of mullet (Mugil liza) from a tropical bay in Southeastern Brazil. Journal of Trace Elements in Medicine and Biology, 36, 38-43.
Herrera, M., & Méndez, N. (2019). Efecto del cadmio sobre la mortalidad de adultos de Polydora sp.(Polychaeta: Spionidae) en el laboratorio. Revista de Biología Tropical, 67(5), 110-118.
Instituto de Investigaciones Marinas y Costeras, INVEMAR, 2003. Manual de técnicas analíticas para la determinación de parámetros fisicoquímicos y contaminantes marinos (agua, sedimento y organismos).
Jímenez, R.M.F. (2008). Caracterización trófica de algunos peces de interés comercial en la bahía de Cartagena (caribe colombiano). Trabajo de grado.
Lemus, M, S chung, J Chópite. (1992). Efecto de la temperatura sobre la acumulación y depuración de cobre en tejidos de juveniles de. Petenia kraussi (Steinchdachner, 1887) (Pisces: Cichlidae). saber Vol 9.
León L, I. & 0S Padilla. Geoquímica y contaminación por metales pesados (Fe, Cu, Pb y Zn) en sedimentos superficiales intermareales y submareales en la ciénaga de mallorquín (Barranquilla-Colombia). 2008, Pág.16.
León, I., Méndez, G., & Rubio, B.. (2004). Fases geoquímicas del Fe y grado de piritización en sedimentos de la Ría de Pontevedra (NO de España): implicaciones del cultivo del mejillón en bateas. Ciencias Marinas, 30(4), 585-602.
Long, E. R., & Mac Donald., D.D. (1998). Recommended uses of empirically derived, sediment quality guidelines for marine and estuarine ecosystems. Human and Ecological Risk Assessment 4(5), 1019-1039.
Marcovecchio, J. E. (2004). The use of Micropogonias furnieri and Mugil liza as bioindicators of heavy metals pollution in La Plata river estuary, Argentina. Science of the Total Environment, 323(1-3), 219-226.
Márquez, B., W. Senior, I. Fermín, G Martínez, J Castañeda & A. Gonzales. (2008). Cuantificación de las concentraciones de metales pesados en tejidos de peces y crustáceos de la laguna de Unare.
Molina, C. I., Ibañez, C., & Gibon, F. M. (2012). Proceso de biomagnificación de metales pesados en un lago hiperhalino (Poopó, Oruro, Bolivia): Posible riesgo en la salud de consumidores. Ecología en Bolivia, 47(2), 99-118.
Mzimela, H. M., Wepener, V., & Cyrus, D. P. (2003). Seasonal variation of selected metals in sediments, water and tissues of the groovy mullet, Liza dumerelii (Mugilidae) from the Mhlathuze Estuary, South Africa. Marine Pollution Bulletin, 46(5), 659-664.
Pájaro, D, P Sánchez. (2016). Evaluación de las concentraciones de Metales Pesados (Cd Y Pb) en especies ícticas comercializadas en la plaza del pescado de la ciudad de Barranquilla y riesgo potencial para la salud humana. trabajo de grado, universidad CUC.
Pérez, M., Martínez. G., & I. Fermín. (2006). Biodisponibilidad de metales traza en sedimentos superficiales del ecosistema lagunar costero bocaripo-chacopata (península de Araya, estado Sucre). Boletín del Instituto Oceanográfico de Venezuela, 45 (2), 81-91.
Ribas, B. 2010, Metalotioneína y algunos elementos minerales como bioindicadores en toxicología y clínica. Monografías de la Real Academia Nacional de Farmacia.
Schuhmacher, M., Domingo, J. L., Bosque, M. A., & Corbella, J. (1992). Heavy metals in marine species from the Tarragona coast, Spain. Journal of Environmental Science & Health, 27(7), 1939-1948.
Siqueiros-Beltrones, D. A., Argumedo-Hernández, U., Murillo-Jiménez, J. M., & Marmolejo-Rodríguez, A. J. (2014). Diversidad de diatomeas bentónicas marinas en un ambiente ligeramente enriquecido con elementos potencialmente tóxicos. Revista Mexicana de Biodiversidad, 85(4), 1065-1085.
Suami, R. B., Sivalingam, P., Kabala, C. D., Otamonga, J. P., Mulaji, C. K., Mpiana, P. T., & Poté, J. (2018). Concentration of heavy metals in edible fishes from Atlantic Coast of Muanda, Democratic Republic of the Congo. Journal of Food Composition and Analysis, 73, 1-9.
Yılmaz, F., Özdemir, N., Demirak, A., & Tuna, A. L. (2007). Heavy metal levels in two fish species Leuciscus cephalus and Lepomis gibbosus. Food chemistry, 100(2), 830-835.
Zapata, L, J Usma. Guía de las especies migratorias de la biodiversidad en Colombia peces. 2013, Ministerio de Ambiente y Desarrollo, Vol 2, Pág. 138.
Zorilla, M. (2011). Estado del arte sobre la presencia de metales pesados en tejidos y agallas de peces. trabajo de grado, Universidad Autónoma de Occidente.


















