



Casos Clínicos
SÍNDROME DE MEIGS SECUNDARIO A TUMOR DE CÉLULAS DE LA GRANULOSA: REPORTE DE CASO
MEIGS SYNDROME SECONDARY TO OVARIAN GRANULOSA CELL TUMOR: CASE REPORT
Revista Médico Científica
Universidad de Panamá, Panamá
ISSN: 1608-3849
ISSN-e: 2218-8266
Periodicidad: Anual
vol. 33, núm. 1, 2020
Recepción: 29 Junio 2020
Aprobación: 27 Julio 2020

Resumen: El síndrome de Meigs es una entidad clínica relacionada a tumor ovárico benigno-sólido tipo fibroma; tecoma, tumor de Brenner o tumor de la granulosa; acompañado de ascitis y derrame pleural. Se caracteriza por una resolución clínica completa posterior a la extracción quirúrgica. Se presenta el caso de una paciente femenina de 33 años con cuatro meses de sangrado uterino anormal, llenura y disnea progresiva. En el ultrasonido abdominal se observó una masa anexial derecha dependiente de ovario con características sugerentes de malignidad; la radiografía de tórax evidenció derrame pleural unilateral con citología negativa para células malignas. El reporte histopatológico definitivo de la pieza quirúrgica refiere un tumor de células de la granulosa (TCG), secretor de estrógenos, de bajo grado de malignidad. La asociación del síndrome de Meigs con un tumor de células de la granulosa es poco frecuente y no se ha reportado en Panamá.
Palabras clave: Tumor de células de la granulosa, ascitis, derrame pleural, Síndrome de Meigs, Antígeno Ca- 125.
Abstract: Meigs syndrome is a clinical entity related to a benign- solid fibroma-like ovarian tumor; thecoma, Brenner's tumor, or granulosa tumor; accompanied by ascites and pleural effusion. It is characterized by complete clinical resolution after surgical removal. The case of a 33-year-old female patient with four months of abnormal uterine bleeding, fullness and progressive dyspnea is presented. An abdominal ultrasound found a right adnexal mass dependent on the ovary with characteristics suggestive of malignancy; Chest radiography showed unilateral pleural effusion with negative cytology for malignant cells. The definitive histopathological report of the surgical specimen related to a low-grade estrogen-secreting granulosa cell tumor (GCT). The association of Meigs syndrome with a granulosa cell tumor is rare and has not been reported in Panama.
Keywords: Adult granulosa cell tumor of the ovary, ascites, pleural effusion, Meigs' Syndrome, Antigen CA- 125.
INTRODUCCIÓN
El síndrome de Meigs se define como la tríada clínica de ascitis, hidrotórax y la presencia de tumor ovárico que macroscópicamente tenga apariencia de fibroma, cuya extirpación quirúrgica alivia la ascitis y el hidrotórax. Los tipos histológicos más frecuentes de estos tumores incluyen los fibromas, los tecomas y tumor de células de la granulosa.[1] Meigs y Cass publicaron 7 casos de fibromas ováricos con síndrome de Meigs en 1937, aunque ya se habían reportado casos de la presentación clínica anteriormente por Spigelberg, Cullinworth y Demons en la segunda mitad del siglo XIX. Posteriormente en 1954, Meigs presentó una definición precisa del síndrome donde especifica que deben ser tumores ováricos tipo fibroma.[1,2]
En la revisión sistemática de Krenke et al, identificaron 454 artículos publicados entre 1940 y 2013 que mencionaban esta entidad clínica, donde aclararon términos relacionados a Síndrome de Meigs para poder diferenciar y agrupar adecuadamente los casos ya que existe confusión de definición en la literatura, por lo que distinguieron el síndrome de Demons-Meigs, síndrome de Pseudo- Meigs (benigno y maligno), síndrome de Meigs incompleto y síndrome de Pseudo-Pseudo Meigs. El síndrome de Demons-Meigs engloba cualquier tipo de tumor benigno ovárico (incluyendo los tipo fibroma), tubárico y del ligamento ancho excluyendo a los tumores benignos uterinos. El síndrome de Pseudo-Meigs es la presencia de ascitis e hidrotórax secundario a cualquier otro tumor pélvico o abdominal que puede ser benigno o maligno y que no forma parte del síndrome de Demons-Meigs.[3]
El tumor de células de la granulosa es la patología de base, siendo el causante de menos del 5% de los tumores de ovario y uno de los más comunes de los
tumores de células estromales. Sus manifestaciones clínicas varían desde asintomática hasta la aparición de una masa abdominal dolorosa, sangrado uterino anormal de origen hormonal e irregularidades menstruales. En mujeres en edad reproductiva se manifiesta con amenorrea o sangrado uterino anormal; en pacientes posmenopáusicas se presenta principalmente como sangrado uterino anormal debido a hiperplasia endometrial.[4]
El marcador tumoral CA125 puede ser de utilidad para ver la evolución del paciente, sin embargo, es inespecífico y puede verse elevado por patologías benignas o malignos con gran porcentaje de falsos positivos, debido a esto se recomienda su utilización en conjunto con pruebas imagenológicas.[5]
CASO CLÍNICO
ENFERMEDAD ACTUAL
Paciente femenina de 33 años de edad, Gestación (G): 1; Aborto (A): 1, acude por cuadro de cuatro meses de evolución de sangrado uterino anormal asociado a dolor pélvico tipo cólico de intensidad 2/10, fatiga, llenura, con posterior aparición de disnea de medianos esfuerzos que progresa a disnea en reposo. Se realiza ultrasonido transvaginal, en el Hospital José Domingo de Obaldía, donde se observó una masa anexial derecha dependiente de ovario con características sugestivas de malignidad por lo que es referida al Instituto Oncológico Nacional (ION).
HISTORIA ANTERIOR
Antecedente personal patológico: migraña con aura.
Antecedentes ginecoobstétricos: G: 1, A: 1, menarquia a los 11 años, ciclos menstruales irregulares desde los 30 años, menometrorragia manejada con anticonceptivos orales, último Papanicolau negativo por células malignas en el 2019.
Antecedentes heredofamiliares: cáncer de mama en tía materna a los 35 años de edad y prima paterna a los 24 años, cáncer de colón en prima materna a los 43 años.
Antecedentes quirúrgicos: legrado uterino por aborto a los 23 años.
Medicamentos: anticonceptivos orales por 5 meses de forma irregular, mal tolerados. Metformina por sospecha de síndrome de ovarios poliquísticos. Actualmente no está medicada.
REVISIÓN POR APARATOS Y SISTEMAS
Síntomas generales: fatiga progresiva, niega otros síntomas.
Gastrointestinal: llenura, aumento del perímetro abdominal transitorio
EXAMEN FÍSICO
Presión arterial: 120/70 mmHg, frecuencia respiratoria: 16 cpm, frecuencia cardiaca: 70 lpm. IMC: 26 kg/m2.
Estado general: alerta, consciente, orientada en las 3 esferas, cooperadora.
Tórax/Pulmonar: disminución de ruidos respiratorios y auscultación de crépitos en base pulmonar derecha.
Abdomen: ligeramente globoso, blando, depresible, no doloroso a la palpación, sin visceromegalias, sin signos clínicos de ascitis.
Ginecológico: masa en anexo derecho de aproximadamente de 8 cm, redonda, consistencia lisa al examen bimanual. No hay evidencia de sangrado. Cérvix móvil sin lesiones.
INTERCONSULTAS Y ESTUDIOS
1. Ultrasonido (USG) pélvico (25/4/2019): útero y ovario izquierdo de aspectos normales. En anexo derecho se observa imagen de masa redonda de
9.12 cm x 9.5 cm x 2.94 cm; puramente sólida con
pequeñas imágenes quísticas en algunas áreas y muy vascularizada con vasos gruesos, algunos con gran calibre de trayectoria irregular, central y periféricos. Se observa un gran vaso que corre aparentemente hacia dentro. Se observa líquido libre en moderada cantidad en el fondo del saco y anexo derecho.
2. Histeroscopía (21/5/2019): 3 pólipos endometriales. Sin otros hallazgos.
3. Tomografía computarizada (TC) toracoabdo- minopélvico con contraste (24/5/2019): derrame pleural derecho. Imagen de masa hipodensa heterogénea de contornos definidos por delante del útero y superior a la vejiga urinaria que mide 8.8 cm x 7.4 cm a considerar una masa anexial. Escaso líquido libre intraabdominal. No se evidencia adenopatías.
4. TC toracoabdominopélvico (18/7/2019): derrame pleural derecho de escaso contenido heterogéneo. Leve ascitis subdiafragmática derecha. No se evidencia adenopatías.
5. Radiografía de tórax (10/9/19): derrame pleural derecho significativo (Ver figura 1).
6. Interconsulta a neumología (11/9/2019): se consulta para realización de toracentesis diagnóstica.
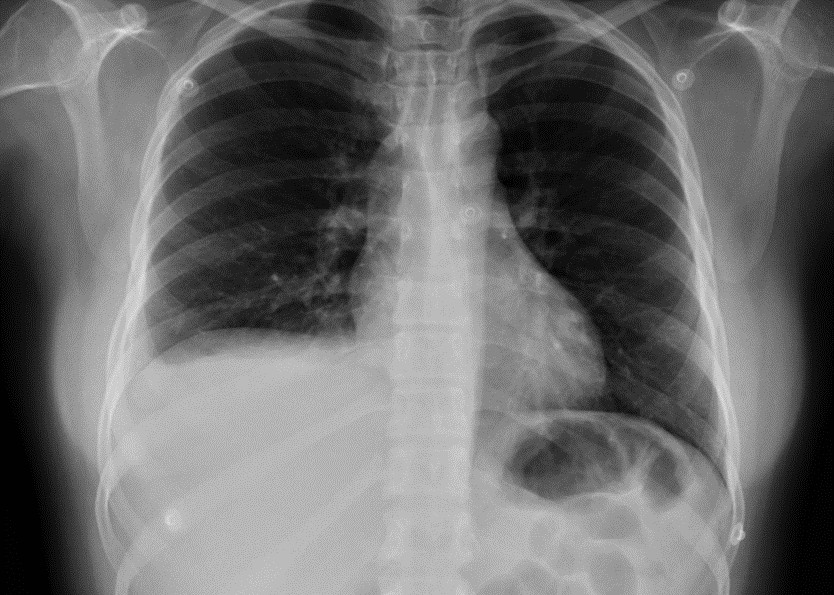
Patología
a. Citología de líquido pleural (12/9): negativo para células malignas.
Laboratorios del ION
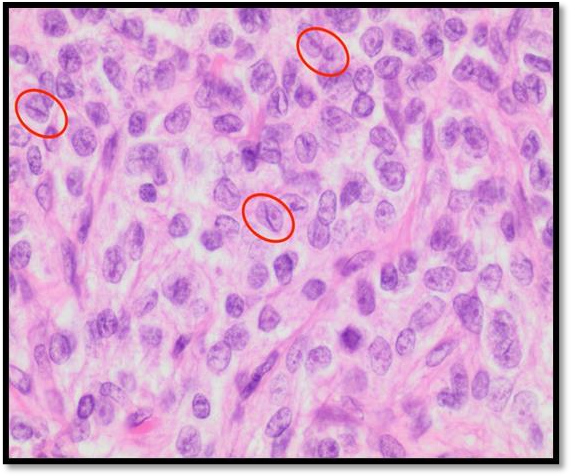
(a) Tumor de células de la granulosa tipo adulto con patrón difuso, tinción de H&E a 400x. Se observan células con escaso citoplasma y núcleo pálido, uniforme y oval. En algunas células, se observan los surcos nucleares (círculos) que les dan el aspecto de gránulos de café.
Servicio de Patología, ION
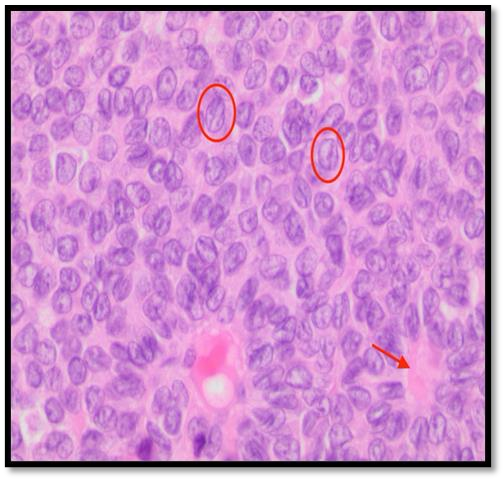
(b) Se observan los surcos nucleares (círculos) que les dan el aspecto de gránulos de café a las células y escasos cuerpos de Call- Exner (flecha).
Servicio de patología de IONTRATAMIENTO
Laparotomía exploratoria con incisión medial donde se le realiza una salpingooforectomía derecha y omentectomía parcial de la porción que cubría el tumor (Ver figura 3). Se evidencia 500 cc de ascitis hemorrágica, adherencias laxas a epiplón y en cuerdas de violín perihepáticas, sin lesiones intraperitoneales ni adenopatías por lo cual se decide no tomar biopsia ganglionar. Se encuentra adherencias periováricas izquierdas. Se realiza corte por congelación que evidencia tumor de células de la granulosa.
Paciente con deseos de fertilidad por lo que se realiza salpingooforectomía derecha. En el ovario contralateral no hay hiperplasia endometrial ni lesiones sospechosa
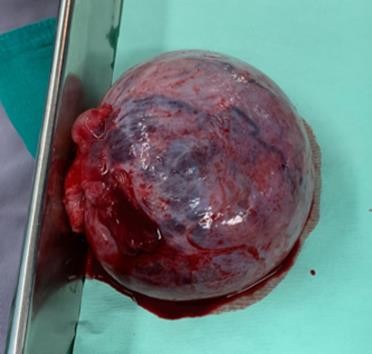
Masa pesa 470 g y mide 13 cm x 11.5 cm x 3.5 cm, superficie externa lisa adherida a trompa uterina. Salida de líquido hemático a la apertura con 90% de área sólida.
Servicio de Ginecología ION
EVOLUCIÓN
La paciente con buena evolución en el postoperatorio, egresó al día siguiente con resolución de los síntomas como disnea causado por derrame pleural y saciedad temprana por efecto mecánico del tumor y ascitis (Ver Figura 4).
Actualmente (Mayo 15, 2020) refiere sentirse bien, con ciclos regulares, sin evidencia de sangrado uterino anormal.
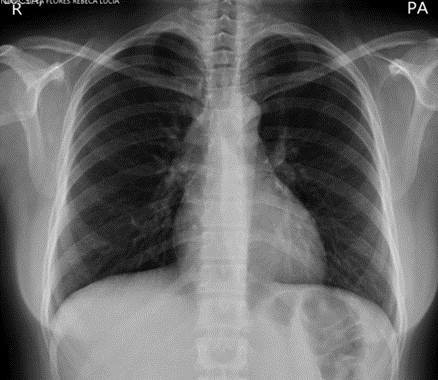
Radiografía de tórax que evidencia resolución de derrame pleural posterior a cirugía (13/11/19).
Servicio de Ginecología, ION.DIAGNÓSTICO DIFERENCIAL
El diagnóstico diferencial se basa en las entidades que causan sangrado uterino anormal y masa anexial asociadas a derrame pleural y ascitis en mujeres en edad reproductiva no embarazada. [6,7]
Además de los hallazgos de la ultrasonografía, los marcadores CA-125 y HE4 pueden ser útiles para orientar el diagnóstico diferencial. Considerando ambos marcadores diferenciar el potencial de benignidad o malignidad. Esta relación se conoce como ROMA y en este caso catalogó a la paciente como riesgo alto, >13.1% premenopáusica o >27.7% postmenopáusica, lo que sugiere malignidad de la masa anexial.[8]
Tecoma, fibroma y otros tumores del estroma de cordón sexual
Los tecomas pueden presentar hiperestrogenismo, manifestando sangrado uterino anormal en la mitad de los casos y el 20% puede presentar carcinoma endometrial sincrónico.[9,,10] Los fibromas son casi siempre tumores endocrinos inertes y en general son asintomáticos, pero pueden presentar dolor abdominal o molestias pélvicas a medida que crecen. [11,12] Tanto los tecomas como los fibromas pueden presentar síndrome de Meigs.[10,11]
Cáncer ovárico epitelial
El cáncer ovárico epitelial (COE) corresponde al 90% de los tipos de cáncer de ovario y generalmente se diagnostica en estadios avanzados. COE suele acompañarse de síntomas inespecíficos como distensión abdominal, saciedad temprana, fatiga, pérdida de peso durante meses. Pueden causar síndrome de pseudo-Meigs y acompañarse de carcinoma endometrial sincrónico, metástasis endometrial o sangrado uterino anormal en el tracto genital inferior. [13,14]
Metástasis ováricas de malignidad extragenital
Las metástasis ováricas representan el 7% de los tumores ováricos malignos, generalmente son secundarios a cáncer colorrectal y cáncer de mama, los cuales pueden acompañarse de derrame pleural y ascitis como en el caso del síndrome de pseudo- Meigs. [15,16]
DISCUSIÓN
Tanto los TCG como el síndrome de Meigs son entidades poco frecuentes de manera individual, la coexistencia de ambas patologías es aún más rara por lo que no se cuenta con estudios de prevalencia de síndrome de Meigs como manifestación de TCG o de TCG como causa de síndrome de Meigs.
Con respecto a la edad de la paciente no es la más frecuente para el desarrollo de tumores de células de granulosa tipo adulto ni juvenil, los cuales son más comunes en las pacientes perimenopáusicas o postmenopáusicas; y menores de 30 años o premenárquicas respectivamente.
La elevación del CA-125 en esta paciente podría ser por las efusiones, tanto pleural como peritoneal, por irritación debido a efecto mecánico del tumor. Su diagnóstico no pudo ser evidenciado al examen físico por tratarse de una ascitis leve, menos de 1500 cc; sin embargo, fue evidenciado por estudios de imagen y al momento de la cirugía. El índice ROMA elevado pronostica malignidad, pero carece de sensibilidad para diferenciar la estirpe. Aunque la inhibina B es el marcador más sensible y específico para TCG, no está disponible en Panamá.
El pronóstico es difícil de establecer en esta paciente ya que la tasa de recurrencias y mortalidad para TCG es distinta al pronóstico de síndrome de Meigs, esto podría deberse a que la mayoría de los casos de
Meigs se asocian a fibroma, el cual es benigno en comparación con TCG que es de bajo potencial maligno, pero con altas tasas de recurrencias.
REVISIÓN BIBLIOGRÁFICA
El síndrome de Meigs se define como la presencia de tumor benigno de ovario asociado a ascitis y derrame pleural que resuelve posterior a la resección del tumor. Los tipos de tumores que se incluyen en el diagnóstico de síndrome de Meigs son fibroma, tecoma, tumor de células de la granulosa, y tumor de Brenner. 17 La asociación de otros tipos de tumores, tanto benignos como malignos con ascitis y derrame pleural se conoce como síndrome de pseudo-Meigs.
[18,19]
Las pacientes con síndrome de Meigs suelen manifestar cansancio, dificultad para respirar, cambio de peso, tos seca, alteraciones del ciclo menstrual; a nivel pulmonar hallazgos de derrame pleural, como taquipnea, taquicardia, matidez a la percusión pulmonar, disminución de los sonidos respiratorios; en el abdomen se puede palpar una masa pélvica o evaluar signos de ascitis.2 Aproximadamente el 70% de los derrames pleurales son del lado derecho, el 15% del lado izquierdo y el 15% son bilaterales.[20]
En un estudio que evaluaba la prevalencia del síndrome de Meigs en Pakistán (2017) se obtuvo que de 1000 pacientes que fueron evaluadas por problemas ginecológicos, 30 (3%) pacientes fueron diagnosticadas con síndrome de Meigs; estas pacientes el 84% eran mayor de 45 años y 16% menor de 20 años.2 El síndrome de Meigs representa aproximadamente el 1% de los tumores de ovario. [21]
Se desconoce el mecanismo de formación de la
ascitis, pero se cuenta con varias teorías que intentan explicar el origen del hidrotórax y la ascitis en el
síndrome de Meigs y pseudo-Meigs.[22] Dentro de estas, la producción de líquido por el peritoneo, que no es alrededor de la superficie del tumor, se ha sugerido como el factor principal en la producción de ascitis. [23]
Otras teorías propuestas son la presión directa sobre los vasos sanguíneos o linfáticos circundantes, la estimulación hormonal y torsión del tumor; aumento de permeabilidad capilar mediado por sustancias como histamina, complemento, factor endotelial de crecimiento vascular (VEGF) y filtración de líquido intersticial en el peritoneo a través de la cápsula del tumor. [18,20]
El derrame pleural generalmente se desarrolla a partir del movimiento del líquido ascítico hacia el espacio pleural a través de defectos congénitos en el diafragma o por los canales linfáticos y, eventualmente, causa un derrame pleural exudativo.[18]
La asociación de síndrome de Meigs con CA-125 elevado es rara, pero posible. Actualmente se desconoce el mecanismo que causa la elevación de CA-125. Sin embargo, dentro de las hipótesis propuestas están la expresión mesotelial de los factores bioquímicos de CA-125 y la irritación mecánica del peritoneo por presión intraperitoneal elevada. [24]
El diagnóstico del síndrome de Meigs es postoperatorio con resolución de ascitis y derrame pleural con confirmación histológica de tumor benigno tipo fibroma.20 En el síndrome de Meigs, después de la extirpación del tumor, la esperanza de vida es la misma que con la población y menos del 2% de los casos se convierten en malignos.[2]
El manejo definitivo del síndrome de Meigs es con cirugía abdominal (laparotomía o laparoscopia) por
medio de la extracción del tumor para la sección congelada inicialmente. Si el tumor es benigno, especialmente en pacientes jóvenes que desean preservar su fertilidad, se realiza una salpingooforectomía unilateral. En mujeres posmenopáusicas, se realiza una histerectomía abdominal total con salpingooforectomía bilateral. [17]
En cuanto a la asociación de síndrome de Meigs y Tumores de células de la granulosa, esta no es frecuente y en nuestra búsqueda de reportes de casos de Meigs y Tumores de Células de la granulosa se obtienen 7 resultados, uno de estos siendo de tipo juvenil.
El TCG fue descrito por Rokitansky en 1859, se caracteriza por lento crecimiento, bajo potencial de malignidad, recurrencias tardías y escasa tasa de metástasis a distancia. Representan el 70% de los tumores estromales de los cordones sexuales y <5% de los tumores de ovario. [22,25,26] Se clasifican en función de la edad de las pacientes, su historia natural y sus características patogénica en tumores de células de la granulosa tipo adulto (TCGA) y tipo juvenil (TCGJ).[21]
En cuanto al TCG, la ecografía transvaginal (TVS) es el mejor estudio inicial para obtener imágenes de las estructuras pélvicas y se observa como masas redondas a ovoides que son multiquísticas y pueden tener componentes sólidos. Los tumores de células de la granulosa son infrecuentes, su incidencia varía de 0.4 a 1.7 casos por cada 100.000 mujeres al año. Los TCG tipo adulto son la forma más frecuente, 95%, aparecen normalmente a partir de los 40 años con un pico de incidencia entre los 50-55 años; las formas juveniles, 5%, se presentan en torno a los 20 años o antes; 45% en la premenarquia.[21]
Las manifestaciones del TCG van desde asintomáti- cas hasta dolor, masa abdominal, sangrado uterino
anormal e irregularidades menstruales. Un estudio retrospectivo de Lee IH et al. efectuado en 102 pacientes, reportó como principales síntomas: sangrado vaginal en el 24.8% de las pacientes, masa abdominal palpable en el 24.8%, dolor abdominal en el 17.6%, amenorrea en el 3.9%, entre otros, 2.9%. El 22.5% de las pacientes no manifestó síntomas.[27] Algunos casos pueden manifestar síntomas virilizantes e hirsutismo debido a la secreción de andrógenos. [28]
Los TCG son los tumores productores de estrógenos más comunes y por tal motivo se asocian con hiperplasia endometrial en el 25–50% y con adenocarcinoma en el 5–10% de los casos[19]. El diagnóstico es histológico, caracterizándose el tipo adulto por células que proliferan en una variedad de patrones que se pueden mezclar. El patrón microfolicular se caracteriza por unas formaciones similares a rosetas llamados cuerpos de Call-Exner, característicos de TCG; el diagnóstico se completa con la inmunohistoquímica utilizando anticuerpos contra células de la granulosa como inhibina, CD99, sustancia mülleriana inhibidora (MIS), vimentina, citoqueratina, S-100, siendo la inhibina la más sensible y específica para tumores de células de la granulosa.[25]
El tratamiento estándar de TCG consiste de histerec- tomía total abdominal con salpingooforectomía bilateral y estadiaje; en caso de deseo de fertilidad se puede realizar una salpingooforectomía unilateral con estadiaje. [28] En pacientes con cirugía conservadora, salpingooforectomía unilateral, se indica la realización de biopsia o legrado de endometrio para descartar la posibilidad de carcinoma de endometrio[29,30]
Es importante aclarar que actualmente no hay evi- dencia de buena calidad para las recomendaciones
terapéuticas del TCG; sin embargo, el tratamiento con mejor evidencia para TCG es la resección quirúrgica temprana con márgenes negativos.[29]
Un estudio retrospectivo del Centro de Cáncer MD Anderson ha cuestionado la necesidad de realizar linfadenectomía de forma rutinaria como parte del procedimiento de estadificación estándar para los TCG debido al bajo riesgo de metástasis en los ganglios linfáticos, incluso en casos de enfermedad en estadio avanzado.[30]
Los TCG tienen mejor pronóstico que los del epitelio superficial del ovario. Sin embargo, muestran alta tasa de recurrencia. El estadio clínico representa el determinante pronóstico más importante, según la International Federation of Gynecology and Obstetrics (FIGO). En pacientes con estadio más temprano de la enfermedad, estadio I, la supervivencia a 5, 10 y 20 años es de 94, 88 y 62%, respectivamente. Entre 50 y 65% de las pacientes en estadio II y de 17 a 33% en estadios III y IV se estima la supervivencia de 5 años.28,31. El estadio IA se asocia con una tasa de recurrencia del 20% y los estadios II
– IV tienen una tasa de recurrencia del 43–48%. [29]
Agradecimientos
Agradecemos al equipo de Patología del Instituto Oncológico Nacional, en especial a la Dra. Ana Porcell por su disposición para ayudar.
Agradecemos a la paciente por ser muy colaboradora y cordial para la realización del caso.
Referencias
1. Meigs J. Fibroma of the ovary with ascites and hydrothorax—Meigs' syndrome. Am. J. Obstet. Gynecol . 1954;67(5):962-987.
2. Imran H, Haidar F, Akhatar S. Prevalence of Meigs Syndrome [Internet]. 2017 [citado 25 abril 2020]. Disponible en: http://www.pjmhsonline.com/2019/april_june/pdf/ 656.pdf
3. Krenke R, Maskey-Warzechowska M, Korczynski P, Zielinska-Krawczyk M, Klimiuk J, Chazan R et al. Pleural Effusion in Meigs’ Syndrome— Transudate or Exudate?. Medicine. 2015;94(49):e2114.
4. DeFriend, D. Ovaries. Clinical Ultrasound [Internet]. 2011 [Citado 23 febrero 2020]; 677–678. Disponible en: doi:10.1016/b978-0-7020-3131- 1.00035-3
5. Medina-Villaseño E, Quezada-Adame I, Oliver-Parra P, Aboites-Lucero J, Neyra-Ortíz E, Pérez-Castro J et al. Tumor pélvico asociado a incremento del CA125 por neoplasia benigna. Presentación de un caso resuelto por vía laparoscópica. Gaceta Mexicana de Oncología. 2011;10(5):311-318.
6. Kottarathil V, Antony M, Nair I, Pavithran K. Recent Advances in Granulosa Cell Tumor Ovary: A Review. Indian J Surg Oncol . 2012;4(1):37-47.
7. Young R. Ovarian sex cord-stromal tumors and their mimics. Pathology. 2018;50(1):5-15.
8. Anton, C., Carvalho, F., Oliveira, E., Maciel, G., Baracat, E. and Carvalho, J., 2012. A comparison of CA125, HE4, risk ovarian malignancy algorithm (ROMA), and risk malignancy index (RMI) for the classification of ovarian masses. Clinics, 67(5), pp.437-441.
9. Crum C, Lee K, Nucci M, Granter S, Howitt B, Parast M et al. Diagnostic Gynecologic and Obstetric Pathology. 3rd ed. Elsevier; 2017; vol 27, 1021.
10. Park J, Bae J. Postmenopausal Meigs' Syndrome in Elevated CA-125: A Case Report. J Menopausal Med. 2015;21(1):56.
11. Taniguchi Y, Nishikawa H, Maeda N, Terada Y. Breathlessness, pleural effusions, fibromas, and Meigs syndrome: look beyond the chest and don't delay!. The Lancet. 2020;395(10223):e32.
12. Horda M, Margaridad T. Sex cord-stromal tumors of the ovary: a comprehensive review and update for radiologists. Diagn Interv Radiol. 2015;21(4):277–286.
13. Lheureux S, Gourley C, Vergote I, Oza A. Epithelial ovarian cancer. The Lancet. 2019;393(10177):1240-1253.
14. DeCherney A, Roman A, Nathan L, Laufer N. Obstetrics & gynecology. 11th ed. United States of America: McGraw-Hill Education.; 2013.
Yamamoto Y, Miyagawa Y, Ehara T, Koyama M, Nakamura S, Takeuchi D et al. Three Cases of Pseudo-Meigs’ Syndrome Secondary to Ovarian Metastases from Colorectal Cancer. Case Reports in Surgery. 2017;:1-8.
16. Shimazaki J, Tabuchi t, Nishida K, Takemura A, Motohashi G, Kajiyama H et al. Synchronous ovarian metastasis from colorectal cancer: A report of two cases. Oncology Letters. 2016;12(1):257-261.
17. Mohammed SA, Kumar A. Meigs Syndrome. [Actualizado 2020 Jun 28]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan [citado el 23 de julio 2020) Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK559322/# article-24920.s1
18. Lessnau KD. Meigs Syndrome [Internet]. Medscape. 2016 [citado 23 julio 2020]. Disponible en: https://emedicine.medscape.com/article/255450- overview#a5
19. Danilos J, Michał Kwaśniewski W, Mazurek D, Bednarek W, Kotarski J. Meigs' syndrome with elevated CA-125 and HE-4: a case of luteinized fibrothecoma. Prz Menopauzalny. 2015;14(2):152- 154. citado el 23 de julio 2020) Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC44 98034/#CIT0011
20. Saha, S., & Robertson, M. Meigs' and Pseudo- Meigs' syndrome. Australasian journal of ultrasound in medicine [Internet]. 2012 [Citado 23 febrero 2020]; 15(1), 29–31. Disponible en: https://doi.org/10.1002/j.2205- 0140.2012.tb00140.x
21. Frías, Z., Rodelgo del Pino, A., Pantoja, M., Rubio, J., Álvarez, J. Tumor de células de la Granulosa. Neoplasia estromal de los cordones sexuales. Revisión de la literatura, a propósito de dos casos clínicos. Rev. chil. obstet. ginecol. [Internet]. 2017 Nov [citado 22 febrero 2020] ; 82( 5 ): 579-588. Disponible en: https://scielo.conicyt.cl/scielo.php?script=sci_arttex t&pid=S0717-75262017000500579&lng=es. http://dx.doi.org/10.4067/s0717- 75262017000500579.
22. Campos S, Pardo I, Vidal R, Vásquez- Rodríguez M, Alonso-Baquero M. Tumor de células de la granulosa de tipo adulto [Internet]. Elsevier; 2010 [citado 23 febrero 2020]. Disponible en: https://www.elsevier.es/es-revista-clinica-e- investigacion-ginecologia-obstetricia-7-articulo- tumor-celulas-granulosa-tipo-adulto- S0210573X09001476
23. Choi, K., Lee, H. J., Pae, J. C., Oh, S. J., Lim, S. Y., Cho, E. Y., & Lee, S. S. Ovarian granulosa cell tumor presenting as Meigs' syndrome with elevated CA125. Korean J Intern Med [Internet], 2005 [Citado 23 febrero 2020]; 20(1), 105–109. Disponible en: https://doi.org/10.3904/kjim.2005.20.1.105
24. Kortekaas KE, Pelikan HM. Hydrothorax, ascites and an abdominal mass: not always signs of a malignancy - Three cases of Meigs' syndrome. J Radiol Case Rep. 2018;12(1):17-26. 2018 Jan 31.Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC59 65394/
25. Gurumurthy M, Bryant A, Shanbhag S. Effectiveness of different treatment modalities for the management of adult‐onset granulosa cell tumours of the ovary (primary and recurrent). Cochrane Database of Systematic Reviews [Internet], 2014 [Citado 23 febrero 2020]; Issue 4. Art. No.: CD006912. Disponible en: DOI: 10.1002/14651858.CD006912.pub2.
26. Coll Bujardón, D., González F., López S., González, Y. Tumor adulto de células de la granulosa del ovario: presentación de un caso. AMC [Internet]. 2015 Oct [citado 2020 Mayo 17] ; 19(5):489-494. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pi d=S102502552015000500008&lng=es.
27. Gámez-Araujo JJ, Barajas-Figueroa LJ, Kortright-Farías M, de Nova-Chávez H. Tumor de células de la granulosa del adulto: reporte de un caso con manifestación inusual. Ginecol. obstet. Méx. [revista en la Internet]. 2017 Ene [citado 22 febrero de 2020];85(1):38-46. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_artt ext&pid=S0300-90412017000100008&lng=es.
28. Lavazzo, C., Gkegkes, I. D., & Vrachnis, N. Fertility sparing management and pregnancy in patients with granulosa cell tumour of the ovaries. Int. J. Gynecol. Obstet..[Internet]. 2015 [Citado 23 febrero 2020]; Vol 35, 331–335. Disponible en: doi:10.3109/01443615.2014.968107
29. B.-L.L. Seagle, et al., Ovarian granulosa cell tumor: A National Cancer Database study, Gynecol Oncol [Internet]. 2017 [citado 23 febrero 2020]. Disponible en: http:// dx.doi.org/10.1016/j.ygyno.2017.05.020
30. Starks D, Chan D. Granulosa-Theca Cell Tumors Treatment & Management. Medscape [Internet]; 2018 [citado 23 febrero 2020]. Disponible en: https://emedicine.medscape.com/article/254489- treatment#showall
31. Khosla, Divya et al. “Ovarian granulosa cell tumor: clinical features, treatment, outcome, and prognostic factors.”North Am J Med Sci vol. 6,3: p 133-8. 2014. doi:10.4103/1947-2714.128475

