



Casos clínicos
Macroglobulinemia de Waldenström: primer caso con confirmación molecular en Honduras
Waldenström Macroglobulinemia: first case with molecular confirmation in Honduras
Revista Médica Hondureña
Colegio Médico de Honduras, Honduras
ISSN: 0375-1112
ISSN-e: 1995-7068
Periodicidad: Semestral
vol. 89, núm. 2, 2021
Recepción: 26 Marzo 2021
Aprobación: 06 Septiembre 2021
Publicación: 05 Octubre 2021
Autor de correspondencia: cjfajardo92@gmail.com

Forma de citar: Duarte F, Mojica R, Calix ES, Fajardo CJ, Artica A, Alvarado D. Macroglobulinemia de Waldenström: primer caso con confirmación molecular en Honduras. Rev Méd Hondur. 2021; 89(2): 136-140. DOI: https://doi.org/10.5377/rmh.v89i2.12524
Resumen: Antecedentes: La Macroglobulinemia de Waldenström (MW) es un desorden proliferativo en el cual está presente un Linfoma Linfoplasmocitoide (LLP) en la médula ósea y asociado a una gammapatía monoclonal IgM. Con una incidencia global de 3 casos por millón de personas-año, representa aproximadamente el 2% de todas las neoplasias hematológicas. Este es el primer caso documentado de MW en Honduras con confirmación molecular de la mutación MYD88 p.L265P. Descripción del caso: Paciente de 58 años de edad evaluado en 2017 con informe de biopsia que reporta infiltración linfoplasmocitaria en glándula salival del labio inferior, refiriendo 3 meses de epistaxis y gingivorragia, anemia severa, leucopenia, episodios de lipotimia y pérdida de peso. Al examen físico presentó agrandamiento bilateral de glándula parótida y submandibular, múltiples adenopatías cervicales, alteración en glándula tiroides, hepatomegalia leve y esplenomegalia masiva. Se encontraron valores elevados de TSH, microglobulina y LDH; eletroforesis y citometría de flujo de médula ósea sugestiva de desorden de IgM monoclonal. Se logró confirmación molecular mediante la detección de la mutación L265P en el gen MYD88. El paciente recibió esquema de primera línea con Ciclofosfamida, Adriamicina, Vincristina, Prednisona y Rituximab(CHOP-R), luego por recaída recibió mismo esquema por haber mostrado buena respuesta. Posteriormente, tras una nueva recaída recibió tratamiento con Chlorambucil presentando nuevamente recaída. Se diagnosticó con MW refractaria y es candidato para recibir Ibrutinib; no disponible en nuestro medio. Conclusión: La escasa casuística de enfermedad de MW en Honduras dificulta el diagnóstico oportuno y tratamiento óptimo en nuestro medio.
Palabras clave: Gammapatía monoclonal, Linfoma linfoplasmacitoide, Macroglobulinemia de Waldenström, paraproteinemias.
Abstract: Background: Waldenström’s macroglobulinemia (WM) is a proliferative disorder in which a lymphoplasmacytic lymphoma (LPL) is present in the bone marrow and is associated with an IgM monoclonal gammopathy. With an overall incidence of 3 cases per million persons per year, it accounts for approximately 2% of all hematological malignancies. This is the first documented case report of WM in Honduras to receive an MYD88 molecular confirmation. Case description: This case concerns a 58-year-old man evaluated in 2017 who presented with prominent lymphoplasmacytic infiltration of the salivary gland of the lower lip, 3 months of nasal and gum bleeding, severe anemia, leukopenia, episodes of lipothymy, and weight loss. Physical examination revealed bilateral parotid and submandibular enlargement, multiple adenopathies in the neck, thyroid gland alteration, mild hepatomegaly, and massive spleen enlargement. There were high serum levels of TSH, beta 2 microglobulinemia and LDH. Serum electrophoresis and flow cytometry of bone marrow suggested an IgM monoclonal disorder. Molecular confirmation was achieved by detection of the L265P mutation in gene MYD88. The patient received a first chemotherapy regimen of Rituximab, Cyclophosphamide, Adriamycin, Vincristine, Prednisone (R-CHOP) but, due to relapse, a second regimen with CHOP was warranted. After a new relapse patient received Chlorambucil presenting a new relapse. The patient was diagnosed with refractory WM, and is a candidate for receiving ibrutinib, which is not available in Honduras. Conclusion: The scarce casuistry of MW disease in Honduras hinders the timely diagnose and standardized treatment in our medium.
Keywords: Monoclonal gammopathy, Lymphoplasmacytic lymphoma, paraproteinemias, Waldenström’s macroglobulinemia.
INTRODUCCIÓN
La Macroglobulinemia de Waldenström (MW) es una enfermedad proliferativa en la cual está presente un Linfoma Linfoplasmacitoide (LLP) en la médula ósea. Está asociado a la demostración de una gammapatía monoclonal de inmunoglobulina M (IgM) en la sangre circulante.1,2,3 LA MW es responsable del 2% de todas las enfermedades hematológicas malignas, con una incidencia global de aproximadamente 3 casos por cada millón de personas por año.2,4 La enfermedad es indolente, comúnmente afectando a hombres caucásicos (60% de los casos). La mediana de edad del diagnóstico es de 60-70 años y solo un 3% de los casos tienen menos de 40 años de edad.1,5 Este es el primer caso de MW evaluado por los autores y el primer caso en Honduras en contar con una confirmación molecular.
La MW se puede manifestar a través de una variedad de síntomas, los cuales pueden ser clasificados en dos grandes categorías: síntomas secundarios a la afectación neoplásica de un órgano y síntomas relacionados para la paraproteína IgM.2,5 La fatiga, fiebre, debilidad y pérdida de peso son los malestares más frecuentemente referidos por los pacientes, usualmente también hay episodios de sangrado de encías y epistaxis, signos que son consecuencia directa de las citopenias. La hiperviscosidad, secundaria a la gammapatía por IgM, puede manifestarse de forma sutil como cefaleas leves o alteraciones visuales o de forma severa como convulsiones y coma.4 Independientemente de la categoría, la sintomatología más común es: anemia, linfadenopatia, esplenomegalia, neuropatía, hiperviscosidad y crioglobulinemia.1
El LLP involucra a la médula ósea, nódulos linfáticos y otros sitios extramedulares. La proliferación neoplásica puede ser difusa, nodular o intersticial con una mezclada población de linfocitos pequeños, linfocitos plasmacitoides y un número variable de células plasmáticas. También se observan frecuencias elevadas de mastocitos. Pseudo inclusiones intranucleares, conocidas como Dutcher bodies, se pueden revelar mediante la tinción de PAS.6 Estudios de inmunohistoquímica revelan además la expresión de antígenos asociados a células B: CD19, CD20, CD22, CD79, CD38. CD10, CD23, CD5 están ausentes generalmente.2
La mutación MYD88 p.L265P es una mutación somática comúnmente encontrada en la MW, apareciendo en 90% de los pacientes con esta enfermedad y se ha mostrado que está fuertemente involucrada en génesis tumoral de MW y en el diagnóstico diferencial de enfermedades de células B tipo LLP no IgM.3,4,5,7 En este caso particular, la confirmación molecular de la mutación MYD88 p.L265P se realizó en el extranjero ya que no hay laboratorios capacitados en la región.
La MW es una enfermedad incurable, por lo que el tratamiento es dirigido a prevenir o paliar cualquier secuela clínica de la enfermedad, aunque los pacientes asintomáticos pueden ser observados sin un tratamiento específico.4 En el Centro de Cáncer Emma Romero de Callejas (CCERC) se utilizó un esquema de Ciclofosfamida, Adriamicina, Vincristina, Prednisona y Rituximab (CHOP-R) como primera línea de tratamiento, presentando varios episodios de neutropenia febril, infecciones respiratorias superiores e infecciones fúngicas en cavidad oral y esófago. Posteriormente se propuso aplicar esquema de Bendamustine + Rituximab pero debido a cuestiones financieras no se pudo aplicar, por lo que se optó por aplicar Ciclofosfamida, Adriamicina, Vincristina y Prednisona (CHOP) mostrando buenos resultados hasta que se evidenció una nueva progresión de la enfermedad, momento en el que recibió chlorambucil. El paciente continúa en seguimiento, con una supervivencia mayor de 3 años desde el diagnóstico. El paciente es candidato para recibir Ibrutinib, un inhibidor de la Tirosina Kinasa de Bruton (BTK), el cual es un agente novedoso aprobado para el tratamiento de MW refractaria y que en últimas recomendaciones de Tenth International Workshops for Waldenström Macroglobulinemia (IWWM) se postula como tratamiento de primera línea para pacientes sintomáticos. Otros fármacos como los inhibidores de proteasoma (bortezomib, carfilzomib, ixazomib) también se han postulado como tratamiento de primera línea.4,8,9
DESCRIPCIÓN DEL CASO
Hombre de 58 años, contador público y Testigo de Jehová, que se presentó en septiembre de 2017 con historia de epistaxis y gingivorragia de 3 meses de evolución, lipotimia, pérdida de peso, alteraciones en los tiempos de coagulación (tiempo de trombina fue de 20.5 s [control de 10-14 s], INR de 1.82, tiempo de tromboplastina parcial fue de 64.5 s [control de 26.1-36.3 s]), anemia macrocítica normocrómica (hemoglobina 7 g/dL), leucopenia a expensas de neutropenia (2,270 leucocitos x µL y 1,430 neutrófilos por µL), plaquetas de 160,000. Refirió también sangrado persistente posterior a una toma de biopsia operatoria por una lesión en ala nasal sospechosa para carcinoma baso celular, la cual fue confirmada y que mostró bordes libres sin infiltración linfovascular o neural. Además, presentó hipotiroidismo manejado con levotiroxina diaria. El paciente experimentó episodios ocasionales de lipotimia y pérdida de peso. Presentó un informe de biopsia de octubre de 2016 que reportaba un infiltrado linfoplasmocitario prominente de glándula salival de mucosa de labio inferior de acuerdo con el Síndrome de Sjögren, por lo que médico reumatólogo decidió en su momento iniciar tratamiento con Metotrexato, Plaquinol e Imuran. El examen físico reveló agrandamiento bilateral de glándula parótida y submandibular, múltiples adenopatías en el cuello, hepatomegalia leve y agrandamiento masivo del bazo.
Niveles elevados de TSH (11 I/mL), beta 2 microglobulinemia (6355 ng/ml) y LDH (529 U/L) fueron encontrados en los estudios iniciales. Un ultrasonido de cuello mostró una alteración generalizada de la ecogenicidad de la glándula tiroidea debido a múltiples imágenes hipoecoicas y vascularidad ligeramente elevada, comprometiendo todo el cuerpo. Las glándulas submaxilares estaban agrandadas, heterogéneas con múltiples formas redondas hipoecoicas de diferentes tamaños; también se encontraron linfadenopatías bilaterales. Otros estudios de laboratorio realizados fueron: electroforesis y citometría de flujo de médula ósea, todos sugestivos de un desorden monoclonal IgM. La electroforesis de proteína mostró una banda anormalmente alta, estrecha de beta + paraproteina (4.6 g/dL), mientras que otras clases de inmunoglobulinas séricas se mantuvieron en rangos normales (Figura 1). La citometría de flujo de la médula ósea reveló un desorden linfoproliferativo crónico que fue escasamente representado por células B maduras CD20 positivas con diferenciación plasmocítica y el perfil inmunofenotípico fue consistente con un LLP.
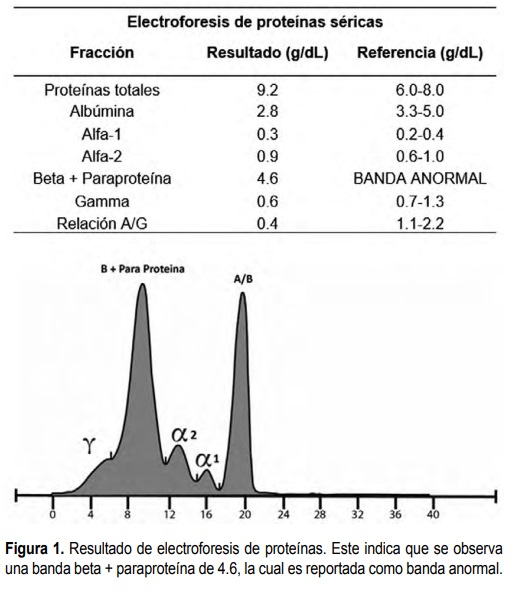
Resultado de electroforesis de proteínas. Este indica que se observa una banda beta + paraproteína de 4.6, la cual es reportada como banda anormal.
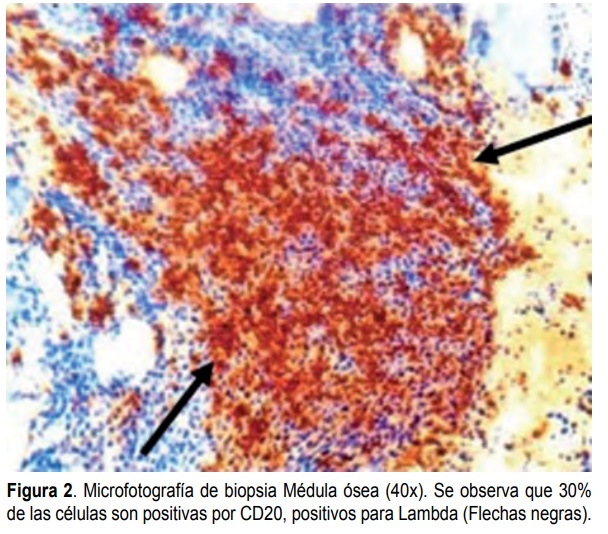
Microfotografía de biopsia Médula ósea (40x). Se observa que 30% de las células son positivas por CD20, positivos para Lambda (Flechas negras)
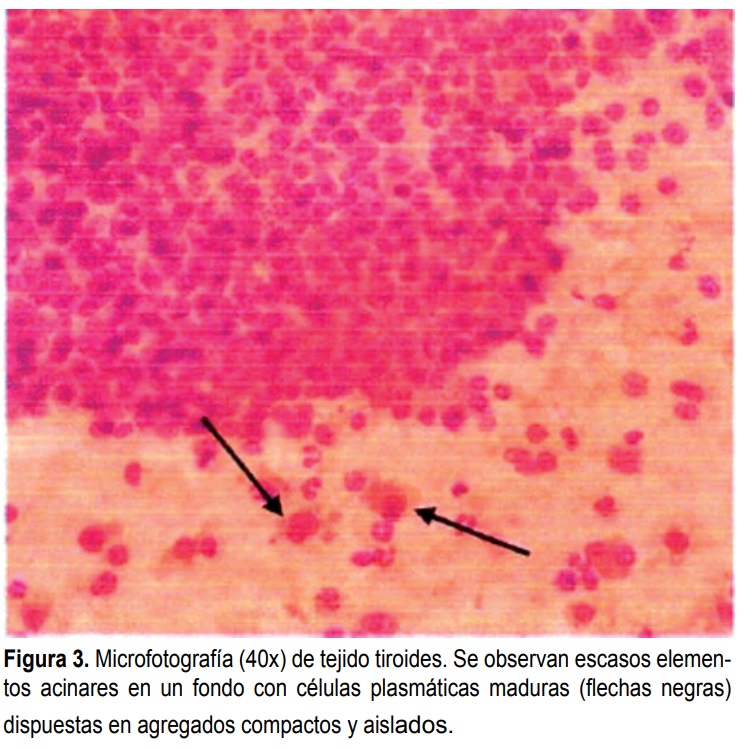
Microfotografía (40x) de tejido tiroides. Se observan escasos elementos acinares en un fondo con células plasmáticas maduras (flechas negras) dispuestas en agregados compactos y aislados.
Una biopsia de una adenopatía supraclavicular también reveló LLP. Biopsia de médula ósea y frotis confirmaron una neoplasia de células linfoplasmocíticas, cuyas células ocupaban 40% de la población celular con un 30% de positividad para CD20 y positivas para Lambda (Figura 2). Citología de aspirado por aguja de un nódulo tiroideo reveló células plasmáticas bien diferenciadas con marcador CD-138 positivo en un 40% (Figura 3). Las células fueron negativas para lambda y los agregados afectando la médula fueron positivos para antígeno leucocitario común. La confirmación molecular fue realizada en noviembre de 2018 en el Laboratorio CIDEGEN en Salamanca, España, basándose en la detección de la mutación L265P en el gen MYD88.
El manejo de soporte del paciente fue particularmente complejo debido a que, por sus creencias religiosas, no aceptó transfusiones sanguíneas de glóbulos rojos u otros derivados, por lo que se recurrió a aplicación de eritropoyetina y con octaplex (factores de coagulación) principalmente. El paciente recibió esquema de quimioterapia inicial de 7 ciclos de R-CHOP entre noviembre del 2017 y marzo del 2018. En julio 2019, presentó una recaída, la cual fue confirmada mediante biopsia de glándula submandibular. Se indicó un esquema de segunda línea con Bendamustine + Rituximab pero el paciente no pudo pagarlo, por lo que se indicó CHOP. Rituximab no fue incluido en este esquema debido a que biopsia de médula ósea y citometría de flujo control reportó CD-20 negativo. El último ciclo fue administrado en febrero 2019. Posterior a este tratamiento, una nueva biopsia de médula ósea reportó un proceso granulomatoso no necrotizante. Tinciones específicas para microorganismos resultaron negativas.
Los únicos síntomas presentados en ese momento fueron anorexia, pérdida de peso y un sabor amargo de la boca. El paciente comenzó a tomar Chlorambucil 2 mg diarios por 28 días, completando 5 ciclos. Sufrió una recaída clínica con sangrados, hipercalcemia, fatiga, pérdida de peso, inflamación bilateral de parótida y linfadenopatías dolorosas. Una nueva elevación monoclonal se confirmó por electroforesis de proteínas. Se estableció diagnóstico de MW refractaria, por lo que el paciente es candidato para recibir tratamiento con Ibrutinib,10 el cual ha sido aprobado en los EEUU y la Unión Europea para el tratamiento de MW en 2015.
Actualmente el paciente tiene más 3 años en seguimiento, durante los cuales ha sufrido varios episodios de neutropenia febril, con disminución de glóbulos blancos de hasta 650 leucocitos/µL, anemia normocítica normocrómica (valor medio de hemoglobina de 10.6 g/dL, rango 8.5-13 g/dL), infecciones respiratorias superiores, infecciones fúngicas orales y esofágicas tratados con Levofloxacina, Fluconazol, Nistatina y Filgrastim como parte de los efectos secundarios de los tratamientos aplicados y de las múltiples recaídas. El paciente continúa recibiendo tratamiento sintomático y controles cada 3 meses en el Centro de Cáncer Emma Romero de Callejas.
DISCUSIÓN
Este es el primer caso visto por los autores de una MW y el primer caso descrito en Honduras que contenga una confirmación molecular. La escasa cobertura de servicios médicos y de acceso a evaluaciones especializadas en Honduras podría significar que otros casos de MW no son detectados. La MW es dos veces más frecuente en pacientes masculinos que en pacientes femeninos y es típicamente diagnosticada entre los 60 y 70 años de edad, mayormente en personas caucásicas. El paciente descrito es de raza mestiza y su edad de diagnóstico está ligeramente por debajo del límite inferior del rango de edad más frecuente descrito en la literatura.11 Aún no se cuenta con caracterizaciones epidemiológicas de pacientes con MW en países latinoamericanos debido a que la mayor parte de la información proviene de reportes de casos o series de casos; la escasa cantidad de casos dificulta la generalización de la información y su posterior comparación con bases de datos realizadas en países desarrollados.12,13
La presentación clínica es consistente con lo que describe la literatura, donde hay infiltración neoplásica de órganos y compromiso de la serie blanca y roja.2,4,5 A pesar que los niveles de IgM no fueron medidos debido a la falta de acceso a laboratorios certificados, las electroforesis de proteínas revelaron una banda beta + paraproteína estrecha y anormalmente alta. Los episodios de lipotimia pueden deberse al síndrome de hiperviscosidad. La confirmación molecular de la mutación L265P del MYD88 es la fortaleza de este caso en particular ya que esta mutación está presente en el 90% de los pacientes con WM.7
La baja incidencia de esta enfermedad ha provocado que el tratamiento de la MW sea basado principalmente en estudios observacionales, opinión de experto, experiencias a largo plazo y menos frecuentemente en ensayos clínicos aleatorizados. Esta falta de ensayos comparativos de los diferentes regímenes de tratamiento dificulta establecer recomendaciones de calidad basada en evidencia tipo A, por tanto, enlenteciendo la estandarización de los tratamientos.14
Desde el Tercer Taller Internacional de MW (Third International Workshop on Waldenström Macroglobulinemia) se han propuesto combinaciones de terapias con análogos de nucleósidos o agentes alquilantes, Rituximab en combinación con análogos de nucleósidos, análogos de nucleósidos más agentes alquilantes o quimioterapia con múltiples fármacos tales como el CHOP.15,16 El Rituximab es un agente activo y no mielosupresor que actúa contra células B CD-20 positivas, que se ha utilizado en combinación con otros agentes quimioterápicos se ha convertido en un tratamiento de elección para pacientes con MW.17
En nuestro caso, un esquema de CHOP-R fue utilizado como primera línea de tratamiento y para la recaída en glándula mandibular se indicó Bendamustina-rituximab, como segunda línea de tratamiento. Desafortunadamente el paciente no pudo costear el tratamiento, por lo que se repitió el esquema CHOP (no se indicó Rituximab porque la nueva biopsia no mostró células CD-20 positivas). Posteriormente, por persistencia de síntomas recibió Chlorambucil, pero por nueva recaída de síntomas se suspendió este tratamiento. Paciente fue diagnosticado como una MW refractaria y es candidato para recibir Ibrutinib. Este último es un inhibidor de la vía del receptor de célula B que ha sido aprobado, mediante ensayos clínicos de fase II-III, para el tratamiento de la MW refractaria y que es considerada como una opción de primera línea de tratamiento.10,17 Desafortunadamente, este medicamento no está disponible en Honduras y su costo es excesivamente alto. El paciente continúa en observación y con manejo sintomático hasta el día de hoy. El CCERC está haciendo esfuerzos considerables para acceder a programas compasivos que permitan al paciente recibir el tratamiento indicado. La baja casuística de esta enfermedad en nuestro medio limita el diagnóstico oportuno y el tratamiento óptimo para estos pacientes.
Agradecimientos
Se agradece a todo el personal técnico y de enfermería del CCERC por los servicios prestados durante el diagnóstico y seguimiento del caso.
REFERENCIAS
1. Ashraf M, Rastogi P. Waldenström Macroglobulinemia: Unusual presentation with cast Nephropathy/Light Chain Tubulopathy. Clin Med Insights Case Rep [Internet]. 2019 [citado 17 enero 2021]; 12:1-4. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6378479/
2. Vijay A, Gertz MA. Waldenstrom macroglobulinemia: Blood. [Internet] 2007 [citado 18 enero 2021];109(12):5096–5103. Disponible en: https://pubmed.ncbi.nlm.nih.gov/17303694/
3. McMaster ML, Berndt SI, Zhang J, Slager SL, Li SA, Vajdic CM, et al. Two high-risk susceptibility loci at 6p25.3 and 14q32.13 for Waldenström macroglobulinemia. Nat Commun [Internet]. 2018 [citado 22 enero 2021];9(1):4182. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6180091/
4. Kasi PM, Ansell SM, Gertz MA. Waldenstrom Macroglobulemia. Clin Adv Hematol Oncol [Internet]. 2015[citado 26 enero 2021];13(1):56–66. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25679974/
5. Yun S, Johnson AC, Okolo ON, Arnold SJ, McBride A, Zhang L, et al. Waldenström macroglobulinemia: review of pathogenesis and management. Clin lymphoma Myeloma Leuk [Internet]. 2017[citado 26 enero 2021]:17(5):252–62. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28366781/
6. Eyre TA, Littlewood TJ, Bain BJ. Dutcher bodies: cytoplasmic inclusions within the nucleus Br J Haematol [Internet]. 2014 [citado 2 febrero 2021];166(6):946–947. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24749887/
7. Treon SP, Xu L, Yang G, Zhou Y, Liu X, Cao Y, et al. MYD88 L265P somatic mutation in Waldenström’s macroglobulinemia. N Engl J Med [Internet]. 2012[citado 2 febrero 2021];367(9):826–33. Disponible: https://pubmed.ncbi.nlm.nih.gov/22931316/
8. Castillo J, Advani RH, Branagan AR, Buske C, Dimopoulos MA, D’Sa S, et al. Consensus treatment recommendations from the tenth International Workshop for Waldenström Macroglobulinaemia. Lancet Haematol [Internet], 2020[citado 22 Marzo 2021];7(11),e827–e837. Disponible en: https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(20)30224-6/fulltext?rss=yes#articleInformation
9. Laribi K, Poulain S, Willems L, Merabet F, Le Calloch R, Eveillard JR et al. Bendamustine plus rituximab in newly diagnosed Waldenström macroglobulinaemia patients. A study on behalf of the French Innovative Leukaemia Organization (FILO) Br J Haematol [Internet]. 2019 [citado 4 febrero 2021];186(1):146-149. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30548257/
10. Kapoor P, Ansell SM, Fonseca R, Chanan-Khan A, Kyle RA, Kumar SK, et al. Diagnosis and Management of Waldenström Macroglobulinemia: mayo stratification of macroglobulinemia and risk-adapted therapy (msmart) guidelines 2016. JAMA Oncol [Internet]. 2017[citado 19 mar 2021];3(9):1257–65. Disponible en: https://pubmed.ncbi.nlm.nih.gov/28056114/
11. Ansell SM, Kyle RA, Reeder CB, Fonseca R, Mikhael JR, Morice WG, et al. Diagnosis and management of Waldenström Macroglobulinemia: Mayo Stratification of Macroglobulinemia and risk-adapted therapy (mSMART) guidelines. Mayo Clin Proc [Internet]. 2010 [citado 13 mar 2021];85(9):824–833. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2931618/
12. Romaní F, Cuadra J, Atencia F, Canelo C. Macroglobulinemia de Waldenstron: comunicación de un caso. An Fac Med. [Internet]. 2008 [citado 13 mar 2021];69(2):112–6. Disponible en: http://www.scielo.org.pe/pdf/afm/v69n2/a09v69n2.pdf
13. Pophali PA, Bartley A, Kapoor P, Gonsalves WI, Ashrani AA, Marshall AL, et al. Prevalence and survival of smouldering Waldenström macroglobulinaemia in the United States. Br J Haematol [Internet]. 2019[citado 26 febrero 2021];184(6):1014–7. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29532912/
14. Gertz MA. Waldenström macroglobulinemia treatment algorithm 2018. Blood Cancer J[Internet]. 2018 [citado 01 marzo 2021];8(4):40. Disponible en: https://www.nature.com/articles/s41408-018-0076-5#
15. Treon SP, Gertz MA, Dimopoulos M, Anagnostopoulos A, Blade J, Branagan AR, et al. Update on treatment recommendations from the Third International Workshop on Waldenstrom’s Macroglobulinemia. Blood [Internet]. 2006 [citado 12 febrero 2021];107(9):3442–6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/16410453/
16. Buske C, Sadullah S, Kastritis E, Tedeschi A, García-Sanz R, Bolkun L, et al. Treatment and outcome patterns in European patients with Waldenström Macroglobulinemia: a large, observational, retrospective chart review. Lancet Haematol [Internet]. 2018 [citado 04 febrero 2021];5(7):e299-e309. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29958569/
17. Leblond V, Kastritis E, Advani R, Ansell SM, Buske C, Castillo JJ, et al. Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia. Blood [Internet]. 2016 [citado 08 marzo 2021];128(10):1321–8. Disponible en: https://pubmed.ncbi.nlm.nih.gov/27432877/7.
Notas
Notas de autor
cjfajardo92@gmail.com
Información adicional
Forma de citar: Duarte F, Mojica R,
Calix ES, Fajardo CJ, Artica A, Alvarado D. Macroglobulinemia
de Waldenström: primer caso con confirmación
molecular en Honduras.
Rev Méd Hondur. 2021; 89(2): 136-140.
DOI: https://doi.org/10.5377/rmh.v89i2.12524
RELACIONES Y ACTIVIDADES FINANCIERAS
Y NO FINANCIERAS: Ninguno
DECLARACIÓN DE CONFLICTOS DE INTERÉS: Ninguno
Enlace alternativo
https://www.camjol.info/index.php/RMH/article/view/12524 (html)
http://www.bvs.hn/RMH/pdf/2021/pdf/Vol89-2-2021-10.pdf (pdf)
https://revistamedicahondurena.hn/assets/Uploads/Vol89-2-2021-10.pdf (pdf)

