Introducción
El uso de la
alfalfa para la confección de reservas forrajeras juega un rol importante en
los planteos de producción bovina de carne y leche, permitiendo no sólo
estabilizar la oferta forrajera, sino también ajustar las dietas en cuanto a su
contenido de fibra efectiva y proteína. Aunque la forma de reserva más común de
la alfalfa es el heno, los análisis de composición química muestran
deficiencias en calidad nutricional: 16 % de proteína bruta (PB), con mínimo de
13 y máximo de 24 %, 56 % de fibra detergente neutro (FDN), 44 % de fibra
detergente ácido (FDA) y 58 % de digestibilidad de la materia seca (DMS), en
parte explicadas por el uso de maquinaria de corte inapropiada, un inadecuado
manejo de los lotes y el almacenamiento de los rollos a la intemperie(1).
Una alternativa de conservación y almacenamiento que puede mejorar el valor
nutricional de las reservas de alfalfa mediante la confección de ensilajes. Sin
embargo, este cultivo tiene una baja concentración de azúcares y un alto
contenido de proteína que limitan una rápida fermentación y acidificación del
material ensilado. La baja concentración de azúcares condiciona el crecimiento
bacteriano, mientras que el elevado contenido proteico cumple la función de buffer(2).
Durante la
fermentación del forraje, la tasa y magnitud de disminución del pH determina el
grado de pérdida de nutrientes del ensilaje. Esta pérdida de calidad es debida
a la acción de enzimas de la planta y de microbios anaerobios. El uso de
aditivos biológicos y químicos puede promover patrones de fermentación
adecuados, especialmente cuando existen condiciones subóptimas,
como puede ser el caso del ensilado de alfalfa. Dentro de los aditivos
biológicos, se encuentran los inoculantes microbianos y las enzimas(3).
Entre los inoculantes microbianos usados más frecuentemente están los que
contienen bacterias ácido lácticas (BAL) homofermentativas
(Ho). Actualmente, la mayoría de las bacterias de este grupo se clasifican
taxonómicamente como heterofermentativas facultativas
(HeF) en lugar de Ho obligadas(4).
Ambos grupos fermentan las hexosas y producen ácido láctico (AL) pero, además,
las BAL HeF poseen la enzima fosfocetolasa
que les permite fermentar pentosas hasta AL y ácido acético (C2). Otro grupo lo
constituyen las heterofermentativas obligadas (por
ejemplo, Lactobacillus buchneri) que
producen otros compuestos, además de AL(5).
La inoculación de ensilajes con BALHo y BALHeF ha demostrado ser efectiva para mejorar los parámetros
de fermentación a través del incremento de AL y de la reducción del pH, de la concentración
de ácido butírico (C4) y de nitrógeno amoniacal
(N-NH3). Por otro lado, también se verificó una inhibición del
crecimiento de microbios epífitos deletéreos, como clostridios y hongos.
Algunas de estas especies de BAL son L. plantarum, L. faecium, Enterococcus faecium y varias especies del género Pediococcus(6).
Otro factor que dificulta
una adecuada fermentación láctica en el cultivo de alfalfa es el alto contenido
de agua en el momento óptimo de calidad nutricional del forraje. En general, el
contenido de materia seca (MS) en la planta de alfalfa se encuentra entre 18,3 ±
6,2 % y 22,4 ± 6,5 % ara alfalfas en pre-floración y mediados de floración, respectivamente(7). Si el forraje es
ensilado con un alto contenido de humedad, el establecimiento de las BAL se ve
alterado y la disminución del pH no es suficiente como para inhibir el
crecimiento de clostridios, los cuales se multiplican y fermentan el AL a
butírico y a los aminoácidos a amonio, resultando en incrementos del pH y
pérdidas de MS(3,8). Una herramienta para reducir el contenido de
humedad del cultivo a ensilar, favorecer la fermentación y disminuir las
pérdidas de MS es realizar el marchitado u oreo previo al picado(2,9).
Sin embargo, un marchitado de mayor magnitud predispone a una fermentación más
lenta y con menores valores finales de AL, debido a que el crecimiento
bacteriano se reduce cuando la concentración de agua es baja(10).
Los ensilajes confeccionados con forrajes marchitados suelen presentar un mayor
pH o una disminución más lenta de este, un mayor nivel de carbohidratos
solubles en agua (CSA), y un menor contenido de AL, C2 y N-NH3(10,9).
Por otro lado,
se han observado interacciones entre el uso de marchitado y la aplicación de
inoculantes microbianos sobre algunos parámetros de fermentación y la
degradabilidad de la MS(9), lo
cual amerita una mayor investigación.
El objetivo del
presente trabajo fue evaluar los efectos del estado fenológico, de la
aplicación de un inoculante microbiano a base de L plantarum y del marchitado sobre la
composición química, la concentración de ácidos orgánicos y la degradabilidad ruminal de la MS
en ensilaje de alfalfa.
Materiales y métodos
Se trabajó con
la variedad de alfalfa Don Gaspar 15-601 (Brandemann
y Cía. S.C.), grupo 6, implantada en un campo ganadero a 35 km al suroeste de
General Pico, La Pampa. El forraje fue cortado mediante motoguadaña,
en diciembre de 2015, en dos estados fenológicos: 10 % (F10) y 50 % (F50) de
floración. El material correspondiente a cada estado fenológico fue dividido en
dos fracciones: con marchitado (CM) y sin marchitado (SM). La fracción SM fue
picada inmediatamente posterior al corte con una minipicadora
de forraje para la confección de los microsilos. En
la fracción CM, el marchitado se llevó a cabo en el mismo lugar de corte, sobre
el suelo y en condiciones naturales. El contenido de MS del forraje CM fue
monitoreado cada una hora por la metodología de microondas, según Petruzzi et al.(11),
hasta alcanzar el valor deseado de 45 %. Una vez alcanzado este porcentaje de
MS, el material fue procesado de igual manera que SM. Para la confección de los
microsilos se procedió de la siguiente manera: de
cada porción del material de F10-SM, F10-CM, F50-SM y F50-CM, se tomaron 12
fracciones de 2,4 kg de peso húmedo, 6 de las cuales fueron asperjadas con 30
ml de una solución de inoculante biológico (con inoculante, CI) y 6 con el
mismo volumen de agua destilada (sin inoculante, SI). El inoculante estuvo
compuesto por cultivos de L. plantarum (5×109 células viables/g) y para
la dosificación se siguieron las indicaciones del fabricante (100 g de
inoculante cada 50 toneladas de peso húmedo de forraje). Cada una de las
porciones de 2,4 kg de forraje fue ensilada en microsilos
de PVC, de 11 cm de diámetro y 50 cm de largo (48 microsilos
en total), equivalente a una densidad de 610 kg/m3.
De esta manera
quedaron definidos 8 tratamientos por la combinación de 3 factores (F: estado
fenológico; M: marchitado; I: inoculante), con 2 niveles cada uno (F: F10 y
F50; M: CM y SM; I: CI y SI), en un diseño completamente aleatorizado con
arreglo factorial 2×2×2, con 6 repeticiones.
Los
microsilos fueron llevados al Laboratorio de
Nutrición Animal de la Facultad de Ciencias Veterinarias (UNLPam) y conservados
a temperatura ambiente hasta su apertura después del día 90 de su confección,
para la realización de los distintos análisis. Inmediatamente luego de la
apertura, se tomaron dos muestras de 25 g, una para la medición del pH con un pHmetro digital, y la otra, para la determinación de ácidos
orgánicos. Para la medición de los ácidos orgánicos se procedió a la obtención
de un extracto de la siguiente manera: la muestra de 25 g se colocó en un recipiente
de vidrio y se adicionaron 250 ml de agua destilada, se tapó herméticamente y
se mantuvo refrigerada a 8 °C. Pasadas 24 h, el contenido fue filtrado. De este
filtrado se tomaron 8 ml, se adicionaron 2 ml de HCl 0,2 N y se refrigeró por 24 h más. Por último,
se procedió a la centrifugación a 10.000 rpm y 10 °C y se obtuvo 1 ml del
sobrenadante, que fue congelado hasta la determinación de los ácidos orgánicos en
el Laboratorio de Nutrición Animal, Facultad de Agronomía, Universidad de
Buenos Aires. La purificación de las muestras se realizó con ácido
meta-fosfórico (25 % en ácido sulfúrico 0,5 M) a razón de 0,5 ml por cada 2 ml
de muestra y luego fueron centrifugadas por 10 minutos a 10.000 rpm. La
determinación de AGVs y AL se realizó por
cromatografía gaseosa con un equipo Konik-3000 y una columna BP-20 (marca SGE)
con N2 como vehículo y según protocolo recomendado por el fabricante
de la columna(12).
La temperatura del inyector y del detector de ionización de llama fue mantenida
a 250 ºC.
Para
la determinación de la concentración de N-NH3 se tomó una muestra de
10 g de ensilaje y se homogeneizó en 600 ml de agua destilada durante 2 minutos,
en licuadora a potencia máxima. El homogeneizado fue filtrado y el líquido
resultante centrifugado a 10.000 g durante 10 minutos a una temperatura de 4
°C. Sobre el líquido sobrenadante se determinó la concentración de N-NH3
por medio de la lectura en un espectrofotómetro, según la técnica de Weatherburn(13).
Por
último, una porción representativa de cada microsilo
fue congelada a – 20 °C, hasta la realización de los análisis de MS, PB, FDN,
FDA y degradabilidad ruminal
de la MS (DRMS). Con una submuestra de 200 g se
determinó MS con estufa de flujo continuo a 105 ºC. Otra submuestra
de 200 g fue secada a 60 °C y molida en un molino tipo Resch,
provisto con una malla de 2 mm de diámetro, la cual fue utilizada para los
análisis de PB(14), FDN y FDA(15)
y DRMS.
Para
la determinación de la DRMS se pesaron 3,6 g de MS de cada muestra y se
colocaron en bolsas de poliamida de 10 × 20 cm con una porosidad de 50 µm (Ankom®). Cada bolsa fue cerrada mediante un precinto
plástico para evitar la pérdida de material, quedando una superficie efectiva
de 360 cm2 (10 × 18 × 2) y una relación de 10 mg/cm2
entre cantidad de muestra y superficie de la bolsa, de acuerdo a Vanzant et al.(16).
Las 48 bolsas correspondientes a cada repetición de cada tratamiento, más 2
blancos, se colocaron dentro de una bolsa rejilla, junto con una cadena de 1 kg
de peso, para permitir su contacto con el saco ruminal
ventral, y una cuerda de nylon de 60 cm de longitud para fijarla a la cánula,
permitiendo su libre movimiento dentro del rumen(17).
La bolsa rejilla fue introducida en el rumen de una hembra bovina Hereford, canulada y alimentada
con heno de alfalfa. Las bolsas fueron retiradas a las 30 h pos incubación e
inmediatamente lavadas bajo el flujo de agua, por aproximadamente 90 segundos,
hasta que el agua salió límpida, para frenar la acción microbiana y eliminar
restos de contenido ruminal(18). Luego, se llevaron a estufa a 60
°C hasta peso constante para determinar la cantidad de MS no degradada y
calcular la DRMS.
Para
el análisis estadístico se realizó un ANOVA con un modelo que consideró los efectos
fijos de los 3 factores (F, M, I) y sus interacciones (F×M, F×I, M×I, F×M×I).
Cuando la interacción triple resultó significativa (p<
0,05), la variable en cuestión fue analizada en dos modelos independientes
separados por el factor “F” que consideró los efectos M, I y M×I. La estimación
y comparación de las medias de los tratamientos se hizo por el método LSMEANS (least squares means: Medias de mínimos cuadrados) del procedimiento
“PROC GLM” del paquete estadístico SAS 9.1(19).
Los efectos de tratamiento y las interacciones fueron declarados significativos
cuando p resultó menor a 0,05.
Resultados
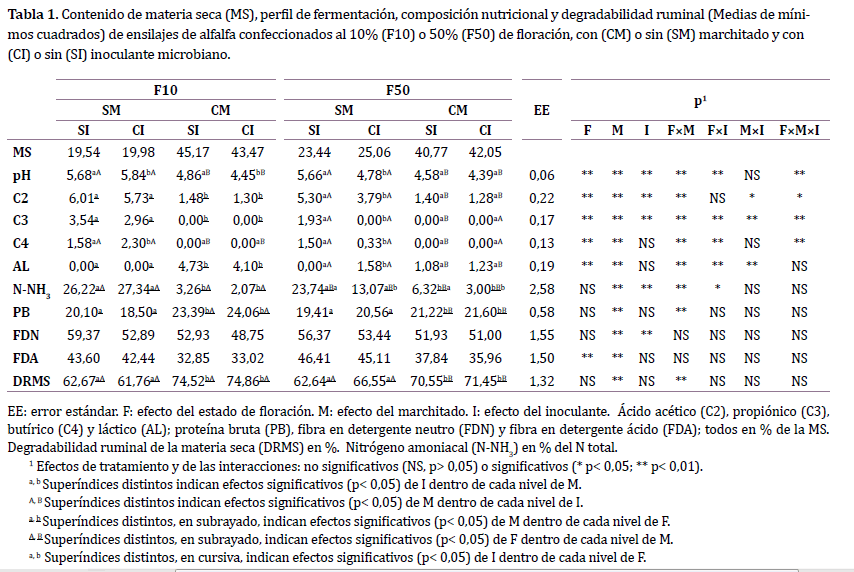
En ambos estados
de floración (Tabla 1), el marchitado disminuyó consistentemente el pH de los
ensilajes, ya sea en SI (-0,82 y -1,08 unidades de pH en F10 y F50,
respectivamente) como en CI (-1,39 y -0,39 unidades de pH en F10 y F50,
respectivamente). En F10, la aplicación de inoculante disminuyó el pH de los
ensilajes CM (-0,41 unidades), pero lo aumentó en SM (+0,16 unidades). Por el
contrario, en F50, el inoculante disminuyó el pH de los ensilajes SM (-0,88
unidades), pero no tuvo efecto en CM.
En F10, los
ensilajes CM tuvieron menor concentración de C2, ácido propiónico
(C3) y C4, y mayor de AL (para C4, M×I p< 0,05). En F50, en cambio, los
tratamientos CM resultaron con menor concentración de C3 y C4 y mayor de AL solamente
cuando no se aplicó el inoculante. La excepción fue para C2, donde el
marchitado disminuyó su concentración tanto en CI como en SI.
El único efecto
detectado del inoculante sobre la concentración de ácidos orgánicos fue en la
combinación de F50-SM, donde su aplicación resultó en menor contenido de C2, C3
y C4, y mayor de AL.
Al aplicar el
marchitado, las concentraciones de N-NH3 se redujeron 90 y 75 % para
F10 y F50, respectivamente. Por otro lado, el efecto del inoculante sobre esta
variable dependió del estado de floración. En F50, los tratamientos CI
presentaron menor concentración de N-NH3 que los SI (- 46 %),
mientras que en F10 no hubo diferencias.
Los ensilajes CM
presentaron mayores contenidos de PB que los SM. Estas diferencias fueron de 23
% en F10 (23,73 vs. 19,30 %) y 7 % en F50 (21,41 vs. 19,99 %). Por otro lado, solo
cuando se aplicó marchitado el contenido de PB difirió entre los estados
fenológicos, siendo mayor en F10 (23,73 vs. 21,41 %). Finalmente, no se halló
efecto del inoculante sobre el porcentaje de PB.
Comparado con
SM, los tratamientos CM presentaron un menor contenido de FDN (51,15 vs. 55,52
%) y FDA (34,92 vs. 44,39 %). De manera similar, los ensilajes CI tuvieron menor
FDN respecto a SI (51,52 vs. 55,15 %). Sin embargo, no hubo efecto del
inoculante sobre el contenido de FDA (CI: 39,13 %, SI: 40,18 %).
La DRMS de los ensilajes CM fue superior a la de lo ensilajes SM. Los incrementos fueron del 20 % en F10 (74,69 vs. 66,22 %) y 9,9 % en F50 (64,60 vs. 71,0 %). Por otro lado, solo cuando se aplicó marchitado hubo diferencias entre estados fenológicos, donde F10 tuvo una DRMS un 5,2 % mayor que F50. No se encontró efecto del inoculante sobre esta variable.
Discusión
a) Fermentación:
pH y ácidos orgánicos
El pH más
adecuado para la conservación de los ensilajes de leguminosas depende del
contenido de MS. Kung et al.(20) recomiendan
valores de 4,3 a 4,7 para ensilajes con menos de 30-35 % de MS y un pH de 4,7 a
5 para ensilajes con 45 a 55 % de MS. Si se toma un pH de 5 como punto de
corte, ninguna de las cuatro combinaciones que incluyeron el marchitado,
superaron ese valor y fluctuaron entre 4,39 y 4,86, lo que sería adecuado para
una correcta estabilidad del ensilaje con los tenores de MS alcanzados (40 a 45
%). Sin embargo, dentro de las cuatro combinaciones SM, la única en alcanzar un
pH relativamente más bajo (4,78) fue F50-CI.
El efecto
marchitado sobre la reducción del pH fue biológicamente importante (alrededor
de un punto de pH), al principio de floración y en floración media, lo que
avala la práctica de realizar un marchitado previo en ensilaje de alfalfa si no
se utiliza ningún tipo de aditivo(21).
La caída del pH por efecto del marchitado puede hallarse, incluso, en alfalfa
con 100 % de floración(22).
Los inoculantes
con BALHo (y BALHeF) promueven
una rápida caída del pH y un menor nivel de pH final en los ensilajes debido a
una mayor producción de AL(3,5).
Sin embargo, la magnitud de esos efectos depende del material utilizado(6), por ejemplo, maíz vs. alfalfa. En un metaanálisis realizado
por Blajman et al.(23),
que cubrió ensayos realizados sobre alfalfa con marchitado previo, la
utilización de BalHo y BALHeF
generó una reducción del pH de 0,4 unidades, pero en los trabajos que
incluyeron solamente L. plantarum, una BALHo obligada,
el efecto fue más modesto (- 0,2 unidades de pH). Los efectos del inoculante
sobre el pH en el presente trabajo fueron diferentes en las combinaciones de
tratamientos, pero de magnitud en dos situaciones de interés práctico. En F10-CM,
la categoría de mejor calidad nutricional, el inoculante disminuyó el pH en
0,41 unidades respecto. Por otro lado, en F50-SM, que es una alternativa
utilizada empíricamente para simplificar la tarea de ensilado, el inoculante
bajó el pH en 0,88 unidades, con un aumento en la concentración de AL y una
disminución en la de C2 y C4. En F50-CM, se halló una tendencia (p= 0,06), pero
la disminución del pH fue menor (0,19), sin modificaciones en AL y AGV.
La capacidad de
un inoculante para disminuir el pH de un ensilaje puede depender de la
concentración de MS y de flora epífita del cultivo al momento de ensilar, y de
la cantidad, de la especie y de la cepa bacteriana incluida en la formulación. A
modo de ejemplo, Filya et al.(24)
hallaron diferentes resultados con inoculantes comerciales a base de L. plantarum,
en alfalfas de primer y segundo corte. En alfalfa de primer corte, la mayor
concentración de MS (47,7 % MS) puede haber restringido la fermentación en el
grupo control (pH: 5,08) y aumentar así la acción del inoculante (pH entre 4,33
y 4,51 en los grupos con L. plantarum). Sin embargo, en alfalfa de segundo corte,
que tenía 39,3 % de MS y mayor población de BAL epífitas, el pH del grupo
control fue más bajo (4,42) y el contenido de AL más elevado (8,65 %, base MS) que
en el grupo control del primer corte, y los 3 inoculantes con L. plantarum
no promovieron una mayor disminución del pH. Similares resultados fueron
informados por Contreras-Govea et al.(25),
quienes atribuyeron la falta de efecto del inoculante (L. plantarum) en alfalfa (10 % de
floración, 39,5 % MS) a una alta población epífita de BAL, que permitió que el
grupo control alcanzara valores bajos de pH (4,58) y elevada concentración de
AL (7,65 %, base MS). Si bien en el presente trabajo no se estudió la
concentración de flora epífita, una concentración bacteriana igual o superior a
la dosis de inoculante aplicada podría explicar la falta de efectos del
inoculante sobre el pH en algunos de los tratamientos, y su evaluación debería
tenerse en cuenta para futuros experimentos.
Se ha informado
que, al aumentar el contenido de MS del cultivo, los inoculantes pueden
producir una mayor fermentación láctica y disminuir el pH del ensilaje más
rápida y eficientemente. La aplicación de L.
plantarum en combinación con Propionibacterium acidipropionici
disminuyó el pH cuando se aplicó en alfalfa con marchitado, pero lo aumentó
cuando esta técnica no fue empleada. Sin embargo, no hubo efectos cuando se usó
L. plantarum solo(9). Lo hallado con ambos
inoculantes combinados concuerda con nuestro trabajo, en el cual la disminución
del contenido de agua, ya sea por la aplicación de marchitado o por el avance
del estado fenológico, permitió que los ensilajes CI presenten menor pH que los
SI.
El efecto de
marchitado en F10 (aumento de AL y disminución de AGV) está en línea con una
fermentación láctica y la disminución del pH hallada, de igual manera a lo
sucedido en F50-SI. Sin embargo, el F50-CI, el marchitado provocó un descenso
del pH, sin modificaciones claras en los ácidos orgánicos que lo expliquen.
Las altas
concentraciones de N-NH3, C2, C3 y C4, y los altos valores de pH
hallados en los ensilajes SM, a excepción de F50-SM-CI, sumado al olor desagradable
percibido (caracteres organolépticos no informados), son indicios del
crecimiento de clostridios(20).
El bajo contenido de MS explicaría este tipo de fermentación indeseable. Cuando
el contenido de MS supera el 30 a 35 %, la elevada presión osmótica inhibe el
crecimiento de los clostridios(20).
Este tipo de ensilajes con fermentaciones indeseables no solamente conlleva
pérdidas de MS, sino que puede comprometer el desempeño productivo de los
animales. En el presente trabajo, los ensilajes en F10-SM y F50-SM-SI
presentaron un promedio de 1,8 % de ácido butírico que podría resultar en una
ingesta diaria de más de 120 g (vaca de 650 kg de peso vivo, consumo del 3,5 %
del peso vivo, 30 % de ensilaje de alfalfa en la ración). Un consumo diario de
más de 50-100 g de ácido butírico podría aumentar los riesgos de incidencia de
cetosis en vacas lecheras(26).
En F10-SM hay
una coincidencia entre la falta de efecto del inoculante sobre el pH y la
imposibilidad de establecer una fermentación láctica en estas condiciones, con
niveles de AL indetectables. Coincidentemente, Hashemzadeh-Cigari
et al.(9) tampoco hallaron efectos
sobre las concentraciones de ácidos orgánicos cuando utilizaron un inoculante a
base de L. plantarum
en alfalfa en prefloración sin oreo. En F10-CM, la disminución del pH producida
por el inoculante no es explicada por ninguna modificación de los ácidos
orgánicos medidos, a diferencia de otros ensayos con L. plantarum(27,28) en los que se asoció a un
incremento de AL. Las concentraciones de ácidos orgánicos en F50-SM fueron
alteradas por el inoculante en forma similar a lo hallado por Liu et al.(29),
en ensilaje de alfalfa florecida sin marchitado previo, y demuestra un efecto
positivo de L. plantarum
en una situación menos desafiante que la hallada en F10-SM. En F50-CM se generó
un pH adecuado en el grupo SI y el inoculante no tuvo efecto sobre las concentraciones
de ácidos orgánicos.
Al igual que lo
observado para la variable pH, la falta de efectos del inoculante sobre AL y
AGV, en especial en F10-CM y F50-CM, podría atribuirse a la presencia de flora
epífita en concentraciones superiores a la dosis de inoculante empleada(24).
b) Composición
nutricional: PB, N-NH3, FDN, FDA
El mayor
contenido de PB de los ensilajes CM indica una mejor preservación de esta
fracción durante el proceso de ensilado, producto de una menor tasa de
fermentación, que se tradujo, además, en una menor proporción de la PB como N-NH3.
Esto coincide parcialmente con Rangrab et al.(30) y con Hashemzadeh-Cigari
et al.(9), quienes hallaron que el marchitamiento disminuyó los
niveles de N-NH3, pero no tuvo efectos sobre el contenido de PB.
El efecto del inoculante
sobre la proporción de N-NH3 en F50, sin efecto sobre la PB, fue
similar a lo hallado por Guo et al.(28).
Sin embargo, no se hallaron efectos del inoculante en F10, lo cual también ha
sido observado en otros trabajos que utilizaron L. plantarum en alfalfa con 10 % de floración(25) o en prefloración(9,31).
La falta de efecto en F10 sobre N-NH3 plantea, las limitaciones de L. plantarum
para actuar en forrajes con menor cantidad de carbohidratos fermentables, en los
cuales pueden verificarse efectos sobre el pH final, pero modificaciones
menores en los patrones de fermentación. Las altas concentraciones de N-NH3
(más del 12 a 15 % de la PB) pueden ser resultado de una descomposición
excesiva de proteínas en el ensilaje causada por una lenta caída del pH que no
inhibe a las proteasas del cultivo o por un crecimiento excesivo de clostridios o enterobacterias.
Los ensilajes con menos del 30 % de MS, como fue el caso de F10-SM y F50-SM,
son más susceptibles a sufrir este tipo de fermentaciones. Las altas
concentraciones de amoníaco implican un exceso de proteína degradable en rumen,
lo que puede tener consecuencias sobre el desempeño reproductivo de las hembras
y aumentar el nitrógeno ureico en leche(20).
La menor
concentración de FDN y FDA en los ensilajes CM coincide con los resultados de Hashemzadeh-Cigari et al.(9).
En nuestro ensayo, el marchitado redujo el contenido de FDN y FDA en el orden
del 8 y 21 %, respectivamente, y estaría relacionado con una mejor preservación
del contenido celular, como lo demuestra la mayor concentración de PB. Además, Hashemzadeh-Cigari et al.(9)
hallaron que el marchitado incrementó el contenido de CSA. Aunque en nuestro
trabajo no se midió la concentración de CSA, una menor fermentación de esa
fracción también podría explicar el menor contenido de pared celular en los
ensilajes CM.
El inoculante
disminuyó el contenido de FDN y esto también puede estar relacionado con una
mejor conservación del contenido celular, aunque no se verificó a través de un
aumento de la PB. Por otro lado, el inoculante no afectó la concentración de
FDA, lo que guarda directa relación con la falta de efecto sobre la DRMS. Otros
investigadores(24,28) no han
podido hallar efectos de inoculantes a base de L. plantarum sobre las cantidades de FDN
y FDA en ensilajes de alfalfa.
c) DRMS
El incremento de
la DRMS provocada por el marchitado muestra una relación con la disminución en
el contenido de FDA y la mejor conservación de los componentes más digestibles
del forraje. Como sucede con la alfalfa en pastoreo directo, el avance del
estado fenológico tuvo como consecuencia una disminución de la DRMS en los
cortes CM.
La falta de
efecto del inoculante a base de L. plantarum sobre la DRMS coincide con los resultados de producción
de gas in vitro(25) y de
degradabilidad in vitro de la MS(31).
De manera similar, Filya et al.(24)
hallaron que la inoculación con BAL mejoró parámetros de fermentación, como pH
y niveles de ácidos orgánicos (disminuyó C2 e incrementó AL), pero no tuvo
efecto sobre la digestibilidad in vitro de
la MS a las 48 h.
Hashemzadeh-Cigari et al.(9) hallaron que la inoculación con L. plantarum y
Propionibacterium acidipropionici aumentó
la DRMS a las 24 h en ensilajes de alfalfa con marchitado, mientras que L. plantarum
tuvo este efecto en los ensilajes sin marchitado, lo que significó una interacción
I x M, situación que no se observó en nuestro trabajo. Sin embargo, Hashemzadeh-Cigari et al.(9)
no hallaron cambios en la DRMS por efecto del marchitado.
Conclusiones
El marchitado
del forraje contribuye a mejorar el proceso de fermentación y la degradabilidad ruminal de
ensilajes de alfalfa en floración temprana y media, lo cual la sitúa como una
práctica de elección para la confección de este tipo de reservas forrajeras. En
F10-CM y en F50-CM la aplicación del inoculante, al menos en las condiciones de
este ensayo, no produce mejoras adicionales de importancia. Sin embargo, en F50-SM,
una situación a la que puede llegarse por dificultades técnicas para realizar
el oreado, la aplicación de L. plantarum mejora los parámetros fermentativos del
ensilaje.
Tabla 1: Contenido de materia seca 8MS), perfil de fermentación, composición nutricional y degradabilidad ruminal ( Medias de mínimos cuadros) de ensilajes de alfalfa confeccionados al 10% (F10) o 50%(F50) de floración, con (CM) o sin (SM) marchitado y con (CI) o sin (SI) inoculante microbiano
Bibliografía
1. Basigalup DH. Situación de la alfalfa en Argentina. 5º Jornada Nacional de Forrajes Conservados, 9 y 10 de abril de 2014, INTA Manfredi, Córdoba, Argentina.
2. Bragachini M, Cattani P, Gallardo M, Peiretti J. Forrajes conservados de alta calidad y aspectos relacionados al manejo nutricional. Manual Técnico N° 6, INTA-PRECOP II. 2008. INTA E.E.A. Manfredi, Córdoba, Argentina.
3. Weinberg ZG, Muck RE. New trends and opportunities in the development and use of inoculants for silage. FEMS Microbiol Rev. 1996; 19(1):53-68. doi:10.1111/j.1574-6976.1996.tb00253.x.
4. Pahlow G, Muck RE, Driehuis F, Oude Elferink SJWH, Spoelstra SF. Microbiology of ensiling. In: Buxton DR, Muck RE, Harrison JH (eds). Silage science and technology. American Society of Agronomy, Inc., Madison, USA. 2003.
5. Muck RE, Nadeau MG, McAllister TA, Contreras-Govea FE, Santos MC, Kung LJr. Silage review: Recent advances and future uses of silage additives. J Dairy Sci. 2018; 101(5):3980-4000. doi:10.3168/jds.2017-13839.
6. Oliveira AS, Weinberg ZG, Ogunade IM, Cervantes AAP, Arriola KG, Jiang Y, Kim D, Li X, Gonçalves MCM, Vyas, D. Meta-analysis of effects of inoculation with homofermentative and facultative heterofermentative lactic acid bacteria on silage fermentation, aerobic stability, and the performance of dairy cows. J Dairy Sci. 2017; 100(6):4587-4603. doi:10.3168/jds.2016-11815.
7. Jaurena G, Danelón JL. Tabla de composición de alimentos para rumiantes de la región pampeana argentina. Buenos Aires: Editorial Hemisferio Sur S.A.; 2006.
8. Oude Elferink, SJWH, Driehuis F, Gottschal JC, Spoelstra SF. Silage fermentation processes and their manipulation. En: FAO Electronic Conference on Tropical Silage, 1 September-15 December, 1999. p. 1-28.
9. Hashemzadeh-Cigari F, Khorvash M, Ghorbani GR, Taghizadeh A. The effects of wilting, molasses and inoculants on the fermentation quality and nutritive value of lucerne silage. S Afr J Anim Sci. 2011; 41(4):377-88. doi:10.4314/sajas.v41i4.8.
10. Whiter AG, Kung LJr. The effect of a dry or liquid application of Lactobacillus plantarum MTD1 on the fermentation of alfalfa silage. J Dairy Sci. 2001; 84(10):2195-202. doi:10.3168/jds.S0022-0302(01)74666-8.
11. Petruzzi HJ, Stritzler NP, Ferri CM, Pagella JH, Rabotnikof CM. Determinación de materia seca por métodos indirectos: utilización del horno a microondas. En: Boletín de Divulgación Técnica Nº 88. 2005. INTA - Facultad de Agronomía, UNLPam, Anguil, Argentina. p. 8-11.
12. Friggens NC, Oldham JD, Dewhurst RJ, Horgan G. Proportions of volatile fatty acids in relation to the chemical composition of feeds based on grass silage. J Dairy Sci. 1998; 81(5):1331-44. doi: 10.3168/jds.S0022-0302(98)75696-6.
13. Weatherburn, MW. Phenol-hypochlorite reaction for determination of ammonia. Anal Chem. 1967; 39(8):971-74. doi: 10.1021/ac60252a045.
14. Association of Official Analytical Chemists. Official methods of analysis. 17th Ed. AOAC. Arlington, USA. 2000.
15. Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J Dairy Sci. 1991; 74(10):3583-97. doi:10.3168/jds.S0022-0302(91)78551-2.
16. Vanzant E, Cochran R, Titgemeyer E. Standardization of in situ techniques for ruminant feedstuff evaluation. J Anim Sci. 1998; 76(10):2717-29. doi: 10.2527/1998.76102717x.
17. Huntington JA, Givens DI. Studies on in situ degradation of feeds in the rumen: 1. Effect of species, bag motility and incubation sequence on dry matter disappearance. Anim Feed Sci Technol. 1997; 64(2-4):227-41. doi: 10.1016/S0377-8401(96)01057-7.
18. Michalet-Doreau B. Ould-Bah MY. In vitro and in sacco methods for the estimation of dietary nitrogen degradability in the rumen: a review. Anim Feed Sci Technol. 1992; 40(1):57–86. doi: 10.1016/0377-8401(92)90112-J.
19. SAS Institute Inc. SAS/STAT 9.1 User’s Guide. Cary, NC, USA. 2004.
20. Kung LJr, Shaver RD, Grant RJ, Schmidt RJ. Silage review: Interpretation of chemical, microbial, and organoleptic components of silages. J Dairy Sci. 2018; 101(5): 4020-4033. doi:10.3168/jds.2017-13909.
21. Albrecht KA, Beauchemin KA. Alfalfa and other perennial legume silage. In: Silage science and technology. 2003. D.R. Buxton, R.E. Muck, J.H. Harrison, Eds. ASA, CSSA and SSSA. Madison, USA. p. 633-64.
22. Zheng M, Niu D, Zuo S, Mao P, Meng L, Xu C. The effect of cultivar, wilting and storage period on fermentation and clostridial community of alfalfa silage. Ital J Anim Sci. 2018; 17(2):336-46. doi:10.1080/1828051X.2017.1364984.
23. Blajman JE, Vinderola G, Páez RB, Signorini RL. The role of homofermentative and heterofermentative lactic acid bacteria for alfalfa silage: a meta-analysis. J Agric Sci. 2020; 158(1-2):107-18. doi:10.1017/S0021859620000386.
24. Filya I, Muck RE, Contreras-Govea FE. Inoculant effects on alfalfa silage: Fermentation products and nutritive value. J Dairy Sci. 2007; 90(11):5108-14. doi: 10.3168/jds.2006-877.
25. Contreras-Govea FE, Muck RE, Mertens DR, Weimer PJ. Microbial inoculant effects on silage and in vitro ruminal fermentation, and microbial biomass estimation for alfalfa, bmr corn, and corn silages. Anim Feed Sci Technol. 2011; 163(1):2-10. doi: 10.1016/j.anifeedsci.2010.09.015.
26. Oetzel GR. Herd-level ketosis - Diagnosis and risk factors. In: Proc. Preconference Seminar 7C: Dairy herd problem investigation strategies: Transition cow troubleshooting. 2007. Vancouver, BC, Canada, p. 67-91.
27. Zhang T, Li L, Wang X, Zeng Z, Hu Y, Cui Z. Effects of Lactobacillus buchneri and Lactobacillus plantarum on fermentation, aerobic stability, bacteria diversity and ruminal degradability of alfalfa silage. World J Microbiol Biotechnol. 2009; 25(6):965-71. doi: 10.1007/s11274-009-9973-x.
28. Guo XS, Ke WC, Ding WR, Ding ML, Xu DM, Wang WW, Zhang P, Yang FH. Profiling of metabolome and bacterial community dynamics in ensiled Medicago sativa inoculated without or with Lactobacillus plantarum or Lactobacillus buchneri. Sci Rep. 2018; 8:357. doi:10.1038/s41598-017-18348-0.
29. Liu QH, Dong ZH, Shao T. Effect of additives on fatty acid profile of high moisture alfalfa silage during ensiling and after exposure to air. Anim Feed Sci Technol. 2018; 236(1):29-38. doi:10.1016/j.anifeedsci.2017.11.022.
30. Rangrab, LH, Frenzel Mühlbach PR, Berto JL. Silagem de alfalfa colhida no início do florescimento e submetida ao emurchecimento e à ação de aditivos biológicos. Rev Bras Zootec. 2000. 29(2):349-356. doi:10.1590/S1516-35982000000200005.
31. Hashemzadeh-Cigari F, Khorvash M, Ghorbani GR, Ghasemi E, Taghizadeh A, Kargar S, Yang WZ. Interactive effects of molasses by homofermentative and heterofermentative inoculants on fermentation quality, nitrogen fractionation, nutritive value and aerobic stability of wilted alfalfa (Medicago sativa L) silage. J Anim Physiol Anim Nutr. 2014; 98(2):290-99. doi:10.1111/jpn.12079.





