Introducción
Objetivo: Caracterización
genética de Acinetobacter baumannii, resistentes a los
carbapenémicos, aisladas de muestras clínicas de pacientes internados en salas
del Hospital Alemán Nicaragüense, enero 2017 - febrero 2018.
Acinetobacter baumannii, (A. baumannii),
ha tomado importancia clínica debido a la capacidad de desarrollar
multiresistencia a diferentes familias de antibióticos, también por los diversos
mecanismos que ha adquirido, como el hidrolisis mediada por enzimas,
disminución de sus porinas, expulsión de los antibióticos; este patógeno oportunista se ha visto
involucrado en algunos brotes endémicos en Bolivia, Colombia, Chile, España,
teniendo gran importancia la caracterización genotípica que conlleva a la
múltiple resistencia (Colón et ál., 2009). Según Fresnadillo, tiene
diferentes tipos de reservorios que le favorece el desarrollo de procesos infecciosos
en pacientes como la limpieza deficiente de las áreas hospitalarias e
instrumentos médicos del personal sanitario, como uno de las principales vías de infección, además de la falta de lavado de manos, el
uso constante del teléfono en áreas críticas, el deterioro de la salud de los
pacientes, así como factores de
comorbilidad, edad y estado inmunológico. Este
patógeno emergente tiene
capacidad de sobrevivir en condiciones adversas en las áreas hospitalarias, de
desarrollar diversos procesos infecciosos y conducir al desarrollo de
bacteriemia de muy mal pronóstico (Fresnadillo et ál., 2015).
A. baumannii, en el año 2017, fue ubicado en la lista de patógenos de prioridad crítica
por la Organización Mundial de la Salud (OMS), por ser un microorganismo resistente
a los Carbapenémicos, los cuales se utilizan para tratar procesos infecciosos
reservados presentándose refractarios ante la medición antimicrobiana, limitando
las alternativas farmacológicas, también tiene alta capacidad para diseminarse,
es eminentemente un peligro para la vida de los pacientes con estadías
prolongadas en las diferentes unidades sanitarias, aspectos importantes que se
deben considerar en estos procesos infecciosos. Desde la aparición de los
antimicrobianos se han implementado estrategias para tratar los procesos
infecciosos quizás de manera no adecuada o de uso indiscriminado, pero estos
microorganismos desarrollan múltiples maneras de defenderse de los ataques antimicrobianos
dificultando cada día la estrategia para erradicar los procesos infecciosos
(Opozo et ál.,2009). La dificultad de determinar fenotípicamente la
resistencia A. baumannii, tipo OXA,
es debido a la falta de inhibidores enzimáticos, lo que nos conlleva al uso
indispensable de técnicas de biología molecular como la PCR, para conocer
genéticamente los genes están portando
las bacterias, es de mucha importancia desde el punto de vista de resistencia
con transmisión plasmídica a otras bacterias Gram negativas, es por eso que no
enfocamos en la detección de genes carbapenemasas clase B, clase D. (Múnera et ál., 2014).
Métodos
Se realizó un estudio descriptivo transversal con el objetivo de caracterizar genéticamente A. baumannii, productora de carbapenemasas clase D, en las que se estudiaron, 16 cepas resistentes a los carbapenémicos aisladas de pacientes internados en el hospital público Alemán Nicaragüense. La identificación del género, especie y la prueba de susceptibilidad a los antimicrobianos se llevó a cabo mediante el sistema VITEK2 compact, a partir del cultivo en MacConkey se tomaron tres Unidades formadoras de colonias (UFC), para la preparación del inóculo, luego se realizó una suspensión homogénea en un tubo de ensayo conteniendo 3ml de solución salina al 0.45%, para las tarjetas restantes se pasaron 145µl en tubos con 3ml de solución salina, se ajustó al estándar 0.5 de McFarland por medio del DenSiCheK Plus, y se procedió a montar (GN, AST -XN06 y AST- GN69), GN: 64 pruebas bioquímicas, AST XN06: AN, ATM, CF, CTX, CTT, FOX, CPD, CZX, CXM, DOR, MEM, MXF, NA, NOR, PIP, TE, TIC, TCC, TGC, AST GN69: AMC, AM, SAM, CZ, FEP, CAZ, CRO, CIP, ETP, GM, IPM, LEV, TZP, TM, SXT. Se consideraron cepas sospechosas productoras de carbapenemasas al presentar Concentración Mínima Inhibitoria (CIM) de 2-4 µg/mL para Imipenem, Meropenem, y 2 µg/mL para Ertapenem (CLSI., 2020). Se realizó el test de sinergia con ácido etilendiaminotetraacético (10µg o 0.1 uM), a partir de la escala 0.5 McFarland de las cepas a evaluar, también se evaluó mediante Kirby Bauer el halo de inhibición ≤ 21 mm se incubó 18-24hrs. Para la caracterización genotípica, se realizó un múltiplex PCR para blaOXA23, blaOXA40, blaOXA51 y blaOXA58 (Colón et ál., 2009). Para conocer, si portaban el gen NDM, realizó un PCR: para blaNDM, (Pasteran F., 2012). Para determinar los genes clase B, se realizó un PCR, múltiples para blaIMP, blaVIM, blaGIM, blaSIM, blaSPM (Escalante et ál., 2013).
Extracción del ADN: fue mediante lisis por calor a partir del cultivo en agar MacConkey de 18-24 horas a 37ºC, se tomó un pool de UFC, se inocularon en un vial de 1.5 mL que contenía 100µl de agua libre de nucleasas, se colocó en baño maría en ebullición por 10 minutos, luego se centrifugó a 12000 rpm por 5 minutos y se extrajo 80µl del sobrenadante, se determinó la concentración de ADN extraído en Nanodrop Lite 2763 ( Vilchez et ál., 2009).
Detección genotípica blaOXA: se realizó una PCR
múltiplex, en aislados de Acinetobacter baumannii,
en la que se utilizaron los siguientes cebadores. Ver Tabla 1.
Tabla 1
Secuencia
de cebadores carbapenemasas clase B y clase D.
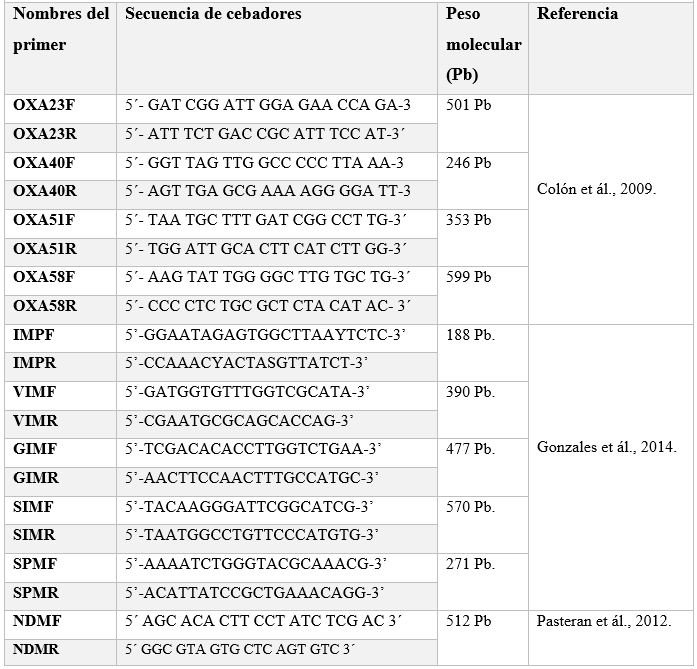
Se realizó mediante PCR convencional para la determinación de carbapenemasas clase B y clase D, en la mezcla se utilizó 2 µL de ADN, Buffer 10X (5 µL), dNTP´s mix 40 mM (2,5 µL), Taq Polymerasa 5U/ul (0.5 µL), Primer Forward 10uM (0,5 µL), Primer Reverse 10uM (0,5 µL), agua libre de nucleasas (18 µL), para un volumen final 25 µL, (Pasteran et ál., 2012).
Amplificación; la identificación genética de carbapenemasas tipo D, se determinó mediante PCR, y se determinaron los genes OXA-23, OXA-40, OXA-51, OXA-58, la amplificación se realizó mediante las siguientes condiciones: desnaturalización 95°c por 4 minutos, seguido de 30 ciclos desnaturalización 94°C por 25 segundos, amplificación 52°C por 40 segundos, 72°C, por 50 segundos, extensión final 72°C por 6 minutos, temperatura final 4°C (Colón et ál., 2009).
Detección de carbapenemasas clases B1; también conocidas como metalo β-lactamasas (MBL), mediante PCR multiplex, se utilizó el siguiente programa de amplificación: Desnaturalización a 94 °C por 5 minutos; 36 ciclos desnaturalización a 94°C por 30 segundos; hibridación a 52°C por 40 segundos; amplificación 72°C por 50 segundos y una extensión final de 72 °C por 5 minutos (Escalante et ál., 2013). Ver tabla 1.
Determinación de New Delhi (NDM), Amplificación se utilizó el siguiente programa, desnaturalización 94°C, por 5 minutos, seguido de 35 ciclos, 94°C por 30seg, hibridación 50°C por 30seg, amplificación 72°C por 60seg, extensión final 72°C por 10 min, final 4°C. La amplificación se realizó en un MásterCycler, Marca Eppendorf, Modelo número 5341, (Pasteran et ál., 2012). Ver tabla 1.
Electroforesis; El producto de PCR fue evaluado en un gel de agarosa al 2% con 0.5 µg/mL de bromuro de etidio, la electroforesis se corrió a 120 voltios por 60 minutos las bandas de ADN de los diferentes genotipos fueron visualizadas en una cámara con luz ultravioleta y fotografiada. Se evaluaron los pesos de las bandas con los controles positivos utilizados (Colón et ál., 2009). Ver anexo figura 1 y 2 de electroforesis.
Resultados
El universo estuvo comprendido por 16
cepas de Acinetobacter baumannii,
resistente a los carbapenémicos Imipenem y Meropenem, durante el periodo de estudio, en la caracterización
genotípicas se demostró diversidad de genes, el 100% de las cepas portaron
OXA51, 87.5% portaban genes OXA40 pero combinado con OXA51, el 13% presentaron
una combinación de genes NDM con OXA51, el 6% de las cepas presentaron genes
VIM, GIM en combinación OXA40 y OXA51, todas las cepas en estudio de A.
baumannii, presentaron multiresistencia, pero el 100% fueron sensible a colistina
ver gráfico 1.
Discusión
A. baumannii, tiene resistencia a
diferentes fármacos, debido a la diversidad de mecanismos de resistencia como:
AMP-C, estos hidrolizan a los Aminopenicilinas, también hidrolizan a los
β-lactámicos y muy eficientemente a Cefepime, igualmente posee Serino
carbapenemasas clase D, estos hidrolizan muy eficientemente a los
carbapenémicos (Múnera
et ál., 2014). En la tabla 4, se
puede observar la diversidad de genes que están portando las cepas de A.
baumannii, este hallazgo es importante porque estamos encontrando genes
MBL, que son casi exclusivo de las enterobacterias, al estar compartiendo estos
genes, lo convierte en un microorganismo altamente peligroso por su
multiresistencia y pudiendo causar brote en diferentes ambientes hospitalarios,
cabe señalar que también están portando genes New Delhi, en Nicaragua este
sería el primer estudio de caracterización de A. baumannii, El gen OXA51, es cromosómico, este tiene la
característica de ser poco compartido, las cepas portan en un 100%, el OXA40,
solo lo portaban en un 87.5%, este se trasmite mediante plásmidos pudiendo ser
compartido por microorganismos muy cercanos a ellos o compartir con las
enterobacterias, dos cepas presentaron una combinación de OXA51 y NDM, para un
13%, una de las cepas presentó una combinación de genes MBL como son VIM, GIM,
con OXA40 y OXA51, hay que seguir monitoreando este patógeno, por el
comportamiento de las características genéticas encontradas (Pillonetto et ál., 2013) . Los genes que codifican para
carbapenemasas clase D, ya han sido estudiadas en países como Colombia, Bolivia,
pero en Nicaragua constituye el primer estudio en este tipo de genes y con un
abordaje más amplio en la caracterización de genes MBL y NDM (Escalante et ál., 2013) (Oliver
et ál., 2010).
Tabla 2
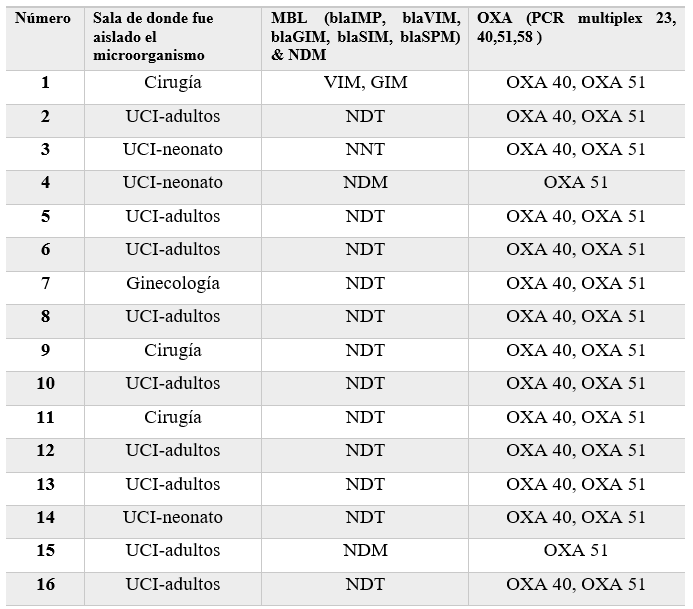 NDT. No detectados.UCI Unidad de Cuidados Intensivos.
NDT. No detectados.UCI Unidad de Cuidados Intensivos.
Según el perfil
de resistencia en A. baumannii,
presentan resistencia, casi a todos los antibióticos analizados, teniendo
sensibilidad a colistina en 100% y tigeciclina en un 93%, siendo las alternativas farmacológicas, el
comportamiento versátil de adquirir genes por transferencia horizontal, abre la
posibilidad de presentar resistencia a corto plazo a Colistina y esto sería muy
alarmante, debido que esta es la alternativa farmacología aunque no muy segura
como reportan algunos investigares por las reacciones adversas que este pueda
generar, pero es la alternativa de tratamiento, es importante destacar que la
multiresistencia se debe a las combinaciones de genes, VIM, GIM, NDM, OXA40,
OXA51, cabe señalar que la hidrólisis de los carbapenémicos, se deba casi
exclusivamente al gen OXA51, pero siendo aún más potenciado por los demás genes
(Colón et ál., 2009).
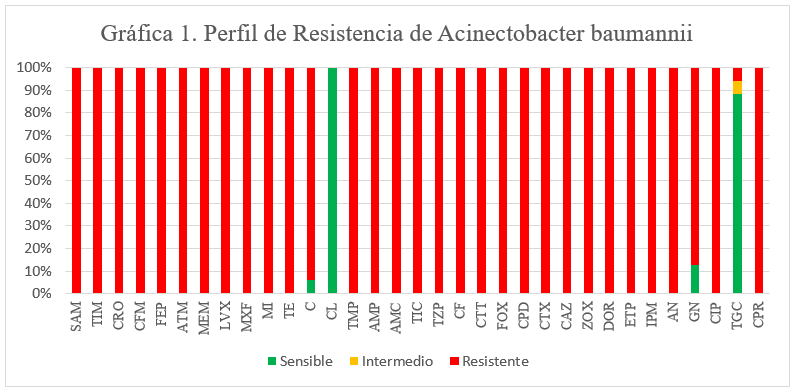 Gráfico 1.
Perfil de Resistencia de Acinectobacter baumannii
Gráfico 1.
Perfil de Resistencia de Acinectobacter baumannii
Conflicto de interés y
Agradecimiento.
Los autores declaran no tener conflicto alguno y
agradecemos por la colaboración en el estudio al Ministerio de Salud de Nicaragua y al personal del Hospital
Alemán nicaragüense.
Financiamiento
Este estudio se realizó con el Fondo para Proyectos de
Investigación (FPI) de la UNAN-Managua, dirigido por el Vicerrectorado de
Investigación, Posgrado y Extensión Universitaria a través de la Dirección de
Investigación.
Conclusiones
La
multiresistencia en A. baumannii a
carbapenémicos se debe al blaOXA51, gen intrínseco y a las combinaciones de
genes VIM, GIM, NDM y OXA40, aumentando la capacidad hidrolítica a estos
antibióticos, estas combinaciones genéticas conducirán a una alta prevalencia en
infecciones intrahospitalaria si no se controla los factores asociados.
Anexos
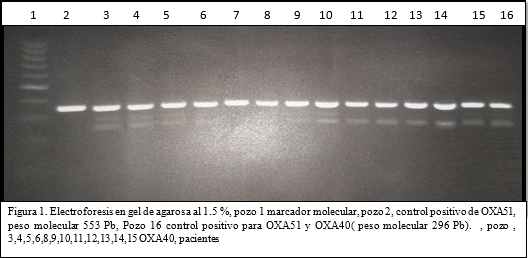 Figura 1
Figura 1
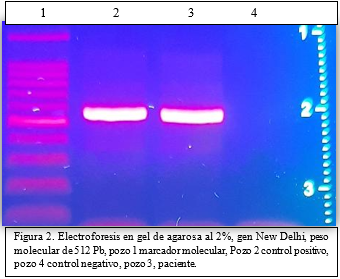 Figura 2
Figura 2
Agradecimientos
Agradecemos por la colaboración en el estudio al Ministerio de Salud de Nicaragua y al personal del Hospital
Alemán nicaragüense.
Bibliografía
(CLSI), C. a. (2020). Performance Standards for Antimicrobial Susceptibility Testing. 30 th ed. supplement M100. Wayne, PA:Clinical and Laboratory Standards Institute .
Andrés Opazo C., S. M. (2009). Bombas de expulsión multidrogas en Acinetobacter baumannii y resistencia a antimicrobianos. Rev Chil Infect 2009, 26 (6): 499-503.
Arbizù Medina, O. (2019). Carbapenemase en Pseudomonas aeruginosa en los hospitales de Managua, Nicaragua. Torreón Universitario. doi:https://doi.org/10.5377/torreon.v8i21.8851
Elena Fernández Colón;. (2009).
Determinación de carbapenemasas y su relación con estructuras genéticas en
aislamientos clínicos de Acinetobacter baumannii de hospitales de la ciudad
de Cochabamba. BIOFARBO, 30-38.
Gonzales-Escalante1, E. (2013). METALO-β-LACTAMASAS EN AISLAMIENTOS CLÍNICOS DE Pseudomonas aeruginosa EN LIMA, PERÚ. Rev Peru Med Exp Salud Publica, 30(2):241-45.
Marcelo Pillonetto, L. A.-A. (2013). First Report of NDM-1-Producing Acinetobacter baumannii Sequence Type 25 in Brazil. Antimicrobial Agents and Chemotherapy. doi:doi:10.1128/AAC.03444-14
María José Fresnadillo-Martínez, E. G.-M.-S.-d.-E.-S.-S. (2015). Prevención de un brote de Acinetobacter baumannii en una unidad de cuidados intensivos: eficacia de diversos métodos matemáticos. Rev Esp Quimioter.
Oliver, C. J. (2010). arbapenemasas en especies del género Pseudomonas. Enferm Infecc Microbiol Clin.
P., A. D. (2005). Infecciones por Acinetobacter baumannii pan-resistente. Consideraciones epidemiológicas y de manejo antimicrobiano actualizado. Rev Chil Infect, 22 (4): 298-320.
Pasteran F., A. E. (2012). Emergence of NDM-1-producing Klebsiella pneumoniae in Guatemala. . Journal of Antimicrobial, 67:1795-1797.
Samuel Vilchez, D. R. (2009). Prevalence of diarrhoeagenicEscherichia coliin children from Leo ́n, Nicaragua. Journal of Medical Microbiology, 58,630–637. doi:10.1099/jmm.0.007369-0
Vanegas-Múnera JM, R.-V. G.-Q. (2014). Acinetobacter baumannii: importancia clínica, mecanismos de resistencia y diagnóstico. Rev CES Med, 28(2): 233-246.










