



CARACTERÍSTICAS DE LA ANIDACIÓN DE TORTUGAS MARINAS: Lepidochelys olivacea y Chelonia mydas, EN PLAYA LAGARTO, LOS SANTOS, PANAMÁ
NESTING CHARACTERISTICS OF THE SEA TURTLES: Lepidochelys olivacea AND Chelonia mydas, IN PLAYA LAGARTO, LOS SANTOS, PANAMA
Tecnociencia
Universidad de Panamá, Panamá
ISSN: 1609-8102
ISSN-e: 2415-0940
Periodicidad: Semestral
vol. 25, núm. 1, 2023
Recepción: 23 Julio 2022
Aprobación: 18 Octubre 2022

Resumen:
El presente trabajo tuvo como objetivo determinar las características de la anidación de tortugas marinas en Playa Lagarto y evaluar el éxito de nidos reubicados. De junio 2021 a enero 2022, se realizaron monitoreos nocturnos para colectar datos biométricos y reubicar nidos a un vivero local. Se identificaron 53 tortugas de la especie Lepidochelys olivacea que promediaron 67.90 cm de largo y 70.26 cm de ancho de caparazón. Se cuantificaron 38 tortugas Chelonia mydas cuyo caparazón promedió 90.18 cm de largo y 86.26 cm de ancho. Se reubicaron 116 nidos al vivero, de los cuales se liberaron 7,059 neonatos, alcanzando 72.68% de éxito de eclosión. Los neonatos promediaron 34.26 mm de ancho y 41.98 mm de largo de caparazón, y 15.39 g de peso. En la playa, se detectaron 16 nidos saqueados, 14 de L. olivacea y dos de
C. mydas, mientras que cuatro fueron saqueados en el vivero. El saqueo en el vivero ascendió a 184 y 199 huevos para L. olivacea . C. mydas, respectivamente. Considerando los porcentajes de eclosión por especie, se estima que 239 neonatos fueron perdidos producto del saqueo. Es necesario fortalecer las estrategias de protección y conservación de estos importantes reptiles marinos.
Palabras clave: Bermas, Chelonia mydas, caparazón, éxito de eclosión, Lepidochelys olivacea.
Abstract:
The present work aimed to determine the characteristics of sea turtle nesting at Lagarto Beach and evaluate the success of relocated nests. Nocturnal monitoring was carried out from June 2021 to January 2022, to collect biometric data and relocate nests to a local nursery. A total of 53 Lepidochelys olivacea turtles were identified, which averaged 67.90 cm in length and 70.26 cm in carapace width. Thirty-eight Chelonia mydas turtles were quantified; whose carapace averaged 90.18 cm in length and 86.26 cm in width. In sum, 116 nests were relocated to the nursery, and their exhumation allowed the release of 7,059 hatchlings, reaching a 72.68% hatching success rate. Hatchlings averaged 34.26 mm in carapace width, 41.98 mm in carapace length, and 15.39 g in weight. On the beach, 16 nests were poached, 14 of L. olivacea and two of
C. mydas, while four were poached in the hatchery. Poaching in the hatchery amounted to 184 and 199 eggs for L. olivacea and C. mydas, respectively. Considering the percentages of hatching by species, it is estimated that 239 hatchlings were lost as a result of egg poaching. It is necessary to further strengthen the protection and conservation strategies for these important marine reptiles.
Keywords: Berms, Chelonia mydas, carapace, hatching success, Lepidochelys olivacea.
INTRODUCCIÓN
Las tortugas marinas poseen el rango más amplio de distribución de los reptiles, desde el Ártico hasta Tasmania (Meylan & Meylan, 2000). Son parte fundamental de ecosistemas marino‐costero tropicales donde desempeñan funciones críticas (Frazer, 1992; Meylan & Meylan, 2000). Sin embargo, las siete especies de tortugas marinas existentes se encuentran en la lista roja de animales amenazados de la UICN (Baillie & Groombridge, 1996).
La vulnerabilidad de estas especies se debe a un ciclo de vida con alta mortalidad (Reavis et al., 2022). Desde la emergencia del nido son depredados por aves, cangrejos y peces, e incluso los adultos son atacados ocasionalmente por tiburones (Georges et al., 1993; Heithaus
et al., 2008). La supervivencia de las tortugas marinas también está influenciada por actividades antrópicas como: contaminación, pesca incidental, desarrollo turístico, saqueo y venta ilegal de huevos y carne de tortuga. Estas actividades han hecho que el número de individuos por especie disminuya (Marcovaldi & Thomé, 2000; Troëng & Rankin, 2005; Vega & Robles, 2007b; Garcés et al., 2020; Reavis et al., 2022).
En el caso específico de la tortuga verde, Chelonia mydas, en Michoacán, México, la población sufrió una drástica disminución luego de la explotación intensa entre 1960 y 1970, con una abundancia anual de hembras anidadoras que se redujo de aproximadamente 25,000 a un promedio de 1,400 entre 1982 y 2001 (Chassin-Noria et al., 2004). Las tortugas lora, Lepidochelys olivacea, también ha sufrido declives poblacionales; a pesar de ser las más abundante de las tortugas marinas (Sosa-Cornejo et al., 2021). En Costa Rica, se ha registrado reducción significativa de 42%, 84% y 90% en el número de hembras anidadoras por arribada en los períodos 1971–1984, 1971–1992 y 1971–2007, respectivamente (Fonseca et al., 2009). Sin embargo, recientemente se ha reportado tendencias de recuperación de las poblaciones de C. mydas del Caribe Costarricense (Troëng & Rankin, 2005), y L. olivacea en el Pacifico oriental centroamericano (Ariano-Sánchez et al., 2020).
En Panamá, Garcés et al. (2020) determinaron las características de Playa Lagarto, Pedasí, Los Santos, como sitio de anidación de tortugas
L. olivacea y C. mydas, de agosto de 2016 a febrero de 2017. Sin embargo, no existen estudios que estén dando seguimiento a las tortugas que anidan en este sitio. Según los mismos autores, este refugio está bajo constante presión por el desarrollo turístico y el saqueo de nidos de tortuga.
En este contexto, la reubicación de nidos es una estrategia de conservación implementada para proteger poblaciones de tortugas marinas en áreas donde la caza, inundación de nidos, depredación natural y la erosión de las playas impactan negativamente el éxito reproductivo (García et al., 2003; Troëng & Rankin, 2005). Aunque existen beneficios en la reubicación de nidadas que de otro modo tendrían pocas posibilidades de sobrevivir si se dejaran in situ, hay evidencia de que la reubicación puede tener efectos adversos para la condición y supervivencia de neonatos (Tanabe et al., 2021).
Por tanto, y en vista de lo antes expuesto, el propósito de este trabajo fue determinar las características de la anidación de tortugas marinas, L. olivacea y C. mydas, en Playa Lagarto y evaluar el éxito de nidos reubicados en un vivero gestionado por la Fundación Tortugas Pedasí; mediante seguimiento a monitoreos nocturnos, colecta, siembra de huevos y exhumación de nidos en el refugio de vida silvestre Pablo A. Barrios.
MATERIALES Y MÉTODOS
Área de estudio
Playa Lagarto, se encuentra ubicada dentro del Refugio de Vida Silvestre Pablo A. Barrios, en el distrito de Pedasí, provincia de Los Santos y fue declarado área protegida mediante resolución AG0313- 2009, del 4 de mayo de 2009. El refugio tiene una superficie total de 137,99 km², de los cuales 136,06 km² son de cobertura marina. La porción de tierra firme consiste en una delgada franja de costa, que es altamente vulnerable al desarrollo de las comunidades y proyectos turísticos asociadas al distrito (Pinto & Yee, 2011). Los límites del área protegida colindan al norte con el río Purio y el Golfo de Panamá (845205.27 N; 602918.71 W), al este con el Refugio de Vida Silvestre Isla Iguana (845220.72 N; 603546.06 W), al sur con Punta Mala y el Océano Pacífico (845367.06 N; 609823.77 W) y al oeste con los corregimientos de Purio, Mensabé y Pedasí (843836.08 N; 609842.48 133 W) (Garcés et al., 2020).
Distribución de nidadas
Durante junio 2021 a enero 2022, se realizó monitoreo nocturno (60 horas mensuales) en Playa Lagarto, distrito de Pedasí, provincia de Los Santos. Se patrulló la playa, dos horas antes y después de la marea alta y baja. Se establecieron segmentos de playa, señalizados por nueve postes de guía, con una separación de 100 metros, para detectar si las tortugas hacen uso preferencial de espacios en la playa para hacer sus nidos (Chacón et al., 2008).
Al encontrar rastros y/o tortugas anidando, se procedió a la toma del
largo y ancho curvos del caparazón; si las tortugas presentaban placa, el código de la marca era registrado. A las tortugas L. olivacea sin marca, se les aplicó una placa de identificación para determinar posibles eventos de reanidación. Adicionalmente, se registraron la ubicación de la puesta (zona baja, media o alta) de acuerdo con el poste de guía más cercano y el estado del nido (saqueado o depredado). De encontrarse solo el rastro, se utilizaron las huellas para identificar la especie y se tomó la medida del ancho de huella interna (HI) y externa (HE) (Bolten, 2000; Rueda-Almonacid et al., 2007; Chacón et al., 2008; Brenes et al., 2015).
Reubicación de nidos
Los huevos de nidos silvestres fueron contabilizados y depositados cuidadosamente en bolsas plásticas para trasladarlos al vivero. En el vivero, voluntarios excavaron nidos similares al de origen, donde se depositaron los huevos corroborando la cantidad inicial. Se tomo nota de la actividad general en el manejo durante la reubicación por parte de los voluntarios. Los nidos fueron etiquetados con: la cantidad de huevos, fecha de puesta y fecha de posible eclosión de acuerdo con la especie (Vega & Robles, 2007b; Chacón et al., 2008).
La temperatura del sustrato en el vivero fue medida con cinco sensores iButton, y un respaldo (USB data‐logger AZ-88163), programados para capturar registros cada 5 minutos. Los sensores fueron suspendidos dentro de tubos (Ø 10.2 cm) de PVC y enterrados 80 cm.
Éxito de eclosión y biometría de neonatos
Al detectar neonatos en superficie, se procedió a contarlos y si sobrepasaban el 50% de los huevos sembrados en el nido, se efectuaba la exhumación de inmediato. Se registró el número de neonatos en superficie, neonatos vivos dentro del nido, neonatos muertos, cascarones, huevos sin desarrollo embrionario (HSD) y huevos con desarrollo embrionario (HCD). Para determinar el éxito de eclosión (Chacón et al., 2008) se empleó la fórmula:
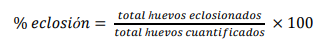
Para evaluar la biometría de los neonatos, se emplearon seis nidos por especie (> 80% de éxito de eclosión), de los cuales se seleccionaron 30 individuos al azar por cada nido. Se midió el ancho, largo del caparazón y el peso, usando un vernier (0.1 mm) y una balanza (0.01 g) digital; posteriormente todos los neonatos fueron liberados en el borde de la playa. Esta data se empleó en el análisis de asociación entre variables biométricas de las tortugas madre y neonatos, mediante correlación de Pearson.
Granulometría y humedad de la arena
Se analizó la granulometría de la arena (González, 2013; Kenny & Sotheran, 2013) de los nidos de ambas especies junto a los postes de guía con mayor y menor actividad de anidación en la zona alta y media de la playa, incluyendo muestras del vivero. De cada muestra se separó una porción de 100 g y otra de 400 g. Estas se pesaron con una balanza digital (0.01 g) y fueron colocadas en platos de aluminio desechable para secado en horno eléctrico (Heratherm OMS100) a 75ºC hasta obtener un peso seco constante por 48 horas. Las muestras de 100 g se pesaron nuevamente en seco y se calculó el porcentaje de humedad mediante la fórmula:
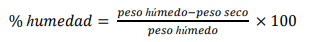
Una vez secas, las porciones de 400 g de arena se pasaron por la pila estándar de tamices (Hubbard Scientific), 0.50, 0.25, 0.125, 0.0625 y < 0.0625 mm. Los tamices se organizaron de manera que la arena pasara de mayor a menor luz de malla con sacudida circular por 15 minutos. Las fracciones resultantes se separaron y luego se procedió a pesarlas por separado. Finalmente, se registró el número de cada una de las muestras, el peso de la fracción y tamiz a la que pertenecía.
Geomorfología de la playa
Para identificar cambios en la playa que pudieran explicar la distribución espacial de nidos, se procedió a tomar registro fotográfico del tramo de playa que comprendió la zona de monitoreo. Para ello se empleó una cámara (12MP‐HDR), y las fotografías se contrastaron con registros históricos de los años: 2015, 2016 y 2020.
Análisis de datos
Las proporciones de nidos por zona (alta, media y baja), y secciones paralelas a playa se analizaron con la prueba Chi‐cuadrado de ajuste de bondad. La distribución de nidos por especie y su ubicación en función de la altura en la playa se analizó con la prueba Chi‐cuadrado (asociación) de Pearson.
Las variables biométricas de los neonatos del vivero fueron comparadas entre nidos mediante la prueba ANOVA, para determinar si existía diferencia entre ellos. La igualdad de varianzas fue evaluada con la prueba de Levene (P < 0.05). Cuando las varianzas fueron significativamente distintas, se empleó la ANOVA de Welch; las medias fueron comparadas por pares con la prueba Tukey. La relación entre las variables biométricas de la tortuga madre y sus neonatos se evaluó con la correlación de Pearson. Del total de neonatos liberados, se comparó entre especies, la cantidad de huevos sembrados (t‐Student), neonatos vivos, neonatos muertos, huevos sin desarrollo y huevos con desarrollo arrestado con la prueba de Mann-Whitney. Adicionalmente, para entender variabilidad en éxito de eclosión, se utilizó la regresión lineal (“stepwise”) para explorar la relación entre las variables predictoras: tiempo de eclosión (TE), cantidad de huevos sembrados (CHS) y especie, con las variables de respuesta: neonatos vivos (NV), neonatos muertos, huevos sin desarrollo (HSD) y huevos con desarrollo (HCD) (Sokal & Rohlf, 1987).
La data de humedad en los nidos del vivero, nidos salvajes de tortuga L. olivacea y C. mydas se analizó con la prueba-t y Kruskal-Wallis según desviación de la normalidad. La prueba Chi-cuadrado, se empleó para analizar las proporciones de arena por cada tamiz correspondientes a los postes; esto se hizo para las muestras de la zona alta y media de la playa (Sokal & Rohlf, 1987). La misma prueba se usó para analizar el conjunto de las proporciones correspondientes al vivero y nidos silvestres de ambas especies, así como también para proporciones de arena en los tamices de los nidos por especie (González, 2013). Para el análisis de la data obtenida en las giras mensuales, los datos fueron organizados en Excel y posteriormente analizados en MiniTab 19; reportados con α =
0.05 y valores-P exactos cuando fue posible calcularlos.
RESULTADOS
Distribución de nidadas y biometría de tortugas
Se encontró diferencia significativa en las proporciones de nidos distribuidos por zona de playa (alta = 62, media = 25 y baja = 3; c2 = 59.27, df = 2, P < 0.001). No se detectó diferencia en la distribución de nidos por especie y su ubicación en función de la altura de la playa (c2
= 1.70, df = 2, P = 0.429). La frecuencia de nidos detectados también mostró diferencia entre secciones de playa (c2 = 57.79, df = 9, P < 0.001; Figura 1A).
Se lograron medir 90 tortugas en la playa, 52 Lepidochelys olivacea y 38 Chelonia mydas. El largo del caparazón de L. olivacea registró 67.90
± 3.37 cm (61–76 cm) y el ancho 70.25 ± 4.46 cm (60–83 cm). En cuanto a C. mydas el largo del caparazón registró 90.18 ± 7.80 cm (70–109 cm) y el ancho 86.26 ± 6.53 cm (79–104 cm). El caparazón de las tortugas
L. olivacea fue más ancho que largo (t = -3.01, P = 0.003), mientras que los caparazones de C. mydas fueron más largos que anchos (t = 2.37, P
= 0.020). El análisis de regresión del ancho y largo del caparazón de ambas especies confirmó relación significativa entre las variables, pero el ajuste fue pobre en L. olivacea (r2 = 14.05%, P = 0.007), mientras que en C. mydas el ajuste fue mejor (r2 = 53.75%, P < 0.001).
Las tortugas L. olivacea más grandes llegaron a anidar en el mes de septiembre (largo 69 ± 3.54 cm; 65–76 cm y ancho 72.54 ± 5.04 cm; 65–83 cm). Las tortugas C. mydas con mayor talla se registraron en enero (largo 92.74 ± 8.46 cm; 80–109 cm y ancho 87.95 ± 6.42 cm; 82– 104 cm). Sin embargo, al comparar las medias de tallas por mes de la tortuga L. olivacea, no se detectó diferencia significativa (largo: ANOVA, F (7,43) = 0.68, P = 0.689; ancho: ANOVA, F (7,43) = 1.98,
P = 0.081). Para tortugas C. mydas tampoco se detectó diferencia en talla por mes (largo: ANOVA, F (6,31) = 0.90, P = 0.508; ancho: ANOVA, F (6,31) = 1.19, P = 0.338).
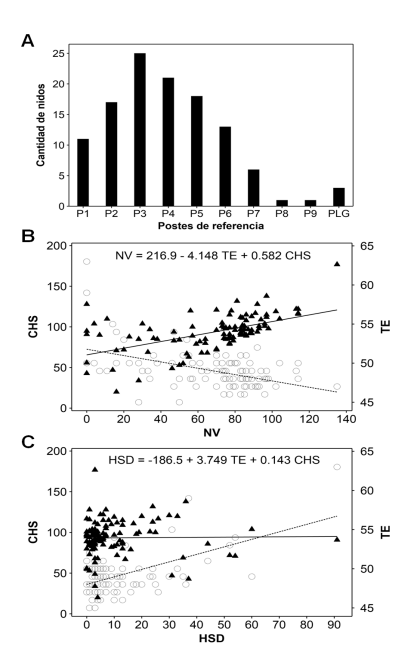
Barras indican cantidad de nidos por poste de referencia; PLG: Playa La Garita. Indicadores de desempeño, B: neonatos vivos (NV), y C: (HSD) huevos sin desarrollo. Predictores: TE (tiempo hasta eclosión); círculos y línea de regresión punteada. CHS (cantidad de huevos sembrados); triángulos negros y línea de regresión sólida.
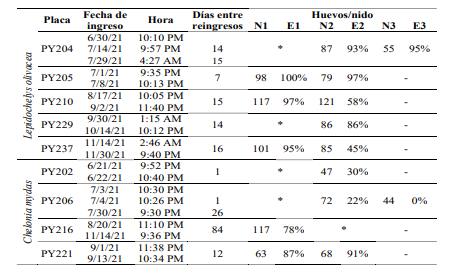
A lo largo del periodo de estudio se lograron marcar 42 tortugas L. olivacea, de las cuales cinco reanidaron, mientras que cuatro tortugas C. mydas, previamente marcadas, reingresaron a la playa para anidar en distintas fechas. Estas hembras promediaron 76.33 ± 9.63 cm y 75.33 ±
7.09 cm de largo y ancho del caparazón, respectivamente. Dos de estas hembras (una de cada especie), retornaron para intentar anidar al menos dos veces (Cuadro 1). No hubo diferencia entre la primera (89.67 ±
19.88 huevos) y segunda (75.33 ± 26.99) nidada de este grupo de tortugas (t = 2.24, P = 0.076).
Reubicación de nidos y éxito de eclosión
En general durante la reubicación de nidos no se observó un estándar implementado en el proceso por parte de los voluntarios y tampoco recibieron refuerzo de asesoría técnica. Se lograron reubicar 116 nidos de tortuga, de los cuales 91 fueron de L. olivácea con un total de 8,631 huevos y 1,081 de C. mydas, de los cuales 7,059 neonatos lograron eclosionar. Se cuantificaron 6,517 neonatos de L. olivacea, mientras que otros 542 fueron de C. mydas. La cantidad de huevos sembrados por los voluntarios en cada nido varió, promediando 93.38 ± 22.33 huevos con
67.88 ± 29.79 neonatos vivos por nido como resultado. La exhumación de los nidos reflejó que la mortalidad de neonatos fue de 283 (2.91%). En conjunto, el éxito de eclosión fue del 72.68%, mientras que los huevos de L. olivacea y C. mydas alcanzaron 75.51% y 50.14% de éxito de eclosión, respectivamente.
Durante la temporada de monitoreo, se detectaron 16 nidos saqueados, 14 de L. olivacea y 2 de C. mydas. En el vivero se dio el saqueo de cuatro nidos con pérdida de 184 huevos de L. olivacea y 199 huevos de C. mydas; dos nidos de cada especie. Considerando los porcentajes de eclosión por especie, se estima que este total de huevos perdidos hubiesen producido 239 neonatos.
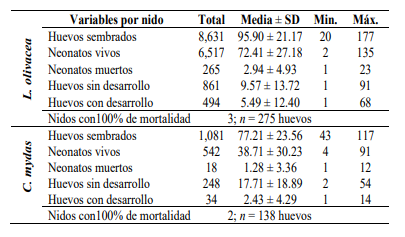
La estadística descriptiva del éxito de eclosión para ambas especies está contenida en el cuadro 2. Los neonatos muertos por nido registraron un promedio de 2.72 ± 4.77, los huevos sin desarrollo, 10.66 ± 14.68 y los huevos con desarrollo arrestado, 5.08 ± 11.68. En cuanto a las demás variables, la comparación entre las tortugas solo reflejó diferencias significativas en la cantidad de neonatos vivos (Cuadro 3).
| Indicadores de éxito de eclosión | Valor‐W | Mann-Whitney Valor‐p |
| Neonatos vivos | 362.50 | < 0.001 |
| Neonatos muertos | 552.00 | 0.059 |
| HSD | 902.50 | 0.111 |
| HCD | 648.50 | 0.393 |
La temperatura promedio en el vivero fue 32.6°C (30.1–34°C). No obstante, el mejor ajuste de los predictores se dio con los indicadores: neonatos vivos (NV) (r2 = 40.68%, P < 0.001; Figura 1B) y huevos sin desarrollo (HSD) (r2 = 36.24%, P < 0.001; Figura 1C).
Biometría de neonatos
Los neonatos (N = 359) promediaron 34.26 ± 3.38 mm (33.34–47.70 mm) para el ancho de caparazón, mientras que para el largo se obtuvo
41.98 ± 3.33 mm (3.54–55.87 mm). Las medias de ancho de caparazón en los nidos variaron de 30.86–37.96 mm, y esta diferencia entre nidos fue significativa (Levene = 13.06, P < 0.001; ANOVA de Welch, F (11,135) = 64.49, P < 0.001). Al comparar las medias por pares (Tukey), se encontró diferencia significativa entre el 90% de los nidos. El largo de caparazón de los neonatos entre nidos varió de 37.67–46.83 mm; esta diferencia fue significativa (Levene = 12.22, P < 0.001; ANOVA de Welch, F (11,135) = 47.36, P < 0.001). La comparación por pares (Tukey) reveló que solo el 10% de los nidos en el vivero presentaron diferencia entre sí.
El peso de los neonatos promedió 15.39 ± 2.08 g, (11–20 g), mientras que el peso promedio por nido fue 12.60–19.17 g; se detectó diferencia entre nidos, (Levene = 1.28, P = 0.149; ANOVA de una vía, F (11,347) = 258.17, P < 0.001). Al comparar las medias por pares (Tukey), el 97% de los nidos presentaron diferencias significativas. El análisis de asociación entre variables biométricas de las tortugas madre y neonatos indicó correlación entre el largo del caparazón de la tortuga adulta (LCTA) y el largo promedio de los neonatos (LPCN), solamente (Pearson, r = 0.46).
Granulometría y humedad de la arena Granulometría en la playa
El 50% de las muestras de arena asociadas a los postes de referencia de la playa presentaron mayor retención en el tamiz de 0,50 mm, el resto de las muestras se retuvo mayormente en el tamiz de 0,25 mm. No se detectó diferencia significativa en la proporción observada de arena retenida en los tamices de 0.25 mm y <0.0625 mm procedentes de la zona superior. Por otro lado, en las muestras correspondientes a la zona media, solo hubo diferencia significativa en el tamiz de 0.50 mm en comparación con la proporción esperada (Cuadro 4).
| Zona superior de playa | Zona media de playa | |||||
| Tamiz (mm) | N (g) | c2 | Valor‐p | N (g) | c2 | Valor‐p |
| 0.50 | 138.90 | 6.65 | 0.036 | 113.20 | 12.90 | 0.002 |
| 0.25 | 113.80 | 0.88 | 0.643 | 145.24 | 4.46 | 0.107 |
| 0.125 | 33.57 | 7.24 | 0.027 | 34.73 | 4.32 | 0.115 |
| 0.0625 | 13.54 | 9.85 | 0.007 | 3.74 | 1.88 | 0.391 |
| <0.0625 | 0.12 | 0.09 | 0.956 | 0.05 | 0.03 | 0.985 |
Granulometría en el vivero y nidos silvestres
El 53.73% de la muestra de arena del vivero consistió en granos de 0,50 mm, mientras que el 80% de las muestras de los nidos silvestres de L. olivacea, tuvo mayor retención en el tamiz de 0,25 mm. El 90% de la arena en muestras procedentes de nidos de C. mydas resultó retenida a 0,50 mm (Figura 2). Esta distribución de proporciones entre muestras fue significativa para los tamices 0.50–0.125 mm. en las muestras de nidos silvestres de L. olivacea; sin embargo, para C. mydas no hubo diferencia entre las proporciones retenidas (Cuadro 5).
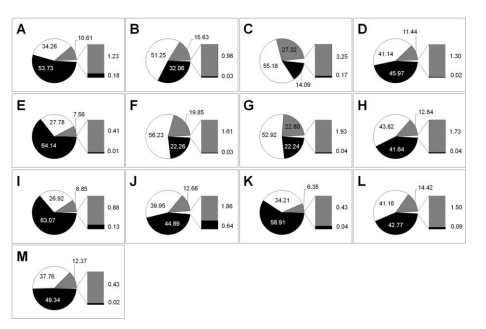
| Lepidochelys olivacea | Chelonia mydas | |||||
| Tamiz (mm) | N (g) | c2 | Valor‐p | N (g) | c2 | Valor‐ p |
| 0.50 | 200.76 | 51.59 | 0.000 | 300.62 | 7.96 | 0.158 |
| 0.25 | 284.50 | 12.82 | 0.025 | 223.81 | 4.88 | 0.431 |
| 0.125 | 104.60 | 15.42 | 0.009 | 67.29 | 4.02 | 0.547 |
| 0.0625 | 9.48 | 3.00 | 0.701 | 6.83 | 1.82 | 0.873 |
| <0.0625 | 0.30 | 0.34 | 0.997 | 0.97 | 1.73 | 0.885 |
Humedad de la arena
Posterior al secado de muestras, se detectó diferencia significativa en el contenido de agua (antes-después) de la arena procedente de distintas secciones de playa (t = 3.35, P = 0.020), vivero y nidos silvestres (vivero y nidos silvestres, t = 7.17, P < 0.001); sin embargo, no hubo diferencia entre muestras de secciones de playa o en nidos (postes, H = 5, P = 0.416; nidos, H = 12, P = 0.446).
Geomorfología de la playa
Durante el presente estudio, el oleaje provocó la formación de bermas a lo largo de la playa. El registro fotográfico histórico (2015, 2016 y 2020) indica que el proceso ha transcurrido en años anteriores con variación en ubicación y severidad de desniveles (Figura 3). Las bermas se distribuyeron, como resultantes del proceso de erosión, de forma diferencial y con menor frecuencia frente a los postes de referencia tres y cuatro.

DISCUSIÓN
En las especies sin cuidado parental, la selección del sitio para anidar es importante, ya que las características de dichos sitios afectan el desarrollo y sobrevivencia de embriones (Kamel & Mrosovsky, 2004; Quiñones et al., 2007; Booth et al., 2020). Según Garcés et al. (2020) y Garcés & Royo (2017), las tortugas L. olivacea optan por anidar en zonas media de la playa, mientras que C. mydas lo hace en la zona alta. Este patrón no se manifestó en este estudio ya que los nidos se ubicaron mayormente en zona alta y tampoco hubo diferencia en la distribución de nidos por especie. Las tortugas tienden a evitar arenas gruesas y finas, dado que bajas tasas de anidación han sido asociadas con dicho tipo de arena (Bolongaro et al., 2010). Al excavar en arena gruesa, las tortugas con frecuencia abandonan la construcción del nido, debido a que esta es poco cohesiva y las paredes de este colapsan. En contraste las arenas finas no promueven intercambio gaseoso apropiado y dificultan el proceso de emergencia de neonatos (Mortimer, 1990;Booth et al.,
2020). La distribución de nidos observada en este estudio pudo deberse, en parte, a que la arena en la zona alta de la playa consistió en una mezcla heterogénea de granos medianos, mientras que la arena de la zona media estuvo mezclada de forma más homogénea con granos finos, ya que en la zona media no hubo diferencia entre las proporciones retenidas de granos de 0.25 a <0.0625 mm.
En este estudio, la biometría del caparazón de las tortugas L. olivacea fue similar (largo y ancho) a lo encontrado en Isla Cañas (Vega & Robles, 2005) y Playa Lagarto (largo) (Garcés et al., 2020) durante los años 2002 y 2016–2017; pero el ancho de caparazón difiere del reporte previo en Playa Lagarto. El largo y ancho promedio del caparazón de C. mydas guardó similitud con el reportado para Playa Cambutal en el 2011 (González, 2014) y Playa Lagarto del 2016–2017. Esta similitud en tallas implica el aparente ingreso a Playa Lagarto de cohortes distintas, con cierto grado de reclutamiento, pero en años diferentes. Este sería el caso, dado que la talla mínima, para hembras L. olivacea maduras, de la temporada 2021–2022, fue de 60–61 cm (largo‐ancho). Cinco años antes (2016–2017), este segmento estuvo representado por hembras de 50–55 cm (largo‐ancho) en Playa Lagarto (Garcés et al., 2020). Esta temporalidad de ingreso por cohortes quizá sea un patrón cíclico para L. olivacea, considerando que la talla mínima en nuestro estudio fue igual a la reportada por Vega & Robles (2005). Este patrón se repitió en C. mydas, pero en orden inverso, donde la talla mínima (largo‐ancho) fue inferior (70–79 cm en 2021–2022) al reporte de Garcés et al. (2020) en Playa Lagarto (82–89 cm). En el presente estudio, no hubo diferencia en las tallas entre meses para ambas especies, lo que indica consistencia en los límites de talla que posiblemente caracterizan dichas cohortes por año.
En este estudio, se logró identificar hembras que ingresaron a la playa en dos y hasta tres ocasiones distintas, para anidar. Brenes et al. (2015) reportó un promedio de dos retornos por temporada para L. olivacea, coincidiendo con el reporte de Chacón et al. (2008). Aunque la reanidación es común en todas las tortugas hembra (López-Castro et al., 2004; Crean & Marshall, 2009; Lovich et al., 2015), este constituye el primer reporte de esta conducta para L. olivacea y C. mydas en Playa Lagarto, y hasta donde se conoce, del Pacifico panameño. Reanidar les permite a las tortugas parcelar el esfuerzo reproductivo, disminuyendo el impacto de factores de riesgo para las nidadas como: erosión,
inundaciones y/o depredación. De manera que, al poner varios nidos las hembras mitigan la imprevisibilidad de los ambientes, dando mejores probabilidades de sobrevivencia a nidos y neonatos durante etapas críticas (Crean & Marshall, 2009; Ekanayake et al., 2016); lo que posiblemente explicaría el patrón de reingresos observado en este estudio.
Las mediciones de temperatura del sustrato en este trabajo coinciden con los registros de Isla Cañas (Vega & Robles, 2007a). En el presente estudio las oscilaciones térmicas probablemente se debieron a las lluvias durante el mes de diciembre e inicio de la época seca. La data fue limitada, pero el registro osciló entre 30–34°C, promediando 32.6°C; temperatura dentro del rango óptimo para una proporción de sexo equilibrada (Valadez et al., 2000).
El número total de nidos reubicados y por especie superó la cantidad reportada por Garcés & Royo (2017) en Mata Oscura y por Garcés et al. (2020) en Playa Lagarto. No obstante, el éxito de eclosión observado en el presente trabajo fue inferior al estudio previo en Playa Lagarto, incluso el vivero en Mata Oscura registró un porcentaje mayor al de este estudio. Los predictores del éxito de eclosión disponibles: tiempo hasta eclosión (TE), cantidad de huevos sembrados (CHS) y especie no explican, en su totalidad, la variabilidad observada en el análisis de regresión. A pesar de contar con más nidos y huevos por nido, el éxito de eclosión en el vivero de Playa Lagarto fue bajo. El saqueo de huevos y la mortalidad de neonatos (2.91%) por si solos tampoco explican el bajo éxito de eclosión; sin embargo, la variabilidad del manejo en reubicación por voluntarios (profundidad de nidos, tiempo hasta la siembra y manipulación de huevos) posiblemente introduce un factor de incertidumbre que debe explorarse en futuros estudios, en especial para tortugas verdes, con solo 50% de éxito de eclosión.
El largo, ancho del caparazón y el peso de neonatos fueron similares a los reportados para Isla Cañas por Vega & Robles, (2007b). El análisis biométrico arrojó variabilidad entre nidos, coincidiendo con el reporte de Isla Cañas, exceptuando, el ancho del caparazón, en el cual Vega & Robles (2007a) no encontraron diferencia. Esta variabilidad esta explicada por efectos maternales entre la talla de la tortuga adulta y el tamaño de los neonatos (Parker & Begon, 1986; Hays et al., 1993;
López-Castro et al., 2004;Quiñones et al., 2007). Este es el caso en nuestro estudio debido a la correlación (positiva) que se detectó entre el largo del caparazón de las tortugas adultas y el largo del caparazón promedio de los neonatos.
El proceso de erosión costera causa formación de barreras paralelas a la playa con desniveles abruptos, llamadas bermas (Payo et al., 2008; Rivera-Solís, 2021). Dichos desniveles pueden impactar negativamente la actividad de las tortugas marinas, debido a que obstaculizan el acceso a sitios de anidación (Sunamura, 1989; Bolongaro et al., 2010). Posiblemente la formación de bermas frente a la playa también influenció la distribución de nidos, ya que durante los monitoreos se pudo encontrar rastros de tortuga frente a bermas, pero eventualmente dichos rastros indicaban retorno al mar sin deposición de huevos. Este escenario es similar al reportado por Witherington et al. (2011) y Fujisaki & Lamont (2016), donde las barreras para el ingreso a sitios de anidación modificaron la conducta de las tortugas. En este estudio, la sección de playa asociada al tercer y cuarto poste de guía acumuló la mayor cantidad de nidos, posiblemente porque en esta zona las bermas fueron infrecuentes. Así, las tortugas que llegaban a esta parte de la playa lograban completar el proceso de anidación con mayor frecuencia, lo que explicaría en parte el patrón de distribución observado.
CONCLUSIONES
La distribución de nidos depende de las características de la arena y erosión en la playa. La mayoría de las tortugas anidó en la zona alta de la playa y secciones asociadas con accesos libres de bermas. La biometría comparada de los años 2017 y 2021 sugiere el ingreso de cohortes específicas por temporada de anidación. Este es el caso ya que no hubo diferencia en la talla de las tortugas entre meses. Se detectó efectos maternales en la biometría de los neonatos, posiblemente asociada al tamaño de la tortuga madre. Este estudio presenta el primer reporte de reanidación confirmada de L. olivacea y C. mydas en Playa Lagarto. Las tortugas expresan esta conducta posiblemente en función al riesgo de depredación y características de la playa para optimizar el esfuerzo reproductivo. Existe la necesidad de desarrollar métodos que aseguren que la incubación de huevos de tortuga en viveros sea una herramienta de conservación más efectiva. Esta necesidad es evidente
ya que el vivero no fue efectivo en proteger las nidadas del saqueo en el área de estudio. La elección del sitio del vivero puede mejorar el éxito de nidos artificiales al estudiar la granulometría y composición de la arena. El éxito de eclosión en este estudio, respecto a otros viveros fue bajo, a pesar de que se contó con más nidos y huevos por nido. El manejo en la reubicación de nidos debe revisarse, ya que se ha demostrado que la manipulación de huevos y profundidad inapropiados puede tener efectos adversos en el desarrollo de embriones y por ende en el éxito de eclosión.
Agradecimientos
Este proyecto fue apoyado parcialmente por la Fundación Tortugas Pedasí, Azuero Sostenible, el Programa de Naciones Unidas para el Desarrollo (PNUD) SGP, Programa de Pequeñas Donaciones del FMAM (PPD) y CREHO (Centro Regional para el hemisferio occidental) RAMSAR. Nuestro agradecimiento se extiende a los revisores que contribuyeron comentarios para la mejora de versiones previas del manuscrito.
REFERENCIAS
Ariano-Sánchez, D., Muccio, C., Rosell, F. & Reinhardt, S. (2020). Are trends in Olive Ridley sea turtle (Lepidochelys olivacea) nesting abundance affected by El Niño Southern Oscillation (ENSO) variability? Sixteen years of monitoring on the Pacific coast of northern Central America. Glob. Ecol. Conserv. 24(2020): p. e01339. DOI:10.1016/j.gecco.2020.e01339.
Baillie, J. & Groombridge, B. (1996). 1996 IUCN red list of threatened animals. Biol. Conserv. Gland, Switzerland: International Union for Conservation ot Nature and Natural Resources.
Bolongaro, A., Márquez, A. Z., Torres, V. & García, A. (2010). Vulnerabilidad de sitios de anidación de tortugas marinas por efectos de erosión costera en el estado de Campeche. in Botello. A. V, Villanueva. S., Gutiérrez. J., & Rojas. J.L. (eds) Vulnerabilidad de las zonas costeras mexicanas ante el cambio climático. 1st edn. Campeche, Mexico: Universidad Autónoma de Campeche pp. 73–96.
Bolten, A. B. (2000). Técnicas para la medición de tortugas marinas. in Eckert. K.L., Bjorndal. K.A., Abreu-grobois. F.A., & Donnelly. M. (eds) Técnicas de investigación y manejo para la conservación de tortugas marinas. 1st edn. Pennsylvania, USA: IUCN Marine Turtle Specialist Group pp. 126–131.
Booth, D. T., Archibald-Binge, A. & Limpus, C. J. (2020). The effect of respiratory gases and incubation temperature on early stage embryonic development in sea turtles. PLoS One 15(12): pp. 1–12. DOI:10.1371/journal.pone.0233580.
Brenes, O., Bonilla, L., Bonilla, A. & Vega, A. (2015). Características de la anidación de, Lepidochelys olivacea (Testudinata: Cheloniidae) entre el 2010 y 2012 en Playa Tortuga Ojochal de Osa, Puntarenas, Costa Rica. Rev. Biol. Trop. 63(1): pp. 339–349.
Chacón, D., Dick, B., Harrison, E., Sarti, L. & Solano, M. (2008). Manual sobre técnicas de manejo y conservación de las tortugas marinas en playas de anidación de Centroamérica. 1st edn. San José, Costa Rica: Secretaria Pro Tempore de la Convención Interamericana para la Protección y Conservación de las Tortugas Marinas (CIT).
Chassin-Noria, O., Abreu-Grobois, A., Dutton, P. H. & Oyama, K. (2004). Conservation genetics of the east Pacific Green Turtle (Chelonia mydas) in Michoacan, Mexico. Genetica 121(2): pp. 195–206. DOI:10.1023/B:GENE.0000040394.47843.e4.
Crean, A. J. & Marshall, D. J. (2009). Coping with environmental uncertainty: Dynamic bet hedging as a maternal effect. Philos. Trans. R. Soc. B Biol. Sci. 364(1520): pp. 1087–1096. DOI:10.1098/RSTB.2008.0237.
Ekanayake, E. M. L., Kapurusinghe, T., Saman, M. M., Rathnakumara, D. S., Samaraweera, P. & Rajakaruna, R. S. (2016). Reproductive output and morphometrics of Green Turtle, Chelonia mydas nesting at the Kosgoda rookery in Sri Lanka. Ceylon J. Sci. 45(3): p. 103. DOI:10.4038/CJS.V45I3.7406.
Fonseca, L. G., Murello, G. A., Guadamúz, L., Spínola, R. M. & Valverde, R. A. (2009). Downward but stable trend in the abundance of arribada Olive Ridley sea turtles (Lepidochelys olivacea) at Nancite Beach, Costa Rica (1971-2007). Chelonian Conserv. Biol. 8(1): pp. 19– 27. DOI:10.2744/CCB-0739.1.
Frazer, N. B. (1992). Sea Turtle Conservation and Halfway Technology. Conserv. Biol. 6(2): pp. 179–184. DOI:10.1046/J.1523- 1739.1992.620179.X.
Fujisaki, I. & Lamont, M. M. (2016). The effects of large beach debris on nesting sea turtles. J. Exp. Mar. Bio. Ecol. 482: pp. 33–37. DOI:10.1016/j.jembe.2016.04.005.
Garcés, H., Batista, A. B. & Sánchez, N. (2020). Caracterización de sitios de anidación de tortugas marinas en Playa Lagarto, Pedasí, Provincia de Los Santos, Panamá. Tecnociencia 22(2): pp. 259–277. DOI:10.48204/j.tecno.v22n2a14.
Garcés, H. & Royo, P. (2017). Éxito de Incubación en vivero de Tortuga Lora en Playa Mata Oscura, Provincia de Veraguas, Panamá. Rev. Científica la Univ. Marítima Int. Panamá 3(1): pp. 18–22.
García, A., Ceballos, G. & Adaya, R. (2003). Intensive beach management as an improved sea turtle conservation strategy in Mexico. Biol. Conserv. 111(2): pp. 253–261. DOI:10.1016/S0006-
Georges, A., Limpus, C. J. & Parmenter, C. J. (1993). Natural history of the Chelonia. In: Fauna of Australia - Amphibia and Reptilia. in Glasby, C.J., Ross. G.J.B., & Beesley. P.L. (eds) Fauna of Australia, Amphibia & Reptilia, Canberra, Australia: Australian Government Publishing Service pp. 1–18.
González, A. (2013). Caracterización física y biológica de la playa de anidación de tortugas marinas de Mata Oscura, Veraguas, Panamá. Universidad Marítima Internacional de Panamá.
González, L. (2014). Descripción y biometría de las especies de tortugas marinas en playas de anidación de Cambutal, Los Santos Panamá. Universidad Marítima Internacional de Panamá.
Hays, G. C., Adams, C. R. & Speakman, J. R. (1993). Reproductive investment by Green Turtles nesting on Ascension Island. Can. J. Zool. 71(6): pp. 1098–1103. DOI:10.1139/z93-149.
Heithaus, M. R., Wirsing, A. J., Thomson, J. A. & Burkholder, D. A. (2008). A review of lethal and non-lethal effects of predators on adult marine turtles. J. Exp. Mar. Bio. Ecol. 356(1–2): pp. 43–51. DOI:10.1016/J.JEMBE.2007.12.013.
Kamel, S. J. & Mrosovsky, N. (2004). Nest site selection in Leatherbacks, Dermochelys coriacea: Individual patterns and their consequences. Anim. Behav. 68(2): pp. 357–366. DOI:10.1016/J.ANBEHAV.2003.07.021.
Kenny, A. J. & Sotheran, I. (2013). Characterising the physical properties of seabed habitats. in Eleftheriou. A. (ed.) Methods for the Study of Marine Benthos: Fourth Edition. 4th edn. Crete, Greece: Blackwell Scientific Publications [for the] International Biological Programme, London pp. 47–96. DOI:10.1002/9781118542392.
López-Castro, M. C., Carmona, R. & Nichols, W. J. (2004). Nesting characteristics of the Olive Ridley turtle (Lepidochelys olivacea) in Cabo Pulmo, southern Baja California. Mar. Biol. 145(4): pp. 811–820. DOI:10.1007/S00227-004-1359-X.
Lovich, J. E., Ennen, J. R., Yackulic, C. B., Meyer-Wilkins, K., Agha, M., Loughran, C., Bjurlin, C., Austin, M. & Madrak, S. (2015). Not putting all their eggs in one basket: bet-hedging despite extraordinary annual reproductive output of desert tortoises. Biol. J. Linn. Soc. 115(2): pp. 399–410. DOI:10.1111/BIJ.12505.
Marcovaldi, M. A. & Thomé, J. C. A. (2000). Reducción de las Amenazas a las Tortugas. in Eckert. K.L., Bjorndal. K.A., Abreu- grobois. F.A., & Donnelly. M. (eds) Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. 1st edn. Pennsylvania, USA: IUCN Marine Turtle Specialist Group pp. 187–191.
Meylan, A. B. & Meylan, P. A. (2000). Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. in Eckert. K.L., Bjorndal. K.A., Abreu-grobois. F.A., & Donnelly. M. (eds) Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. 1st edn. Pennsylvania, USA: IUCN Marine Turtle Specialist Group pp. 3–5.
Mortimer, J. A. (1990). The influence of beach sand characteristics on the nesting behavior and clutch survival of Green Turtles (Chelonia mydas). Copeia 1990(3): pp. 802–817. DOI:10.2307/1446446.
Parker, G. A. & Begon, M. (1986). Optimal egg size and clutch size: effects of environment and maternal phenotype. Am. Nat. 128(4): pp. 573–592. DOI:10.1086/284589.
Payo, A., Kobayashi, N., Muñoz-Pérez, J. & Yamada, F. 2008. Predictibilidad de la formación de escarpe en playas de arena en un tanque multidireccional de oleaje. Ciencias Mar. 34(1): pp. 45–54. DOI:10.7773/cm.v34i1.1265.
Pinto, I. & Yee, J. (2011). Diagnóstico de las Áreas Marinas Protegidas y de las Áreas Marinas para la Pesca Responsable en el Pacífico Panameño. 1st edn. Fundación MarViva. Panamá.
Quiñones, L., Patiño-Martínez, J. & Marco, A. (2007). Factores que influyen en la puesta, la incubación y el éxito de eclosión de la Tortuga Laúd, Dermochelys coriacea, en La Playona, Chocó, Colombia. Rev. española Herpetol. (21): pp. 5–17.
Reavis, J. L., Rojas-cañizales, D., Mejías-balsalobre, C., Naranjo, I., Arauz, R. & Senko, J. F. (2022). Dynamics of human take and animal predation on sea turtle nests in Northwest Costa Rica. PeerJ (10:e12925): pp. 1–16. DOI:10.7717/peerj.12925.
Rivera-Solís, J. A. (2021). Depósitos eólicos del trópico húmedo: caso de la franja marino-costera del este de la Península de Azuero, Panamá. Rev. Geográfica América Cent. 1(66): pp. 99–125. DOI:10.15359/rgac.66-1.4.
Rueda-Almonacid, J. V. et al. (2007). Las tortugas y los crocodilianos de los paises andinos del trópico. 1st edn. Russell A. Mittermeier & A. Rylands. Bogotá, Colombia: Conservación Internacional.
Sokal, R. R. & Rohlf, F. J. (1987). Biostatistics. 2nd edn. USA, New York: Francise & Co.
Sosa-Cornejo, I. et al. (2021). Nesting trends of Olive Ridley sea turtles, Lepidochelys olivacea (Testudinata: Cheloniidae) on two beaches in Northwestern Mexico after 30 and 40 years of conservation. Rev. Biol. Trop. 69(3): pp. 1124–1137. DOI:10.15517/RBT.V69I3.46490.
Sunamura, T. (1989). Sandy beach geomorphology elucidated by laboratory modeling. in Lakhan. V.C. & Trenhaile. A.S. (eds) Elsevier Oceanography Series. 1st edn. Ontario, Canada: Elsevier pp. 159–213. DOI:10.1016/S0422-9894(08)70126-0.
Tanabe, L. K., Steenacker, M., Rusli, M. U. & Berumen, M. L. (2021). Implications of nest relocation for morphology and locomotor performance of Green Turtle (Chelonia mydas) hatchlings. Ocean Coast. Manag. 207. DOI:10.1016/j.ocecoaman.2021.105591.
Troëng, S. & Rankin, E. (2005). Long-term conservation efforts contribute to positive Green Turtle Chelonia mydas nesting trend at Tortuguero, Costa Rica. Biol. Conserv. 121: pp. 111–116. DOI:10.1016/j.biocon.2004.04.014.
Valadez, C., Silva, F. & Hemández, S. (2000). Proporción sexual en crías de la tortuga marina Lepidochelys olivacea, producida en corral de incubación en la playa de anidación La Gloria, Jalisco, Mexico. Boletín del Cent. Investig. Biológicas 34(3): pp. 305–313.
Vega, A. & Robles, Y. (2005). Descripción del proceso de anidación y biometría de hembras, huevos y nidos en Tortuga Golfina Lepidochelys olivacea (Eschscholtz, 1829) en Isla Cañas, Pacifico Panameño. Tecnociencia 7(2): pp. 43–55.
Vega, A. & Robles, Y. (2007a). Determinación del porcentaje de emergencia de neonatos en Tortuga Golfina Lepidochelys olivacea (Eschscholtz, 1892) en Isla Cañas, Pacífico Panameño. Tecnociencia 9(2): pp. 19–30.
Vega, A. & Robles, Y. (2007b). Evaluación del manejo de la Tortuga Golfina (Lepidochelys olivacea) en Isla Cañas, Pacífico Panameño. Tecnociencia 9(1): pp. 27–40.
Witherington, B., Hirama, S. & Mosier, A. (2011). Sea turtle responses to barriers on their nesting beach. J. Exp. Mar. Bio. Ecol. 401: pp. 1–6. DOI:10.1016/j.jembe.2011.03.012.
Xavier, R., Barata, A., Cortez, L. P., Queiroz, N. & Cuevas, E. (2006). Hawksbill turtle (Eretmochelys imbricata, Linnaeus 1766) and Green Turtle (Chelonia mydas, Linnaeus 1754) nesting activity (2002-2004) at El Cuyo beach, Mexico. Amphib. Reptil. 27(4): pp. 539–547. DOI:10.1163/156853806778877077.
Sifuentes-Romero, I., Tezak, B. M., Milton, S. L. & Wyneken, J. (2018). Hydric environmental effects on turtle development and sex ratio. Zoology 126: pp. 89–97. DOI:https://doi.org/10.1016/j.zool.2017.11.009.

