



Artículos científicos
REMOCIÓN DE LOS COLORANTES ORGÁNICOS AZOICOS ROJO CONGO Y VIOLETA DE METILO EN SOLUCIONES ACUOSAS USANDO NANOPARTÍCULAS DE HIERRO CEROVALENTE RECUBIERTAS CON Solanum mammosum L.
REMOVAL OF ORGANIC AZOIC DYES CONGO RED AND METHYL VIOLET IN WATER SOLUTIONS USING ZEROVALENT IRON NANOPARTICLES COATED WITH Solanum mammosum L.
infoANALÍTICA
Pontificia Universidad Católica del Ecuador, Ecuador
ISSN: 2602-8344
ISSN-e: 2477-8788
Periodicidad: Semestral
vol. 11, núm. 2, 2023
Recepción: 30 Septiembre 2022
Aprobación: 10 Mayo 2023
Autor de correspondencia: vcse691@gmail.com

Resumen: El uso de colorantes azoicos puede causar un sin número de enfermedades alérgicas e incluirse como sustancias cancerígenas. En este estudio se analizó el uso de nanopartículas cerovalentes de hierro recubiertas con un extracto acuoso vegetal de Solanum mammosum L. (8,9±2,8 nm) sobre los colorantes rojo Congo y violeta de metilo en agua. La metodología constó del acondicionamiento del proceso de remoción usando como control nanopartículas de hierro cerovalentes sin recubrimiento (24,8±6,1 nm). Se obtuvieron los espectros de absorción UV-Vis de los colorantes y se determinó las condiciones óptimas de remoción en cuanto a cantidad de adsorbente (0 a 200 mgL-1), pH (3, 5, 9 y 11) y tiempo de contacto por agitación (0 a 30 min). Además, las nanopartículas obtenidas se caracterizaron por microscopía de transmisión electrónica, microscopía de barrido electrónico, difracción de rayos X y espectrofotometría de infrarrojos. Como resultados se obtuvo que el porcentaje de remoción del colorante rojo Congo aumentó de 94,31 a 99,29% y violeta de metilo de 96,28 a 99,47 % usando FeNPs-S. mammosum L. Se concluye que las nanopartículas de hierro cerovalentes recubiertas con un extracto ve- getal, son una alternativa económica y amigable con el medio ambiente en procesos de descontaminación de colorantes orgánicos azoicos disueltos en agua.
Palabras clave: colorantes azoicos, hierro cerovalente, nanopartículas, mammosum, remoción, rojo Congo, violeta de metilo.
Abstract: The usage of azo dyes can induce a variety of allergy disorders and may even be carcinogenic. The effect of zerovalent iron nanoparticles coated with an aqueous plant extract of Solanummammosum L. (8.9±2,8 nm) on Congo red and methyl violet dyes in water was investigated in this work. The approach included conditioning the removal process with zerovalent iron nanoparticles without coating (24.8±6.1 nm). The UV-Vis absorption spectra of the dyes were obtained, and the best removal parameters in terms of adsorbent quantity (0 to 200 mgL-1), pH (3, 5, 9, and 11), and contact time by agitation were identified (0 to 30 min). Moreover, the nanoparticles were examined using transmission electron microscopy, scanning electron microscopy, X-ray diffraction and in-fared spectroscopy. Because of utilizing of FeNPs-S. mammosum L., the comparative percentage of Congo red dye removal increased from 94.31 to 98.84% and methyl violet removal from 96.28 to 99.90%. It is concluded that zerovalent iron nanoparticles coated with a plant extract are a cost-effective and ecologically friendly option for organic azo dye decontamination operations in water.
Keywords: azoic dyes, iron zerovalent, nanoparticles, mammosum, removal, Congo red, methyl violet.
INTRODUCCIÓN
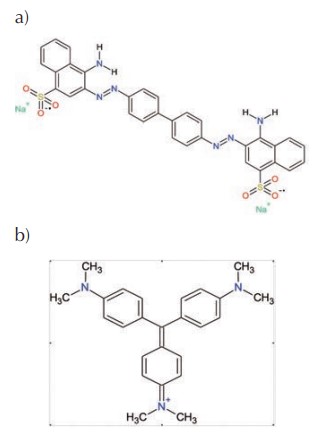
Con el rápido crecimiento de las diferentes industrias en el mundo, la demanda de colorantes ha aumentado en los últimos años. Actualmente más de 100.000 colorantes circulan en el mercado con una producción anual total de alrededor de 7x105 toneladas (Varjani et al., 2021). El colorante rojo Congo (CR, por sus siglas en inglés) fue el primero en descubrirse en 1884, y desde entonces ha sido ampliamente usado debido a su fácil aplicación sobre cualquier tipo de superficies sin la necesidad de someterse a un pretratamiento con una sal metálica (King, 2007). Sin embargo, este colorante se metaboliza en benzidina, que es un compuesto orgánico carcinogénico y mutagénico, por lo ha sido retirado de la gama de fabricación de muchos productores de colorantes orgánicos (Chattopadhyay, 2011). Su estructura química (Figura 1a), está conformada por la sal sódica ácido naftalenosufónico y su apariencia es de un polvo café rojizo. Controversialmente, se lo sigue utilizando extensamente en distintas aplicaciones como guía de ondas, sensor óptico, tintas, pesticida, entre otros. Adicionalmente, las principales aplicaciones en el campo de la biología, incluyen la detección de bacterias que producen desórdenes protéicos, desórdenes dermatológicos, enfermedades neurodegenerativas entre ellas el Alzheimer (Sabnis, 2007). A través de distintos estudios mediante la administración oral, intravenosa y por inhalación, se ha determinado su toxicidad en humanos (Deichman & Gerarde, 1969), animales (Rosendal & Bernheimer, 1952) y otras especies de mamíferos. De acuerdo con otras investigaciones se lo considera un colorante de alto peligro ya que presenta carcinogenicidad (Kauppinen et al., 2003) y mutagenicidad asociado a un riesgo latente para mujeres embarazadas y fetos en desarrollo (Brown & Dietrich, 1983).
Por otro lado, violeta de metilo (MV, por sus siglas en inglés) es el nombre que reciben un conjunto de colorantes orgánicos catiónicos azoicos (Figura 1b), los cuales conforme al número de las sustituciones de grupos metilo en el grupo amino secundario, pueden presentar diferentes tonalidades (Herbst & Hunger, 2005). Esta propiedad permite que el MV sea usado en biología con fines de tinción. Este colorante también se usa en la industria farmacéutica, textil, cosmética, de tintas de impresión e inclusive de tatuajes (Sabnis, 2010). Su uso puede producir graves alteraciones en la salud, como por ejemplo, en seres humanos se absorbe a través de la piel causando lesiones a las vías respiratorias, diarrea, dolor, vómitos, dolor de cabeza y mareos (Ofomaja, 2008). Además, de ser mutagénico y carcinogénico (Crini, 2006).
La nanotecnología se ha convertido en una herramienta que ofrece productos versátiles, que aportan con soluciones para este tipo de problemas de contaminación ambiental (R. Liu et al., 2011). Uno de ellos son las nanopartículas de hierro Cero Valentes (FeNps) (Zhao et al., 2008), las cuales presentan propiedades magnéticas y una elevada relación de superficie/volumen (Shu et al., 2010). Se han descubierto un sin fin de aplicaciones de las FeNps dentro del campo ambiental, debido a su alta capacidad de adsorción y bajo costo de producción (Alazaiza et al., 2021). Existe un vasto número de publicaciones sobre el uso de FeNPs para la adsorción de colorantes, entre los cuales podemos encontrar el azul ácido (Flores-Rojas et al., 2019), entre otros (Li et al., 2021). El reductor químico predominante para la síntesis de FeNPs es el borohidruro de sodio (Liu et al., 2015), sin embargo, existe una alternativa amigable con el medio ambiente al usar extractos vegetales (Wanaki et al., 2023). Solanum mammosum L. es una especie nativa del Ecuador que se encuentra en las regiones costeras y andinas del país, entre 0 y 500 metros sobre el nivel del mar. El nombre común (teta de vaca) alude a las protuberancias únicas en forma de pezón en la base de los frutos de la planta, que son utilizadas por las poblaciones locales para matar pequeños artrópodos (Vega Orcacitas, 2001). Además, se ha reportado el uso de su fruto como biocida de la especie Aedes aegypti y la elevada actividad antioxidante de sus hojas, por ejemplo en el estudio desarrollado por Pilaquinga et al. (2019), se usó el extracto acuoso tanto del fruto como de las hojas para la síntesis de nanopartículas de plata. Por otro lado, algunas investigaciones han reportado la síntesis de otro tipo de nanopartículas (CuO y ZnO) usando extractos de otras especies de la familie Solanaceae (Ramesh et al., 2015; Ullah et al., 2017), sin embargo, éstas no incluyen estudios de la síntesis de FeNPs o su aplicación en el campo de la remoción de colorantes.
Consecuentemente, el objetivo de este estudio fue emplear FeNps usando el extracto acuoso de las hojas de S. mammosum L. y FeNPs sin recubrimiento usadas como control, para emplearlas en la remoción de rojo congo y violeta de metilo di- sueltos en soluciones acuosas.
MATERIALES Y MÉTODOS
Síntesis de nanopartículas de hierro cerovalente
La síntesis de FeNPs sin recubrimiento usadas como control, se realizó a partir de la reducción del cloruro de hierro (III) (FeCl3) al 99,9 % de la marca Fisher Scientific con borohidruro de sodio (NaBH4) al 99,9 % de la marca Merck, siguiendo el procedimiento optimizado de Saltos et al. (2019). Se empleó 30 mL de FeCl3 0,6 M disuelta en 30 mL de una solución de etanol al 83,3 %. Se añadió NaBH4 0,8 M gota a gota y se agitó a una velocidad de 300 rpm durante 30 min, bajo atmósfera inerte de helio. Para recuperar las nanopartículas se empleó un superimán de NdFeB (Supermagnete) y se realizaron tres lavados con etanol absoluto (Merck) y agua desionizada.
Síntesis de FeNPs-S. mammosum L.
Para la preparación del extracto, las hojas se secaron a 25°C durante cinco días antes de ser pulverizadas. La concentración óptima del extracto fue de 1 g en 20 mL de agua desionizada y se obtuvo mediante agitación magnética por una hora a 60°C. El extracto acuoso se filtró al vacío utilizando papel filtro marca WhatmanTM 41 (GE Healthcare) y se mantuvo a 4°C. Para la síntesis de FeNPs-S. mammosum L. se empleó el método sugerido por Abdelfatah y colaboradores (2021). En un Erlenmeyer se añadieron 10 mL de extracto de S. mammosum L. a una solución de 5 mL de FeCl3 0,05M. Se agitó a temperatura ambiente a una velocidad de 400 rpm durante 3 horas.
Caracterización de nanopartículas
Para evaluar el tamaño y la morfología de las FeNPs, se usó un microscopio electrónico de transmisión (MET) de marca FEI, modelo Tecnai Spirit Twin con filamento de LaB6 operando a 80kV equipado con una cámara Eagle 4k HR. 5 µL de la muestra resuspendida en etanol puro se depositó sobre una rejilla de cobre cubierto de Formvar/Carbono de malla 300 para microscopía electrónica de transmisión.
Además, se realizó un mapeo elemental para verificar la presencia de hierro. Esto se realizó en la cámara de muestras del microscopio electrónico de barrido (MEB) utilizando el detector de energía dispersiva de rayos X (EDS, por sus siglas en inglés) de marca Bruker, modelo Xflash® 6- 30 con una resolución de 123 eV in Mn Kα.
La estructura cristalina de las FeNPs se estudió mediante difracción de rayos X (DRX) en un Difractómetro de Marca PANalytical, modelo Empyrean, configuración de Bragg–Bren- tano con un tubo de rayos X de cobre, operando a 45kV y 40 mA.
Remoción de colorantes orgánicos rojo Congo y violeta de metilo
La remoción de colorantes orgánicos en agua se ejecutó mediante el protocolo propuesto por Saltos et al. (2019). Se inició preparando una solución stock de 75 ppm de CR y una solución stock de 25 ppm de MV. Se estudió el efecto de la concentración de nanopartículas en la remoción del colorante, del pH y del tiempo de contacto de las FeNPs con muestras sintéticas acuosas de colorantes en un ensayo realizado por triplicado. Para esto se colocó 10 mL de la solución stock de cada colorante en 5 tubos de ensayo y se añadieron las FeNPs con concentraciones de 25, 50, 100, 150 y 200 mg L-1.Se homogeneizó cada tubo utilizando un vórtex modelo Genie2 de la marca Daigger. Para estudiar el efecto del pH se añadió nuevamente 10 mL de cada solución stock de los colorantes en 5 tubos de ensayo; y se ajustó el pH utilizando dos soluciones de HCl 0,1 M y NaOH 0,1 M. Los ensayos fueron efectuados a pH: 3, 5, 7, 9 y 11, y se utilizó el vórtex para homogenizar las muestras. Una vez concluida la homogenización las muestras reposaron durante 30 min. Se tomaron alícuotas de 2 mL cada 10 min, las mismas que fueron analizadas en un espectrofotómetro UV- Visible marca Agilent Technologies Cary 60. El precipitado decantado de cada muestra fue analizado con un espectrofotómetro de infrarrojo FTIR- ATR.
Concentración residual de rojo Congo y violeta de metilo
A tiempos de contacto de 10, 20 y 30 min se determinó la concentración remanente de los colorantes CR y MV utilizando el espectrofotómetro UV-Vis. La eficiencia del ensayo de remoción se calculó mediante la Ec. (1):
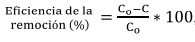 (1)
(1)Donde C0 es la concentración inicial del colorante y C es la concentración final.
Para el análisis por infrarrojo de remoción de los colorantes se utilizó el espectrofotómetro de infrarrojo FTIR- ATR marca Perkin Elmer, modelo Spectrum BX.
RESULTADOS
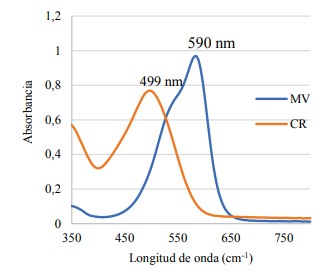
En la Figura 2, se muestran los espectros UV-Vis de los colorantes CR y MV.
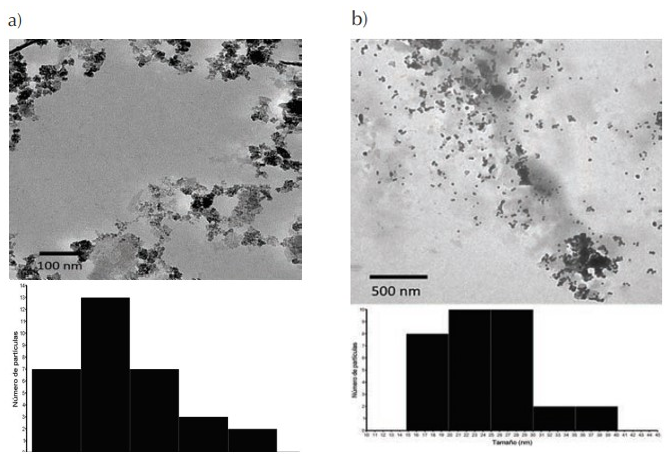
En la Figura 3 se presentan las micrografías MET de las FeNPs sin recubrimiento (a) y con recubrimiento de S. mammosum L. (b).
En la Figura 4, se observa la imagen del mapeo elemental realizado para el elemento Hierro de FeNPs-S. mammosum L.

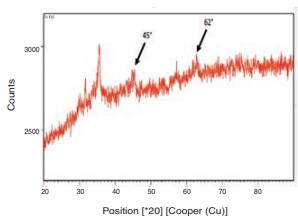
En la Figura 5, se muestra el difractograma XRD de FeNPs-S. mammosum L.
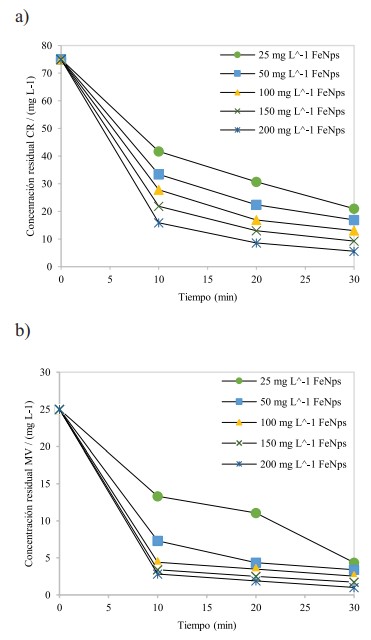
Respecto al estudio de remoción de CR y MV, para realizar la comparación del porcentaje de remoción y cantidad de colorantes adsorbidos con FeNPs-Solanum mammosum L., se determinó la cantidad de nanopartículas (adsorbente), tiempo de agitación y pH usando como blanco a FeNPs. En la Figura 6, se observan los resultados obtenidos utilizando de 25 a 200 mg de FeNPs con tiempos decontacto que variaron de 0 a 30 min para CR (a) y MV (b).
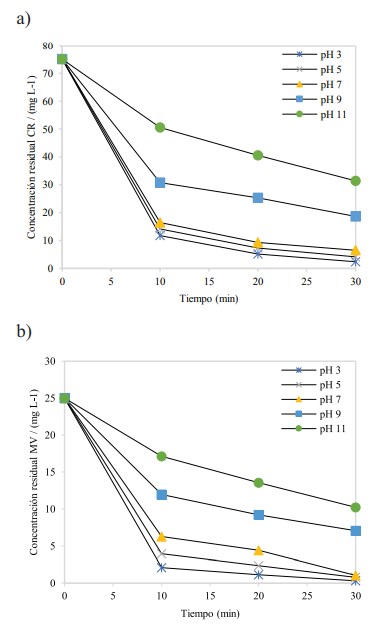
En la Figura 7 se muestra el estudio de pH usando FeNPs tanto para CR (a) como MV (b).
Una vez optimizadas las mejores condiciones para el ensayo con FeNPs, se comparó el uso de 200 mg L-1 de FeNPs-S. mammosum L., tiempo de agitación hasta 30 min y pH 3. En la Figura 8, se muestra el porcentaje de remoción de FeNPs-S. mammosum L. con CR (a) y MV (b)
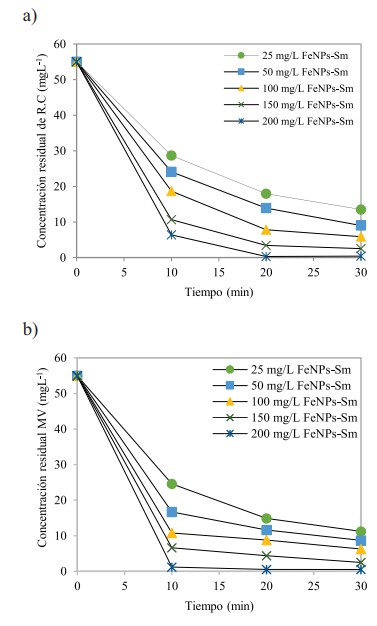
Mediante la Ec. (1), se determinó que el porcentaje de remoción con FeNPs fue 94,31 % para el CR y 96,28% para MV. Mientras que usando FeNPs-S. mammosum L. fue del 99,29% para CR y 99,47% para MV.
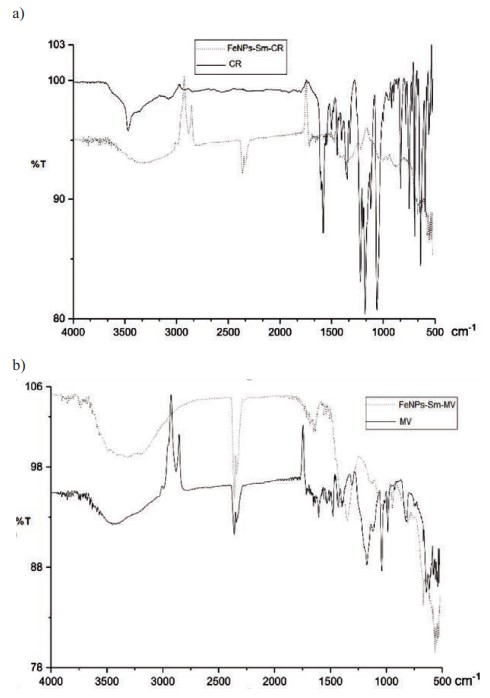
Para comprobar el proceso de remoción, por espectrofotometría de infrarrojos (FT-IR) se obtuvieron los espectros IR de FeNPs-S. mammosum L. con CR (a) y MV (b), mostrandos en la Figura 9.
DISCUSIÓN
Los colorantes azoicos CR y MV fueron analizados por espectrofotometría UV-Vis. Los máximos de absorción corresponden a 499 nm para CR y 590 nm para MV (Figura 2); valores que concuerdan con lo reportado en la literatura.
El tamaño obtenido de FeNPs sin recubrimiento fue 24,8 +- 6,1 nm y para FeNPs-S. mammosum L. de 8,9 +- 2,8 nm (Figura 3 a y b,respectivamente). Por otro lado, el mapeo elemental mostró la presencia de hierro en las muestras de FeNPs-S. mammosum L. (Figura 4). Además, en la Figura 5 se muestran picos de difracción aproxi- madamente a 2θ= 45° y 62°. Singhal et al. (2012) mencionan que estos picos de difracción corresponden a Fe0, evidenciando la formación de FeNPs-S. mammosum L. La caracterización concuerda con varios estudios que afirman que los extractos funcionan como agentes de recubrimiento y estabilización del tamaño de las nanopartícula (Puthukkara P et al., 2021; Wanakai et al., 2023).
Respecto a los ensayos de remoción usando como control FeNPs, se observa en la Figura 6, que mientras mayor es la concentración de FeNPs (200 mgL-1) y tiempo de contacto (30 min), el proceso de adsorción es mayor; dichos resultados concuerdan con los obtenidos por Jha et al. (2020).
En la Figura 7, se observa que las mejores codiciones de remoción se obtienen a pH 3. El efecto del pH inicial es crucial, ya que la eficiencia de eliminación de colorante varía de aprox. 20 % (en condiciones básicas) a casi 100 % (en condiciones ácidas). No obstante, en condiciones ácidas el pH de la solución sobrenadante aumenta con el tiempo, mientras que permanece casi constante (o disminuye ligeramente) en condiciones básicas. Este efecto concuerda por el análisis realizado por Freyria y colaboradores (Freyria et al., 2017).
En la Figura 8, se muestra la comparación de remoción de FeNPs-S. mammosum L. Se observa que para CR y MV la remoción fue mayor al 98% desde los 10 min, superando a los porcentajes obtenidos solamente con FeNPs-sin recubrimiento. Un estudio similar llevado a cabo por Khashij et al. (2020), logró una eficiencia máxima de eliminación del colorante negro reactivo 5 del 99,6 % a pH 4 y a una dosis superior de FeNPs sintetizadas con el extracto de Thymus vulgaris de 600 mg/L y tiempo de contacto de 5 min. Por otro lado, en el estudio de Abdelfatah et al. (2021) obtuvo una eficiencia máxima de 96,8 % al remover azul de metileno a pH 6 y 25 °C usando FeNPs sintetizadas con el extracto de las semillas de Ricinus Communis. Otras investigaciones igualmente empleando FeNPs sintetizadas por química verde obtuvieron porcentajes de remoción ligeramente superiores al 95 % durante tiempos mayores a los 30 min para remover naranja de metilo (Ebrahiminezhad et al., 2018), rodamina-B (Le et al., 2022) o verde ácido 25 (Shojaei & Shojaei, 2017).
En los espectros IR del colorante puro CR (Figura 9a), se presenta el pico más representativo del enlace azo N=N a 1582,94 cm-1. Bandas entre los 1400 a 1600 cm-1 corresponden a los enlaces C=C de los anillos aromáticos del compuesto. Las vibraciones de estiramiento S=O del ácido sulfónico se observan a los 1061,81 cm-1. Al compararlo con el espectro IR deFeNPs-Sm-CR, la estructura del colorante se modificó considerablemente, lo que evidencia su interacción. Además, se muestra la banda característica de las FeNPs alrededor 500 cm-1, perteneciente al estiramiento del enlace Fe-O (Lin et al., 2010). En la Figura 9b, se comparan el espectro IR del colorante MV puro y el FeNPs- Sm-MV. En el colorante se observa la banda característica de las vibraciones de estiramiento N-H de las aminas secundarias a los 3211,00 cm-1. El pico de las vibraciones de flexión del enlace N-H de las aminas secundarias se observa a 1576,77 cm-1. Las vibraciones d elos enlaces C=C del anillo bencénico se ubican entre los 1352,13 cm-1. Si se compara con FeNPs-Sm-MV se puede verificar claramente su modificación, debido a la interacción de las FeNPs con el colorante. Las bandas sobre 1600 a 1750 cm-1 disminuyen su intensidad y la banda a 1300 cm-1 del enlace C-N se desplaza hacia la izquierda.
CONCLUSIÓN
Se concluye que empleando 200 mgL-1 de FeNPs-S. mammosum L. de 8,9±2,8 nm, a pH 3 y un tiempo de contacto por agitación de 30 min, el porcentaje de remoción de CR aumentó del 94,31 al 99,29 % y para el MV de 96,28% a 99,47%. Los resultados indican que el proceso de remoción de estos colorantes fue óptimo y puede ser empleado con otro tipo de colorantes azoicos.
LISTA DE REFERENCIAS
Abdelfatah, A. M., Fawzy, M., Eltaweil, A. S., & El-Khouly, M. E. (2021). Green Synthesis of Nano-Zero-Valent Iron Using Ricinus Communis Seeds Extract: Characterization and Application in the Treatment of Methylene Blue-Polluted Water. ACS Omega, 6(39), 25397–25411. https://doi.org/10.1021/acsomega. 1c03355
Alazaiza, M. Y. D., Albahnasawi, A., Ali, G. A. M., Bashir, M. J. K., Copty, N. K., Amr, S. S. A., Abushammala, M. F. M., & Al Maskari, T. (2021). Recent Advances of Nanoremediation Technologies for Soil and Groundwater Remediation: A Review. Water, 13(16), 2186. https://doi.org/10.3390/w13162186
Brown, J. P., & Dietrich, P. S. (1983). Mutagenicity of selected sulfonated azo dyes in the Salmonella/microsome assay: Use of aerobic and anaerobic activation procedures. Mutation Research/Genetic Toxicology, 116(3–4), 305–315. https://doi.org/10.1016/0165-1218(83)90068-X
Chattopadhyay, D. P. (2011). Chemistry of dyeing. In M. Clark (Ed.), Handbook of Textile and Industrial Dyeing (Vol. 1, pp. 150–183). Elsevier. https://doi.org/10.1533/ 9780857093974.1.150
Crini, G. (2006). Non-conventional low-cost adsorbents for dye removal: A review. Bio- resource Technology, 97(9), 1061–1085. https://doi.org/10.1016/j.biortech. 2005.05.001
Deichmann, W. B., & Gerarde, H. W. (1969). Toxicology of drugs and chemicals (4th ed.). Academic Press, Inc.
Ebrahiminezhad, A., Taghizadeh, S., Ghasemi, Y., & Berenjian, A. (2018). Green synthesized nanoclusters of ultra-small zero valent iron nanoparticles as a novel dye removing material. Science of The Total Environment, 621, 1527–1532. https://doi.org/10.1016/j.scitotenv.2017.10.076
Flores-Rojas, E., Schnabel, D., Justo-Cabrera, E., Solorza-Feria, O., Poggi-Varaldo, H. M., & Breton-Deval, L. (2021). Using Nano Zero-Valent Iron Supported on Diatomite to Remove Acid Blue Dye: Synthesis, Characterization, and Toxicology Test. Sustainability, 13(24), 13899. https://doi.org/10.3390/su 132413899
Herbst, W., & Hunger, K. (2005). Industrial organic pigments: production, properties, applications (3rd. Ed.). Wiley-VCH Verlag GmbH.
Jha, A. K., & Chakraborty, S. (2020). Photocatalytic degradation of Congo Red under UV irradiation by zero valent iron nano particles (nZVI) synthesized using Shorea robusta (Sal) leaf extract. Water Science and Technology, 82(11), 2491–2502. https://doi.org/10.2166/wst.2020.517
Kauppinen, T., Pukkala, E., Saalo, A., & Sasco, A. J. (2003). Exposure to chemical carcinogens and risk of cancer among Finnish laboratory workers. American Journal of Industrial Medicine, 44(4), 343–350. https://doi.org/10.1002/ ajim.10278
Khashij, M., Dalvand, A., Mehralian, M., Ebrahimi, A. A., & Khosravi, R. (2020). Removal of reactive black 5 dye using zero valent iron nanoparticles produced by a novel green synthesis method. Pigment & Resin Technology, 49(3), 215–221. https://doi.org/10.1108/PRT-10-2019-0092
King, D. (2007). Dyeing of cotton and cotton products. In S. Gordon & Y.-L. Hsieh (Eds.), Cotton (1st. Ed., pp. 353–377). Elsevier. https://doi.org/10.1533/978184 5692483.2.353
Le, N. T., Dang, T.-D., Hoang Binh, K., Nguyen, T. M., Xuan, T. N., La, D. D., Kumar Nadda, A., Chang, S. W., & Nguyen, D. D. (2022). Green synthesis of highly stable zero-valent iron nanoparticles for organic dye treatment using Cleisto- calyx operculatus leaf extract. Sustainable Chemistry and Pharmacy, 25, 100598. https://doi.org/10.1016/j.scp.2022.100598
Li, Q., Chen, Z., Wang, H., Yang, H., Wen, T., Wang, S., Hu, B., & Wang, X. (2021). Removal of organic compounds by nanoscale zero-valent iron and its composites. Science of The Total Environment, 792, 148546. https://doi.org/ 10.1016/j.scitotenv.2021.148546
Liu, A., Liu, J., & Zhang, W. (2015). Transformation and composition evolution of na- noscale zero valent iron (nZVI) synthesized by borohydride reduction in static water. Chemosphere, 119, 1068–1074. https://doi.org/10.1016/j.chemosphere. 2014.09.026
Liu, R., Zhang, B., Mei, D., Zhang, H., & Liu, J. (2011). Adsorption of methyl violet from aqueous solution by halloysite nanotubes. Desalination, 268(1–3), 111–116. https://doi.org/10.1016/j.desal.2010.10.006
Ofomaja, A. E. (2008). Kinetic study and sorption mechanism of methylene blue and methyl violet onto mansonia (Mansonia altissima) wood sawdust. Chemical En- gineering Journal, 143(1–3), 85–95. https://doi.org/10.1016/j.cej.2007. 12.019
Pilaquinga, F., Morejón, B., Ganchala, D., Morey, J., Piña, N., Debut, A., & Neira, M. (2019). Green synthesis of silver nanoparticles using Solanum mammosum L. (Solanaceae) fruit extract and their larvicidal activity against Aedes aegypti L. (Diptera: Culicidae). PLOS ONE, 14(10), e0224109. https://doi.org/10.1371 /journal.pone.0224109
Puthukkara P, A. R., Jose T, S., & S, D. lal. (2021). Plant mediated synthesis of zero valent iron nanoparticles and its application in water treatment. Journal of Environmental Chemical Engineering, 9(1), 104569. https://doi.org/10.1016/ j.jece.2020.104569
Ramesh, M., Anbuvannan, M., & Viruthagiri, G. (2015). Green synthesis of ZnO nano- particles using Solanum nigrum leaf extract and their antibacterial activity. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 136, 864–870. https://doi.org/10.1016/j.saa.2014.09.105
Rosendal, K., & Bernheimer, A. W. (1952). Paradoxical effect of Congo red on the toxicity of streptolysin S for mice. Journal of Immunology (Baltimore, Md. : 1950), 68(1), 53–60.
Sabnis, R. W. (2007). Handbook of Acid-Base Indicators. CRC Press. https://doi.org/ 10.1201/9780849382192
Sabnis, R. W. (2010). Handbook of biological dyes and stains: synthesis and industrial applications. John Wiley & Sons.
Saltos E., C., Chuquer S., D., Pazmiño V., K., Fernández M., L., & Pilaquinga F., F. (2019). Remoción de tartrazina en agua usando nanopartículas de hierro cerovalentes. InfoANALÍTICA, 7(2), 95–109. https://doi.org/10.26807/ia.v7i2.106
Shojaei, S., & Shojaei, S. (2017). Experimental design and modeling of removal of Acid Green 25 dye by nanoscale zero-valent iron. Euro-Mediterranean Journal for Environmental Integration, 2(1), 15. https://doi.org/10.1007/s41207-017- 0026-9
Shu, H.-Y., Chang, M.-C., Chen, C.-C., & Chen, P.-E. (2010). Using resin supported nano zero-valent iron particles for decoloration of Acid Blue 113 azo dye solution. Journal of Hazardous Materials, 184(1–3), 499–505. https://doi.org/10.1016/ j.jhazmat.2010.08.064
Ullah, H., Ullah, Z., Fazal, A., & Irfan, M. (2017). Use of Vegetable Waste Extracts for Controlling Microstructure of CuO Nanoparticles: Green Synthesis, Characterization, and Photocatalytic Applications. Journal of Chemistry, 2017, 1–5. https://doi.org/10.1155/2017/2721798
Varjani, S., Rakholiya, P., Shindhal, T., Shah, A. V., & Ngo, H. H. (2021). Trends in dye industry effluent treatment and recovery of value added products. Journal of Water Process Engineering, 39(June), 101734. https://doi.org/10.1016/j.jwpe. 2020.101734
Vega Orcacitas, M. (2001). Etnobotánica de la amazonía peruana (1ra. Ed.). Abya-Yala.
Wanakai, S. I., Kareru, P. G., Makhanu, D. S., & Madivoli, E. S. (2023). Advances in green nanotechnology: Data for green synthesis and characterization of iron nanoparticles synthesized using Galinsoga parviflora, Conyza bonariensis and Bidens pilosa leaf extracts, and their application in degradation of methylene blue dye an. Data in Brief, 46, 108882. https://doi.org/10.1016/j.dib.2022. 108882
Zhao, Z., Liu, J., Tai, C., Zhou, Q., Hu, J., & Jiang, G. (2008). Rapid decolorization of water soluble azo-dyes by nanosized zero-valent iron immobilized on the exchange resin. Science in China Series B: Chemistry, 51(2), 186–192. https://doi.org/10.1007/s11426-007-0121-x
Notas de autor
vcse691@gmail.com

