



ÁREA AMBIENTAL
BISFENOL A Y EFECTOS DE DISRUPCIÓN ENDOCRINA EN HUMANOS Y ANIMALES: REVISIÓN SISTEMÁTICA
BISPHENOL A AND ENDOCRINE DISRUPTION EFFECTS ON HUMANS AND ANIMALS: A SYSTEMATIC REVIEW
Revista de Investigación Agraria y Ambiental
Universidad Nacional Abierta y a Distancia, Colombia
ISSN: 2145-6097
ISSN-e: 2145-6453
Periodicidad: Semestral
vol. 13, núm. 2, 2022
Recepción: 04 Mayo 2021
Aprobación: 13 Julio 2021
Publicación: 17 Junio 2022
Autor de correspondencia: johana.marquez@curnvirtual.edu.co

CÓMO CITAR: Tamayo, F., Agaméz, J., Aparicio, D. y Márquez, J. (2022). Bisfenol A y efectos de disrupción endocrina en humanos y animales: Revisión sistemática. Revista de Investigación Agraria y Ambiental, 13(2), 175 – 200. DOI: https://doi.org/10.22490/21456453.4691
Resumen:
Introducción: El Bisfenol A (BPA es su sigla por su nombre en inglés, Bisphenol A) es una sustancia química utilizada en la fabricación de recipientes de plástico de policarbonato, recubrimiento de latas de metal, empaques de productos cosméticos y de cuidado personal, utensilios de cocina, juguetes, papel térmico para recibos, equipos deportivos y dispositivos médicos y dentales, que posee la facilidad de lixiviarse con el paso del tiempo y las altas temperaturas. En la actualidad, el BPA se ha categorizado como disruptor endocrino, debido a su capacidad de alterar la homeostasis del sistema endocrino tanto de humanos como animales.
Vacío de investigación: El uso de plásticos se ha convertido en una problemática mundial, debido al impacto generado en los diferentes compartimientos ambientales, así como la salud de los animales y el hombre. En este sentido, se hace necesario la recopilación de información que evidencie el panorama general de los efectos asociados a sustancias presentes en los plásticos, tales como el BPA.
Propósito del estudio: Revisar los efectos de disrupción endocrina inducidos por la exposición a BPA en humanos y animales.
Metodología: Revisión sistemática de acuerdo con la guía
PRISMA. Para ello se realizaron búsquedas en las bases de datos Scielo, Science Direct, MedLine (PubMed,OVID) entre el periodo de
2017 hasta 2021. Como palabras claves se emplearon los siguientes términos: Bisphenol, endocrine disrupter, animals y humans. Se incluyeron
todos los artículos que evidenciaran el efecto disruptor endocrino del BPA en
humanos y animales.
Resultados: Para esta revisión se incluyeron 35
estudios, de los cuales 17 se realizaron en humanos y 18 en animales; los
estudios seleccionados evidenciaron que la exposición a BPA puede tener efectos
sobre la reproducción, aumento de peso (obesógeno), diabetes, neurotoxicidad,
estrés oxidativo y función tiroidea.
Conclusión: El BPA puede filtrarse de plásticos y
productos y ser ingerido o absorbido por vía transdérmica en los seres vivos,
así como lixiviarse al ambiente; allí puede alcanzar aguas residuales,
suelo y cuerpos de agua (superficiales y subterráneos). Por tanto, esta
sustancia es considerada como ubicua en el medio ambiente e inevitable para los
humanos y animales, en los cuales ha mostrado inducir efectos de disrupción
endocrina equiparables.
Palabras clave: Bisfenol A, disruptor endocrino, reproducción, obesógeno, hormonas.
Abstract:
Contextualization: Bisphenol A (BPA) is a chemical substance used in the
manufacture of polycarbonate plastic containers, lining of metal cans,
packaging of cosmetic and personal care products, kitchen utensils, toys,
thermal paper, sports equipment, and medical and dental devices. The BPA has
the capacity to leach from containers or
environmental matrices through time and
high temperatures. Currently, BPA has been categorized as an endocrine
disruptor, due to its capacity to alter the homeostasis of the endocrine system
in humans and animals.
Knowledge gap: The
use of plastics has become a global problem, due to the impact generated in the
different environmental compartments, as well as the health of animals and man.
In this sense, it is necessary to review the information that shows the general
panorama of the effects associated with substances present in plastics, such as
BPA.
Purpose: To review the endocrine-disrupting effects induced by exposure to BPA
in humans and animals.
Methodology: Systematic review according to the PRISMA guide. For
this, Scielo, Science Direct, PubMed and
MedLine databases were searched between the period of 2017 to 2021. The
keywords Bisphenol, endocrine disrupter, animals, and humans were used. All
articles that evidenced the endocrine disrupting effect of BPA in humans and
animals were included.
Results: In this review 35 studies were included, they were divided in humans (17) and animals
(18). Selected studies showed that BPA exposure can have effects on
reproduction, weight gain (obesogen), diabetes, neurotoxicity, oxidative stress,
and thyroid function.
Conclusion: BPA can leach from plastics and other products and
then be ingested or absorbed by living beings via transdermal, as well as
leaching into the environment, where it can reach wastewater, soil, and water
bodies (surface and underground). Thus, this substance is considered ubiquitous
in the environment and unavoidable for humans and animals, and it has been shown to induce comparable
endocrine disrupting effects on them.
Keywords: Bisphenol A, endocrine disruptor, reproduction, obesogen, hormones.
1. INTRODUCCIÓN
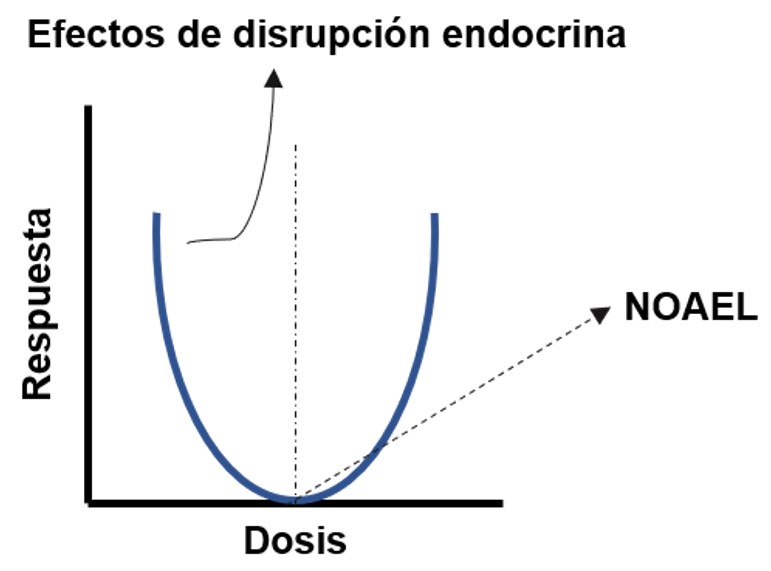
En los últimos años el incremento de la síntesis y producción de compuestos químicos destinados a la fabricación de materiales y/o productos de uso cotidiano ha sido motivo de preocupación por parte de la comunidad científica, puesto que, en la mayoría de los casos, se desconoce su impacto a corto, mediano y largo plazo, tanto en la salud humana como en los distintos ecosistemas (Sivaranjanee & Kumar, 2021). Un ejemplo de estas sustancias son los químicos disruptores endocrinos (EDCs es la sigla en inglés para Endocrine Disruptor Chemicals), cuyos efectos se han asociado a la capacidad de interferir con la síntesis, metabolismo y acción de hormonas endógenas (Chen et al., 2017; Paschoalini et al., 2021). Los EDCs, a diferencia de otras sustancias toxicas, se caracterizan por ejercer su efecto a concentraciones por debajo de su Nivel de Efecto No Observado (NOAEL, del inglés No Observed Adverse Effect Level). Ese comportamiento, al graficarse, exhibe curvas dosis-respuesta no monotónicas (Figura 1)(Son et al., 2018).
Dentro de las sustancias catalogadas como EDCs se encuentra el BPA (2,2-bis (4-hidroxidifenil) propano), una sustancia química ampliamente utilizada en la síntesis de polímeros (policarbonato, resinas) y en la fabricación de envases de alimentos, contenedores de plástico, biberones, botellas, discos compactos y cosméticos (Ma et al., 2020; Song et al., 2019). Después de su síntesis en el año de 1891 por el químico Aleksandr Dianin, se ha estimado que la producción de este compuesto por cada año es de más de tres millones de toneladas (Hart et al., 2017); cantidad exorbitante pero coincidente con el número de materiales que lo contienen, en especial las botellas de plástico usadas para el almacenamiento de agua. Adicionalmente, se estima que alrededor de 100 toneladas/año de BPA son liberadas al medio ambiente (Hart et al., 2017), situación preocupante porque este puede acumularse en diferentes fuentes hídricas (superficial y subterráneas), potencializando su exposición tanto en seres humanos como en los animales (Hart et al., 2018;Zhang et al., 2018).
Por otro lado, con el paso del tiempo, el BPA puede lixiviarse a los alimentos o las bebidas de los envases fabricados con esta sustancia; fenómeno que es acelerado por la temperatura (28 y 34°C) y cambios de pH (Sarria-Villa et al., 2019). Por tanto, bajo estas condiciones, la ingestión es la principal vía de exposición al BPA en humanos. Después de la ingestión el BPA es rápidamente metabolizado a varios metabolitos inactivos, como BPA-glucurónido y BPA-sulfato. El BPA libre se excreta principalmente en las heces (56 a 82 %) y sus metabolitos en la orina (13 a 28 %). A pesar del rápido metabolismo, el BPA libre se ha encontrado en la orina de adultos y niños, el suero de mujeres embarazadas y leche materna.
En particular, la presencia de esta sustancia en el suero materno y fetal, así como en la leche materna, puede provocar una exposición prolongada al BPA durante el período fetal y neonatal, y por tanto inducir efectos nocivos a largo plazo en el feto y el recién nacido (Murata & Kang, 2018). A nivel celular, el BPA mimetiza la acción hormonal e interfiere en vías de señalización involucradas en procesos como carcinogénesis, toxicidad reproductiva, respuesta inflamatoria o inmunitaria, cerebro y sistema nervioso (Chen et al., 2018; Eker et al., 2021; Qiu et al., 2020; Salehpour et al., 2020; Wen et al., 2020).
En los procesos cancerígenos (ej. mama, ovario, testicular) el BPA participa en la regulación del crecimiento, supervivencia, proliferación, migración e invasión de las células malignas a través de la unión o estimulación de los siguientes receptores: de estrógeno α / β (ERα / β), de andrógenos (AR), de estrógeno acoplado a proteína G (GPER), del factor de crecimiento similar a la insulina-1 (IGF-1R) y receptor gamma relacionado con el estrógeno (ERRγ) (Di Donato et al., 2017; Shafei et al., 2018; Sheng et al., 2019).
Respecto a la toxicidad reproductiva, el BPA en las hembras puede inducir desórdenes de desarrollo ovárico, desórdenes en la morfología del útero, decrecimiento de la implantación y desregulación de la secreción de hormonas sexuales (ej. Estrógeno y la progesterona) (Pivonello et al., 2020;Tomza-Marciniak et al., 2018; Ziv-Gal & Flaws, 2016), mientras que en los machos puede afectar la espermatogénesis y la calidad del esperma, criptorquidia, disfunción sexual y desregulación de hormonas sexuales (testosterona, androsterona y androstenediona) (Castellini et al., 2020; Mínguez-Alarcón et al., 2016; Rahman & Pang, 2019; Tomza-Marciniak et al., 2018). A pesar de que estos eventos no tienen un mecanismo definido, se han asociado a la capacidad antagónica del BPA con los receptores de andrógenos, estrógenos y procesos adyacentes como apoptosis y estrés oxidativo (Murata & Kang, 2018).
Por otra parte, el BPA puede inducir trastornos del desarrollo del cerebro y del sistema nervioso como memoria espacial y visión reducida, comportamientos similares a la migraña y morfogénesis dendrítica. Estos trastornos se han relacionado con la unión del BPA a los receptores IR, ERα / β, GR, del ácido gamma-aminobutírico (GABAA), del ácido N-metil-D-aspártico (NMDA) y GPER (Murata & Kang, 2018; Patisaul, 2020; Santoro et al., 2019).
En aras de proteger la salud, organizaciones internacionales como la Unión Europea (UE), a través de los Reglamentos 2011/10 y 2018/213, han prohibido el uso de BPA en la fabricación de biberones y establecieron el límite de migración del BPA a las superficies o al interior de los alimentos procedente de barnices o revestimientos aplicados a materiales u objetos en 0,05 mg de BPA por kg de alimento. La Ingesta Diaria Tolerable Temporal (TDI-t) para BPA en la UE es de 4 µg/kg de peso/día (Reglamento 213/2018, Unión Europea), mientras que en Estados Unidos la EPA (Environmental Protection Agency) ha fijado la dosis de referencia (RfD) de BPA en 50 µg/Kg de peso/día (Sarria-Villa et al., 2019). En Colombia, el Ministerio de Salud, a través de la Resolución 4143 de 2012, ha prohibido el uso de BPA en productos que tengan relación con el consumo humano y ha establecido como límite de migración 50 mg/Kg de alimento o estimulante, siendo esta cantidad 1000 veces mayor a la establecida por la UE; suponiendo así un riesgo más alto de exposición a BPA a través de la ingesta de alimentos o bebidas envasadas en recipientes fabricados con dicha sustancia. Por tanto, el objetivo de este trabajo es revisar los efectos de disrupción endocrina inducidos por la exposición a BPA en humanos y animales, a través de la búsqueda bibliográfica de artículos originales publicados entre 2017 y 2020.
2. METODOLOGÍA
2.1 Protocolo
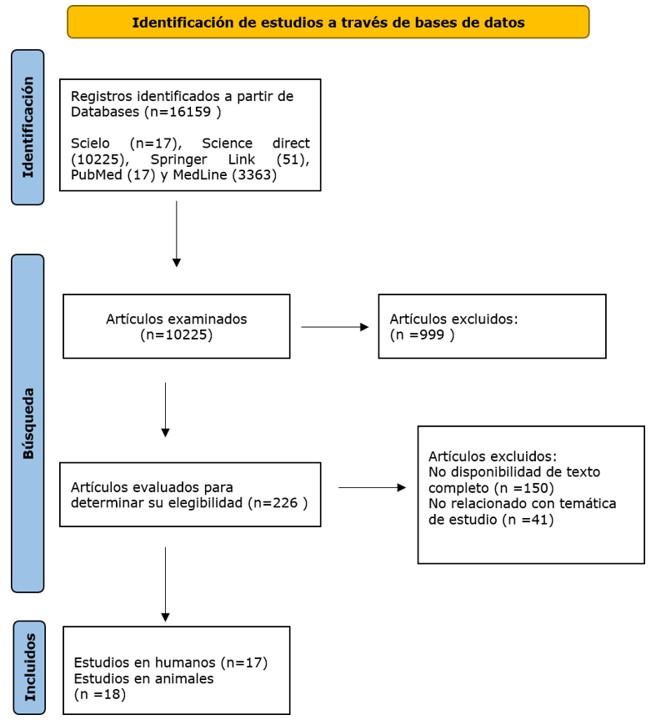
Esta revisión se realizó bajo las directrices del protocolo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses Guidelines). La búsqueda de los artículos se realizó por dos investigadores independientes en las siguientes bases de datos: Scielo, Science Direct, Springer Link y MedLine (OVID, PubMed), sin restricción de idioma o lugar, y abarco el periodo de enero de 2017 a junio de 2021. El resultado de la búsqueda se muestra en la Figura 2.
Adicionalmente, la búsqueda se estructuró y organizó con base en la estrategia PICOS de esta manera: P: humanos y animales: I: exposición a BPA; C: no expuestos a BPA; O: disrupción endocrina; (S): estudios experimentales, estudios de cohortes, estudios de casos y controles.
2.2 Estrategia de búsqueda bibliográfica
Para la búsqueda de los artículos se seleccionaron estas palabras claves: Bisphenol A/ Bisfenol A, endocrine disrupter/ Disruptor endocrino, animals/animales y humans/humanos, las cuales fueron previamente verificadas en el tesauro MeSH (Subject Headings (MeSH)). La construcción de la ecuación de búsqueda incluyó el operador booleano and/y. Posteriormente, se procedió a su lanzamiento en las bases de datos: Scielo, Science Direct, Springer Link, PubMed y MedLine (OVID).
2.3 Criterios de inclusión
Los criterios de inclusión se basaron en la selección de artículos originales que indicaran la realización de estudios experimentales, estudios de cohortes y estudios de casos y controles, sin restricción de idioma o lugar, abarcando el periodo de enero de 2017 a junio de 2021.
2.4 Criterios de exclusión
Se excluyeron de la revisión cartas al editor, resúmenes, comunicaciones cortas, revisiones narrativas y sistemáticas, y metaanálisis. También se excluyeron los artículos sin disponibilidad de texto completo, no relacionados a la temática y duplicados.
2.5 Extracción de datos
La selección de artículos se realizó mediante la lectura del título y/o resumen y, posteriormente, mediante la aplicación de los criterios de inclusión y exclusión al texto completo. El proceso de selección de los artículos fue realizado por dos revisores de forma independiente. Con el propósito de tabular la información obtenida de cada estudio se construyó una base de datos en Excel, la cual incluyó: autor, año de publicación, titulo, objetivo del estudio, modelo biológico, metodología, tipo de estudio, principales resultados y conclusión.
3. RESULTADOS
Identificamos 16.159 artículos a través de nuestra búsqueda en las bases de datos. Después de evaluar títulos y resúmenes, se seleccionaron 226 artículos que cumplían con los criterios inclusión. La revisión adicional de los textos completos y la aplicación de los criterios de inclusión y exclusión permitió seleccionar 35 estudios, como se observa en la Figura 2. Los artículos incluidos se clasificaron en estudios en animales y humanos, como se muestra en las Tablas 1 y 2, respectivamente.
3.1 Efectos de disrupción endocrina del BPA en humanos
Los estudios seleccionados en humanos incluyeron cuatro estudios de cohorte prospectivo, seis de cohorte transversal, cinco de casos y controles, y dos experimentales in vitro (Tabla 1). Los niveles de BPA se cuantificaron en la mayoría de los estudios como BPA total y/o BPA-creatinina, empleando para esto muestras de orina (70,5 %), sangre (17,7 %) y tejido (11.8 %). Por otro lado, los desenlaces de cada estudio fueron variables, imposibilitando así la realización de un metaanálisis. A continuación, se describen los hallazgos de acuerdo con la similitud de los principales resultados.
3.1.1 BPA y reproducción
Hart y Col (2018) demostraron que la exposición perinatal a BPA indujo la reducción del volumen testicular, calidad del semen y motilidad de espermatozoides en la etapa de niñez y adultez de los participantes en el estudio, los cuales procedían de mujeres embarazadas con concentraciones de BPA en sangre comprendida entre ≤5 - 12 580 ng/L. Por su parte, Li y Col (2020) encontraron una disminución en los niveles de estrógenos de mujeres embarazadas con concentraciones bajas de BPA en orina, así como una asociación significativa entre BPA y E3 de madres con fetos femeninos en el segundo trimestre, evento concordante con la curva dosis-respuesta no monotónica de un EDC. Chen y Col (2018) reportaron una correlación negativa entre las concentraciones de BPA en niñas y los niveles de la hormona folículo estimulante (FSH, del inglés Follicle stimulating hormone). Joensen y Col (2018) encontraron asociaciones significativas entre los niveles urinarios de BPA y marcadores de función testicular (testosterona, estradiol y porcentaje de espermatozoides móviles), así como de portadores de la mutación del gen de la filagrina (FLG). Esta mutación conlleva a una mayor exposición a sustancias químicas a través de la piel, a causa de un incremento en permeabilidad de la barrera epidérmica.
Por otra parte, Shen y Col (2020) y Mínguez-Alarcón y Col (2019), tuvieron hallazgos contradictorios entre las concentraciones de BPA en orina y el proceso de fertilización in vitro. Los primeros autores relacionaron las concentraciones de BPA con una disminución en la cantidad de ovocitos y las tasas de embarazo clínico e implantación, mientras que los segundos no encontraron ninguna asociación con el recuento de ovocitos, tasa de fertilización y probabilidades de implantación, así como el embarazo clínico y los nacidos vivos.
3.1.2 BPA y efecto obesógeno
El efecto obesógeno del BPA fue descrito por autores como Li y Col (2017), quienes evaluaron el efecto del BPA en el índice de masa corporal en niños y adolescentes. Los niveles más altos de BPA en orina mostraron estar relacionados con un aumento en el índice de masa magra en niños, hecho que también fue evidenciado por Zhang y Col (2017) en niños expuestos a BPA en la etapa prenatal. Adicionalmente, el estudio realizado por Choi y Col (2020) evidenció que la exposición prenatal a BPA indujo una metilación diferencial de IGF2R en niñas y niños de dos años. Este evento podría estar asociado con el aumento del índice de masa corporal dependiente del sexo.
Siguiendo esta línea, Jain y Col (2019) han reportado que los niveles de BPA en pacientes con diabetes tipo 2 podrían causar un desequilibrio en el tejido adiposo (adipocinas) de los pacientes, una situación que podría favorecer el incremento de esta patología a través del efecto obesógeno del bisfenol A. Soundararajan y Col (2019) refuerzan la hipótesis antes mencionada, porque ellos encontraron una asociación positiva entre niveles elevados de BPA, control glucémico, resistencia a la insulina, senescencia acelerada y acortamiento de los telómeros de pacientes con diabetes tipo 2. Adicionalmente, el estudio in vitro realizado por Ahmed y Col (2020) mostró que la exposición de células de tejido adiposo humano, a concentraciones ambientales de BPA por un periodo de 24 h, redujo la expresión génica de marcadores proinflamatorios y adipocinas e inhibió la captación de glucosa en los adipocitos independientemente de la señalización por insulina. Fenómeno que podría explicar la posible contribución de la exposición a BPA en el aumento de la obesidad en pacientes con diabetes (Ahmed et al., 2020).
3.1.3 BPA y efecto sobre hormonas tiroideas
En cuanto al efecto del BPA sobre las hormonas tiroides, Derakhshan y Col (2019) relacionaron concentraciones altas de BPA con niveles bajos de T4 total, mientras que Know y Col (2020) hallaron niveles bajos de T3, los cuales fueron más notorios en el grupo con mayor índice de masa corporal. Adicionalmente, Li y Col (2019), reportaron un aumento en la presencia del anticuerpo tiroideo en sangre de mujeres con altos niveles de BPA en orina. Por su parte, el estudio realizado por Zhang y Col (2017) sobre células de cáncer de tiroides humano evidenció la susceptibilidad que tienen estas de activar mecanismos de proliferación celular, mediada por la sobrexpresión del receptor de estrógenos, ante la presencia de concentraciones ambientales de BPA. Bajo este contexto, la presencia de BPA puede desequilibrar la producción de hormonas tiroideas e inducir un aumento de peso, lo cual podría estar relacionado con el efecto obesógeno que ha mostrado este contaminante.
3.1.4 BPA y efectos sobre la capacidad cognitiva
Sobre este aspecto solo fue encontrado el estudio realizado por Rodríguez y Col (2019), en el que se evidenció que no existe una asociación entre los niveles de BPA y las capacidades cognitivas de niños de 9 a 11 años, excepto la disminución en la memoria de trabajo (almacenamiento y manipulación temporal de la información para la realización de tareas cognitivas complejas).
3.2 Efectos de disrupción endocrina del BPA en animales
Los estudios seleccionados en animales se muestran en la Tabla 2. Estos se realizaron en peces (55,5 %), ratas (16,7 %), caracol (11,1 %), cerdo (11,1 %) y cangrejo (5,6 %). Los tejidos diana incluyeron órganos reproductivos (55.5 %) y órganos en general (44,5 %, cerebro, hígado, riñones, etc.). Al igual que los resultados en humanos, estos se mostrarán de acuerdo con sus desenlaces.
3.2.1 BPA y reproducción
Zhang y Col (2018) reportaron que la exposición a BPA en concentraciones crecientes genera una disminución en la motilidad de los espermatozoides de peces Gobiocypris rarus, así como cambios en su estructura y capacidad de fertilización. Además, indujo un aumento en la expresión de genes de osmorregulación (aqp3 y aqp8), a través del receptor de estrógeno en su región flanqueante 5’. Por su parte, Chen y Col (2017) evidenciaron que la exposición de peces cebra juveniles a BPA, durante el período de diferenciación gonadal, tenía un impacto sobre la proporción de hembras en los peces tratados, con respecto al control (imposex); este evento podría estar mediado por la supresión de la expresión de fshb a nivel pituitario, así como de fshr y lhcgr a nivel gonadal. Bajo este contexto, Li y Col (2017) indicaron que la exposición de peces macho a BPA promovía daños a nivel testicular y disminuía la cantidad de esperma, así como la capacidad de cortejo hacia las hembras.
De Andrade y col (2017) indicaron que la exposición a BPA indujo cambios en los patrones de reproducción del caracol manzana (Pomacea lineata), así como la disminución en la frecuencia cardíaca, y un aumento de la actividad aspartato aminotransferasa. Estos hallazgos fueron corroborados por Forner-Piquer y Col (2020) y Wang y Col (2019), quienes, además, relacionaron la exposición a BPA con los trastornos reproductivos y asignación de sexo en peces cebras y de colores, respectivamente. Por otra parte, Sporndly-Nees y Col (2018) no encontraron evidencias que indicaran alteración en la reproducción de ratas Fischer machos (jóvenes y adultas) expuestas a BPA, sin embargo, observaron en las ratas adultas un leve infiltrado en las células de epidídimo, hecho que podría afectar la maduración y activación de los espermatozoides en esta zona.
En contraste, Qiu y Col (2020) hallaron que la exposición prenatal a BPA promovía el inicio temprano de la pubertad en ratas hembra, evento que se relacionó con el incremento de LH, FSH y GnRH, así como con cambios en el tejido ovárico (estimulación de folículos) y con la expresión de la proteína kisspeptina (regulador critico de la pubertad). Siguiendo en esta línea, Molina y Col (2018) encontraron que la exposición a dosis bajas de BPA afecta el sistema neuroendocrino de peces cebra adultos, observándose modificaciones en la adenohipófisis e hipertrofia/hiperplasia en las células gonadotropas, situación que podría afectar la fertilidad y reproducción femenina al interferir con la funcionalidad ovárica. Adicionalmente, Elmetwally y Col (2019) evidenciaron que la exposición a BPA indujo alteraciones en la proliferación, migración y adhesión de las células del trofectodermo porcino, hecho que podría repercutir en el desarrollo e implantación del blastocito y, por tanto, conllevar a una falla en el embarazo.
| Población | Estudio | Muestra | Concentración BPA | Ensayos | Resultados | Referencia |
| Mujeres embarazadas de menos de 16 semanas de gestación (Wuhan, China) | Cohorte transversal | Orina | Primer trimestre: 1, 47 ng/mL; Segundo trimestre: 1,45 ng/ml; Tercer trimestre: 1,33 ng/mL | Medidas antropométricas y concentración de estrógenos | Primer trimestre: Los niveles estrógeno disminuyeron. Segundo trimestre: Las concentraciones de E3 disminuyeron. Tercer trimestre: Los niveles de E1 y E3 disminuyeron. | Li y Col (2020) |
| Hombres y mujeres | Experimental/ in vitro | Tejido adiposo sub- cutáneo humano | Cultivo celular de adipocitos expuestos a BPA: 1, 10 y 1010nM. | Ensayos de viabilidad celular, expresión de IL6, IL1B, IL33, TNFα, transportador de ácidos grasos, GLUT 1 y 4, adipoquinas, receptor de estrógenos, ingesta de glucosa y western blot. | El tejido expuesto a BPA mostró una reducción en la expresión de citoquinas y adipoquinas. Adicionalmente, la exposición a BPA indujo en el tejido adiposo una disminución en la captación de glucosa independiente a la insulina. | Ahmed y Col (2020) |
| Mujeres embarazadas e hijos (2-4 años) (Corea del Sur, Seúl) | Cohorte prospectiva | Orina Sangre | Grupo de madres de baja exposición: 1.34 ± 0.60 µg/g creatinina Grupo de madres de alta exposición: 7.92±4.97µg/g creatinina. | Cuantificación de BPA en orina por HPLC-MS. Medidas antropométricas en los niños (peso, altura, IMC). Metilación de ADN de niños. | Se encontró un incremento de la metilación en el gen IGF2R en niños y niñas de dos años, mediada por la exposición prenatal a BPA. Además, este estudio evidenció una asociación significativa entre la metilación y el IMC en niñas. | Choi y Col (2020) |
| Mujeres con infertilidad por factor tubárico sometidas a fertilización in vitro (Zhejiang, China) | Cohorte prospectiva | Orina | <Límite de detección- 12. 862 ng/mL | Niveles de estrógenos, FSH, AFC y recuento de ovocitos. | Las mujeres con concentraciones de BPA urinarias más altas exhibieron un número más bajo de ovocitos, así como, la disminución de estos durante la fertilización y período de gestación, en comparación con las que mostraron niveles más bajos de BPA en orina. | Shen y Col (2020) |
| Mujeres y hombres mayores a 19 años. (Corea) | Cohorte transversal | Orina | >0.15 mg/L | Cuantificación de BPA HPLC-MS. Hormonas tiroideas: T3, T4 y TSH. | Los niveles de BPA se relacionaron de forma indirecta con las concentraciones de las hormonas T3 y T4. Sin embargo, no se encontró relación con la hormona TSH. | Kwon y Col (2020) |
| Pacientes diagnosticados con diabetes mellitus tipo 2 y grupo control sin diabetes diagnosticada por criterios OMS. (Chennai, India) | Casos y controles | Sangre | Media de BPA en grupo diabéticos tipo 2: 52.4±3.8 ng/mL. Media grupo de control: 41,7±3.0 ng/mL | Medidas antropométricas (talla, peso y circunferencia de la cintura). Glucosa en ayunas, TGs, VLDL HDL y LDL, HbA1c. Niveles de insulina y resistencia a insulina. Cuantificación de BPA por ELISA. Expresión de los genes β- GLB1, p16, p21, p53, ER-α, ER-β, ERR-α, ERR-β, ERR-γ, SOCS-3, IL-6, factor de TNF-α, CYP2C9, CYP2C18, AhR, AR, NOD-1, NOD-2, GPER-1 y PPAR-γ. | La exposición a BPA mostró correlación positiva con la expresión de genes inflamatorios y de senescencia. Además, los niveles de glucosa plasmática, HbA1c, VLDL y la resistencia a la insulina se correlacionaron con los niveles de BPA en los pacientes con diabetes. | Soundararajan y Col (2019) |
| Mujeres embarazadas (Suecia) | Cohorte transversal | Orina | 1,51 ng/dL | TSH, T4, T3, TT3 y TPOAb. | Niveles más altos de BPA se asociaron con concentraciones más bajas de TT4 o T4 Total, además, de proporciones más bajas de T4/T3, T4/TT3. | Derakhshan y Col (2019) |
| Mujeres (Xuzhou, China) | Casos y controles | Orina | BPA nivel corregido con creatinina 1,35ng/mL | Cuantificación de BPA urinario y ecografía tiroidea | Los niveles de BPA urinario se relacionaron con la presencia del anticuerpo tiroideo positivo en sangre. | Li y Col (2019) |
| Mujeres en tratamiento de fertilización in vitro (Massachusetts, Estados Unidos) | Cohorte prospectiva | Orina | 1,14 µg/L | Niveles de estrógenos y ovocitos recuperados. | No se encontró asociación entre niveles de BPA y tasa de fertilización, implantación, embarazo clínico y nacidos vivos. | Mínguez-Alarcón y Col (2019) |
| Niños de 9 a 11 años (Granada, España) | Cohorte trasversal | Orina | Mediana de 4.76 ng/mL de BPA y mediana de 4.75 ng/g creatinina/BPA | Cuantificación de BPA HPLC-MS. Evaluación de funciones cognitivas. | No se encontró una relación entre los niveles de BPA en los niños y el desarrollo neuropsicológico. Sin embargo, se encontró una asociación entre los niveles de BPA y la disminución de la memoria de trabajo. | Rodríguez-Carrillo y Col (2019) |
| Pacientes diagnosticados con diabetes mellitus tipo 2 (Jaipur, India) | Casos y controles | Sangre | Grupo diagnosticado con Diabetes mellitus tipo 2: 109.04 ± 30.32 pg/mL Grupo de control sanos: 102.04 ± 20.67 pg/mL. | Medidas antropométricas (peso, talla, relación cintura-cadera, IMC). Colesterol, triglicéridos, fosfolípidos, HDL, glucosa, insulina sérica, adiponectina, leptina, TNF-α, IL-6 e IL-1, BPA, péptido C e índice de resistencia a la insulina para la homeostasis. | Los niveles de BPA fueron correlacionados de forma positiva con las medidas antropométricas de pacientes diabéticos. Correlación positiva entre BPA y leptina fueron encontrados, así como correlación negativa entre BPA y adiponectina de los pacientes diabéticos. | Jain y Col (2019) |
| Madres e hijos (Australia) | Cohorte transversal | Suero materno | ≤5 – 12580 ng/L | Suero materno: testosterona, estradiol y estrona, LH, FSH e inhB. Hijos: volumen de testículos, características del semen (abstinencia, volumen, salida, concentración, morfología, motilidad y estructura de cromatina espermática). | Las concentraciones de BPA en suero materno fueron correlacionadas positiva con la concentración y motilidad de los espermatozoides. | Hart y Col. (2018) |
| Niñas 6 a 9 años (Shanghái, China) | Caso y controles | Orina | Casos: 6.88mcg/L – Controles: 1,02mcg/L | Niveles séricos de estradiol, LH, FSH, GnRH. | Encontraron una correlación negativa entre las concentraciones de BPA y los niveles de FSH, que podría significar un mecanismo potencial de toxicidad del BPA en el desarrollo puberal de las niñas. | Chen y Col (2018) |
| Hombres con genotipo FLGR501X, 2282del4 y mutaciones R2447X (Dinamarca) | Casos y controles | Orina | 3.5 ng/mL | Cuantificación de BPA, parabenos, filtros UV y benzofenonas | Los portadores de mutaciones tuvieron concentraciones más altas de BPA y benzofenonas como BP-1y BP-3, lo cual fue relacionado a su vez con altos niveles de testosterona y estradiol y FSH más baja. | Joensen y Col (2018) |
| Niños y adolescentes entre 8 y 19 años (Estados Unidos) | Cohorte transversal | Orina | 5.61 ng/mL | Índice de masa corporal (composición corporal medida mediante DXA scan) | Los niveles más altos de BPA urinario se asociaron con el aumento del índice de masa corporal magra elevada (LBMI) en niños, pero no en niñas. | Li y Col (2017) |
| Tumor papilar de tiroides | Experimental /in vitro | Células de cáncer papilar de tiroides | Las células fueron expuestas a niveles de BPA de 1mM – 10 nM | Ensayos de viabilidad y proliferación celular. Identificación Ers y GPR30 por inmunofluorescencia Expresión de los genes Era, Erb y GPR30. | La exposición a BPA influye en los procesos de proliferación celular en el cáncer de tiroides; evento mediado por la expresión de receptor de estrógenos y receptor GPR30. | Zhang y Col (2017) |
| Mujeres e hijos (México) | Corte prospectiva | Orina | Media de BPA urinario de madres en tercer trimestre de embarazo: 0.74 ng/mL Nacidos de las madres estudiadas con edades de 8-14 años media de BPA de: 1,4 ng/mL | Medidas antropométricas a los niños (IMC Z). La concentración de BPA en orina fue cuantificada por cromatografía isotópica de dilución liquida/MS-MS. | Los niveles de exposición a BPA en el útero mostraron una relación con un el aumento del índice de masa corporal de niñas que no habían entrado a la pubertad. | Yang y Col (2017) |
3.2.2 BPA y efecto obesógeno
Manukyan y Col (2019) reportaron que la exposición a BPA de ratas embarazadas y su descendencia incrementó la producción de insulina, suponiendo así un posible riesgo de enfermedades metabólicas como la diabetes tipo 2. Además, las concentraciones empleadas de BPA para este estudio fueron ocho veces menor que la ingesta diaria tolerable (TDI) de la Autoridad Europea de Seguridad Alimentaria (EFSA), situación alarmante dado que estas concentraciones son consideradas seguras para los seres humanos. Martínez y Col (2020) indicaron que la exposición intrauterina a BPA de peces cebra aumentó los niveles de triglicéridos, diglicéridos, fosfatidilcolinas y fosfatidilinositoles con respecto al control. En ambas situaciones la exposición a BPA puede conllevar a obesidad, considerando que los altos niveles de insulina conducen a una mayor captación de glucosa, la cual es posteriormente almacenada en forma de lípidos (triglicéridos). Otro aspecto revelado por estos estudios es la modulación del BPA al receptor PPARγ, involucrado en procesos transporte y anabolismo de lípidos (Manukyan et al., 2019).
3.2.3 BPA y efectos sobre sistema nervioso
Gupta y Col (2018) encontraron que la exposición a BPA induce un aumento en la expresión del gen cyp19a1b en el cerebro de los peces (Labeo rohita). Este gen codifica la aromatasa Citocromo P450, la cual cataliza la conversión del andrógeno C19 en estrógeno C18 durante el desarrollo y la reproducción temprana. En este contexto, los autores indican que la exposición temprana a BPA tiene efectos estrogénicos en el desarrollo del cerebro, aun cuando la gónada no se diferencia, evento que a su vez puede repercutir en la diferenciación sexual del pez. Adicionalmente, esta investigación resalta que el BPA induce una fuerte sobreexpresión de la aromatasa B y su actividad en cerebro, a través de la unión a los receptores de estrógenos nucleares.
Por otro lado, Liliana y Col (2019) determinaron que la exposición a dosis bajas de BPA tenía un impacto significativo en la codificación química de nervios pertenecientes al sistema nervioso simpático ubicados en el cuello y cuernos del útero porcino. Este suceso evidencia los efectos neurotóxicos del BPA, los cuales, según los autores, pueden estar modulados por la unión a los receptores de estrógenos.
| Modelo | Muestra | Ensayos | Concentración de exposición a BPA | Resultados | Referencia |
| Aristichthys nobils | Sangre, cerebro, hígado, riñones y branquias. | Cambios morfológicos y nucleares en eritrocitos. Genotoxicidad y determinación de ROS, TBARS, GSH, proteína total y enzimas antioxidantes: SOD, CAT y POD. | 0.5, 1 y 1.5 mg/L | La exposición a BPA indujo cambios morfológicos en los eritrocitos y daño oxidativo por disminución del contenido de proteínas totales, actividad CAT, SOD y POD. Además, de inducir peroxidación lipídica y ROS en el cerebro, riñones y branquias. | Akram y Col (2021) |
| Ratas hembra Sprague-Dawley | Sangre del tronco, ovarios e hipotálamo | Morfología de ovarios. Cuantificación: HL, FSH, estradiol, GnRH y testosterona. Expresión de los genes Kiss1 y Gnrh1 en hipotálamo. Expresión de las proteínas kisspeptina y GnRH. | 0,05-0,5-5,0 y 10 mg/Kg/día | La exposición a BPA indujo un incremento en las hormonas LH, FSH y GnRH y una disminución en los niveles de testosterona a todas las concentraciones ensayadas. A nivel de hipotálamo, la expresión de los genes Gnrh1 y Kiss1 y sus proteínas kisspeptina y GnRH fue mayor en las ratas expuestas a 10 mg/Kg/día de BPA. | Qiu y Col (2020) |
| Aristichthys nobils | Células del tejido del bazo | Determinación de ROS, actividad de SOD, CAT, GSH-PX, contenido de GSH, NOS y MDA. Expresión de miR-27b-3p, CYP1B1 y BCL-2. | 1, 5 y 10 nM | La exposición al BPA reguló al alza la expresión de CYP1B1 y a la baja la expresión de miR-27b-3p, provocando estrés oxidativo por la inhibición de la actividad de las enzimas antioxidantes y acumulación de ROS. | Liu y Col (2020) |
| Danio rerio | Tejido de gónadas y hígado | Expresión de genes rplp0 y 18s para el ovario, y rplp0 y rpl13a para los testículos y vtg en hígado. Determinación de AEA y 2-AG y PEA y OEA e Histológía. | 10 y 20 μg/L | La exposición a BPA indujo un aumentó la proporción de ovocitos en estadio vitelogénico. La exposición a 20 μg/L de BPA causó una disminución significativa del área de las espermatogonias, lo cual a afectó la función gonadal en peces machos y hembras. | Forner-Piquer y Col (2020) |
| Procambarus clarkii | Hepatopáncreas | Análisis histológico. Actividades SOD, CAT y POD, ACP, AKP y lisozima. Expresión de genes relacionados a la inmunidad. | 225 μg/L | El hepatopáncreas de los cangrejos tratados con BPA mostró una desaparición del borde de cepillo, aumento de lumen y desconexión entre los túbulos hepáticos. Adicionalmente, se observó un incremento en el número de gotitas de lípidos en el hepatocito y las mitocondrias se hincharon y algunas crestas mitocondriales desaparecieron. Las enzimas antioxidantes mostraron un decremento en sus actividades. | Zhang y Col (2020) |
| Sus scrofa | Células del trofectodermo porcino | Proliferación, adhesión y migración celular. Expresión de genes Acuaporinas (AQP3 y AQGP4), transportadores de aminoácidos catiónicos (SLC7A1) y de aromáticos (SLC7A6); IGF1 e IGF1R. Análisis de aminoácidos. | 0.1×10−9, 1×10-8, 1×10-7, 1×10-6, 1×10-5, y 1×10-4 M | Las células pTr2 expuestas a BPA disminuyeron su proliferación, migración y adhesión. En altas concentraciones de BPA se redujo la liberación de los aminoácidos catiónicos y aromáticos; además, la expresión de genes IGF1, IGF1R y de acuaporinas (AQP) 3 y 4, se regularon a la baja. | Elmetwally y Col (2020) |
| Ratas Fisher | Páncreas | Secreción y contenido de insulina | 0,5 y 50 μg /Kg peso | La exposición de madres y sus descendencias a BPA inducen una disminución en la secreción de insulina a dosis de 50 μg/Kg peso, mientras que a la dosis 0.5 μg/Kg peso indujo una hipersecreción. | Manukyan y Col (2019) |
| Sus scrofa domesticus | Tejido del cuerpo uterino | Doble inmunofluorescencia con marcaje contra dopamina beta-hidroxilasa, isoforma neuronal del óxido nítrico sintasa, sustancia P, polipéptido intestinal vasoactivo, galanina y péptido relacionado con el gen de la calcitonina y densidad de nervios inmunoreactivos. | 0.05 mg/kg pc/día y 0.5 mg/kg pc/día | Ambas dosis de BPA causaron los cambios en el número y la caracterización neuroquímica de los nervios DBH-LI en la pared uterina. En la capa muscular del cuerpo uterino, dosis bajas de BPA provocaron el aumento del número promedio de fibras de DAP-LI por campo microscópico. En la capa muscular del cuerpo uterino, dosis bajas de BPA provocaron el aumento del número promedio de fibras de DAP-LI por campo microscópico. | Liliana y Col (2019) |
| Danio rerio | Saco endodérmico de útero-embriones | Observación de tasas de mortalidad, eclosión, inflación de la vejiga natatoria. Análisis lipídico mediante HPTLC y UHPLC-TOF/MS. | 4, 6 y 8 mg/L | La exposición a BPA redujo las tasas de inflación de la vejiga natatoria a concentraciones ≥ 6 mg/L y provocó un aumento en el área del saco vitelino. El análisis lipídico correlacionó el efecto obesógeno de BPA con un aumento en cantidades de lípidos relacionados con el metabolismo energético, principalmente, TG, DG, PC y PI. | Martínez y Col (2019) |
| Carassius auratus | Tejido gonadal, cerebro y sangre | Análisis histológico. Expresión de genes: 17b-estradiol y 11-cetotestosterona. Inmunohistoquímica (IHC) y tinción TUNEL. | 1, 50 y 500 mg/ L | La exposición al BPA reduce la maduración de las células germinales masculinas. Los resultados de la histología testicular sugieren que, después de la exposición a BPA, las espermátidas y los espermatocitos desaparecieron. El índice gonadosomático en los peces machos se redujo significativamente en comparación con el control. Adicionalmente, la tinción TUNEL en células germinales y células de Leydig evidenció una disminución en los niveles de 11-KT de los peces expuestos. | Wang y Col (2019) |
| Gobiocypris rarus | Testículos | Densidad, movilidad y capacidad de fertilización espermática. Gradiente osmótico espermático. Análisis histopatológico e inmunohistoquímico testicular. Expresión de los genes aqp3 y 8. | 15 y 225 µg /L | La exposición a BPA indujo una disminución de la rapidez y movimiento testicular en la semana 3 y 4. Además de un decremento en la tasa de fertilización, anormalidades en la estructura espermática y aumento de la expresión de los genes aqp3 y aqp8, así como de sus respectivas proteínas (AQP3 Y AQP8). | Zhang y Col (2018) |
| Ratas Fischer en pubertad media y adultos | Testículos y epidídimo, vesícula seminal, próstata dorsolateral y ventral, plasma | Histopatología, histomorfología, Cuantificación de testosterona, estrona, androstenediona. | 0,5- 50 μg/Kg/día | La exposición a BPA indujo en ratas adultas un incremento del índice anogenital. El peso de los testículos fue significativamente menor en las ratas que no presentaron espermiogénesis. | Sporndly-Nees y Col (2018) |
| Danio rerio | Cabeza | Acumulación de BPA en cerebro. Expresión de gen Cyp19b. Cambios histológicos y morfométricos. | 1, 10, 100 y 1000 µg/L | No se observó mortalidad en ninguna de las concentraciones de BPA. La exposición a 1000 ug/L indujo modificaciones irreversibles en las células gonadotropas y regulación a la baja de cyp19b. | Molina y Col (2018) |
| Physa acuta | Molusco completo | Expresión de los genes ER, ERR, RXR, Hsp70 y hsp90. Actividad glutatión-S-transferasa | 100 y 500 μg/ L | La actividad transcripcional de ER aumentó a 500 μg/L de BPA, mientras que los niveles de ARNm de RXR se regularon negativamente con 100 y 500 μg / L de BPA. La expresión de ERR aumento a la exposición de 500 μg / L. La expresión de los genes de choque térmico Hsp70 y Hsp90 aumentaron con la exposición a BPA. | Morales y Col (2018) |
| Danio rerio | Cerebro, pituitaria y ovarios | Expresión de los genes kiss1, kiss2, gnrh2, gnrh3, fshb, lhb, cga, gh, fshr, lhcgr y ef1a. | 1 y 10 μM | La exposición a BPA 1 μM no afectó la proporción de sexos ni el índice gonadosomático de los peces expuestos. El BPA aumentó la proporción de peces hembra en aproximadamente un 78 %. | Chen y Col (2017) |
| Pomacea lineata | Neonatos, adultos y hemolinfa | LC50 y frecuencia cardíaca. Aspectos morfométricos y comportamentales. Perfil bioquímico de hemolinfa: aspartato aminotransferasa, gamma GT, fosfatasa alcalina, albúmina, creatinina, proteína total, colesterol triglicéridos, urea, ácido úrico. | 1, 5, 10, 15 y 20 mg/L. 10 % y 50 % de LC50. | Exposiciones ≥ a 10 mg/L de BPA indujeron un aumento de al menos 77%, sobre la actividad de aspartato aminotransferasa en hemofilina y disminución de la frecuencia cardíaca de los caracoles. | de Andrade y Col (2017) |
| Danio rerio | Cerebro y testículos | Análisis histopatológico y de expresión génica. Análisis de comportamiento. Ensayo modelo de cadena de Markov. | 50 ng/L y 500 ng/L. | La exposición a BPA inhibió los comportamientos de cortejo del macho hacia la hembra y promovió los comportamientos agresivos contra el competidor, así como daño en la estructura histológica del tejido testicular. | Li y Col (2017) |
3.2.4 BPA y estrés oxidativo
Morales y Col (2018) hallaron que la exposición a BPA induce la expresión de los genes hsp70 y hsp90 en el caracol, los cuales codifican las proteínas de choque térmico Hsp70 y Hsp 90, respetivamente. Estos productos génicos actúan como sensores de estrés, mediados por la presencia de microorganismos, hipoxia, virus y/o sustancias químicas (Morales et al., 2018). Su función principal es reparar las proteínas que sufren daños por condiciones de estrés, incluido el oxidativo, el cual ha sido ampliamente documentado para el BPA en términos de actividades enzimáticas antioxidantes y daño a macromoléculas (Murata & Kang, 2018).
Por su parte, Liu y Col (2020) evidenciaron que la presencia de BPA induce en los linfocitos del bazo del pez carpa una sobreexpresión del gen cyp1b1, e interrumpe las actividades enzimáticas de SOD, GSH y CAT, situación que conlleva a un aumento del estrés oxidativo y activación de la vía apoptótica mitocondrial. Así mismo, Zhang y Col (2020) también encontraron un incremento en la producción de especies reactivas de oxígeno en el hepatopáncreas de cangrejos expuestos a BPA. Adicionalmente, Akram y Col (2021) observaron que la exposición a BPA inducia un aumento del estrés oxidativo y una reducción de las actividades enzimáticas antioxidantes de cerebro, hígado, riñones y branquias de la carpa cabezona de manera dosis-dependiente.
4. DISCUSIÓN
Esta revisión sistemática se centró en examinar los efectos de disrupción endocrina del BPA documentados para humanos y animales. Los estudios seleccionados evidenciaron que el BPA tiene impacto sobre la reproducción, hormonas tiroideas, aumento de peso (obesógeno), sistema nervioso y estrés oxidativo. Si bien los mecanismos por los cuales se dan estos eventos no son iguales, la gran mayoría confluyen en la importancia de la unión del BPA a los receptores de estrógenos y su efecto en la posterior modulación de vías de señalización involucradas en procesos apoptóticos, estrés, metabolismo hormonal y diferenciación celular. De ahí que la presencia ubicua de este contaminante a nivel ambiental suponga un riesgo para la salud del hombre y los ecosistemas (Ohore & Songhe, 2019).
En los últimos años, las investigaciones que estudian los efectos de la disrupción endocrina del BPA en los humanos se han incrementado, sin embargo, la extrema heterogeneidad en la medición de la exposición, población, diseño del estudio y resultados dificulta la posibilidad de encontrar una relación definitiva entre la exposición y los efectos observados (Tabla 1). De acuerdo con los hallazgos obtenidos en nuestra revisión, el bisfenol A puede afectar la fertilidad, tanto de hombres como mujeres, y la exposición prenatal tiene un rol preponderante en este fenómeno. Este impacto está evidenciado en la presencia de pubertad temprana, decremento en la calidad de espermatozoides y ovocitos, así como por fallas en la implantación de óvulos fecundados en la progenie (Chen et al., 2018; Hart et al., 2018; Joensen et al., 2018; Jiufeng Li et al., 2020; Mínguez-Alarcón et al., 2019; Shen et al., 2020). Estos resultados son similares a los reportados por Gonsioroski y Col (2020), quienes (a través de una revisión sistemática) evidenciaron que el BPA reduce la función reproductiva de hombres y mujeres, a través del detrimento de la concentración de esperma, calidad del semen y disminución de los niveles de antioxidante, así como aumento en la producción de hormonas sexuales y perdida de la calidad de ovocitos (Gonsioroski et al., 2020). Con relación a esto, existen varios estudios que han resaltado la implicación del BPA en la infertilidad. En hombres, se ha documentado que puede causar disminución en el recuento, motilidad y concentración de espermatozoides, así como daños en del ADN e incremento de la apoptosis en los tubos seminíferos; mientras que en mujeres, ha sido relacionado con la aparición de enfermedades como endometriosis y ovario poliquístico, razón por la cual se hipotetiza que la exposición a contaminantes ambientales, durante las actividades diarias, tiene un rol importante en el desarrollo de patologías (Adoamnei et al., 2018; De Toni et al., 2020; Di Nisio & Foresta, 2019; Radwan et al., 2018; Simonelli et al., 2017).
El efecto obesógeno de BPA es otro de los efectos de disrupción endocrina encontrado en esta revisión, el cual fue caracterizado por la ganancia de grasa (>IMC) en niños expuestos en la etapa prenatal (Choi et al., 2020; Li et al., 2017; Zhang et al., 2017). Además, este se relacionó con la susceptibilidad al desarrollo de diabetes tipo 2 y alteraciones en las hormonas tiroideas (Adoamnei et al., 2018; Derakhshan et al., 2019; Jain et al., 2020; (Li et al., 2019; Soundararajan et al., 2019). Al igual que los efectos en la reproducción, la ganancia de peso inducida por el BPA es un tema de gran interés en la comunidad científica, dados los altos índices mundiales de obesidad presentada en niños y adultos. No obstante, se requieren de más estudios en humanos que permitan validar esta información. De acuerdo con la evidencia presentada por diferentes autores, se cree que el efecto obesógeno estaría mediado por la activación de la adipogénesis y lipogénesis; así como por la modulación de la secreción de adipocinas (mediadas por la unión del BPA a receptores nucleares) y de los receptores de estrógeno, de los receptores de glucocorticoides, del receptor gamma activado por proliferador de peroxisomas (PPARγ), del receptor de retinoides X (RXR) y de los receptores de tiroides (TR) (Braun, 2017; Legeay & Faure, 2017; Rubin et al., 2019; Sonavane & Gassman, 2019).
Por otra parte, los efectos de disrupción endocrina del bisfenol A encontrados en animales son equiparables a los previamente descritos en humanos. Así, la reproducción, obesidad, y estrés oxidativo fueron los efectos más destacados (Ahmed et al., 2020; Akram et al., 2021; Chen et al., 2017; Forner-Piquer et al., 2020; Li et al., 2020; Li et al., 2017; Morales et al., 2018; Qiu et al., 2020; Spörndly-Nees et al., 2018; Wang et al., 2019; Zhang et al., 2020; Zhang et al., 2018; Zhang et al., 2017).
La inducción de estrés oxidativo es uno de los efectos regularmente asociado al bisfenol A, debido a su implicación en los daños observados en células sexuales femeninas y masculinas, los cuales pueden conllevar a la infertilidad, tanto en animales como humanos, como se describió anteriormente (Huang et al., 2020; Meli et al., 2020). En general, el estrés oxidativo puede promover daños al ADN e inducción de apoptosis en las células, como proceso subsecuente a la unión del BPA a receptores nucleares y su posterior expresión génica (Akram et al., 2021; Li et al., 2020; Zhang et al., 2020). Adicionalmente, los efectos del BPA sobre el sistema nervioso y cerebro de animales también se han atribuido al estrés oxidativo, hecho que resalta la importancia de este mecanismo bioquímico en la toxicidad de esta molécula (Arita et al., 2019; Birla et al., 2019).
Otro fenómeno observado en animales, fue el incremento de la población de peces cebra hembra expuestos a BPA en la etapa de diferenciación gonadal, las cuales no tuvieron desarrollo ovárico, evento que podría estar vinculado a una gónada intersexual (ovostesis), caracterizada por una morfología tanto testicular como ovárica (Chen et al., 2017). Bajo este panorama, sería de esperarse que el BPA impacte en la prolongación de la especie, considerando que las hembras con esta condición mueren en las etapas de reproducción (Liu et al., 2017; Zheng et al., 2015). En paralelo, este hecho resulta opuesto al imposex, imposición de características sexuales masculinas en el sistema reproductor femenino de algunos gasterópodos. Sin embargo, ambos evidencian la implicación de los disruptores endocrinos en la conservación de los ecosistemas (Rodríguez-Grimon et al., 2020; Sierra-Marquez et al., 2017).
Dentro de las limitaciones de este estudio se encuentra que solo se consideraron artículos enfocados en la disrupción endocrina del BPA de forma general, excluyendo así aquellos que consideraban temas específicos como la infertilidad, intersexualidad, estrés oxidativo, cáncer etc., tanto en animales como humanos. Además, debido al acceso a algunas publicaciones, los autores de la revisión solo pudieron examinar los artículos que estaban de forma abierta en las bases de datos. Por otra parte, los resultados de esta revisión evidencian la necesidad de la realización de más investigaciones centradas en los efectos del BPA en humanos, especialmente en los países en vías de desarrollo donde los sistemas de monitoreo de contaminantes ambientales son laxos, y algunos materiales y utensilios aún incorporan esta sustancia dentro de su fabricación.
5. CONCLUSIÓN
De acuerdo con la evidencia publicada, se sugiere que la exposición ambiental y experimental a BPA tiene efectos de disrupción endocrina a nivel reproductivo, produce obesidad, afecta las hormonas tiroideas, y aumenta el estrés oxidativo en humanos, animales y sus progenies. Por tanto, la presencia ubicua de este contaminante constituye una problemática de interés global en salud pública que requiere de control y monitoreo constante, particularmente en los países donde aún se emplea a escala industrial.
LITERATURA CITADA
Adoamnei, E., Mendiola, J., Vela-Soria, F., Fernández, M. F., Olea, N., Jørgensen, N., Swan, S. H. & Torres-Cantero, A. M. (2018). Urinary bisphenol A concentrations are associated with reproductive parameters in young men. Environmental Research, 161, 122–128. https://doi.org/10.1016/j.envres.2017.11.002
Ahmed, F., Sarsenbayeva, A., Katsogiannos, P., Aguer, C. & Pereira, M. J. (2020). The effects of bisphenol A and bisphenol S on adipokine expression and glucose metabolism in human adipose tissue. Toxicology, 445, 152600. https://doi.org/10.1016/J.TOX.2020.152600
Akram, R., Iqbal, R., Hussain, R., Jabeen, F. & Ali, M. (2021). Evaluation of Oxidative stress, antioxidant enzymes and genotoxic potential of bisphenol A in fresh water bighead carp (Aristichthys nobils) fish at low concentrations. Environmental Pollution, 268, 115896. https://doi.org/10.1016/j.envpol.2020.115896
Arita, Y., Park, H. J., Cantillon, A., Getahun, D., Menon, R. & Peltier, M. R. (2019). Effect of bisphenol-A (BPA) on placental biomarkers for inflammation, neurodevelopment and oxidative stress. Journal of Perinatal Medicine, 47(7), 741–749. https://doi.org/10.1515/jpm-2019-0045
Birla, H., Keswani, C., Rai, S. N., Singh, S. Sen, Zahra, W., Dilnashin, H., Rathore, A. S. & Singh, S. P. (2019). Neuroprotective effects of Withania somnifera in BPA induced-cognitive dysfunction and oxidative stress in mice. Behavioral and Brain Functions : BBF, 15(1), 9. https://doi.org/10.1186/s12993-019-0160-4
Braun, J. M. (2017). Early-life exposure to EDCs: role in childhood obesity and neurodevelopment. Nature Reviews. Endocrinology, 13(3), 161–173. https://doi.org/10.1038/nrendo.2016.186
Castellini, C., Totaro, M., Parisi, A., D’Andrea, S., Lucente, L., Cordeschi, G., Francavilla, S., Francavilla, F. & Barbonetti, A. (2020). Bisphenol A and Male Fertility: Myths and Realities. Frontiers in Endocrinology, 11, 353. https://doi.org/10.3389/fendo.2020.00353
Chen, W., Lau, S.-W., Fan, Y., Wu, R. S. S. & Ge, W. (2017). Juvenile exposure to bisphenol A promotes ovarian differentiation but suppresses its growth – Potential involvement of pituitary follicle-stimulating hormone. Aquatic Toxicology, 193, 111–121. https://doi.org/10.1016/j.aquatox.2017.10.008
Chen, Y., Wang, Y., Ding, G., Tian, Y., Zhou, Z., Wang, X., Shen, L. & Huang, H. (2018). Association between bisphenol a exposure and idiopathic central precocious puberty (ICPP) among school-aged girls in Shanghai, China. Environment International, 115, 410–416. https://doi.org/10.1016/j.envint.2018.02.041
Choi, Y. J., Lee, Y. A., Hong, Y. C., Cho, J., Lee, K. S., Shin, C. H., Kim, B. N., Kim, J. I., Park, S. J., Bisgaard, H., Bønnelykke, K. & Lim, Y. H. (2020). Effect of prenatal bisphenol A exposure on early childhood body mass index through epigenetic influence on the insulin-like growth factor 2 receptor (IGF2R) gene. Environment International, 143, 105929. https://doi.org/10.1016/J.ENVINT.2020.105929
de Andrade, A. L. C., Soares, P. R. L., da Silva, S. C. B. L., da Silva, M. C. G., Santos, T. P., Cadena, M. R. S., Soares, P. C. & Cadena, P. G. (2017). Evaluation of the toxic effect of endocrine disruptor Bisphenol A (BPA) in the acute and chronic toxicity tests with Pomacea lineata gastropod. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 197, 1–7. https://doi.org/10.1016/j.cbpc.2017.04.002
De Toni, L., De Rocco Ponce, M., Petre, G. C., Rtibi, K., Di Nisio, A. & Foresta, C. (2020). Bisphenols and Male Reproductive Health: From Toxicological Models to Therapeutic Hypotheses. Frontiers in Endocrinology, 11, 301. https://doi.org/10.3389/fendo.2020.00301
Derakhshan, A., Shu, H., Peeters, R. P., Kortenkamp, A., Lindh, C. H., Demeneix, B., Bornehag, C. G. & Korevaar, T. I. M. (2019). Association of urinary bisphenols and triclosan with thyroid function during early pregnancy. Environment International, 133, 105123. https://doi.org/10.1016/J.ENVINT.2019.105123
Di Donato, M., Cernera, G., Giovannelli, P., Galasso, G., Bilancio, A., Migliaccio, A. & Castoria, G. (2017). Recent advances on bisphenol-A and endocrine disruptor effects on human prostate cancer. Molecular and Cellular Endocrinology, 457, 35–42. https://doi.org/10.1016/J.MCE.2017.02.045
Di Nisio, A. & Foresta, C. (2019). Water and soil pollution as determinant of water and food quality/contamination and its impact on male fertility. Reproductive Biology and Endocrinology : RB&E, 17(1), 4. https://doi.org/10.1186/s12958-018-0449-4
Elmetwally, M. A., Halawa, A. A., Tang, W., Wu, G. & Bazer, F. W. (2020). Effects of Bisphenol A on expression of genes related to amino acid transporters, insulin- like growth factor, aquaporin and amino acid release by porcine trophectoderm cells. Reproductive Toxicology, 96, 241–248. https://doi.org/10.1016/J.REPROTOX.2020.07.008
Forner-Piquer, I., Beato, S., Piscitelli, F., Santangeli, S., Di Marzo, V., Habibi, H. R., Maradonna, F. & Carnevali, O. (2020). Effects of BPA on zebrafish gonads: Focus on the endocannabinoid system. Environmental Pollution, 264, 114710. https://doi.org/10.1016/J.ENVPOL.2020.114710
Gonsioroski, A., Mourikes, V. E. & Flaws, J. A. (2020). Endocrine Disruptors in Water and Their Effects on the Reproductive System. International Journal of Molecular Sciences, 21(6), 1929. https://doi.org/10.3390/ijms21061929
Gupta, S., Guha, P., Majumder, S., Pal, P., Sen, K., Chowdhury, P., Chakraborty, A., Panigrahi, A. K. & Mukherjee, D. (2018). Effects of bisphenol A (BPA) on brain-specific expression of cyp19a1b gene in swim-up fry of Labeo rohita. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 209, 63–71. https://doi.org/10.1016/j.cbpc.2018.04.002
Hart, R. J., Doherty, D. A., Keelan, J. A., Minaee, N. S., Thorstensen, E. B., Dickinson, J. E., Pennell, C. E., Newnham, J. P., McLachlan, R., Norman, R. J. & Handelsman, D. J. (2018). The impact of antenatal Bisphenol A exposure on male reproductive function at 20–22 years of age. Reproductive BioMedicine Online, 36(3), 340–347. https://doi.org/10.1016/j.rbmo.2017.11.009
Huang, M., Liu, S., Fu, L., Jiang, X. & Yang, M. (2020). Bisphenol A and its analogues bisphenol S, bisphenol F and bisphenol AF induce oxidative stress and biomacromolecular damage in human granulosa KGN cells. Chemosphere, 253, 126707. https://doi.org/10.1016/j.chemosphere.2020.126707
Jain, J., Gupta, N., Mathur, R., Nimesh, S. & Mathur, S. K. (2020). A Study on Impact of BPA in the Adipose Tissue Dysfunction (Adiposopathy) in Asian Indian Type 2 Diabetes Mellitus Subjects. Indian Journal of Clinical Biochemistry, 35(4), 451–457. https://doi.org/10.1007/s12291-019-00843-y
Joensen, U. N., Jørgensen, N., Thyssen, J. P., Szecsi, P. B., Stender, S., Petersen, J. H., Andersson, A. M. & Frederiksen, H. (2018). Urinary excretion of phenols, parabens and benzophenones in young men: Associations to reproductive hormones and semen quality are modified by mutations in the Filaggrin gene. Environment International, 121, 365–374. https://doi.org/10.1016/J.ENVINT.2018.09.020
Kwon, J. A., Shin, B. & Kim, B. (2020). Urinary bisphenol A and thyroid function by BMI in the Korean National Environmental Health Survey (KoNEHS) 2012–2014. Chemosphere, 240, 124918. https://doi.org/10.1016/J.CHEMOSPHERE.2019.124918
Legeay, S. & Faure, S. (2017). Is bisphenol A an environmental obesogen? Fundamental & Clinical Pharmacology, 31(6), 594–609. https://doi.org/10.1111/fcp.12300
Li, J., Lai, H., Chen, S., Zhu, H. & Lai, S. (2017). Gender differences in the associations between urinary bisphenol A and body composition among American children: The National Health and Nutrition Examination Survey, 2003-2006. Journal of Epidemiology, 27(5), 228–234. https://doi.org/10.1016/j.je.2016.12.001
Li, J., Zhang, W., Zhao, H., Zhou, Y., Xu, S., Li, Y., Xia, W. & Cai, Z. (2020). Trimester-specific, gender-specific, and low-dose effects associated with non-monotonic relationships of bisphenol A on estrone, 17β-estradiol and estriol. Environment International, 134, 105304. https://doi.org/10.1016/J.ENVINT.2019.105304
Li, L., Ying, Y., Zhang, C., Wang, W., Li, Y., Feng, Y., Liang, J., Song, H. & Wang, Y. (2019). Bisphenol A exposure and risk of thyroid nodules in Chinese women: A case-control study. Environment International, 126, 321–328. https://doi.org/10.1016/J.ENVINT.2019.02.026
Li, X., Guo, J. Y., Li, X., Zhou, H. J., Zhang, S. H., Liu, X. D., Chen, D. Y., Fang, Y. C. & Feng, X. Z. (2017). Behavioural effect of low-dose BPA on male zebrafish: Tuning of male mating competition and female mating preference during courtship process. Chemosphere, 169, 40–52. https://doi.org/10.1016/J.CHEMOSPHERE.2016.11.053
Liliana, R., Slawomir, G., Tomasz, J., Joanna, W. & Andrzej, P. (2019). The effects of Bisphenol A (BPA) on sympathetic nerve fibers in the uterine wall of the domestic pig. Reproductive Toxicology, 84, 39–48. https://doi.org/10.1016/j.reprotox.2018.12.004
Liu, K. C., Lau, S.W. & Ge, W. (2017). Spatiotemporal expression analysis of nuclear estrogen receptors in the zebrafish ovary and their regulation in vitro by endocrine hormones and paracrine factors. General and Comparative Endocrinology, 246, 218–225. https://doi.org/10.1016/j.ygcen.2016.12.011
Liu, Q., Wang, W., Zhang, Y., Cui, Y., Xu, S. & Li, S. (2020). Bisphenol A regulates cytochrome P450 1B1 through miR-27b-3p and induces carp lymphocyte oxidative stress leading to apoptosis. Fish & Shellfish Immunology, 102, 489–498. https://doi.org/https://doi.org/10.1016/j.fsi.2020.05.009
Ma, L., Yu, H., Wang, X., Li, D., Zhang, Y., Pei, X., Duan, Z. & Ma, M. (2020). The effects of maternal exposure to BPA during pregnancy on the male reproductive system and the testicular microRNA expression profile. Environmental Science and Pollution Research, 27(14), 17290–17302. https://doi.org/10.1007/s11356-020-08156-x
Manukyan, L., Dunder, L., Lind, P. M., Bergsten, P. & Lejonklou, M. H. (2019). Developmental exposure to a very low dose of bisphenol A induces persistent islet insulin hypersecretion in Fischer 344 rat offspring. Environmental Research, 172, 127–136. https://doi.org/10.1016/j.envres.2019.02.009
Martínez, R., Navarro-Martín, L., Van Antro, M., Fuertes, I., Casado, M., Barata, C. & Piña, B. (2020). Changes in lipid profiles induced by bisphenol A (BPA) in zebrafish eleutheroembryos during the yolk sac absorption stage. Chemosphere, 246, 125704. https://doi.org/10.1016/j.chemosphere.2019.125704
Meli, R., Monnolo, A., Annunziata, C., Pirozzi, C. & Ferrante, M. C. (2020). Oxidative Stress and BPA Toxicity: An Antioxidant Approach for Male and Female Reproductive Dysfunction. Antioxidants (Basel, Switzerland), 9(5). https://doi.org/10.3390/antiox9050405
Mínguez-Alarcón, L., Hauser, R. & Gaskins, A. J. (2016). Effects of bisphenol A on male and couple reproductive health: a review. Fertility and Sterility, 106(4), 864–870. https://doi.org/10.1016/j.fertnstert.2016.07.1118
Mínguez-Alarcón, L., Messerlian, C., Bellavia, A., Gaskins, A. J., Chiu, Y. H., Ford, J. B., Azevedo, A. R., Petrozza, J. C., Calafat, A. M., Hauser, R. & Williams, P. L. (2019). Urinary concentrations of bisphenol A, parabens and phthalate metabolite mixtures in relation to reproductive success among women undergoing in vitro fertilization. Environment International, 126, 355–362. https://doi.org/10.1016/J.ENVINT.2019.02.025
Moher, D., Liberati, A., Tetzlaff, J., Altman, D. G., & Group, T. P. (2009). Preferred eporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLOS Medicine, 6(7), e1000097. https://doi.org/10.1371/JOURNAL.PMED.1000097
Molina, A., Abril, N., Morales-Prieto, N., Monterde, J., Ayala, N., Lora, A. & Moyano, R. (2018). Hypothalamic-pituitary-ovarian axis perturbation in the basis of bisphenol A (BPA) reproductive toxicity in female zebrafish (Danio rerio). Ecotoxicology and Environmental Safety, 156, 116–124. https://doi.org/10.1016/J.ECOENV.2018.03.029
Morales, M., Martínez-Paz, P., Sánchez-Argüello, P., Morcillo, G. & Martínez-Guitarte, J. L. (2018). Bisphenol A (BPA) modulates the expression of endocrine and stress response genes in the freshwater snail Physa acuta. Ecotoxicology and Environmental Safety, 152, 132–138. https://doi.org/10.1016/j.ecoenv.2018.01.034
Murata, M. & Kang, J.-H. (2018). Bisphenol A (BPA) and cell signaling pathways. Biotechnology Advances, 36(1), 311–327. https://doi.org/10.1016/j.biotechadv.2017.12.002
Ohore, O. E. & Zhang, S. (2019). Endocrine disrupting effects of bisphenol A exposure and recent advances on its removal by water treatment systems. A review. Scientific African, 5, e00135. https://doi.org/10.1016/j.sciaf.2019.e00135
Paschoalini, A. L., Savassi, L. A., Weber, A. A., Moreira, D. P., Ribeiro, Y. M., Rizzo, E. & Bazzoli, N. (2021). Evaluation of the oestrogenic potential of oestrone and bisphenol-A on the reproduction of Astyanax bimaculatus males after subacute exposure. Fish Physiology and Biochemistry, 47(4), 797–810. https://doi.org/10.1007/s10695-021-00938-5
Patisaul, H. B. (2020). Achieving CLARITY on bisphenol A, brain and behaviour. Journal of Neuroendocrinology, 32(1), e12730. https://doi.org/10.1111/jne.12730
Pivonello, C., Muscogiuri, G., Nardone, A., Garifalos, F., Provvisiero, D. P., Verde, N., de Angelis, C., Conforti, A., Piscopo, M., Auriemma, R. S., Colao, A. & Pivonello, R. (2020). Bisphenol A: an emerging threat to female fertility. Reproductive Biology and Endocrinology : RB&E, 18(1), 22. https://doi.org/10.1186/s12958-019-0558-8
Qiu, J., Sun, Y., Sun, W., Wang, Y., Fan, T. & Yu, J. (2020). Neonatal exposure to bisphenol A advances pubertal development in female rats. Molecular Reproduction and Development, 87(4), 503–511. https://doi.org/10.1002/mrd.23329
Radwan, M., Wielgomas, B., Dziewirska, E., Radwan, P., Kałużny, P., Klimowska, A., Hanke, W. & Jurewicz, J. (2018). Urinary Bisphenol A Levels and Male Fertility. American Journal of Men’s Health, 12(6), 2144–2151. https://doi.org/10.1177/1557988318799163
Rahman, M. S. & Pang, M.-G. (2019). Understanding the molecular mechanisms of bisphenol A action in spermatozoa. Clinical and Experimental Reproductive Medicine, 46(3), 99–106. https://doi.org/10.5653/cerm.2019.00276
Rodríguez-Carrillo, A., Mustieles, V., Pérez-Lobato, R., Molina-Molina, J. M., Reina-Pérez, I., Vela-Soria, F., Rubio, S., Olea, N. & Fernández, M. F. (2019). Bisphenol A and cognitive function in school-age boys: Is BPA predominantly related to behavior? NeuroToxicology, 74, 162–171. https://doi.org/10.1016/J.NEURO.2019.06.006
Rodríguez-Grimon, R., Campos, N. H. & Castro, Í. B. (2020). Imposex Incidence in Gastropod Species from Santa Marta Coastal Zone, Colombian Caribbean Sea. Bulletin of Environmental Contamination and Toxicology, 105(5), 728–735. https://doi.org/10.1007/s00128-020-03020-7
Rubin, B. S., Schaeberle, C. M. & Soto, A. M. (2019). The Case for BPA as an Obesogen: Contributors to the Controversy. Frontiers in Endocrinology, 10, 30. https://doi.org/10.3389/fendo.2019.00030
Santoro, A., Chianese, R., Troisi, J., Richards, S., Nori, S. L., Fasano, S., Guida, M., Plunk, E., Viggiano, A., Pierantoni, R. & Meccariello, R. (2019). Neuro-toxic and Reproductive Effects of BPA. Current Neuropharmacology, 17(12), 1109–1132. https://doi.org/10.2174/1570159X17666190726112101
Sarria-Villa, R., Gallo-Corredor, J. & Perez, E. (2019). Bisfenol-A: Un contaminante presente en los envases plásticos. Revista ITTPA, 1(1), 35–41. https://doi.org/10.1016/j.envint.2018.02.041
Shafei, A., Ramzy, M. M., Hegazy, A. I., Husseny, A. K., EL-hadary, U. G., Taha, M. M. & Mosa, A. A. (2018). The molecular mechanisms of action of the endocrine disrupting chemical bisphenol A in the development of cancer. Gene, 647, 235–243. https://doi.org/10.1016/J.GENE.2018.01.016
Shen, J., Kang, Q., Mao, Y., Yuan, M., Le, F., Yang, X., Xu, X. & Jin, F. (2020). Urinary bisphenol A concentration is correlated with poorer oocyte retrieval and embryo implantation outcomes in patients with tubal factor infertility undergoing in vitro fertilisation. Ecotoxicology and Environmental Safety, 187, 109816. https://doi.org/10.1016/J.ECOENV.2019.109816
Sheng, Z., Wang, C., Ren, F., Liu, Y. & Zhu, B. (2019). Molecular mechanism of endocrine-disruptive effects induced by Bisphenol A: The role of transmembrane G-protein estrogen receptor 1 and integrin αvβ3. Journal of Environmental Sciences (China), 75, 1–13. https://doi.org/10.1016/j.jes.2018.05.002
Sierra-Marquez, L., Sierra-Marquez, J., De la Rosa, J. & Olivero-Verbel, J. (2017). Imposex in Stramonita haemastoma from coastal sites of Cartagena, Colombia. Brazilian Journal of Biology, 78(3), 548–555. https://doi.org/10.1590/1519-6984.173301
Simonelli, A., Guadagni, R., De Franciscis, P., Colacurci, N., Pieri, M., Basilicata, P., Pedata, P., Lamberti, M., Sannolo, N. & Miraglia, N. (2017). Environmental and occupational exposure to bisphenol A and endometriosis: urinary and peritoneal fluid concentration levels. International Archives of Occupational and Environmental Health, 90(1), 49–61. https://doi.org/10.1007/s00420-016-1171-1
Sivaranjanee, R. & Kumar, P. S. (2021). A review on remedial measures for effective separation of emerging contaminants from wastewater. Environmental Technology & Innovation, 23, 101741. https://doi.org/10.1016/j.eti.2021.101741
Son, S., Nam, K., Kim, H., Gye, M. C. & Shin, I. (2018). Cytotoxicity measurement of Bisphenol A (BPA) and its substitutes using human keratinocytes. Environmental Research, 164, 655–659. https://doi.org/10.1016/j.envres.2018.03.043
Sonavane, M. & Gassman, N. R. (2019). Bisphenol A co-exposure effects: a key factor in understanding BPA’s complex mechanism and health outcomes. Critical Reviews in Toxicology, 49(5), 371–386. https://doi.org/10.1080/10408444.2019.1621263
Song, D., Wu, G., Wei, Q. & Shi, F. (2019). Bisphenol A attenuates thyroxine‐induced apoptosis in ovarian granulosa cells of pigs. Reproduction in Domestic Animals, 54(6), 864–872. https://doi.org/10.1111/rda.13436
Soundararajan, A., Prabu, P., Mohan, V., Gibert, Y. & Balasubramanyam, M. (2019). Novel insights of elevated systemic levels of bisphenol-A (BPA) linked to poor glycemic control, accelerated cellular senescence and insulin resistance in patients with type 2 diabetes. Molecular and Cellular Biochemistry, 458(1–2), 171–183. https://doi.org/10.1007/s11010-019-03540-9
Spörndly-Nees, E., Boberg, J., Ekstedt, E., Holm, L., Fakhrzadeh, A., Dunder, L., Kushnir, M. M., Lejonklou, M. H. & Lind, P. M. (2018). Low-dose exposure to Bisphenol A during development has limited effects on male reproduction in midpubertal and aging Fischer 344 rats. Reproductive Toxicology, 81, 196–206. https://doi.org/10.1016/j.reprotox.2018.08.007
Tomza-Marciniak, A., Stępkowska, P., Kuba, J. & Pilarczyk, B. (2018). Effect of bisphenol A on reproductive processes: A review of in vitro, in vivo and epidemiological studies. Journal of Applied Toxicology : JAT, 38(1), 51–80. https://doi.org/10.1002/jat.3480
Wang, Q., Yang, H., Yang, M., Yu, Y., Yan, M., Zhou, L., Liu, X., Xiao, S., Yang, Y., Wang, Y., Zheng, L., Zhao, H. H. & Li, Y. (2019). Toxic effects of bisphenol A on goldfish gonad development and the possible pathway of BPA disturbance in female and male fish reproduction. Chemosphere, 221, 235–245. https://doi.org/10.1016/J.CHEMOSPHERE.2019.01.033
Yang, T. C., Peterson, K. E., Meeker, J. D., Sánchez, B. N., Zhang, Z., Cantoral, A., Solano, M. & Tellez-Rojo, M. M. (2017). Bisphenol A and phthalates in utero and in childhood: association with child BMI z-score and adiposity. Environmental Research, 156, 326–333. https://doi.org/10.1016/J.ENVRES.2017.03.038
Zhang, Y., Guan, Y., Zhang, T., Yuan, C., Liu, Y. & Wang, Z. (2018). Adult exposure to bisphenol A in rare minnow Gobiocypris rarus reduces sperm quality with disruption of testicular aquaporins. Chemosphere, 193, 365–375. https://doi.org/10.1016/j.chemosphere.2017.11.034
Zhang, Y. H., Wei, F., Zhang, J., Hao, L., Jiang, J., Dang, L., Mei, D., Fan, S. S., Yu, Y. & Jiang, L. (2017). Bisphenol A and estrogen induce proliferation of human thyroid tumor cells via an estrogen-receptor-dependent pathway. Archives of Biochemistry and Biophysics, 633, 29–39. https://doi.org/10.1016/J.ABB.2017.09.002
Zhang, Y., Mi, K., Xue, W., Wei, W. & Yang, H. (2020). Acute BPA exposure-induced oxidative stress, depressed immune genes expression and damage of hepatopancreas in red swamp crayfish Procambarus clarkii. Fish & Shellfish Immunology, 103, 95–102. https://doi.org/10.1016/j.fsi.2020.04.032
Zheng, B., Liu, R., Liu, Y., Jin, F. & An, L. (2015). Phenolic endocrine-disrupting chemicals and intersex in wild crucian carp from Hun River, China. Chemosphere, 120, 743–749. https://doi.org/10.1016/j.chemosphere.2014.10.049
Ziv-Gal, A. & Flaws, J. A. (2016). Evidence for bisphenol A-induced female infertility: a review (2007-2016). Fertility and Sterility, 106(4), 827–856. https://doi.org/10.1016/j.fertnstert.2016.06.027
Notas de autor
johana.marquez@curnvirtual.edu.co
Información adicional
CÓMO CITAR: Tamayo, F., Agaméz, J., Aparicio, D. y Márquez, J. (2022). Bisfenol A y efectos de disrupción endocrina en humanos y animales: Revisión sistemática. Revista de Investigación Agraria y Ambiental, 13(2), 175
– 200. DOI: https://doi.org/10.22490/21456453.4691
CONTRIBUCIÓN DE LA AUTORÍA: Fernando Tamayo: Recolección, análisis e interpretación de la información, escritura y borrador original. Jorge Agaméz: Recolección, análisis e interpretación de la información, escritura y borrador original. Dilia Aparicio: Escritura, revisión y edición. Johana Márquez: Supervisión, conceptualización, escritura, revisión y edición.
CONFLICTO
DE INTERESES: Los
autores declaran no tener ningún conflicto de intereses.
Enlace alternativo
https://hemeroteca.unad.edu.co/index.php/riaa/article/view/4691 (html)
https://hemeroteca.unad.edu.co/index.php/riaa/article/view/4691/5611 (pdf)

