Artículos de Investigación
Cultivo celular de una apatita bovina como sustituto óseo: pruebas preliminares
Cellular culture of a bovine apatite as a bone substitute: preliminar tests
Cultivo celular de una apatita bovina como sustituto óseo: pruebas preliminares
Informador Técnico, vol. 82, núm. 2, 2018
Servicio Nacional de Aprendizaje
Recepción: 17 Febrero 2018
Aprobación: 27 Junio 2018
Resumen: Las pérdidas óseas limitan la posibilidad de rehabilitaciones odontológicas, siendo necesario en muchas ocasiones realizar procedimientos de reconstrucción ósea para la colocación de implantes intraóseos y mejorar los perfiles protésicos, para lo cual se indican los sustitutos óseos. El sustituto ideal es el hueso autólogo, pero existen alternativas como el tejido proveniente de donantes (homólogo), el de origen animal (xenólogo) y el sintético (aloplástico). En la Escuela de Ingeniería de Materiales de la Universidad del Valle se está desarrollando un sustituto óseo a partir de hidroxiapatita bovina, la cual fue obtenida de huesos de ternera procedentes de la industria cárnica, los cuales fueron lavados para eliminar grasa y tejidos blandos, fraccionados, molidos y sometidos a tratamiento térmico a 800 °C. Las muestras fueron caracterizadas mediante difracción de Rayos X (DRX) y espectroscopía de infrarrojos por transformada de Fourier (FTIR); en este trabajo se evaluó la capacidad osteoconductora del material realizando pruebas preliminares a 15 muestras que fueron cultivadas con osteoblastos por 15 días. Se determinaron las características de superficie de dichas muestras con Microscopía Electrónica de Barrido (SEM) y Espectroscopia por Energía Dispersiva (EDS), con lo que se determinaron las funciones celulares como adhesión, maduración y formación de matriz extracelular. Los resultados mostraron adhesión y crecimiento celular, además de presencia de depósitos compatibles con matriz ósea extracelular con contenido orgánico e inorgánico, lo cual es un indicador de maduración.
Palabras clave: Hidroxiapatita, injertos óseos, xenoinjerto, matriz extracelular, osteoblastos.
Abstract: The bone loss limits the possibility of dental rehabilitation, being necessary in many occasions to carry out bone reconstruction process for the placement of intraosseous implants and to improve the prosthetics profiles. The autologous bone is the ideal substitute, but there are other alternatives such as tissue of donor origin (homologous), animal origin (xenologous) and synthetic origin (alloplastic). At the engineering school of materials of the university of Valle, a bone substitute is being developed from bovine hydroxyapatite, which was obtained from veal bones previously washed (to eliminate fat and soft tissues) provided by the beef industry. These bones were fractionated, ground, and submitted to a thermal treatment up to 800 celsius degrees.The samples were characterised by X ray diffraction and fourier transformed infrared spectroscopy (FTIR). In this paper, the osteoconduction of the material was evaluated; for this purpose, 15 samples were submitted to preliminary tests and then cultured with osteoblasts for 15 days.The surface characteristics of these samples were determined by scanning electron microscopy (SEM) and energy dispersive spectroscopy (EDS), these characteristics determined cellular functions such as adhesion, maturation and extracellular matrix formation.The results revealed adhesion and cellular growth, as well as the presence of deposits that are compatible with extracellular osseous matrix and that disclose organic and inorganic contents, which is an indicator for maturing.
Keywords: Hydroxyapatite, bone grafts, xenograft, extracellular matrix, osteoblasts.
Introducción
Los huesos son órganos vascularizados e inervados que están compuestos de tejido óseo, médula ósea y un tejido conectivo circundante llamado periostio. Los huesos desempeñan una serie de funciones tales como apoyo a los músculos, protección de órganos internos, producción de sangre, homeostasis del calcio, tampón ácido / base, entre otros (Ratner, Hoffman, Schoen, y Lemons, 1996).
Existen varios tipos de células implicadas en la formación y remodelación del tejido óseo; entre éstas los osteoblastos, que son los encargados de sintetizar la matriz ósea; los osteocitos, los cuales son células diferenciadas terminalmente a partir de osteoblastos maduros que se han quedado dentro de una matriz calcificada; las células de recubrimiento óseo, también diferenciadas a partir de osteoblastos; y por último, los osteoclastos, cuyo papel en el metabolismo óseo es la resorción del hueso (Rucci y Teti, 2016).
Hay numerosos estudios sobre hueso debido (entre otras razones) a que es el segundo tejido más injertado; es considerado un tejido complejo con una estructura y una composición única que le permiten adaptarse a los requerimientos biológicos y biomecánicos del sistema, pero además posee capacidad de auto-regenerarse; sin embargo, la capacidad de auto-reparación está limitada por la pérdida de sustancia; en situaciones de pérdidas grandes (lesiones de tamaño crítico) se debe recurrir a sustitutos idóneos, cuya búsqueda ha impulsado importantes desarrollos en el campo de la ingeniería de tejido (Igwe, Amini, Mikael, Laurencin, y Nukavarapu, 2011).
En los últimos años, el desarrollo de las técnicas regenerativas ha dado impulso a la búsqueda de nuevos materiales para regeneración ósea que tendrían la función de actuar como matrices temporales estimulando a las células del tejido óseo para formar y mantener la matriz extracelular recuperándose una parte del tejido perdido. Para este fin se han creado los sustitutos óseos que suplen y regeneran los defectos del sistema estomatognático, originados en su mayor parte por pérdidas dentarias, traumas faciales y enfermedades sistémicas.
Los sustitutos deben cumplir ciertas funciones principales para lograr su desempeño como injerto óseo. Dentro de estas funciones se encuentran:
Osteogénesis: “Es la formación ósea que se produce desde las células que están presentes en el injerto, sobreviviendo al trasplante, proliferando y diferenciándose en osteoblastos” (Kao y Scott, 2007).
Osteoinducción: Es la formación ósea en sitios donde normalmente no se forma hueso; “… es la estimulación y reclutamiento de células indiferenciadas mesenquimales en el sitio del injerto. Una vez en el sitio del injerto, las células madre se activan para diferenciarse en condrocitos y osteoblastos” (Kao y Scott, 2007), puede ser activa o pasiva (Daculsi, Fellah, Miramond, y Durand, 2013) .
Osteoconducción: Es el crecimiento de tejido y células madres mesenquimales en la estructura del material de injerto, esta matriz apoya y facilita el crecimiento del huésped, la migración de células osteoblásticas y la eventual fabricación de nuevo hueso (Daculsi et al., 2013).
Osteointegración: Es la capacidad del injerto para integrar y unirse al hueso receptor generando una resistencia estructural del material injertado a la compresión, torsión y al cizallamiento. Para que el injerto sea funcional, debe existir una cantidad de hueso nuevo en el injerto y unirse con el hueso del huésped (Kao y Scott, 2007).
Los sustitutos óseos se clasifican dependiendo del material del cual son obtenidos en:
Autoinjertos: Tejido obtenido de otro sitio del mismo organismo que lo recibe (injerto autólogo). Son la mejor opción para defectos de gran tamaño, aunque presentan desventajas como mayor trauma quirúrgico, incremento del dolor para el paciente y mayor morbilidad (Tortolini y Rubio, 2012).
Aloinjertos (homoinjertos): Tejido obtenido a partir de individuos donantes de la misma especie (Kao y Scott, 2007).
Xenoinjertos: Tejido obtenido de una especie genéticamente diferente al huésped. Uno de los xenoinjertos más utilizados es el hueso bovino (Kao y Scott, 2007).
Aloplásticos: Son materiales sintetizados en el laboratorio, los más utilizados son las cerámicas y los polímeros (Tortolini y Rubio, 2012).
El hueso autólogo ha sido considerado como el gold standar por sus cualidades osteogénicas, osteoinductivas y osteoconductivas (Wu, Li, y Lin, 2016), sin embargo, presenta algunas limitaciones, como el aumento del tiempo quirúrgico para la extracción del injerto óseo, la morbilidad del sitio del donante, la resorción del injerto y la disponibilidad limitada.
En el caso de regeneración de defectos de tamaño pequeño en cavidad oral es posible utilizar como sitios donantes la sínfisis mentoniana, la tuberosidad del maxilar y la rama mandibular (Tortolini y Rubio, 2012) y se ha estudiado la factibilidad de uso del proceso palatino maxilar como posible sitio donador para la reconstrucción de defectos (Bernades, Guijarro, y Hernández, 2016). El proceso palatino maxilar muestra una serie de ventajas, como la ubicación, tamaño y tipo de injerto; pero hay posibles complicaciones intra y postoperatorias (Wu et al., 2016).
Las complicaciones relacionadas con los autoinjertos y la limitada oferta por ausencia de un número adecuado de donantes, en el caso de los homoinjertos, ha hecho necesaria la utilización de otras fuentes como los xenoinjertos y aloplásticos.
En las últimas décadas la hidroxiapatita ha sido considerada como la biocerámica más destacada con uso amplio en ortopedia y en odontología, su amplia utilización se explica por la similitud que presenta en su composición química y su similitud cristalográfica con el componente inorgánico de la matriz ósea extracelular (Ayatollahi, Yahya, Asgharzadeh Shirazi, y Has San, 2015). Vallet (2010) había mencionado la llegada de las biocerámicas de tercera generación, las cuales se consideran materiales bioactivos.
La demanda por cerámicas bioactivas se ha incrementado debido a sus propiedades biológicas que le permiten integrarse fácilmente con el hueso receptor (Niakan et al., 2015). El hueso bovino es considerado una fuente potencial para la obtención de hidroxiapatita debido a que es un material económico, fácilmente disponible y con características muy similares al hueso humano (Ayatollahi et al., 2015). Por tanto, en este artículo se presentan las caracterizaciones preliminares a un material cerámico de origen bovino con un uso potencial como sustituto óseo.
Materiales y métodos
Las partículas de apatita utilizadas fueron obtenidas en la Escuela de Ingeniería de materiales de la universidad del Valle (UV) a partir de huesos de ternera procedentes de la industria cárnica, los cuales fueron inicialmente lavados para eliminar tejidos blandos, fraccionados y sometidos a un proceso de secado a 130 ºC durante 24 horas, bajo atmosfera de aire; posteriormente los fragmentos se molieron con molino de martillo y molino de bolas, para luego realizar el tratamiento térmico final a una tasa de calentamiento de 5 °C/min y 2 horas de sostenimiento a la temperatura de 800 °C.
Inicialmente a las partículas de hueso tratados térmicamente (a 800 °C), sin cultivar, se les realizó una serie de caracterizaciones, donde se esperaba observar la influencia del tratamiento térmico y tipo de hueso (tibia) en los resultados obtenidos, entre ellos: la porosidad (microporosidad y macroporosidad), la presencia o ausencia de compuestos orgánicos (como por ejemplo, grasas y proteínas), la microestructura y el grado de cristalinidad del fosfato de calcio fueron tomados en cuenta después de cultivar partículas grandes de aproximadamente 500-600 µm con osteoblastos por 15 días.
Se realizó un ensayo de FTIR a muestras de hidroxiapatita comercial, a muestras de hueso (porción cortical) y a las muestras experimentales con el fin de compararlas y determinar la presencia del componente orgánico de la matriz ósea extracelular. Los espectros se obtuvieron en un espectrofotómetro infrarrojo por Transformada de Fourier marca NICOLET 6700 FT-IR. Las muestras de fosfato de calcio fueron mezcladas con KBr y prensadas para formar pastillas, las cuales fueron analizadas en modo de transmisión en el intervalo de 4000 – 450 cm-1.
Las muestras fueron caracterizadas mediante difracción de rayos X (DRX) para estudiar el incremento del grado de cristalinidad del mineral al aumentar la temperatura del tratamiento térmico a 800 °C; los patrones de difracción de rayos X de las partículas analizadas se obtuvieron en un equipo de rayos PANalytical modelo X´Pert Powder con geometría Bragg Brentano, utilizando radiación Kα Cu (λ=1,54056 Å). La muestra se colocó en un porta muestras rotatorio y las difracciones se registraron en un intervalo angular de 10°< 2θ < 70°.
Para los ensayos de cultivo celular se seleccionaron partículas de las muestras con tratamiento térmico a 800 °C; quince partículas de un tamaño promedio de 500 µm x 600 µm fueron seleccionados mediante tamizaje; cultivadas con osteoblastos murinos de un cultivo primario previamente caracterizado; mantenidas en medio de crecimiento osteogénico (OGM™) durante 15 días, en cabina de incubación con CO2 al 5 % a 37 °C y cambio de medio cada 3 días; después de completar el tiempo de cultivo, fueron retiradas y fijadas en alcoholes ascendentes (50 %, 60 %, 70 %, 80 %, 95 % y 100 %) y secadas en cabinas de seguridad biológica a temperatura ambiente; una vez deshidratadas se analizaron por SEM y EDS para estudiar adhesión celular y formación de matriz ósea extracelular.
Esta investigación contó con el aval del comité de revisión de Ética de la Universidad del Valle.
Resultados y discusión
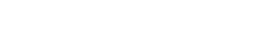
La prueba de infrarrojo con transformada de Fourier (FTIR) es utilizada habitualmente para detectar presencia de componentes orgánicos e inorgánicos, en este trabajo se compararon las muestras de la apatita obtenida con muestras de hueso cortical y con muestras de hidroxiapatita comercial, encontrándose que en la apatita obtenida los espectros eran diferentes a los de las otras dos estudiadas, evidenciándose la ausencia de componentes orgánicos de la matriz ósea extracelular.
El espectro infrarrojo del hueso ha sido reportado por algunos investigadores, mostrando la presencia de las especies inorgánicas principales, grupos fosfato y carbonato, y también componentes orgánicos tales como grupos funcionales amida de los constituyentes de proteínas de hueso, es decir, colágeno (Boskey y Camacho, 2007). Las bandas asociadas con los grupos amida de proteínas de hueso en números de onda 1250, 1560 y 1650 cm-1, efectivamente aparecieron en el FTIR del hueso deshidratado en la presente investigación, en números de onda 1250, 1549,4 y 1652,6 cm-1; por otra parte, también hay presencia de bandas de absorción relacionadas con los enlaces C-H en números de onda 2852,6 y 2925,9 cm-1, tal como se observa en la Figura 1. Para analizar las bandas correspondientes a los componentes inorgánicos que aparecen en el espectro del hueso femoral de la figura 1, se pueden dividir las mismas en tres principales categorías, bandas de fosfatos, bandas de carbonatos y bandas del grupo hidroxilo. Una banda fuerte y relativamente ancha a 1043,6 cm-1, bandas relativamente fuertes y estrechas a 472,5, 565,9 y 600 cm-1, y otras a 961,5 y 1089,0 cm-1 que aparecen en el espectro FTIR están relacionadas a los grupos fosfato; las bandas que aparecen a 874,7, 1417,5 y 1456,2 cm-1 están asociadas con los grupos carbonato con sustitución tipo B. Continuando con el análisis del espectro, encontramos que las bandas a 1250, 1549,4, 1652,6, 2852,6 y 2925,9 cm-1 han desaparecido después del tratamiento térmico del hueso (800 °C). Se puede inferir que lo anterior puede deberse a la eliminación de carbono y los grupos amida asociados a las proteínas presentes en el hueso en forma de gas de dióxido de carbono en presencia del oxígeno del aire. Las bandas originadas por los grupos fosfato (1041,4, 464,8, 565,0, 601,7, 960,4 y 1089,0 cm-1) y carbonato (874,7, 1419,8 y 1454,9 cm-1) siguen apareciendo aproximadamente en las mismas longitudes de onda que para el hueso sin tratar térmicamente, lo que confirma que todas las bandas observadas en el FTIR del fosfato de calcio natural están relacionadas con los componentes inorgánicos del hueso que se trató térmicamente (Younesi, Javadpour, y Bahrololoom, 2011).
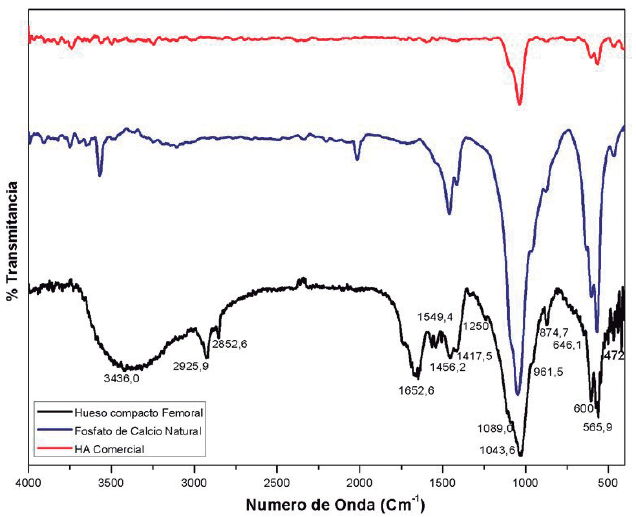
La Figura 2 presenta los patrones DRX de hueso compacto femoral (deshidratado a 130 °C), de Apatita Natural (partículas de hueso a las que se les realizó tratamiento térmico a 800 °C) y de HA comercial usada como referencia en esta investigación. Se puede observar que al realizar el tratamiento térmico (800 °C) a partículas de hueso compacto, los patrones de difracción muestran un incremento significativo de los picos, no obstante, los picos de difracción del hueso deshidratado (130 °C) son muy anchos y poco alargados. Lo anterior nos permite evidenciar el incremento del grado de cristalinidad del mineral al aumentar la temperatura del tratamiento térmico.
Observaciones similares han sido reportadas por Shipman, Foster, y Schoeninger (1984), ellos analizaron los resultados de los patrones de DRX en términos de alteración en el tamaño del cristal, encontrando que se presentaba un incremento gradual en el tamaño del cristal de HA asociado con el incremento de la temperatura del tratamiento térmico. Por otro lado, hay que anotar que algunos factores químicos pueden afectar el tamaño de cristalito, entre los que se encuentra la desnaturalización de la matriz ósea durante la calcinación a través de la liberación de agua puesto que los cristales minerales recristalizan y la eliminación de las redes de fibrillas de colágeno influye en el tamaño de los cristalitos de la ceniza de hueso (Rootare y Craig, 1977).
En las imágenes SEM de la Figura 3, correspondientes al fosfato de calcio natural, se puede observar que el tratamiento térmico de las partículas de hueso compacto de tibia molido (800 °C) da lugar a la formación de granos de gran tamaño. La formación de las partículas grandes en el proceso térmico puede deberse a la tendencia de los granos de fosfato de calcio a aglomerarse y crecer a altas temperaturas (Meejoo, Maneeprakorn, y Winotai, 2006). En la Figura 3, la micrografía del fosfato de calcio natural a bajos aumentos (150X) muestra la presencia de granos con geometría irregular, de diferentes tamaños y muy angulosos. Al realizar un mayor aumento (2000X) a las partículas, se observa que están completamente pobladas de poros con forma irregular, que presentaron tamaños desde 4 a 14 µm y algunas regiones cavernosas de hasta 50 µm. Este resultado es muy importante, puesto que se ha encontrado que cuando los fosfatos de calcio son porosos ofrecen una química de superficie que conduce a la nueva formación del hueso (Hendriks, Riesle, y Blitterswijk, 2010; López, 2003).

Los análisis con SEM realizados en todas las muestras cultivadas revelan cómo las células (osteoblastos) aprovecharon las superficies irregulares de los granos para anclarse y producir matriz extracelular (figura 4).
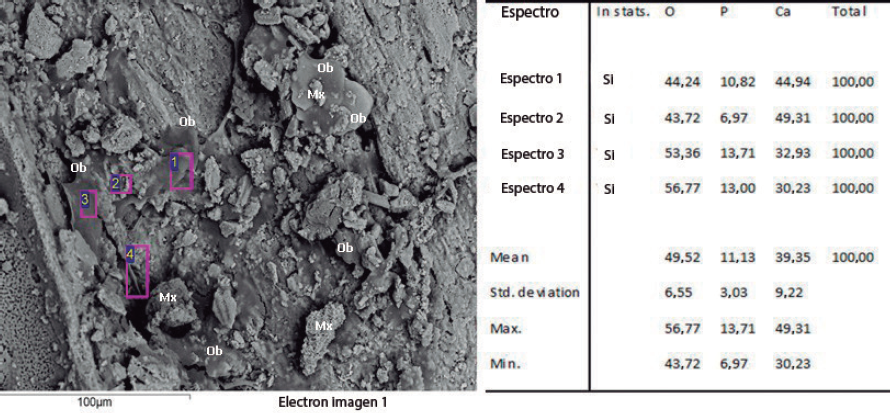
Los depósitos de material observados en las micrografías muestran estructuras fibrilares compatibles con colágeno y depósitos de fosfato de calcio, evidenciados mediante análisis por energía dispersiva (EDS); adicionalmente 2 de las 15 muestras mostraron presencia de nitrógeno (Figura 5), indicando la presencia de proteínas en la matriz extracelular formada.
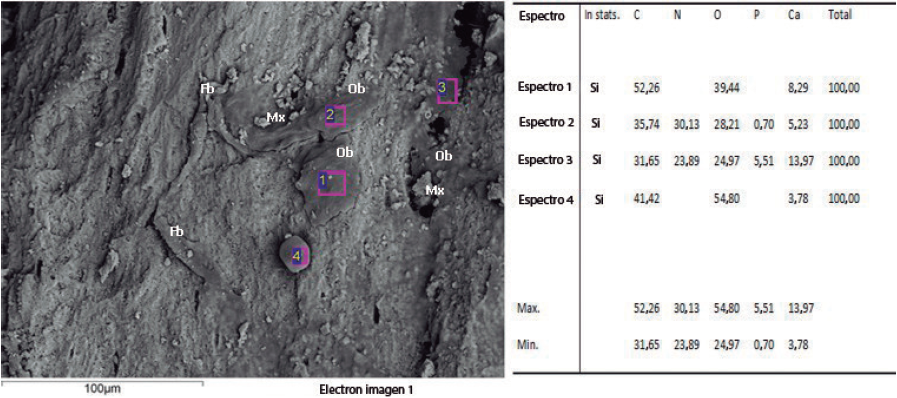
El hallazgo tanto de fosfato de calcio como de nitrógeno en los análisis realizados son importantes en la medida que muestran cómo se está formando y mineralizando la matriz extracelular; de acuerdo con la caracterización realizada por Siggelkow et al.(1999) en un cultivo de osteoblastos murinos. La etapa proliferativa ocurre entre los días 0 y 12, la de maduración entre los días 12 y 20 y la de mineralización a partir del día 20, en esa investigación los cultivos se suspendieron al día 15, para este tiempo lo esperado era el hallazgo de colágeno y presencia de proteínas de matriz, así como depósitos de calcio y fosforo procedentes de los ostoblastos.
Nudelman, Lausch, Sommerdijk, y Sone (2013) muestran cómo el fosfato de calcio que se precipita inicialmente en la formación de la matriz extracelular bajo condiciones in vitro no se cristaliza como un producto estable, pero posteriormente se transforma en una fase más estable. En cuanto a los contenidos proteicos, éstos están representados en las proteínas colágenas cuya función es ensamblar la matriz extracelular y las proteínas no colágenas que guían el ensamble mismo de la matriz y su mineralización.
Conclusiones
Los resultados de la presente investigación mostraron que partículas de apatita natural de origen bovino permitieron la adhesión y proliferación de osteoblastos en su superficie, con la formación de depósitos de material compatibles con componentes orgánicos e inorgánicos de la matriz ósea extracelular.
Referencias
Ayatollahi, M. R., Yahya, M. Y., Asgharzadeh Shirazi, H., y Hassan, S. A. (2015). Mechanical and tribological properties of hydroxyapatite nanoparticles extracted from natural bovine bone and the bone cement developed by nano-sized bovine hydroxyapatite filler. Ceramics International, 41(9), 10818–10827. doi: https://doi.org/10.1016/j.ceramint.2015.05.021
Bernades Mayordomo, R., Guijarro Martínez, R., y Hernández Alfaro, F. (2016). The anterior maxilla as a potential source of bone grafts: a morphometric cone beam computed tomography analysis of different anatomical areas. International Journal of Oral and Maxillofacial Surgery, 45(8), 1049–1056. doi: https://doi.org/10.1016/j.ijom.2016.03.001
Boskey, A., y Camacho, N. P. (2007). FT-IR imaging of native and tissue-engineered bone and cartilage. Biomaterials, 28(15), 2465–2478. doi: https://doi.org/10.1016/j.biomaterials.2006.11.043
Daculsi, G., Fellah, B. H., Miramond, T., y Durand, M. (2013). Osteoconduction, Osteogenicity, Osteoinduction, what are the fundamental properties for a smart bone substitutes. Irbm, 34(4–5), 346–348. doi: https://doi.org/10.1016/j.irbm.2013.07.001
Hendriks, J., Riesle, J., y Blitterswijk, C. A. van. (2007). Co-culture in cartilage tissue engineering. Journal of Tissue Engineering and Regenerative Medicine, 1(3), 170–178.
Igwe, J., Amini, A., Mikael, P., Laurencin, C., y Nukavarapu, S. (2011). Nanostructured scaffolds for bone tissue engineering. InActive implants and scaffolds for tissue regeneration (pp. 169–192). Berlin, Heidelberg: Springer. doi: https://doi.org/10.1007/8415_2010_60
Kao, S. T., y Scott, D. D. (2007). A Review of Bone Substitutes. Oral Maxillofacial Surgery Clinics, 19(4), 513–521. doi: https://doi.org/10.1016/j.coms.2007.06.002
Khairallah, M., y Almeshaly, H. (2016). Present Strategies for Critical Bone Defects Regeneration. Oral health case Rep 2016, 2:3, 2:3.
López, M. E. (2003). Hidroxiapatita macroporosa obtenida en la Universidad de Antioquia: síntesis, caracterización y comparación con el hueso esponjoso y calcinado de bovino. Revista Facultad de Ingeniería, 30(30), 109–124.
Meejoo, S., Maneeprakorn, W., y Winotai, P. (2006). Phase and thermal stability of nanocrystalline hydroxyapatite prepared via microwave heating. Thermochimica Acta, 447(1), 115–120. doi: https://doi.org/10.1016/j.tca.2006.04.013
Niakan, A., Ramesh, S., Ganesan, P., Tan, C. Y., Purbolaksono, J., Chandran, H., … Teng, W. D. (2015). Sintering behaviour of natural porous hydroxyapatite derived from bovine bone. Ceramics International, 41(2), 3024–3029. doi: https://doi.org/10.1016/j.ceramint.2014.10.138
Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., y Sone, E. D. (2013). In vitro models of collagen biomineralization. Journal of Structural Biology. 183(2), 258-269. doi: https://doi.org/10.1016/j.jsb.2013.04.003
Ratner, B. D., Hoffman, A. S., Schoen, F. J., y Lemons, J. E. (1996). Biomaterials Science: An Introduction to Materials in Medicine. San Diego, CA, USA: Academic. doi: https://doi.org/10.1016/B978-0-08-087780-8.00148-0
Rootare, H., y Craig, R. (1977). Vapor Phase Adsorption of Water on Hydroxyapatite. Journal of dental research, 56(12), 1437–1488.
Rucci, N., y Teti, A. (2016). The “love-hate” relationship between osteoclasts and bone matrix. Matrix Biology, 52, 176–190. doi: https://doi.org/10.1016/j.matbio.2016.02.009
Shipman, P., Foster, G., y Schoeninger, M. (1984). Burnt Bones and Teeth: An Experimental Study of Color, Morphology, Crystal Structure and Shrinkage. Journal of archaeological science, 11(4), 307–325.
Siggelkow, H., Rebenstorff, K., Kurre, W., Niedhart, C., Engel, I., Schulz, H., … Hüfner, M. (1999). Development of the osteoblast phenotype in primary human osteoblasts in culture: Comparison with rat calvarial cells in osteoblast differentiation. Journal of Cellular Biochemistry, 75(1), 22–35.
Tortolini, P., y Rubio, S. (2012). Diferentes alternativas de rellenos óseos. Avances En Periodoncia E Implantología Oral, 24(3), 133–138.
Vallet, M. (2010). Tendencias en Biomateriales. Revista de La Fundación de Ciencias de La Salud, Eidon, 33, 6–10.
Wu, J., Li, B., y Lin, X. (2016). Histological outcomes of sinus augmentation for dental implants with calcium phosphate or deproteinized bovine bone: a systematic review and meta-analysis. International Journal of Oral and Maxillofacial Surgery, 45(11), 1471–1477. doi: https://doi.org/10.1016/j.ijom.2016.04.020
Younesi, M., Javadpour, S., y Bahrololoom, M. E. (2011). Effect of heat treatment temperature on chemical compositions of extracted hydroxyapatite from bovine bone ash. Journal of Materials Engineering and Performance, 20(8), 1484–1490. doi: https://doi.org/10.1007/s11665-010-9785-z
Información adicional
Cómo citar: Payán
Valero, A., Moreno Cepeda, Y., Gil Bedoya, J. P., Grueso Ruiz, L., Guzmán
Valencia, J., Lozano Nieva, K. J., Pustovrh Ramos, M. C. y Valencia Llano, C.
H. (2018). Cultivo celular de una apatita bovina como sustituto óseo: pruebas
preliminares. Informador Técnico, 82(2),
172-180.