

Germinación in vitro de embriones de Nogal (Juglans boliviana)
Germination in vitro embryo of Walnut (Juglans boliviana)
Journal of the Selva Andina Biosphere, vol.. 3, núm. 1, 2015
Selva Andina Research Society


NOTAS TÉCNICAS
Recepción: 01 Marzo 2014
Aprobación: 01 Abril 2015
Publicación: 01 Mayo 2015
DOI: https://doi.org/10.36610/j.jsab.2015.030100015
Resumen: Juglans boliviana es una especie forestal importante que se encuentra dentro de los bosques húmedos de Bolivia. La semilla de esta especie es recalcitrante con cubierta endurecida, la cual dificulta la germinación y propagación de la especie. El objetivo de este trabajo fue determinar el medio de cultivo para la germinación in vitro de embriones maduros de Juglans boliviana. Inicialmente se determinó la técnica de escarificación y el proceso de desinfección. Posteriormente se realizó el cultivo in vitro utilizando el medio de cultivo Woody Plant Medium (WPM) con la adición de fitorreguladores (ácido indolbutírico y 6-bencil aminopurina) en diferentes concentraciones. Como testigo se utilizó el medio de cultivo WPM al 100%. Las variables de respuesta evaluadas fueron: porcentaje de contaminación y germinación; longitud de vitroplanta, número de hojas, número de brotes, número de raíces por vitroplanta, longitud de raíces y porcentaje de sobrevivencia. La germinación in vitro de vitroplantas en los tratamientos y el testigo en el l medio de cultivo WPM suplementado con 0.15 mg/l de IBA y 1.5 mg/l de BAP fue de un 90%; los otros tratamientos inhiben el crecimiento del tallo y las raíces de vitroplantas.
Palabras clave: Germinación, semilla, embrión, escarificación, medio de cultivo, fitorreguladores.
Abstract: Bolivian Juglans is an important forest species found in the rain forests of Bolivia. The seed of this species is recalcitrant with hardened cover, which hinders germination and propagation of the species. The aim of this study was to determine the culture medium for in vitro germination of mature embryos of Bolivian Juglans. Technique initially scarification and disinfection process was determined. Subsequently in vitro culture was performed using the culture medium Woody Plant Medium (WPM) with the addition of plant growth regulators (indole butyric acid and 6-benzyl aminopurine) in different concentrations. As control WPM, culture medium was used 100%. Response variables evaluated were percentage of contamination and germination; vitroplant length, number of leaves, number of shoots, number of roots per vitroplant, root length and percentage of survival. The plantlets in vitro germination in treatments and the control in the middle l culture WPM supplemented with 0.15 mg / l of IBA and 1.5 mg / l BAP was 90%; other treatments inhibit the growth of the stem and roots of plantlets.
Keywords: Germination, seed, embryo, scarification, medium of cultivation, phytoregulators.
Introducción
El Nogal (Juglans boliviana) es una especie maderable que se encuentra dentro la categoría de Casi Amenazada, según la lista roja preliminar del Herbario Nacional de Bolivia (Meneses & Beck 2005). Juglans boliviana no tiene programas de manejo para su extracción, por lo que existe amenaza de extinción de la especie.
Las semillas de Juglans boliviana son nueces de color café oscuro y de testa gruesa, la nuez presenta una cubierta o episperma endurecida, la cual no se abre ni se fragmenta cuando llega a la madurez (Rodríguez 1991). Esta característica ocasiona la difícil germinación y propagación de la especie (García 2002).
La semilla es recalcitrante y tiene una viabilidad de 3 meses en un almacenamiento a 4 ºC y se caracterizan por su sensibilidad a la deshidratación y una rápida pérdida de viabilidad posterior a la diseminación, lo que implica limitaciones graves para el almacenamiento de la semilla con fines de propagación (Magnitskiy & Plaza 2007).
El cultivo in vitro permite acelerar y facilitar la germinación de las semillas, la cual a veces representa un obstáculo grande para la multiplicación efectiva de las plantas (Ibisch 2003).
Una de las técnicas de cultivo de tejidos de forma aséptica es el cultivo in vitro de embriones (Hartmann & Kester 1992). Esta técnica implica el aislamiento de un embrión y su germinación in vitro, con el fin de obtener una planta viable, pudiendo tener varias utilidades como la prevención del aborto embrionario (Pierik 1990). Por otra parte, esta técnica es útil para inducir la pronta germinación de semillas maduras en letargo, superando las restricciones ocasionadas por la cubierta de la semilla o del endospermo (Hartmann & Kester 1992).
El propósito del presente trabajo fue evaluar la germinación in vitro de embriones maduros de Juglans boliviana, en el medio de cultivo Woody Plant Medium (WPM) con la adición de fitorreguladores: ácido indolbutírico IBA y 6 bencil aminopurina (BAP) en diferentes concentraciones.
Materiales y métodos
Se utilizó como material vegetal, 700 semillas de Nogal Juglans boliviana, procedente del “Banco de Germoplasma de Especies Tropicales Forestales Agrícolas”, que conservan la semilla a una temperatura promedio de -15 ºC, se encuentra en el municipio de Palos Blancos ubicado en la provincia de Sud Yungas en el departamento de La Paz a una altura de 414 msnm, a una temperatura promedio de 30 ºC y una humedad relativa que varía de 20% a 50%.
El estudio fue realizado en el Laboratorio de Biotecnología Vegetal del Centro de Investigaciones de Ciencia y Tecnología de la Escuela Militar de Ingeniería (CICYT) situado en la meseta de Alto Irpavi provincia Murillo de la ciudad de La Paz, este sector presenta un clima templado con una temperatura media de 21 ºC y la mínima anual de -2 ºC, humedad relativa de 65% a 85% a una altura de 3650 msnm. El desarrollo de la investigación fue de febrero a septiembre 2010.
La investigación se dividió en tres etapas (i) se realizó pruebas preliminares, dónde se determinó la técnica de escarificación de las semillas y el proceso de desinfección de los endospermos. (ii) selección del material. (iii) se realizó el establecimiento y estudió la germinación in vitro.
Para la escarificación de las semillas se utilizaron tres técnicas:
Escarificación con agua, se introdujo 20 semillas en agua en estado de ebullición a 76 ºC, luego se esperó a que la temperatura baje a 30 ºC e inmediatamente se introdujo a la incubadora (marca boekel scientific, serie 030200586).
Escarificación con ácidos, se utilizó tres semillas, en cada una se vertió 100 mL de ácidos diferentes: ácido sulfúrico (PA) a una concentración del 98%, densidad 184, número de lote 568, ácido clorhídrico (PA) a una concentración del 37%, densidad 1.19, número de lote 1789 y ácido nítrico (PA) a una concentración de 65%, densidad 1.42, número de lote 798190 en relación 3:1 (agua regia) respectivamente. El tiempo de tratamiento fue de 24 horas a una temperatura de 20 ºC.
Escarificación mediante la remoción total de la cascara, se utilizó una prensa de compresión manual de capacidad de 50 KN marca E.L.E. para fraccionar la semilla.
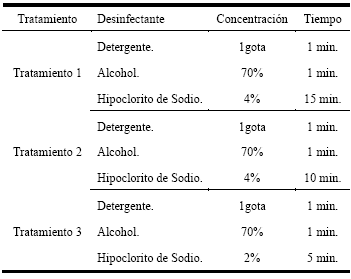
Se realizó la desinfección de la parte superior de 21 endospermos. Estos fueron divididos en tres grupos, aplicando un tratamiento diferente a cada grupo. Los desinfectantes utilizados fueron detergente, alcohol etílico e hipoclorito de sodio.
Todos los tratamientos consistían en desinfectar los endospermos en una solución de detergente antibacterias y alcohol etílico al 70% durante un minuto, sin embargo estos varían según la concentración y tiempo de inmersión del explante en el hipoclorito de sodio. Para el tratamiento 1, se tiene hipoclorito de sodio al 4% durante 15 min., para el tratamiento 2, al 4% durante 10 min., y para el tratamiento 3, al 2% durante 10 min.
Una vez realizada la escarificación y desinfección se seleccionó el material vegetal, utilizándose 425 semillas.
Se seleccionaron los embriones para la siembra en un medio de cultivo básico (WPM al 100%), con la adición de fitorreguladores en diferentes concentraciones: a) 0.15, 0.2 y 0.25 mg/L de ácido indolbutírico (IBA) código I-5386, marca SIGMA, lote 042K1664 y, b) 1.5, 2.0, y 2.5 mg/L de 6- bencil aminopurina (BAP) código B3408, lote 59H3868. La combinación de las concentraciones dio nueve tratamientos. Como muestra testigo, se utilizó el medio de cultivo WPM sin la adición de fitorreguladores. Los medios de cultivo se ajustaron a un pH de 5.6 ± 0.2, y fueron esterilizados durante 15 minutos en un autoclave a 121 ºC y 1.5 atmósferas de presión.
El diseño utilizado fue completamente al azar con arreglo bifactorial y testigo añadido. Se realizaron tres repeticiones por cada tratamiento. Las variables de respuesta fueron: (i) porcentaje de contaminación, (ii) porcentaje de germinación, (iii) longitud de la vitroplanta, (iv) número de hojas, (v) número de brotes, (vi) número de vitroplantas con raíces, (vii) longitud de la vitroplanta y (viii) porcentaje de sobrevivencia.
Los datos fueron analizados con el análisis de varianza (ANVA). Diferencias estadísticas en los grupos fueron analizados con la prueba DUNCAN y con el Análisis se efectos simples. Los datos en porcentajes se transformaron con la función sen-1 (√%/100), y los datos de las variables de respuesta: número de hojas, brotes, y número de vitroplantas con raíces, se transformaron a (x+0,5)1/2 (Arteaga 2004).
Resultados
No se obtuvieron resultados favorables en la escarificación mediante el remojo de las semillas en agua y en ácidos, debido a que la episperma de la semilla seguía endurecida.
Los resultados fueron favorables en la remoción total de la cáscara mediante la prensa mecánica manual, debido a que se pudo extraer el endospermo de las semillas (figura 1).

A los dos meses algunas vitroplantas miden aproximadamente 3 cm de longitud y se observa la formación de raíces, principalmente en las vitroplantas testigo.

Según el análisis de varianza, para la variable de respuesta longitud de la vitroplanta, existen diferencias en los tratamientos en relación a los factores de estudio y el testigo. Las vitroplantas testigo miden en promedio 7.50 mm de longitud y las vitroplantas con tratamientos miden 9.75 mm de longitud (figura 3).

A) vitroplanta testigo y B) vitroplanta con tratamiento

Existen diferencias altamente significativas de los tratamientos con relación al testigo. Las vitroplantas testigo presentan raíces con una longitud 13.02 mm y las vitroplantas con tratamiento presentan una longitud de 4.27 mm.
Discusión
En la desinfección se utilizó el tratamiento 3 (solución de detergente durante 1 minuto, alcohol al 70% durante 1 min., e hipoclorito de sodio al 2% durante 2 min), debido a que existe mayor número de explantes vivos (5 muestras vivas) y no existe la presencia de muestras necróticas, a comparación de los tratamientos uno y dos. La necrosis se debe a la concentración y el tiempo de inmersión de los endospermos en el hipoclorito de sodio que es mayor con relación al tratamiento tres. Es decir, las condiciones fisiológicas de los explantes son fuertemente alteradas dando lugar a una necrosis, lo que provoca la pérdida de viabilidad del explante al estar expuesto al hipoclorito de sodio en un tiempo prolongado y a elevadas concentraciones (Flores et al. 2008).
El porcentaje de contaminación fue de un 24.94% de todos los explantes establecidos. Según el análisis de varianza, no existen diferencias en los tratamientos en relación a los factores de estudio (IBA y BAP) y el testigo. La presencia de hongos fue el principal agente de contaminación. Los hongos del género Penicillum, Aspergillus, Alternaria y Rhizopus se encuentran en el endospermo de la semillas de Juglans sp., afectando su viabilidad (Seta et al. 2009). En el proceso de selección del material vegetal, es probable que no se pudiera observar a simple vista los endospermos contaminados con estos hongos, debido a que los explantes también tienen agentes contaminantes en su interior y son difíciles de eliminar (Roca et al. 1991).
El porcentaje de germinación es de un 90% del total de los explantes establecidos. La germinación de los embriones no es influenciada por las concentraciones de fitorreguladores, debido a que en el análisis de varianza no existen diferencias en el testigo y los factores de estudio (IBA y BAP).
El proceso de germinación se observó cada dos semanas, durante dos meses (figura 2). En la primera semana, en todos los casos, el embrión presenta una coloración rojiza en la plúmula. A las dos semanas, el epicótilo es la primera parte en emerger y se observa un ensanchamiento de la base aproximadamente de cinco milímetros. Al mes, el talluelo de la planta presenta una coloración verde rojiza. Esta coloración es una característica de la planta, sin embargo, se observa con mayor intensidad en las vitroplantas sembradas en los medios de cultivo con tratamiento, también se observa la formación de las hojas primordiales, de la gémula y en algunos casos la presencia de brotes.
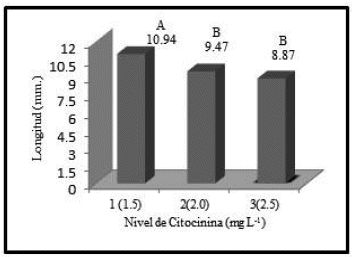
Después de seis semanas, el talluelo de la planta, en algunos casos, mide 2 cm, sin embargo, en las vitroplantas testigo mide 5 mm. En ambos casos la formación de las hojas es más notoria, la inducción de la citocinina IBA y la auxina BAP tiene efecto en la longitud de la vitroplanta, debido a las diferencias en los tratamientos en ambos factores. Según la prueba Duncan para la citocinina BAP, se ha determinado que el nivel uno de citocinina (1.5 mg/L) da como resultado vitroplantas con mayor longitud, con un promedio de 10.94 mm (Figura 4).
El nivel más bajo de citocinina da lugar a vitroplantas con mayor longitud, por lo que es probable que si se maneja las concentraciones por debajo de este nivel, se obtenga vitroplantas con mayor tamaño. Esto debido a que las citocininas inhiben el crecimiento del tallo, si no se tiene el balance adecuado (Hurtado & Merino 1987).
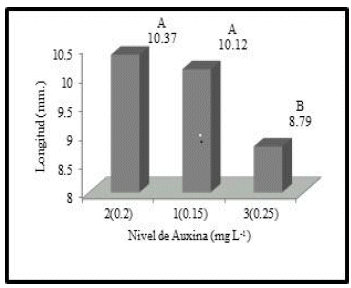
Según la prueba Duncan para la Auxina IBA, el nivel dos y uno de auxina IBA, correspondientes a 0.2 mg/L. y 0.15 mg/L respectivamente, dan como resultado vitroplantas con mayor longitud (10.37 y 10.12 mm. respectivamente) (Figura 5).
Las auxinas actúan en el crecimiento por alargamiento celular. Este proceso se da incrementando el contenido osmótico de la célula y la permeabilidad al agua, reduciendo la presión de la pared o aumentando la síntesis de ARN y de proteínas específicas (enzimas), lo que provoca un aumento en la plasticidad de la pared celular, que trae como consecuencia su extensión y con ello un crecimiento por alargamiento (Devlin 1980). Por otra parte las auxinas participan en la regulación de proporciones de crecimiento diferencial y la regulación de fenómenos de diferenciación, los cuales son estimulados o inhibidos según la concentración auxina presente en la estructura vegetal (Hurtado & Merino 1987). Es por esta razón, que el nivel 3 de auxina (0.25 mg/L) da lugar a vitroplantas con menor longitud.
No existe un efecto del medio de cultivo WPM y los tratamientos en el número de hojas, debido a que no existen diferencias en los factores de estudio y el testigo. Todos los tratamientos dan lugar a un promedio de cinco hojas por vitroplanta.
Para la variable, número de brotes, existen diferencias en los tratamientos y el testigo. Las vitroplantas con tratamiento, presentan tres brotes, sin embargo, el testigo da lugar a un brote por vitroplanta.
Los brotes de los tratamientos presentan mayor tamaño, llegando a hasta 6 mm de longitud. Sin embargo, los brotes del testigo miden aproximadamente 1 mm de longitud. Esto debido a que las citocininas en interacción con las auxinas estimulan la división celular y la elongación, dando lugar a la formación de brotes (Hurtado & Merino 1987) (Figura 6).
Para la variable, número de vitroplantas con raíces, existen diferencias en el testigo y los tratamientos, debido a que el testigo da lugar a mayor número de vitroplantas con raíces a comparación de los tratamientos, por lo que existe una inhibición en el crecimiento de las raíces en las vitroplantas con tratamiento. Esto se debe a que si no se tiene la concentración óptima de citocininas, éstas inhiben el crecimiento de las raíces (Hurtado & Merino 1987).
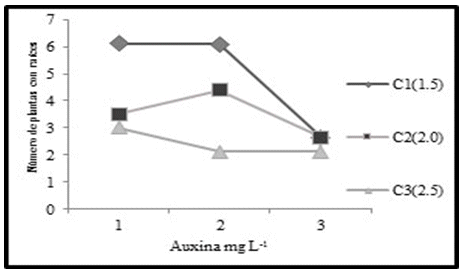
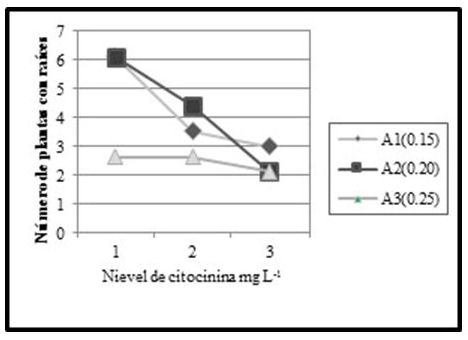
Para la misma variable, en la interacción de los factores, existen diferencias y según el ANVA de efectos simples (efecto de citocininas en auxinas), entre los niveles de citocininas en el nivel de auxina uno, existen diferencias, y de acuerdo a la figura 7, el nivel de citocinina uno (1.5 mg/L.), da lugar a mayor número de vitroplantas con raíces. También, entre los niveles de citocininas en el nivel dos de auxina, existen diferencias altamente significativas, y el nivel de citocinina uno, que corresponde a 1.5 mg/L, da lugar a un mayor número de vitroplantas con raíces.
Por otra parte, del ANVA de efectos simples (efecto de auxinas en citocininas), entre los niveles de auxinas en el nivel de citocinina uno, existen diferencias altamente significativas, y de acuerdo a la figura 8, los niveles uno y dos de auxinas (0.15 mg/L y 0.20 mg/L respectivamente), da lugar a mayor número de vitroplantas con raíces.
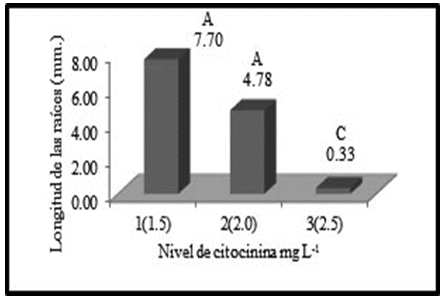
Existe un efecto de los niveles de la citocinina BAP en el crecimiento de las raíces, debido a las diferencias altamente significativas en el factor BAP. Según la prueba Duncan, los niveles uno y dos de citocininas, correspondientes a 1.5 y 2.0 mg/L respectivamente, dan lugar a raíces con mayor longitud, sin embargo, el nivel más alto de citocinina (2.5 mg/L) da lugar a vitroplantas con menor longitud de raíces (Figura 9).
Este resultado es debido a que la concentración de 2.5 mg/L de citocinina inhibe el crecimiento de las raíces, ya que las citocininas generalmente pueden estimular en muy bajas concentraciones la iniciación del crecimiento de las raíces, e inhiben el crecimiento de las raíces si no se tiene una concentración adecuada (Hurtado y Merino, 1987).
Por otra parte, el porcentaje de sobrevivencia es de un 75.05% del total de los explantes establecidos. La principal causa de la pérdida de las muestras es por la presencia de agentes contaminantes en el medio de cultivo. Estos agentes destruyen el medio de cultivo y compiten con el explante por el medio de cultivo (Roca et al. 1991), dando lugar a una inhibición en la sobrevivencia de las vitroplantas.
No existe un efecto de medio WPM al 100%, el medio WPM al 100% con la adición de fitorreguladores en el porcentaje de sobrevivencia, debido a que no existen diferencias significativas en el testigo y los factores de estudio.
Según los resultados obtenidos, se puede realizar el cultivo in vitro de embriones de Juglans boliviana, en el medio de cultivo WPM al 100% suplementado con 0.15 mg/L de IBA y 1.5 mg/L de BAP, debido a que las otras concentraciones de auxinas y citocininas tienen un efecto inhibitorio en la germinación, este efecto principalmente se da por la adición de la citocinina BAP concentraciones por arriba de 1.5 mg/L de BAP. Por otra parte, el medio de cultivo WPM al 100% sin la adición de fitorreguladores da lugar mayor número de vitroplantas enraizadas, sin embargo el crecimiento del tallo es menor, presentando vitroplantas con 7.50 mm de longitud, por lo que se recomienda realizar estudios de germinación solo con la adición de auxinas por debajo de 0.15 mg/L.
Agradecimientos
Laboratorio de Biotecnología Vegetal. DNICyT Dirección Nacional de Investigación Ciencia y Tecnología. Escuela Militar de Ingeniería. Banco de Germoplasma de Especies Tropicales Forestales Agrícolas.
Literatura citada
Arteaga Y. Diseños experimentales. 1ra Edición. Editorial Agaetra. Bolivia. 2004; 1-19 pp.
Devlin RM. Fisiología vegetal. 3ra Edición. Ed. Omega S.A. Barcelona, España. 1980; 517 pp.
Garcia R, Calixto J, Aguedo N, Linares J. Estudio silvícola y de utilización del nogal (Juglans olanchana Standl. & L.O. Williams) en bosque latifoliados de Honduras. 2002. Consultado marzo 10 del 2010. Disponible en: http://bdigital.zamorano.edu/handle/11036/226.
Flores A, Álvarez JG, Rodriguez JL, Corona A. Germinación in vitro de semillas de Nolina parviflora (H.B.K.) Hemsl. Foresta Veracruzana 2008; 10(2); 27.33.
Hartmann HT, Kester DE. Propagación de plantas. Principios y prácticas. Trad. A. M. Ambrosio. Sexta reimpresión. Compañía Editorial Continental, S. A. De C. V. México. 1992; 760 pp.
Hurtado DV, Merino ME. Cultivo de Tejidos Vegetales. Ed.Trillas. México. 1987; 232 pp.
Ibisch PL, Mérida G. Biodiversidad: La riqueza de Bolivia. Ed. FAN-Bolivia. Santa Cruz de la Sierra; 2003. 638 pp.
Magnitskiy S, Plaza G. Fisiología de semillas recalcitrantes de árboles tropicales. Agron Colomb. 2007: 25(1); 96-103.
Meneses RI, Beck S. Especies amenazadas de la flora de Bolivia. Herbario Nacional de Bolivia. 2005; 34:4-33.
Pierik RLM. Cultivo in vitro de las plantas superiores. Madrid: Editorial Multiprensa. 1990; 326 pp.
Rodríguez M. Morfología y Anatomía Vegetal. 2da Edición. 1991; 2050 y 441.
Roca W, Núñez V, Mornan K. Cultivo de anteras y mejoramiento de plantas. In: Cultivo de tejidos en la agricultura. Fundamentos y aplicaciones. Roca W, Mroginski L. (eds). CIAT, Cali, Colombia. 1991: 271-294 pp.
Seta S, González M, Moyano, M. Calidad en pos cosecha del nogal (Juglans regia. L). Rev Fac Cienc Agrar Univ Nac Cuyo. 2004; 4:51-54.
Notas de autor
cicyt@emi.edu.bo
Declaración de intereses
Enlace alternativo

