

Evaluación de bacterias endófitas promotoras de crecimiento en el cultivo de quinua
Evaluation of endophytic growth promoting bacteria in quinoa cultivation
Journal of the Selva Andina Biosphere, vol.. 7, núm. 2, 2019
Selva Andina Research Society


NOTAS TÉCNICAS
Recepción: 01 Julio 2019
Aprobación: 01 Septiembre 2019
Publicación: 01 Noviembre 2019
DOI: https://doi.org/10.36610/j.jsab.2019.070200088
Resumen: En la presente investigación se evaluó la interacción simple y combinada de bacterias endófitas, para desarrollar nuevas formulaciones de bioinoculantes y así generar alternativas viables para los productores andinos sobre las variables agronómicas del cultivo de quinua. Se formularon bioinoculantes con tres cepas, solas y combinadas de Bacillus sp., junto con un sustrato inerte para obtener un producto en polvo, así posteriormente compararlo con el producto comercial (TRICOBAL), como testigo positivo, más el testigo negativo (suelo sin inoculante), bajo condiciones in vitro e invernadero. Se identificaron como sobresalientes a los siguientes tratamientos, en cuanto a la altura de planta (104.14 cm), altura de panoja (34.32 cm), peso de raíces (5 g) y rendimiento en grano: Bacillus pumilus (Bp), la interacción B. pumilus y P. polymyxa (Bp + Bv54) y la combinación de B. pumilus, B. subtilis y P. polymyxa (Bp + Bs + Bv54), señalando que éstas cepas nativas promueven el crecimiento de las plantas de quinua significativamente superior al producto comercial TRICOBAL. Complementariamente, en condiciones in vitro se determinó que las tres cepas de Bacillus utilizadas en el estudio pueden coexistir.
Palabras clave: Bacillus sp, interacción de bacterias, compatibilidad de Bacillus.
Abstract: The present research aims to evaluate the interaction of simple and combined endophytic bacteria, to develop new bioinoculants formulations, over the agronomic variables of the quinoa cultivation, to generate viable alternatives for the Andean farmers. A powder product was obtained by mixing a bioinoculants formulation developed with three single and combined strains of Bacillus sp. and an inert substrate, to be compared in a greenhouse/in vitro environment with a commercial product (TRICOBAL) as a positive control group and normal soil (without inoculants) as a negative control group. The following treatments were identified: Bacillus pumilus (Bp), interaction between Bacillus pumilus and Paenibacillus polymyxa (Bp + Bv54) and the combination of Bacillus pumilus, Bacillus subtilis and Paenibacillus polymyxa (Bp + Bs + Bv54) with prominent results on: plant height (104.14 cm), panicle height (34.32 cm), roots weight (5 grs.) and grain performance; demonstrating that these native strains significantly promote the growth of quinoa plants in relation to the commercial product (TRICOBAL). In addition, it was determined that in an in vitro environment the three used strains of Bacillus can coexist.
Keywords: Evaluation, Bacillus sp, bacteria interaction, viability, in vitro compatibility.
Introducción
El ser humano tiene alta dependencia del suelo, brindándole sustrato físico, químico, biológico para su sustento, y producción de alimentos. Tomando en cuenta, el suelo, no es una fuente inagotable de nutrientes para nuestros alimentos, pocos cuentan con cantidad suficiente de nutrientes para los cultivos, normalmente algunos nutrientes son más limitantes que otros, por eso los productores usan fertilizantes sintéticos para solucionar su déficit.1
El uso intensivo de fertilizantes sintéticos ha causado alteraciones en el medio ambiente como la contaminación de aguas subterráneas y el aire.2 Por otro lado existe la necesidad de aumentar la producción agrícola, tratando así de evitar los agroquímicos, por eso es necesario investigaciones orientadas al desarrollo de nuevas biotecnología alternativas.3,4,5
De ahí, el interés en explorar la diversidad de microorganismos benéficos del suelo, en los últimos años ha ido creciendo los estudios en estos, como promotores de crecimiento de plantas y otros, para evitar la infección del tejido vegetal por patógenos. Tales microorganismos pueden ser simbióticos o de vida libre.6,7 En el primer caso, se encuentran los endófitos, un grupo específico de microorganismos (bacterias, actinomicetos, hongos) que se encuentran asociadas a diversos tejidos vegetales.
Entre los endófitos, están bacterias promotoras de crecimiento vegetal (PGPB), los que presentan un metabolismo versátil con capacidad de utilizar diversos sustratos liberados por la planta para su desarrollo. Al estar menos afectados por estrés ambiental y más aclimatado con su simbionte8, pueden representar una mayor ventaja ecológica. El mecanismo principal de los promotores de crecimiento incluye, la producción de fitohormonas (giberelinas, citocininas y auxinas), sideróforos, antibióticos induciendo a una resistencia sistémica a patógenos, a la solubilización y movilización de fosfatos.9,10,11,12,13
Ante la necesidad por una tecnología amigable al ambiente y los recursos microbiológicos nativos poco explorados, es necesario desarrollar nuevas tecnologías que mejoren la fertilidad de los suelos y hacer una producción saludable y sostenible, para eso es necesario desarrollar y evaluar microorganismos como bacterias endófitas tipo Bacillus y determinar su eficiencia en el crecimiento de las plantas de quinua.
Materiales y métodos
El ensayo se realizó en la provincia Quillacollo del departamento de Cochabamba, que se encuentra a 15 Km de la ciudad de Cochabamba, a una altitud de 2613 msnm y cuyas coordenadas geográficas son 17˚21’00,7” latitud sur y 66˚ 15’40,6” longitud oeste, durante 90 días en condiciones de invernadero y 45 días en laboratorio. La Fundación PROINPA cuenta con 123 cepas nativas bolivianas de Bacillus sp., en su colección de trabajo, se lograron activar 3 cepas de este género con las que se trabajó durante el ensayo.
Cepas microbianas. Bacillus subtilis (Bs), Bacillus pumilus (Bp) y Paenibacillus polymyxa (Bv54), fueron activadas en (TSA: Trypticase-Soy-Agar), incubadas en cajas Petri a 28 °C durante dos días.
Pruebas bioquímicas para la verificación de cepas utilizadas. De manera complementaria se realizó las siguientes: hidróxido de potasio (KOH) y catalasa, se hizo verificación mediante shock térmico (ST), ya que las bacterias del género Bacillus presentan endosporas que pueden subsistir hasta 80 °C por 20 min.14 Posterior al ST se sembró en medio TSA, las colonias crecieron en 48 h se reportaron como positivas para el género Bacillus.
Después de la verificación por ST, se procedió con las pruebas bioquímicas, teniendo como reportes: negativo para KOH, no se levantó un hilo viscoso con el asa y positivo para catalasa, si existió la presencia de burbujeo.
Formulación en sólido y evaluación de viabilidad en el tiempo de los bioinoculantes. Se hizo la mezcla del caldo MS (melaza soya) con cepas previamente inoculadas junto con un sustrato inerte (Carbonato de Calcio). La evaluación de viabilidad de bioinoculantes, se tomaron datos de concentraciones microbianas iniciales, mediante siembras en cajas Petri con medio TSA y también al final del ensayo, después de la cosecha de las plantas de quinua. Se utilizó la técnica de diluciones y siembra en medio TSA, se procedió a verificar si las concentraciones microbianas de los bioinóculos almacenados mantenían su viabilidad y población original a través del tiempo.
Preparación de sustrato y siembra de quinua en macetas. El sustrato estuvo compuesto por limo, arena y tierra vegetal (2:1:1). Para este estudio se utilizó la variedad de quinua Jacha Grano (obtenida de productores de quinua de la zona de Uyuni-Bolivia), se sembró 5 semillas que fueron regadas dos veces por semana con agua de pozo. Una vez emergidas se eliminaron las plantas débiles y quedo la más vigorosa.
Inoculación en platines de quinua. El bioinoculante en polvo se aplicó a una dosis de 1 Kg/ha. Realizando hoyos alrededor del cuello de plantines, la inoculación se marcó con estacas de plástico cada maceta con el código del tratamiento y repetición.
Los tratamientos fueron los siguientes: T1= Bs, T2= Bp, T3= BV54, T4= Bs+Bp, T5= Bs+Bv54, T6= Bp+Bv54, T7= Bs+Bp+Bv54, T8= TRICOBAL (producto comercial)-Testigo positivo, T9= TESTIGO-testigo negativo.
Evaluación del crecimiento y rendimiento de la quinua. En la fase de floración, se tomaron muestras al azar de plantas completas de dos repeticiones, los granos tenían características lechosa o pastosa, se evaluaron las siguientes variables agronómicas:
Altura de planta (AP). Con una regla metálica midiendo desde el cuello de la planta hasta la punta de la panoja (en caso de tener múltiples panojas se tomó en cuenta la más alta), se evaluó cada antes de la floración.
Altura de panoja (APj). Con una regla metálica, midiendo desde la base de panoja hasta su punta (antes de la cosecha).
Diámetro de panoja (DPj). Se utilizó un calibre Vernier midiendo el lado más ancho de la panoja (antes de la cosecha).
Peso de panoja (PPj). Con balanza digital, se pesó la panoja previamente cortada desde la base (a la cosecha).
Peso foliar (PF). Con balanza digital, se pesó toda la masa foliar de cada planta (a la cosecha).
Volumen de raíz (VR). Una probeta graduada, midiendo el desplazamiento de volumen de agua generado por las raíces (a la cosecha).
Peso de raíz (PR). Se realizó un corte en el cuello de la planta, pesando la raíz en una balanza digital (a la cosecha).
Longitud de raíz (LR). Con regla metálica, midiendo desde el cuello de la planta hasta el ápice de la raíz (a la cosecha).
Rendimiento (R). Cuando se completó el proceso de floración se detuvo el riego de las plantas, se las dejó madurando y secando durante 2 semanas para realizar la medición de cada una de las variables agronómicas a la cosecha, esto debido a que la evaluación del rendimiento en grano debe estar deshidratada, para que tenga madurez de cosecha. Para la medición del rendimiento se desgranó la panoja y se pesaron todos los granos por plantas en una balanza de precisión.
Extracción de endófitos en las raíces. Se tomaron raíces de las mismas macetas y se procesaron en laboratorio para la extracción de bacterias endófitas (Bacillus inoculados al suelo).
Evaluación de compatibilidad de cepas evaluadas. Se verificó mediante enfrentamientos, con el fin de visualizar mejor el comportamiento entre las bacterias utilizadas para este estudio. Se utilizó placas Petri con medio TSA, se procedió a sembrar las cepas, una al lado de la otra, con un asa bacteriológica de manera lineal así formando enfrentamientos y codificándolas.
Análisis estadístico. Se utilizó diseño de bloques completos al azar con 9 tratamientos y 10 repeticiones. Se realizó el ANOVA bajo la distribución normal con un nivel de confianza del 95% y se utilizó el programa SAS-9.2.
Resultados
A. Evaluación del sinergismo entre los aislados bacterianos tipo Bacillus sobre el crecimiento y desarrollo del cultivo de quinua.
Altura de planta. Se observaron diferencias significativas, el tratamiento Bp tuvo un comportamiento superior al resto, 104.138 cm, seguido del tratamiento interacción con 98.067 cm, mientras que Bs presentó la media más baja, figura 1.
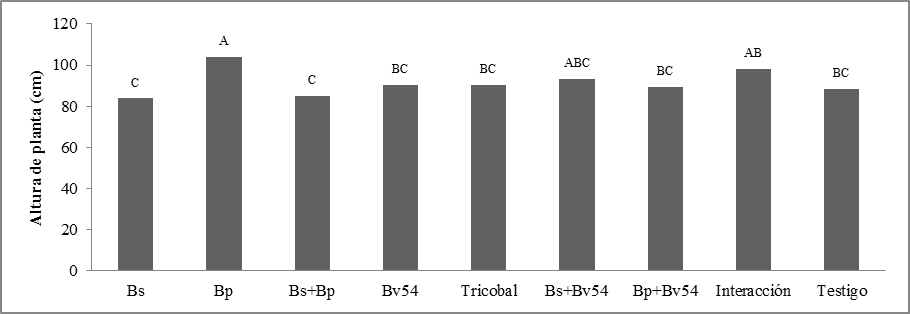
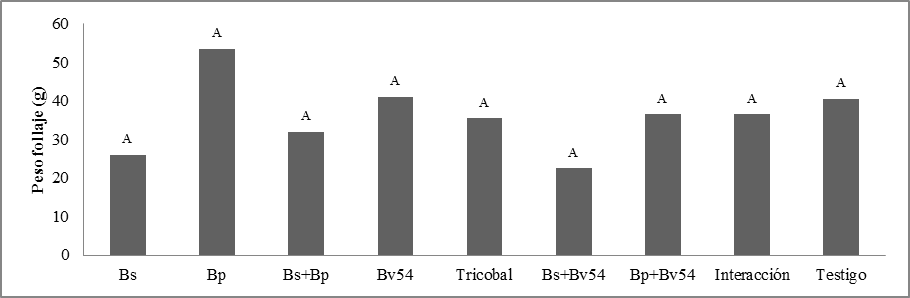
Peso de follaje. No se observaron diferencias significativas. La respuesta Bp puede explicarse si se analiza el tiempo destinado para la evaluación, en los tres meses del ensayo, se podía visualizar granos maduros, esto significa que se aceleró el ciclo de maduración y que a futuro debería ser un factor de evaluación, los microorganismos pueden contribuir a inducir la precocidad en las plantas de quinua figura 2.
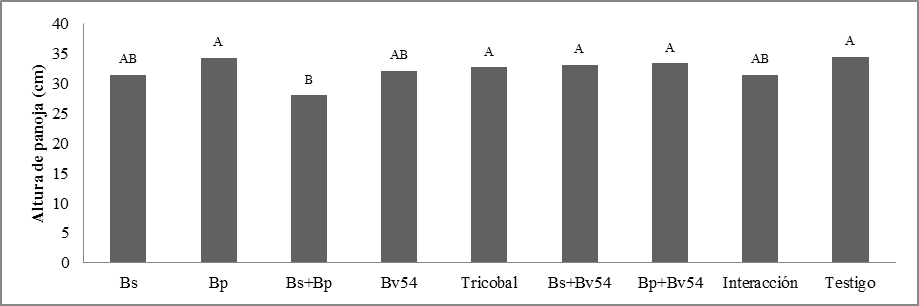
Altura de panoja. Se observaron diferencias significativas. En Bp y Testigo actúan de la misma manera presentando una altura mayor de 34.317 cm y 34.433 cm respectivamente, siendo Bs+Bp, presentó una menor altura de 28.05 cm figura 3.
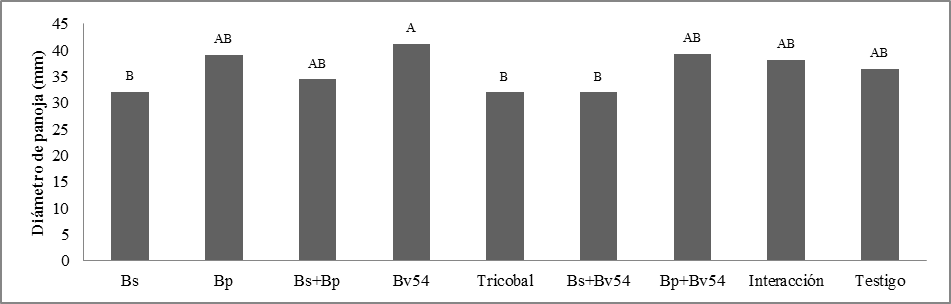
Diámetro de panoja. Se observaron diferencias significativas. En la figura 4, Bp+Bv54 tuvo una respuesta superior a Bp. Sin embargo, Bv54 presentó el diámetro más elevada frente a la media más baja para Bs+Bv54.
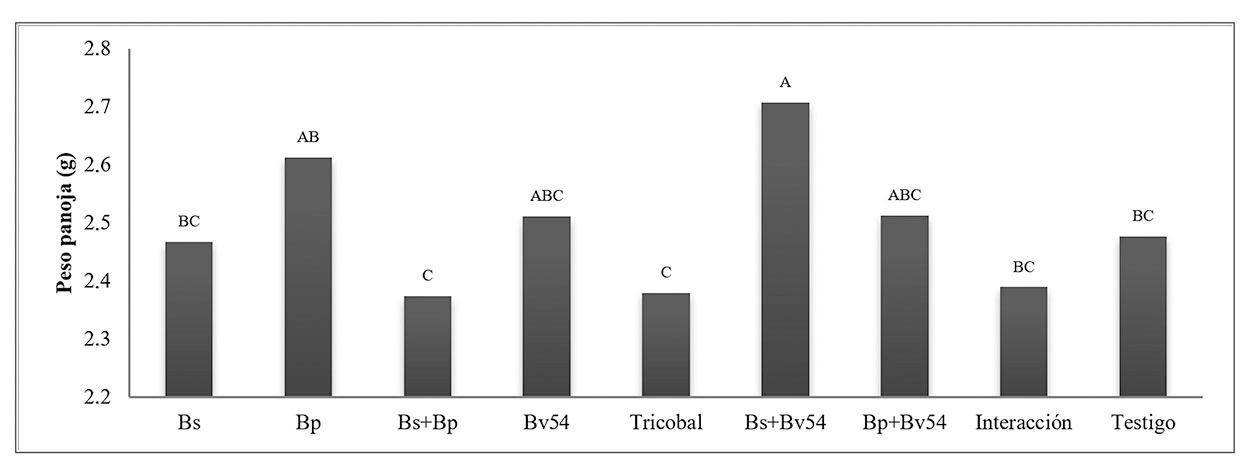
Peso de panoja. Se observaron diferencias significativas. La figura 5, Bs+Bv54 presenta el mayor peso, seguido Bp frente a la media más baja registrada de Bs+Bp.
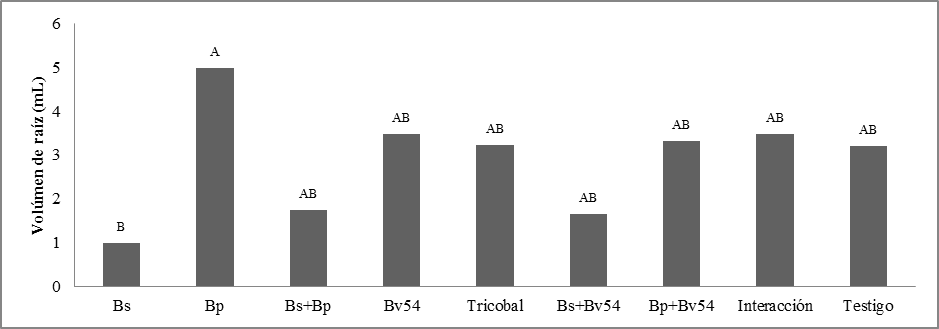
Volumen de raíz. Estadísticamente no presentó diferencias significativas (p=0.05), la figura 6 se observa Bp con mayor media (5 mL), seguido por Bv54 e interacción con 3.48 mL, frente a la media más baja de 1 mL de Bs. Bp aumenta el volumen de las raíces en 20% en relación al testigo.
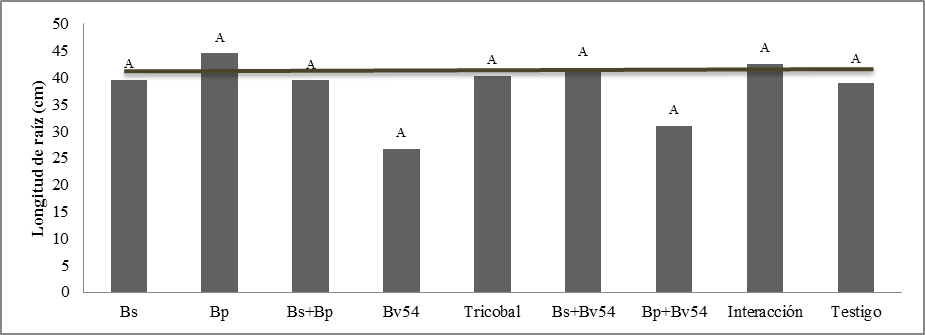
Longitud de raíz. Estadísticamente no presentan diferencias significativas, figura 7 se observa Bp expresa la media más elevada, seguido por la interacción frente a la media más baja Bp+Bv54. Bp incrementa 5% LR en relación al testigo en el cultivo de quinua, bajo condiciones de estudio.
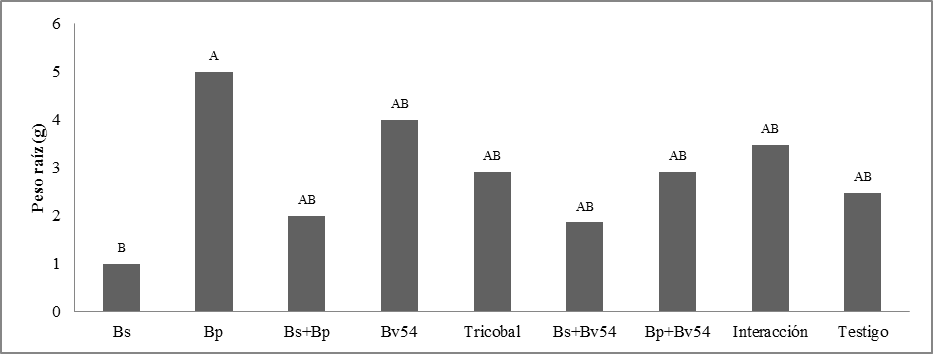
Peso de raíz. Se observaron diferencias significativas. Bp presentó la media más elevada con 5 g. Bv54 con 4 g y el más bajo de 1 g Bs. El PR tiene una relación notable con la variable de LR, que respaldan al evidenciar la respuesta Bp en estas dos variables que expresa las medias más elevadas figura 8.
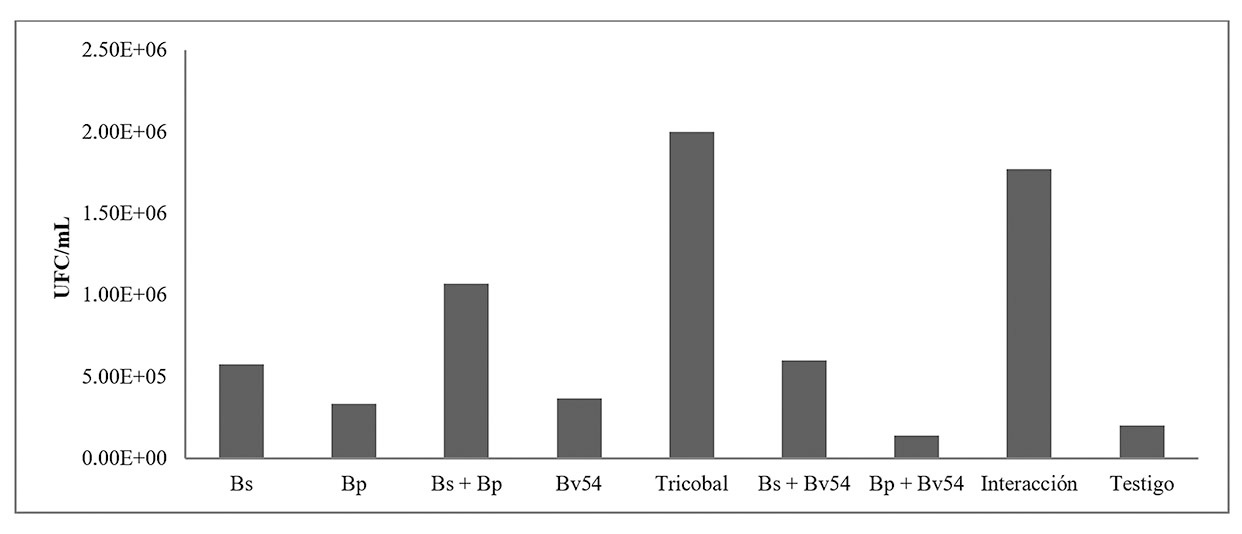
B. Estimación de la población bacteriana en las raíces inoculadas. Se observó que no existieron diferencias significativas, pero si en los bloques. En la figura 9 se observa que la población de bacterias dentro las raíces (endófitas) inoculadas presentaron poblaciones mayores a 10 veces al testigo. En el tratamiento TRICOBAL se registró el mayor número de colonias siguiendo con las interacciones frente Bp+Bv54, que fue el que presentó menos colonias.
C. Evaluación del efecto simple y combinado entre los aislados bacterianos tipo Bacillus sobre el rendimiento del cultivo de quinua. Para la evaluación del efecto simple y combinado entre las cepas se procedió primeramente al peso de granos por tratamiento, teniendo como resultado diferencias significativas (p=0.05), figura 10.
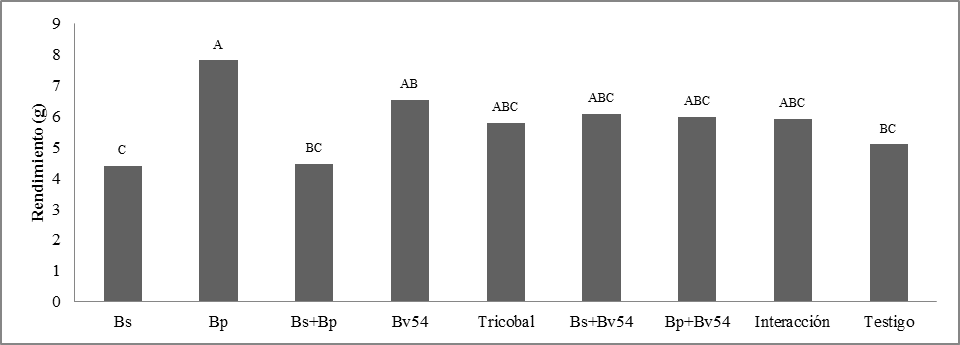
Comparación de medias. Observando todas las variables, se destaca el efecto simple de la bacteria B. pumilus sola y combinada en interacción doble Bp+Bv54, además de la interacción triple Bp+Bv54+Bs, todas superiores al efecto del testigo positivo (TRICOBAL), en el cultivo de quinua bajo condiciones de estudio.
Correlación múltiple. Se destacan la alta correlación y significancia entre el PR vs VR indicando que a futuro sólo una de las variables será suficiente para evaluar bajo condiciones de estudio. En cambio, las correlaciones entre AP vs APj y PPj vs R son bajos, pero aún significativos.
D. Evaluación de viabilidad en el tiempo de los bioinoculantes. Para la evaluación de viabilidad de los bioinoculantes se tomó en cuenta las concentraciones en el proceso de formulación y al finalizar el estudio en invernadero. Las concentraciones son las siguientes:
En la tabla 1 se observa que la concentración inicial versus la concentración final de las respectivas cepas en estudio, no presentan variaciones importantes en un periodo de 6 meses, sin embargo el producto comercial al componerse de B. subtilis y Trichoderma presentan concentraciones diferenciadas, es decir, el B. subtilis se mantiene en el rango de viabilidad, pero el de Trichoderma disminuyó aproximada 1000 unidades hasta el final del estudio.

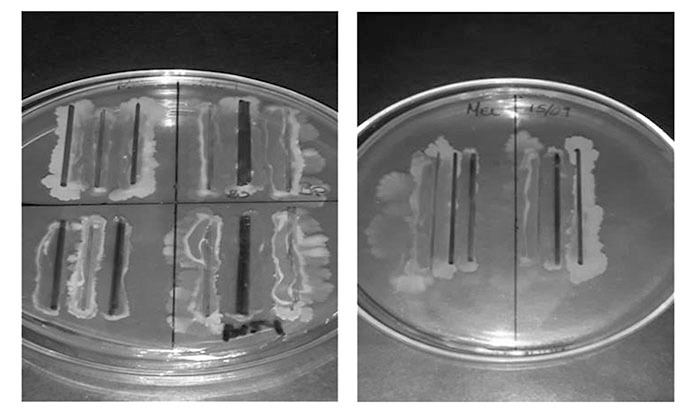
En la figura 11 se puede apreciar las pruebas de compatibilidad in vitro realizadas con las bacterias de estudio, éstas muestran un crecimiento y desarrollo diferenciado. En la primera figura (izquierda) se realizó enfrentamientos duales en distintas posiciones, donde las cepas laterales se las coloca posteriormente al medio. Tal es el caso del primer enfrentamiento entre Bs y Bp, ambas compiten por los nutrientes necesarios para su crecimiento y desarrollo sin importar la posición. De igual forma con las cepas de Bv54 y Bp. Siendo que la cepa Bv54 no es competitiva ante las demás cepas por que pierde su crecimiento en todos los casos.
Discusión
A. Evaluación del sinergismo entre los aislados bacterianos tipo Bacillus sobre el crecimiento y desarrollo del cultivo de quinua.
Altura de planta. En un estudio realizado por Angulo et al15, se determinó el efecto de diferentes cepas promotoras de crecimiento, tanto fijadoras de nitrógeno como solubilizadoras de fósforo. Se presentaron dos cepas de B. pumilus, solubilizadoras de fósforo, tienen efecto sobre la AP.
La quinua en ambiente natural alcanza una altura hasta de 2 m durante todo su desarrollo, que varía de tres a ocho meses.16 La importancia que tiene esta variable para la selección se debe a que durante el desarrollo vegetativo, esta es vulnerable a los factores abióticos como la competencia con malezas por nutrientes, cambios bruscos de temperatura, ataques de plagas, entre otros, que pueden influir la supervivencia de la planta. Por tanto, una cepa bacteriana que estimule el crecimiento de las mismas aumenta la resistencia a estos factores y la permanencia de las plantas de quinua.
Peso de follaje. La respuesta que presenta el tratamiento Bp puede explicarse si se analiza el tiempo destinado para la evaluación, es decir que en los tres meses del ensayo ya se podía visualizar granos maduros, esto significa que se aceleró el ciclo de maduración y que a futuro debería ser un factor de evaluación ya que los microorganismos pueden contribuir a inducir la precocidad en las plantas de quinua.
Altura de panoja y Peso de Panoja. Calvo-García17, menciona que los microorganismos tienen la capacidad de fijar nitrógeno de la atmosfera de manera libre formando nódulos resultantes de la simbiosis entre la planta y la bacteria. Morales18, complementa que entre estos microorganismos tenemos los géneros tenemos: Bacillus, Pseudomona y Azospirillum.
Choque19 indica que tanto el abono como las cepas fijadoras de nitrógeno utilizadas influyeron en el desarrollo de las panojas en campo. Además, es importante saber que en suelos con mayor cantidad de nitrógeno disponible para la planta existe mejor desarrollo de la longitud de panoja, por lo que es erróneo considerar que la quinua deba desarrollarse en terrenos pobres, sino en aquellos relativamente ricos en materia orgánica para su mejor desarrollo morfológico principalmente de la panoja.20
Diámetro de panoja. Una cepa del género Paenibacillus, junto con un tratamiento de roca fosfórica presentó resultados significativos, respecto al testigo sin inoculante, la variable DPj del cultivo de quinua.17
Se considera, que los microorganismos del suelo, que solubilizan distintas rocas fosfatadas y de otras fuentes de fósforo inorgánico, es una alternativa fundamental para incrementar la cantidad de nutrientes disponibles para las plantas.18
Volumen de raíz. La mayoría de las asociaciones microorganismo-planta ocurre a nivel de la rizósfera, porción de suelo que está fuertemente influenciada por las raíces de las plantas, las PGPR, mediante relaciones simbióticas con la planta estimulan el desarrollo del sistema radicular.19 De esta forma conocer el VR también proporciona una estimación del desempeño microbiológico de las cepas bacterianas evaluadas a nivel del desarrollo radicular.
Longitud de Raíz. La cepa P. polymyxa (Bv54), con adición de roca fosfórica, mostró resultados positivos en cuanto a la LR en plantas de quinua. También se puede destacar que el tratamiento de interacción triple no es el que presenta la mayor media en este ensayo, el tratamiento Bp favoreció al crecimiento de raíces de plantas de quinua.19 Observando las interacciones, Bp/Bv54 disminuye en 8% la LR de las plantas de quinua en relación al testigo negativo y la interacción entre Bp/Bs mantiene el mismo efecto que el testigo negativo.
Peso de Raíz. Según un estudio realizado para la elaboración de biofertilizantes con PGPR para quinua, indica que una cepa de B. pumilus aumentó el PR en plantas de quinua.20
Flores-Gallegos21, menciona que la capacidad de las PGRB para la síntesis de sustancias reguladoras de crecimiento, como giberelinas, citocininas y auxinas, estimula la densidad y longitud de los pelos radicales, aumentando así la longitud y cantidad de raíces en las plantas (por tanto, también el peso de las mismas), lo que incrementa su capacidad de absorción de agua y nutrimentos, permitiendo que las plantas sean más tolerantes a condiciones climáticas adversas, como las sequías.
Peso de follaje. La respuesta que muestra el tratamiento Bp puede explicarse si se analiza el tiempo destinado para la evaluación, es decir que en los tres meses que duró el ensayo ya se podía visualizar granos maduros, esto significa que se aceleró el ciclo de maduración y que a futuro debería ser un factor de evaluación ya que los microorganismos pueden contribuir a inducir la precocidad en las plantas de quinua.
Altura de panoja y Peso de Panoja. Calvo-García17, menciona que los microorganismos tienen la capacidad de fijar nitrógeno de la atmosfera de manera libre formando nódulos resultantes de la simbiosis entre la planta y la bacteria. Morales18, complementa que entre estos microorganismos tenemos los géneros tenemos: Bacillus, Pseudomona y Azospirillum.
Choque19 indica que tanto el abono como las cepas fijadoras de nitrógeno utilizadas influyeron en el desarrollo de las panojas en campo. Además, es importante saber que en suelos con mayor cantidad de nitrógeno disponible para la planta existe mejor desarrollo de la longitud de panoja, por lo que es erróneo considerar que la quinua deba desarrollarse en terrenos pobres, sino en aquellos relativamente ricos en materia orgánica para su mejor desarrollo morfológico principalmente de la panoja.20
B. Estimación de la población bacteriana en las raíces inoculadas. Se puede decir que el tratamiento TRICOBAL en comparación con el testigo presentó un incremento del 80% en las colonias. De igual manera el tratamiento interacción aumentó en 78% el crecimiento de colonias en las raíces. La actividad de estos microorganismos inicia con mecanismos de quimiotaxis, las bacterias capaces de interactuar con la raíz de la planta, se ven atraídas, por los exudados que ésta secreta. Este mecanismo facilita la colonización de la rizósfera por parte de las bacterias promotoras de crecimiento.22
Se sabe que las PGPR’s están entre los varios grupos de microorganismos asociados a plantas que aumentan las defensas de su hospedero, estimulando la inducción de mecanismos de resistencia a patógenos en la planta, entre ellos tenemos a cepas del género Bacillus sp.12,23
C. Evaluación del efecto simple y combinado entre los aislados bacterianos tipo Bacillus sobre el rendimiento del cultivo de quinua. De igual forma sus resultados, siendo el B. pumilus y una cepa de Paenibacillus (solubilizadoras de fósforo ambos) los tratamientos que dan mejores resultados en cuando al rendimiento del cultivo de quinua, se puede decir que dichas cepas bacterianas solubilizaron el fosforo poco soluble de manera eficiente y además permitiendo así que las plantas de quinua puedan aprovechar el nutriente que necesitan para crecer.17
D. Evaluación de viabilidad en el tiempo de los bioinoculantes. Algunas especies de bacterias Gram positivas (principalmente de los géneros Bacillus, Clostridium, Sporosarcina y Thermoactinomyces), disponen de una serie de estrategias adaptativas cuando se ven sometidas a privación de nutrientes o un estrés en su medio ambiente: como primera etapa, intentan alcanzar un medio ambiente más propicio, pero si no logran obtener una fuente de nutrientes pues las células se preparan para un periodo de carencia nutricional, dónde existe una diferenciación celular que conduce a la producción de una estructura llamada endosporas, que es capaz de resistir una amplia gama de agentes agresivos ambientales, físicos y químicos.24
Por otro lado, una de las limitaciones más importantes del uso de Trichoderma es su bajo nivel de tolerancia osmótica (0.5 M o menos). Las condiciones de agua afectan las actividades de este hongo, en especial la germinación de la espora y el crecimiento del tubo germinal, así como el crecimiento del micelio, y tiene un efecto crítico en la interacción con otros hongos y la producción de enzimas.25,26
E. Evaluación de compatibilidad entre los aislados bacterianos tipo Bacillus. Las interacciones entre microorganismos siempre han tenido mayor atención en la evaluación de la capacidad de producir compuestos que proporciona una ventaja para los competidores inhibiendo o eliminando directamente los competidores potenciales. Una evidencia clara de ello es lo que pasa en la rizósfera, la producción de antibióticos por una cierta cantidad de bacterias contribuye a su capacidad para proteger plantas de patógenos específicos.27 Por lo general los experimentos en el laboratorio se hacen al estudio de una sola especie sin contar que las especies en su hábitat natural viven y se desarrollan dentro de las comunidades complejas donde interactúan con otras especies (interacción inter específica).28
En general, de acuerdo a los resultados obtenidos, se establece que los diferentes tratamientos aplicados al cultivo de quinua en condiciones de invernadero, tanto simple como en interacción doble y triple (Bp, Bp+Bv54, Bp+Bs + Bv54), generaron efectos significativos en el crecimiento y desarrollo del cultivo de quinua de la variedad Jacha Grano.
Por otro lado, se determinó que existe un efecto significativo de Bp en el rendimiento del cultivo de quinua bajo condiciones de estudio. Se observó que B. pumilus tiene un efecto positivo en la precocidad de la maduración de los granos, porque indujo una floración precoz. Después de realizar pruebas a nivel invernadero, se hizo pruebas de compatibilidad in vitro de las cepas de Bacillus utilizadas, observándose que entre ellas pueden coexistir, es decir que pueden obtener sus nutrientes sin perjudicar de manera significativa en el crecimiento del otro.
Finalmente, después de formular en polvo con cada una de las bacterias utilizadas, se evaluaron su viabilidad como bioinoculantes, después de seis meses, se observó que las concentraciones se mantenían, mientras que el hongo Trichoderma que es uno de los componentes del TRICOBAL, disminuyó de manera significativa su concentración.
Agradecimientos
Los autores agradecen a la Fundación PROINPA por sus facilidades brindadas para la ejecución de esta investigación y a la Fundación Mck Nigth por el financiamiento.
Literatura Citada
1. Brechelt A. Manejo ecológico de plagas y enfermedades. En: Fundación Agricultura y Medio Ambiente, editores. Red de acción de Plaguicidas y sus alternativas para América Latina [Internet]. Santiago de Chile; 2004. p. 36. Recuperado a partir de: https://scholar.google.com/scholar_lookup?title=El%20manejo%20ecol%C3%B3gico%20de%20plagas%20y%20enfermedades&publication_year=2004&author=A.%20Brechelt
2. Satorre EH. Cambios tecnológicos en la agricultura argentina actual. Cienc Hoy 2005;15(87):24-31.
3. Barrera A. Nuevas realidades, nuevos paradigmas: la nueva revolución agrícola. Comunica 2011;8: 10-21.
4. Higa T, Parr JF. Microorganismos benéficos y efectivos para una agricultura y medio ambiente sostenibles. En: Centro Internacional de Investigación de Agricultura Natural y Departamento de Agricultura de los Estados Unidos. Beltsville, Maryland, Estados Unidos; 2013. p. 13.
5. Biofabrica. Fertilizantes químicos usos y consecuencias en la agricultura y a la salud [Internet]. Biofertilizantes y agro-sustentabilidad (Mexico); 2014 [citado 5 de octubre de 2018]. Recuperado a partir de: http://www.biofabrica.com.mx/blo/que-son-los-biofertilizantes/fertilizantes-quimicos-usos-y-consecuencias-en-la-agricultura-y-a-la-salud/
6. Benizri E, Baudoin E, Guckert A. Root Colonization by Inoculated Plant Growth-Promoting Rhizobacteria. Biocontrol Sci Technol 2001;11(5): 557-74. DOI: https://doi.org/10.1080/09583150120076120
7. Bacilio Jiménez M, Aguilar Flores S, Ventura Zapata E, Pérez Campos E, Bouquelet S, Zenteno E. Chemical characterization of root exudates from rice (Oryza sativa) and their effects on the chemotactic response of endophytic bacteria. Plant Soil 2003 249(2): 271-7. DOI: https://doi.org/10.1023/A:1022888900465
8. Sturz A, Christie B, Nowak J. Bacterial endophytes: Potential role in developing sustainable systems of crop production. Crit Rev Plant Sci 2000;19(1):1-30. DOI: https://doi.org/10.1080/07352680091139169
9. Kumar A, Prakash A, Johri BN. Bacillus as PGPR in Crop Ecosystem. In: Maheshwari D, editors. Bacteria in Agrobiology. Crop Ecosystems. Springer, Berlin, Heidelberg; 2011. p .37-59. DOI: https://doi.org/10.1007/978-3-642-18357-7_2
10. Rodgers PB. Potential of biological control organisms as a source of antifungal compounds for agrochemical and pharmaceutical product development. Pestic Sci 1989;27(2):155-164. DOI: https://doi.org/10.1002/ps.2780270206
11. Handelsman J, Stab EV. Biocontrol of soilborne plant pathogens. Plant Cell 1996;8(10):1855-1869. DOI: http://www.doi.org/10.1105/tpc.8.10.1855
12. Kloepper JW, Ryu CM, Zhang S. Induced systemic resistance and promotion of plant growth by Bacillus spp. Phytopathology 2004;94(11): 1259-66. DOI: http://www.doi.org/10.1094/phyto.2004.94.11.1259
13. Chávez García MP. Producción de Trichoderma sp. y evaluación de su efecto en cultivo de crisantemo (Dendranthema grandiflora) [tesis licenciatura]. [Bogotá]. Pontificia Universidad Javeriana; 2007 [citado 20 de octubre de 2015]. Recuperado a partir de: https://repository.javeriana.edu.co/handle/10554/8312
14. Contreras R. El género Bacillus [Internet]. La Guía; 2014 [citado 20 de diciembre de 2015]. Recuperado a partir de: http://biologia.laguia2000.com/microbiologia/el-genero-bacillus
15. Angulo M, Claros M, Ortuño N. Efecto de diferentes cepas de bacterias promisorias en plantas de quinua (Chenopodium quinoa) en condiciones de invernadero. En: Congreso Científico de la Quinua: 14 y 15 de Junio de 2003. La Paz; 2003. p. 185-91.
16. Mujica A, Jacobsen S. La quinua (Chenopodium quinoa Willd.) y sus parientes silvestres. En: Mónica MR, Benjamin Ø, Lars Peter K, Finn B, Henrik B, editores. Botánica Económica de los Andes Centrales [Internet]. La Paz: Universidad Mayor de San Andrés; 2006. p. 449-457. Recuperado a partir de: https://www.researchgate.net/publication/312313242_Botanica_Economica_de_los_Andes_Centrales
17. Peña A. Selección de bacterias genero Bacillus solubilizadoras de fósforo, adaptadas a la producción orgánica de quinua [tesis licenciatura]. [La Paz]. Universidad Católica Boliviana San Pablo; 2015.
18. Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils. Soil Biol Biochem 1992; 24(4): 389-95. DOI: http://doi.org/10.1016/0038-0717(92)90199-8
19. Caballero Mellado J. Microbiología agrícola e interacciones microbianas con plantas. Rev Latinoam Microbiol 2006;48(2):154-61.
20. Toledo, L. Selección de bacterias endófitas promotoras de crecimiento vegetal (PGPR) del género Bacillus sp. aisladas de plantas de quinua para el desarrollo de biofertilizantes [tesis licenciatura]. [Cochabamba]. Universidad Mayor de San Simon; 2013.
21. Flores Gallegos AC, González V, Aguilar CN, Rodríguez Herrera R. Biofertilizantes microbianos [Internet]. México Distrito Federal: Plata & Valdez editores; 2014 [citado 22-de octubre de 2015]. 24 p. Recuperado a partir de: https://www.researchgate.net/publication/264442301_Cinetica_microbiana_de_microorganismos_biofertilizantes
22. Camelo M, Vera SP, Bonilla RR. Mecanismos de acción de las rizobacterias promotoras del crecimiento vegetal. Corpoica Cienc Tecnol Agropecu 2011; 12(2): 159-66. DOI: http://doi.org/10.21930/rcta.vol12_num2_art:227
23. Bargabus RL, Zidack NK, Sherwood ES, Jacobsen BJ. Characterisation of systemic resistance in sugar beet elicited by a non-pathogenic, phyllosphere-colonizing Bacillus mycoides, biological control agent. Physiol Mol Plant Pathol 2002; 61(5):289-98. DOI: https://doi.org/10.1006/pmpp.2003.0443
24. Iáñez-Pareja E. Microbiología general [Internet]. Granada; 1998 [citado 22-de octubre de 2018]. Recuperado a partir de: https://dialnet.unirioja.es/servlet/libro?codigo=113531
25. Kredics L, Antal Z, Manczinger L, Szekeres A, Kevei F, Nagy E. Influence of Environmental parameters on Trichoderma strains with biocontrol potential. Food Technol Biotechnol 2003;41(1): 37-42.
26. Moore Landecker E. Fundamentals of the fungi [Internet]. New Jersey: Editorial. Prentice Hall. 1996 [citado 22-de octubre de 2015] 574. p. Recuperado a partir de: https://trove.nla.gov.au/work/17305347
27. Compant S, Duffy B, Nowak J, Clement C, Barka EA. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Appl Environ Microbiol 2005; 71(9):4951-9. DOI: http://doi.org/10.1128/aem.71.9.4951-4959.2005
28. Celiker H, Gore J. Competition betweeen species can public-goods cooperation within a species. Mol Syst Biol 2012;8(1): 621. DOI: http://doi.org/10.1038/msb.2012.54
Notas
Notas de autor
n.ortuno@umss.edu.bo
Declaración de intereses
Enlace alternativo

