



Evaluación neuroprotectora de Valeriana prionophylla, Wigandia urens y Tagetes lucida contra pérdida de memoria inducida por escopolamina en ratones CD-1
Neuroprotective effects of Valeriana prionophylla, Wigandiaurens,Tagetes lucida against scopolamine-induced memory impairment in CD-1 mice
Revista Científica
Universidad de San Carlos de Guatemala, Guatemala
ISSN-e: 2224-5545
Periodicidad: Semestral
vol. 30, núm. 1, 2021
Recepción: 30 Abril 2021
Aprobación: 13 Julio 2021
Autor de correspondencia: castaneda.rodrigo@usac.edu.gt
Resumen: En la última década, las enfermedades neurológicas afectan a aproximadamente mil millones de personas a nivel mundial. En Guatemala existe un amplio uso de especies vegetales con uso tradicional para trastornos relacionados con el sistema nervioso central (SNC). Sin embargo, a la fecha aún no ha sido ampliamente explorado su potencial biológico. El objetivo de este estudio fue evaluar in vivo la actividad neuroprotectora de tres plantas nativas usadas tradicionalmente en Guatemala para afecciones del SNC. Los extractos etanólicos de Tagetes lucida (TL), Valeriana prionophylla (VP) y metanólico de Wigandia urens (WU) fueron administrados oralmente (100 y 200 mg/kg), previo a administración intraperitoneal de escopolamina (ESC, 3 mg/kg) en ratones macho CD-1. Posteriormente se evalúo memoria de adquisición (días 2-6) y de referencia (día 7) utilizando el laberinto acuático de Morris a partir de análisis automatizado de comportamiento por software. Se utilizó como control positivo N-acetilcisteína (NAC) vía oral 100 mg/kg. Los resultados mostraron una significativa reducción en los tiempos de nado en el cuadrante objetivo durante la sesión de prueba entre el grupo control tratado con vehículo y el grupo tratado con ESC (p<.05). Esta disminución fue suprimida significativamente (p<.05) tras la administración de NAC, WU en 200 mg/kg y VP en 200 y 100 mg/kg. El grupo administrado con TL no mostró diferencia significativa en los tiempos de nado comparado con ESC. Los extractos de VP y WU presentaron un efecto neuroprotector contra la pérdida de memoria y adhiere evidencia a los efectos en el SNC producidos por estas especies endémicas.
Palabras clave: Sistema nervioso central, etnofarmacología, comportamiento, Alzheimer, in vivo.
Abstract: In the last decade, neurological diseases have been estimated to affect approximately one billion people worldwide. In Guatemala, there is wide use of herbs with a traditional use for disorders related to the central nervous system (CNS). However, to date, its biological potential has not yet been widely explored. Therefore, the aim of this study was to evaluate the neuroprotective activity in vivo of three native plants traditionally used in Guatemala for CNS disorders. The ethanolic extracts of Tagetes lucida (TL), Valeriana prionophylla (VP) and methanolic extracts of Wigandia urens (WU) were administered orally (100-200 mg/kg), prior to intraperitoneal administration of scopolamine (ESC, 3 mg/kg) in male CD-1 mice. Subsequently, acquisition memory (day 2-6) and reference memory (day 7) were evaluated using the Morris water maze using automated behavior analysis by software. N-acetylcysteine (NAC) 100 mg/kg was used as a positive control. The results showed a significant reduction in swimming times in the target quadrant during the test session between the vehicle-treated control group and the ESC-treated group (p <.05). This decrease was significantly suppressed (p <.05) by the administration of NAC, WU at 200 mg/kg and VP at 200 and 100 mg/kg. Oral administration with TL showed no significant differences in swimming times compared to the ESC-treated group. Therefore, this study showed that VP and WU extracts protect against scopolamine-induced memory loss and contributes to revealing the ethnopharmacological potential on the CNS produced by these endemic species.
Keywords: Central nervous system NS, ethnopharmacology, behavior, Alzheimer's, in vivo.
Introducción
Los trastornos neurológicos están asociados actualmente a la primer causa de discapacidad mundial y la segunda causa principal de muerte, con aproximadamente 276 y 9 millones, respectivamente (Feigin et al., 2019). Muchas de estas afecciones neurológicas involucran procesos neurodegenerativos, caracterizados por la disfunción progresiva de neuronas específicas, lo que determina la manifestación clínica del trastorno (Jellinger, 2010). A medida que las poblaciones crecen y envejecen, la prevalencia de los principales trastornos neurodegenerativos discapacitantes aumenta abruptamente con la edad. La enfermedad de Alzheimer es una enfermedad neurodegenerativa progresiva con déficits en transmisión colinérgica que influencia en aspectos de cognición y comportamiento, impactando en el deterioro de la memoria a corto plazo como uno de los primeros síntomas que se desarrollan (Ferreira-Vieira, Guimaraes, Silva, & Ribeiro, 2016). Se ha estimado que en países de ingreso alto, trastornos neurodegenerativos como enfermedad de Alzheimer y otras demencias están asociadas a la segunda causa de muerte y a la séptima a nivel mundial (World Health Organization [WHO], 2018). Los gobiernos se enfrentarán en los próximos años a una creciente demanda de tratamiento, rehabilitación y servicios de apoyo para los trastornos neurológicos. La escasez de control para factores de riesgo para la mayor parte de la carga neurológica demuestra que se requieren nuevos conocimientos para desarrollar estrategias eficaces de prevención y tratamiento.
Numerosos modelos animales han contribuido en buscar candidatos farmacológicos para la enfermedad de Alzheimer y envejecimiento basados en la hipótesis colinérgica y en la sobreexpresión de genes humanos que dan como resultado la formación de placas amiloides y en la alteración de fosforilación en proteínas tau (Gilles, Ertlé, & Macher, 2001; Ferreira-Vieira et al., 2016). Entre ellos se encuentra un modelo a partir del alcaloide escopolamina (ESC), el cual es un bloqueador no selectivo, competitivo del receptor muscarínico, lo que asemeja a una pérdida de memoria producida por procesos neurodegenerativos. Aunque es un modelo que no refleja en totalidad la pérdida de memoria con modelos neurodegenerativos asociados con la edad, brinda potencial farmacológico para la búsqueda de candidatos con actividad en memoria. Los productos naturales han cobrado un papel importante en desarrollo de nuevas alternativas terapéuticas. En las últimas décadas, sólo para la enfermedad de Alzheimer se han identificado a nivel mundial más de 300 plantas con potencial terapéutico mediante la regulación de la acetilcolinesterasa (Barbosa Filho et al., 2006). En Guatemala, han sido poco exploradas las alternativas terapéuticas tradicionales para problemas asociados a la calidad de vida, como pérdida de memoria, o para problemas relacionados a la neurodegeneración. Gran parte de la población del área rural no cuenta con atención primaria en salud, por lo cual la medicina tradicional sigue siendo un pilar para lograr la cobertura nacional de salud ( Kragel, Merz, Flood, & Haven, 2020). Así mismo, existe una limitada evidencia de la seguridad y eficacia de las plantas utilizadas tradicionalmente en la región de forma medicinal, lo cual dificulta la formulación de políticas que regulen e integren su uso en la atención primaria de salud (Geck et al., 2020). Existe una gran diversidad de plantas medicinales nativas de Guatemala que actúan a nivel del sistema nervioso (Awad et al., 2009; Hitziger, et al., 2016; Ortiz, Valdez, & Cáceres, 2013). Sin embargo, la gran mayoría de estas especies carecen de suficiente evidencia que exploren su actividad farmacológica y su potencial protector en el sistema nervioso central.
En el presente estudio se evalúo la actividad neuroprotectora de tres plantas nativas de uso tradicional en Guatemala para afecciones neurológicas (Tagetes lucida Cav, Valeriana prionophylla Standl.y Wigandia urens Ruiz & Pav. Kunth) en un modelo de pérdida de memoria inducida por ESC en ratones CD-1 a partir del laberinto acuático de Morris. Este estudio adiciona una actividad en memoria dependiente de dosis a nivel in vivo de especies nativas, contribuyendo en el campo de la etnofarmacología a partir de evidenciar protección de cambios en comportamiento de roedores y contribuyendo a la hipótesis de su potencial interacción con estructuras del SNC.
Materiales y métodos
Declaración de ética
Todos los procedimientos experimentales en animales se llevaron a cabo de acuerdo con la Guía del Instituto Nacional de Salud de Estados Unidos para el Cuidado y Uso de Animales de Laboratorio (publicación NIH, No. 80-23, revisada en 1996). Los protocolos fueron sometidos y aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Ciencias Químicas y Farmacia (Ref. CICUAL-CCQQF-01-2021).
Químicos y drogas experimentales
Escopolamina clorhidrato (ESC, Sigma, ST. Luis, USA) fue disuelta en solución salina inyectable y administrado vía intraperitoneal (IP). N-acetilcisteína (Sigma, ST. Luis, USA) y los extractos experimentales fueron disueltos en DMSO 1.5% y administrados vía oral a partir de sonda orogástrica (PO). El material vegetal utilizado para preparar los extractos etanólico de hoja de T. lucida (TL), etanólico de raíz de V. prionophylla (VP), y metanólico de flor de W. urens, fue colectado en Totonicapan, Quiché y Chimaltenango (respectivamente), identificados y depositados en los herbarios BIGU, AGUAT, y Farmaya (con números de Voucher 1127, 49181, 1068, respectivamente). Todas las preparaciones fueron realizadas a partir de los extractos secos y administradas frescas y diluidas inmediatamente antes de la administración.
Animales de experimentación
Se utilizaron ratones CD-1 macho de 10 semanas con un peso aproximado de 25-30 gramos, de progenitores obtenidos de Charles River Laboratories International, Inc (Wilmington, Massachusetts, USA); lo cuales se mantuvieron desde su nacimiento a una temperatura de 22±3°, humedad 40-60%, con un ciclo de 12 h de luz y 12 h de oscuridad, con comida y agua ad libitum y con control de comportamientos innatos. Estos fueron aclimatados en sus cajas por grupos de experimentación por un periodo de 5 días, antes de comenzar con la experimentación. Se realizó una validación previa a la realización de los experimentos evaluando distintas dosis de ESC, con el fin de determinar un correcto número de muestra con base a poder estadístico utilizando el software G power 3 (número óptimo de n=8 por grupo). El diseño del experimento consistió en los siguientes grupos: Control normal (vehículo PO y salino IP), Control ESC (vehículo PO y ESC IP), Control positivo (NAC PO y ESC IP) y grupos experimentales a 200 y 100 mg/kg (VP, WU o TL PO junto a ESC vía IP).
Evaluación de memoria
Se evaluó la pérdida de memoria mediante el laberinto de Morris (Morris, 1984), a partir de una piscina circular (104 cm de diámetro y 48 cm de altura), llena con agua coloreada con un tinte negro soluble en agua no tóxico y con temperatura de 25±1°C, dividida en cuatro cuadrantes iguales. Dentro de uno de los cuadrantes se encontraba una plataforma transparente (8 cm de diámetro y 29-32 cm de altura) y sumergida 1 cm debajo de la superficie del agua para que sea invisible en la superficie (Vorhees & Williams, 2006). La piscina contenía varias señales visuales prominentes para diferenciar los cuatro cuadrantes. La trayectoria de cada ratón mientras nadaba desde la posición inicial hasta la plataforma se monitoreo usando “Trox trac” como software de seguimiento.
La fase experimental se dividió en tres fases, adaptación (día 1), entrenamiento (día 2-6), sesión de prueba (día 7). En la fase de adaptación el agua estaba sin colorante y la plataforma se encontraba en el centro y visible en la superficie a 1 cm sobre el agua, colocando al ratón 20 s sobre la plataforma y posterior se le dejo dejó nadar 60 s. En esta fase, al encontrar la plataforma se dejaba al ratón en ella 10 s y si no la encontraba en los 60 s, se le transportaba a esta. Esta fase se realizó en un total de tres veces, cambiando de cuadrante en cada prueba. En la fase de entrenamiento, se realizaron pruebas de 60 s con la plataforma colocada siempre en el mismo cuadrante, con agua con colorante y sumergida 1 cm. Al igual que la fase anterior, al encontrar la plataforma se dejaba al ratón en ella 10 s y si no la encontraba en los 60 s, se le transportaba a esta, en un total de tres veces. En la sesión de prueba, se realizó una única evaluación de 60 s sin plataforma.
El esquema del tratamiento de cada grupo de experimentación se realizó en tres periodos en tiempos idénticos para cada ratón. Posterior a aclimatación de 1 h en el sitio de evaluación, se inició la administraron oral a los ratones de los extractos vegetales y N-acetilcisteína, con sus respectivos controles de vehículo. Después de 30 min, se administró ESC por vía IP, con sus respectivos controles de vehículo. Posteriormente, 30 min después, se colocaron a los ratones en el laberinto de Morris (Rubio et al., 2007).
Análisis estadístico
Los datos (tiempo de nado) se analizaron utilizando el software estadístico Prism 8.0.1 (GraphPad, San Diego, CA, USA). Todos los datos se expresaron como la media ± error estándar de la media (SEM) junto con el intervalo de confianza del 95% (CI95%). La prueba M de Box se utilizó para determinar la homogeneidad de las covarianzas. Las comparaciones estadísticas se realizaron entre tiempos de nado en los días de entrenamiento utilizando ANOVA de dos vías de medidas repetidas entre los grupos tratados con tratamiento experimental y tratados con vehículo, seguido de la prueba posterior de comparación Dunnett. Los valores de p< .05 se consideraron estadísticamente significativos. Los datos se normalizaron para todos los grupos en cada día individual, a partir de dividir cada valor en los valores promedios del grupo ESC (corrección automática por software estadístico) con el fin de hacer comparaciones en distintos experimentos.
Resultados
Para la evaluación del potencial neuroprotector de las especies vegetales se realizó la evaluación de pérdida de memoria inducida por ESC en laberinto acuático de Morris. Inicialmente, se evaluó el efecto de una concentración de 200 mg/kg para todos los extractos (Figura 1), siendo el grupo administrado con TL el extracto que menor neuroprotección obtuvo comparado con el control de ESC, tanto en el entrenamiento como en la prueba final, por lo cual no se incluyó en posteriores evaluaciones. Los resultados muestran que los tiempos de nado dentro del cuadrante dentro de la sesión de prueba para VP (28.31±1.34 con CI95% = [25.15, 31.48]) fueron significativamente mayores (p<.05) comparados con los observados para el grupo ESC (22.59±2.19 con CI95% = [17.40, 27.78]).
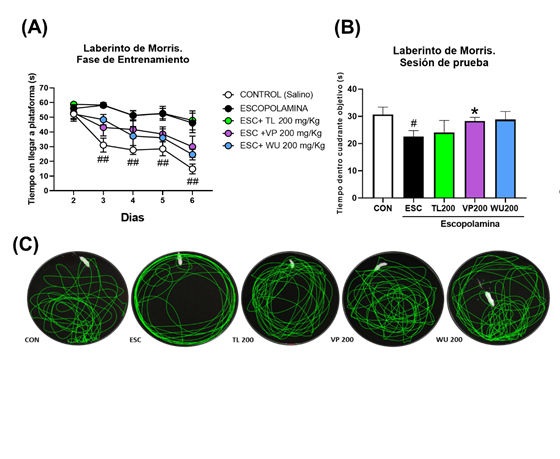
Los efectos obtenidos por los extractos de VP y WU se evaluaron a 200 mg/kg y 100 mg/kg comparándolos con un control normal salino (CON), un control de ESC 3 mg/kg y un control positivo de N-acetilcisteína (NAC) 100 mg/kg. Se observó una diferencia significativa entre el grupo ESC y CON (p<.05), con menores tiempos de nado en el cuadrante objetivo durante la sesión de prueba (25.10±2.44 con CI95% = [19.33, 30.86]; 34.10±3.03 con CI95% = [26.93, 41.26], respectivamente). Esta disminución fue suprimida significativamente (p<.05) tras la administración de NAC y WU únicamente a 200 mg/kg (Figura 2), observando mayores tiempos de nado en cuadrante objetivo durante la sesión de prueba (31.87±1.41 con CI95% = [28.54, 35.21]; 33.76±3.28 con CI95% = [25.74, 41.79]; respectivamente). A su vez, ambas dosis de VP administradas (200 y 100 mg/kg) mostraron significativamente mayores tiempos de nado (31.46±1.49 con CI95% = [27.94, 34.97]; 34.25±2.64 con CI95% = [28.02, 40.49]; respectivamente) comparado con ESC (Figura 3).
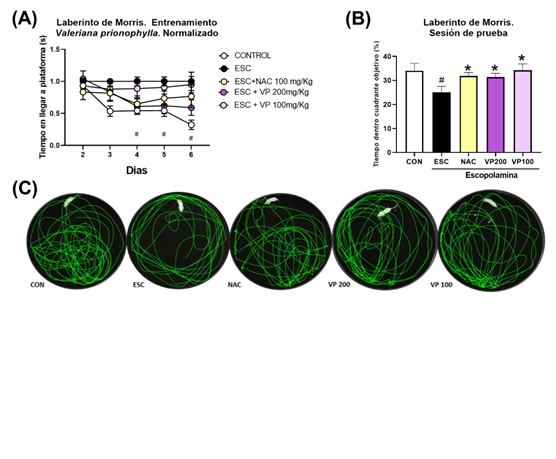
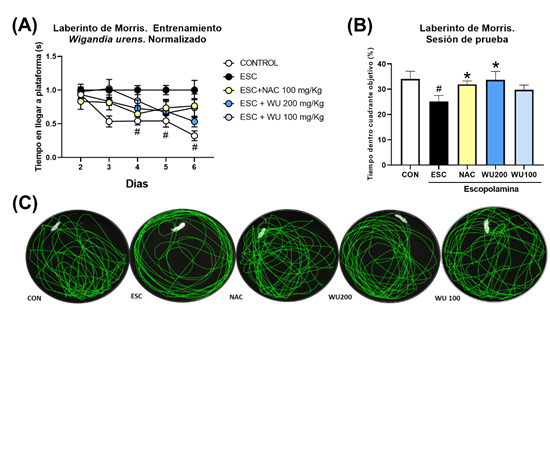
Discusión
El uso tradicional de plantas medicinales es una característica distintiva de civilizaciones antiguas mesoamericanas la cual se mantiene aún en la actualidad (Geck et al., 2020; Vargas & Andrade-Cetto, 2018). A pesar de esto la etnofarmacología orientada a la exploración de enfermedades neurodegenerativas es una rama que se encuentra poco estudiada en Guatemala. El presente estudio evaluó el potencial neuroprotector frente a la pérdida de memoria ocasionada por ESC de 3 plantas nativas con uso tradicional en Guatemala en afecciones del SNC. Para esto se inició con la validación de la concentración de (ESC) para el modelo del laberinto acuático de Morris. Seguidamente se evaluaron los extractos de V. prionophylla (VP), W. urens (WU) y T. lucida (TL).
En el SNC se encuentran altamente distribuidas neuronas colinérgicas, que participan en procesos fisiológicos importantes como atención, aprendizaje, memoria, respuesta al estrés, información sensorial, vigilia y sueño (Ferreira-Vieira et al., 2016). En la enfermedad de Alzheimer, la degeneración de estas neuronas por la formación de placas amiloides impide la función de acetilcolina endógena con la modulación de la adquisición, la codificación, la consolidación, la reconsolidación, la extinción y la recuperación de la memoria. Como modelo para evaluar la memoria espacial se utilizó el laberinto acuático de Morris (Barnes, Danysz, & Parsons, 1996; Morris, 1984), donde se evalúa la memoria de adquisición (durante el entrenamiento) y de referencia (durante la prueba final) (Vorhees & Williams, 2006). Los neurotransmisores colinérgicos como la acetilcolina son los principales responsables de la transmisión sináptica, por tanto, la disfunción de esta puede causar pérdida de memoria. Como inductor de pérdida de memoria se utilizó ESC, ya que se ha demostrado que esta afecta la adquisición de la memoria, mediante el antagonista competitivo no especifico de los receptores colinérgicos muscarínicos (Can et al., 2018). Producto de esto se traduce en un déficit en el aprendizaje y memoria al interrumpir la neurotransmisión colinérgica (Kim et al., 2018). Por lo cual, esta molécula es usada comúnmente para inducir pérdida de memoria en sujetos experimentales y modelar con cierto grado la Enfermedad de Alzheimer (Gilles et al., 2001). Como control positivo se utilizó N-acetilcisteína (NAC) el cual ha demostrado minimizar el daño cortical causado por la administración de ESC (Al-Quraishy et al., 2020); así como producir un efecto antioxidante y regular la disminución de la noradrenalina, dopamina, serotonina, histamina y ATP en el hipocampo (Al omairi et al., 2019).
VP es una planta que se encuentra descrita en varios países de Centroamérica y México. En Guatemala se encuentra descrita en al menos 8 departamentos, conocida tradicionalmente como Valeriana del monte, se ha usado como sedante y antiespasmódico, para tratar afecciones nerviosas (Chavadej, Becker, & Weberling, 1985; Holzmann et al., 2016). Se ha comprobado que tiene efectos relajantes, ansiolíticos, antidepresivos y sedantes con extractos hidroalcohólico en modelos in vivo en ratones utilizando modelos como: campo abierto, varilla de rotación, laberinto en cruz elevado (EPM), el nado forzado; así mismo también demostró tener efectos vasorelajante con extracto etanolico en un modelo in vivo en ratas (Reis et al., 2013). No hay gran variedad estudios específicos sobre esta especie en particular, pero se infiere que puede tener actividades similares a otras del mismo género que se ha demostrado, que actúa a nivel del SNC. Esto debido a sus similitudes químicas, por ejemplo, la presencia de valepotriatos que se encuentran en otras especies del género Valeriana y encontrados en gran proporción en VP (Chavadej et al., 1985), los cuales se ha demostrado que actúan a nivel del SNC ( Maurmann, Reolon, Rech, Fett-Neto, & Roesler, 2011). Los datos demostraron que tanto la concentración de 200 mg/kg como la de 100 mg/kg protegen de los daños inducidos por la ESC 3 mg/kg, lo cual sugiere que ambas concentraciones del extracto de VP son neuroprotectoras frente al mecanismo de la ESC que causa perdida de memoria. Esto concuerda con un anterior estudio in vitro que demostró que VP tiene un efecto moderado inhibitorio de la acetilcolinesterasa (Ortiz et al., 2013). Siendo este uno de los posibles mecanismos de acción de VP contra la ESC, debido a que se impide la destrucción de la acetilcolina y produce un efecto parasimpaticomimético indirecto mediante el aumento de la concentración de acetilcolina en el receptor. VP también comparte ciertos metabolitos secundarios con Valeriana officinalis L. (De Souza et al., 2011). En la cual el efecto neuroprotector y los mecanismos de acción están más estudiados, como la influencia en las vías de señalización que involucran ión calcio y el estado antioxidante de las células (Malva, Santos, & Macedo, 2004) y los mecanismos contra la hiperexcitabilidad, disminución de muerte neuronal, asfixia y agotamiento de ATP (Santos et al., 2016). Pudiendo ser estos mecanismos alternativos que también influyan en la neuroprotección de VP siendo nuevos punto de partida para posteriores investigaciones de VP.
WU se encuentra descrita en al menos 9 departamentos de Guatemala (Ortiz et al., 2013). Se ha reportado su uso en la fitoterapia maya en el tratamiento de la epilepsia y síntomas psicológicos (Hitziger, 2016). Esta especie casi no se ha estudiado en modelo in vitro y la presente investigación representa el primer estudio en un modelo in vivo. Los datos demostraron que la concentración de 200 mg/kg presento un mejor efecto de neuroprotección contra la ESC respecto a la concentración de 100 mg/kg, presentando valores similares a los del control N-acetilcisteína y sugiriendo la dosis mínima para alcanzar actividad. Este primer reporte crea un precedente para futuras investigaciones en WU, pudiendo ser que el efecto neuroprotector no sea estrictamente a través de regulación de acetilcolina, el cual es el que más comúnmente se evalúa al utilizar como control ESC.
TL se encuentra descrita en al menos nueve departamentos de Guatemala. Se usa por la población maya para tratar patologías del SNC como el susto, nerviosismo y (Hitziger, 2016). Se ha demostrado que tiene actividad como antidepresiva, ansiolítica y sedantes en modelos in vitro e in vivo utilizando extractos acuosos en modelos de nado forzado (Guadarrama-Cruz, Alarcon-Aguilar, Lezama-Velasco, Vazquez-Palacios, & Bonilla-Jaime, 2008; Mata-Pinzón, Pérez-Ortega, Reyes-Chilpa, Hobompich, & Roo, 2018). A pesar de tener cierto efecto como inhibitorio in vitro sobre la acetilcolinesterasa (Ortiz et al., 2013), el presente estudio no demostró tener actividad contra la pérdida de memoria ocasionada por la ESC. Aunque esto no descarta el potencial de esta especie, donde futuros estudios podrían esclarecer las condiciones de extracción o de química específica para demostrar su actividad.
Este estudio demostró la relación que puede existir entre algunas plantas con usos tradicionales para tratar afecciones del SCN y su actividad y potencial neuroprotector. Así mismo algunos de los extractos de las plantas evaluadas redujeron significativamente la pérdida de memoria causada por la ESC, lo cual puede dar pauta a futuras investigaciones que evalúen más específicamente fracciones de extractos y mecanismo de acción. Sin embargo, para este estudio solo se evaluaron parámetros de comportamiento sin tomar encuentra pruebas complementarias como análisis histológicos y marcadores biológicos específicos, por lo que estudios posteriores contribuirían en mostrar más evidencia de éstos efectos.
En conclusión, este estudio demostró que puede existir una posible relación entre las plantas usadas tradicionalmente para tratar afecciones del SNC y una posible actividad neuroprotectora. Se determinó que las concentraciones de 200 mg/kg y 100 mg/kg de extracto de VP tiene un efecto de neuroprotección frente a la pérdida de memoria ocasionada por ESC. La concentración de 200 mg/kg del extracto de WU presentó un efecto de neuroprotección similar al que produce el control positivo N-acetilcisteína. El extracto de TL no mostró un efecto de neuroprotección frente a la ESC. Este estudio sugiere que el enfoque de etnofarmacología en Guatemala puede llegar a tener contribuciones en la búsqueda de nuevos candidatos farmacológicos.
Agradecimientos
Este trabajo fue realizado con el financiamiento del laboratorio de investigación de farmacología experimental y bioterio, USAC. Los extractos fueron proporcionados por el laboratorio de investigación de productos naturales, USAC.
Referencias
Al-Quraishy, S., Dkhil, M. A., Abdel-Gaber, R., Zrieq, R., Hafez, T. A., Mubaraki, M. A., & Abdel Moneim, A. E. (2020). Myristica fragrans seed extract reverses scopolamine-induced cortical injury via stimulation of HO-1 expression in male rats. Environmental Science and Pollution Research, 27(11), 12395-12404. doi:10.1007/s11356-020-07686-8
Al omairi, N. E., Al-Brakati, A. Y., Kassab, R. B., Lokman, M. S., Elmahallawy, E. K., Amin, H. K., & Abdel Moneim, A. E. (2019). Soursop fruit extract mitigates scopolamine-induced amnesia and oxidative stress via activating cholinergic and Nrf2/HO-1 pathways. Metabolic Brain Disease, 34 (3), 853-864. doi:10.1007/s11011-019-00407-2
Awad, R., Ahmed, F., Bourbonnais-Spear, N., Mullally, M., Ta, C. A., Tang, A., … & Arnason, J. T. (2009). Ethnopharmacology of Q’eqchi’ Maya antiepileptic and anxiolytic plants: Effects on the GABAergic system. Journal of Ethnopharmacology, 125(2), 257-264. doi:10.1016/j.jep.2009.06.034
Barbosa Filho, J. M., Medeiros, K. C., Diniz, M. de F. F., Batista, L. M., Athayde-Filho, P. F., Silva, M. S., … & Quintans-Júnior, L. J. (2006). Natural products inhibitors of the enzyme acetylcholinesterase. Revista Brasileira de Farmacognosia, 16(2), 258-285. doi:10.1590/s0102-695x2006000200021
Barnes, C. A., Danysz, W., & Parsons, C. G. (1996). Effects of the Uncompetitive NMDA Receptor Antagonist Memantine on Hippocampal Long-term Potentiation, Short-term Exploratory Modulation and Spatial Memory in Awake, Freely Moving Rats. European Journal of Neuroscience, 8(3), 565-571. doi:10.1111/j.1460-9568.1996.tb01241.x
Can, M. Van, Tran, A. H., Pham, D. M., Dinh, B. Q., Le, Q. Van, Nguyen, B., … & Nishijo, H. (2018). Willughbeia cochinchinensis prevents scopolamine-induced deficits in memory, spatial learning, and object recognition in rodents. Journal of Ethnopharmacology, 214, 99-105. doi:10.1016/j.jep.2017.06.035
Chavadej, S., Becker, H., & Weberling, F. (1985). Further investigations of valepotriates in the Valerianaceae. Pharmaceutisch Weekblad Scientific Edition, 7(4), 167-168. doi:10.1007/BF02097255
De Souza, M. M., Holzmann, I., Cechinel Filho, V., Mora, T. C., Cáceres, A., Martínez, J. V., & Cruz, S. M. (2011). Evaluation of behavioral and pharmacological effects of hydroalcoholic extract of Valeriana prionophylla Standl. from Guatemala. Evidence-Based Complementary and Alternative Medicine, 2011,1-9. doi:10.1155/2011/312320
Feigin, V. L., Nichols, E., Alam, T., Bannick, M. S., Beghi, E., Blake, N., …Vos, T. (2019). Global, regional, and national burden of neurological disorders, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet Neurology, 18(5), 459-480. doi:10.1016/S1474-4422(18)30499-X
Ferreira-Vieira, T. H., Guimaraes, I., Silva, F., & Ribeiro, F. (2016). Enfermedad de Alzheimer: dirigida al sistema colinérgico. Neurofarmacología Actual, 14 (1), 101-115.
Geck, M. S., Cristians, S., Berger-González, M., Casu, L., Heinrich, M., & Leonti, M. (2020). Traditional Herbal Medicine in Mesoamerica: Toward Its Evidence Base for Improving Universal Health Coverage. In Frontiers in Pharmacology, 11, 1-49. doi:10.3389/fphar.2020.01160
Gilles, C., Ertlé, S., & Macher, J. P. (2001). Pharmacological models in Alzheimer’s disease research. In Annales Medico-Psychologiques,159 (1), 54- 62. doi:10.1016/S0003-4487(00)00011-1
Guadarrama-Cruz, G., Alarcon-Aguilar, F. J., Lezama-Velasco, R., Vazquez-Palacios, G., & Bonilla-Jaime, H. (2008). Antidepressant-like effects of Tagetes lucida Cav. in the forced swimming test. Journal of Ethnopharmacology, 120(2), 277-281. doi:10.1016/j.jep.2008.08.013
Hitziger, M. (2016). Mayan phytotherapy in Guatemala: A transdisciplinary study for ethnographic documentation and local empowerment. (Tesis doctoral). Swiss Federal Institute of Technology in Zürich, Federal Republic of Germany. Recuperado de https://www.research-collection.ethz.ch/bitstream/handle/20.500.11850/121326/1/ETH23585.pdf
Hitziger, M., Heinrich, M., Edwards, P., Pöll, E., Lopez, M., & Krütli, P. (2016). Maya phytomedicine in Guatemala - Can cooperative research change ethnopharmacological paradigms?. Journal of Ethnopharmacology, 186, 61–72. https://doi.org/10.1016/j.jep.2016.03.040
Holzmann, I., Cechinel Filho, V., Cáceres, A., Martínez, V., Cruz, S. M., & María De Souza, M. (2016). Antidepressant-like effect of hydroalcoholic extract of Valeriana prionophylla Standl. from Guatemala: Evidence for the involvement of the monoaminergic systems. International Journal of Phytopharmacy, 6(1), 14-26. doi:10.7439/ijpp.v6i1.2692
Jellinger, K. A. (2010). Basic mechanisms of neurodegeneration: A critical update. Journal of Cellular and Molecular Medicine, 14(3), 457-487. doi:10.1111/j.1582-4934.2010.01010.x
Kim, M. S., Lee, D. Y., Lee, J., Kim, H. W., Sung, S. H., Han, J. S., & Jeon, W. K. (2018). Terminalia chebula extract prevents scopolamine-induced amnesia via cholinergic modulation and anti-oxidative effects in mice. BMC Complementary and Alternative Medicine, 18(1), 1-11. doi:10.1186/s12906-018-2212-y
Kragel, E. A., Merz, A., Flood, D. M. N., & Haven, K. E. (2020). Risk factors for stunting in children under the age of 5 in rural guatemalan highlands. Annals of Global Health, 86(1), 1-5. doi:10.5334/aogh.2433
Malva, J. O., Santos, S., & Macedo, T. (2004). Neuroprotective properties of Valeriana officinalis extracts. Neurotoxicity Research, 6(2), 131-140. doi:10.1007/BF03033215
Mata-Pinzón, S., Pérez-Ortega, G., Reyes-Chilpa, R., Hobompich, I., & Roo, Q. (2018). Plantas Medicinales Para El Tratamiento Del Susto y Mal De Ojo. Análisis De Sus Posibles Efectos Sobre El Sistema Nervioso Central Por Vía Transdérmica E Inhalatoria. Revista Etnobiología, 16(2), 30-47.
Maurmann, N., Reolon, G. K., Rech, S. B., Fett-Neto, A. G., & Roesler, R. (2011). A valepotriate fraction of valeriana glechomifolia shows sedative and anxiolytic properties and impairs recognition but not aversive memory in mice. Evidence-Based Complementary and Alternative Medicine, 2011, 1-7. doi:10.1093/ecam/nep232
Morris, R. (1984). Developments of a water-maze procedure for studying spatial learning in the rat. Journal of Neuroscience Methods, 11(1), 47-60. doi:10.1016/0165-0270(84)90007-4
Ortiz, D., Valdez, A., & Cáceres, A. (2013). Actividad inhibitoria de la acetilcolinesterasa por extractos de 18 especies vegetales nativas de Guatemala usadas en el tratamiento de afecciones nerviosas. Revista Científica de La Facultad de Ciencias Químicas y Farmacia, 22(1), 17-25.
Reis, M. R., Oliveira Filho, A. A. De, Rodrigues, L. S., Araújo, J. P., Maciel, P. M., De Albuquerque, J. M., … & Silva, D. F. (2013). Involvement of potassium channels in vasorelaxant effect induced by Valeriana prionophylla Standl. in rat mesenteric artery. Evidence-Based Complementary and Alternative Medicine, 2013, 1-10. doi:10.1155/2013/147670
Rubio, J., Dang, H., Gong, M., Liu, X., Chen, S. lin, & Gonzales, G. F. (2007). Aqueous and hydroalcoholic extracts of Black Maca (Lepidium meyenii) improve scopolamine-induced memory impairment in mice. Food and Chemical Toxicology, 45(10), 1882-1890. doi: 10.1016/j.fct.2007.04.002
Santos, G., Giraldez-Alvarez, L. D., Ávila-Rodriguez, M., Capani, F., Galembeck, E., Neto, A. G., … & Andrade, B. (2016). SUR1 receptor interaction with hesperidin and linarin predicts possible mechanisms of action of Valeriana officinalis in Parkinson. Frontiers in Aging Neuroscience, 8, 1-12. doi:10.3389/fnagi.2016.00097
Vargas, J. M., & Andrade-Cetto, A. (2018). Ethnopharmacological field study of three Q’Eqchi communities in Guatemala. Frontiers in Pharmacology, 9, 1-14. doi:10.3389/fphar.2018.01246
Vorhees, C. V., & Williams, M. T. (2006). Morris water maze: Procedures for assessing spatial and related forms of learning and memory. Nature Protocols, 1(2), 848-858. doi:10.1038/nprot.2006.116
World Health Organization. (2020). The top 10 causes of death. Ginebra, Suiza: Autor. Recuperado de http://www.who.int/en/news-room/fact-sheets/detail/the-top-10-causes-of-death
Notas de autor
castaneda.rodrigo@usac.edu.gt

