



Casos clínicos
Nefroma mesoblastico congénito: reporte de un caso
Gaceta Médica Boliviana
Universidad Mayor de San Simón, Bolivia
ISSN: 1012-2966
ISSN-e: 2227-3662
Periodicidad: Semestral
vol. 44, núm. 1, 2021
Recepción: 05 Febrero 2021
Aprobación: 12 Mayo 2021
Resumen: El nefroma mesoblastico congénito es un tumor renal infrecuente, pero común en el periodo neonatal. De comportamiento benigno y pronóstico excelente en su variedad clásica pero en el subtipo celular puede presentar recurrencia local, invasión retroperitoneal y metástasis pulmonares y cerebrales. El tratamiento es la nefrectomía radical. Los factores pronósticos son la edad menor a tres meses y la resección quirúrgica completa. Paciente de 17 días nacida a las 35 semanas por polihidramnios, con diagnóstico prenatal de masa abdominal. Al examen físico masa en flanco derecho e hipertensión arterial (121/79 mm Hg, TAM 77mm Hg). Ecografía abdominal con riñón derecho aumentado de tamaño y voluminosa formación sólida, de 4,4 x 4,3 x 4,8 cm, heterogénea y vascularizada al Doppler en polo inferior. Tomografía de abdomen con formación nodular heterogénea de 5,0 x 4,1 x 5,1 cm en polo inferior del riñón derecho. Se realizó nefrectomía radical derecha sin complicaciones. Evolución en los últimos 20 meses satisfactoria y libre de enfermedad.
Palabras clave: nefroma mesoblástico congénito, riñón, tumor renal.
Abstract: Congenital mesoblastic nephroma is an uncommon renal tumor, but frequent in neonates. Classical variety usually benign with excellent prognosis. Cellular cases may be recurrent with retroperitoneal invasion, brain and lung metastasis. Radical nephrectomy is the treatment of choice. Relevant prognostic factors are diagnosis before three months of age and complete resection. A 17 day old patient, borned at 35 weeks due to polyhydramnios, with prenatal diagnosis of abdominal mass. On examination, right flank abdominal mass and arterial hypertension (121/79 mm Hg, MAP 77 mm Hg). Abdominal ultrasound showed an enlarged right kidney with a voluminous solid heterogeneous mass, 4.4 x 4.3 x 4.8 cm in the lower pole, vascularized on Doppler scan. Computed tomography showed a big 5.0 x 4.1 x 5.1 cm, nodular, heterogeneous mass in the lower pole of the right kidney. Right radical nephrectomy was performed with an uneventful recovery. Follow up for the last 20 months satisfactory and free of disease.
Keywords: congenital mesoblastic nephroma, kidney, renal tumor.
El nefroma mesoblástico congénito (NMC) es un tumor renal poco frecuente1-4, pero el más común en recién nacidos5,6. habitualmente se presenta antes de los tres meses de edad como masa abdominal asociada a hipertensión arterial7-9 en algunos casos. El laboratorio puede mostrar anemia, hipercalcemia10 o hiperreninemia7-9. La ecografía y la resonancia magnética obstétrica y postnatal son importantes para el diagnóstico11-16. Hay tres variantes histopatológicas, una clásica con escasa celularidad y pocas mitosis, otra celular con muchas células y mitosis y una variante mixta con características de las dos anteriores17,18. El NMC se considera benigno y con pronóstico favorable luego de la nefrectomía radical temprana abierta o laparoscópica y con amplios márgenes de seguridad19. Hay casos dependiendo de la variedad histológica y del estadio, con tendencia a la recidiva o con metástasis ganglionares, pulmonares o cerebrales que pueden eventualmente responder a la quimioterapia20,21.
Presentamos las características clínicas, histopatológicas, diagnósticas y terapéuticas de este tumor, considerando su poca frecuencia y comentamos lo descrito en la literatura.
Presentación del caso
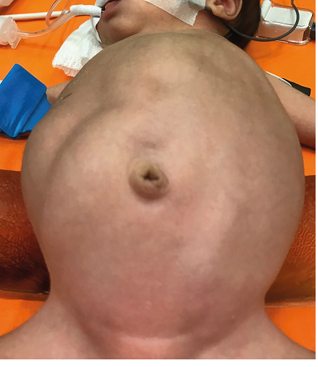
Paciente de 17 días de vida, nacida a las 35 semanas por polihidramnios, con 2.290 gramos y diagnóstico prenatal de masa abdominal. Embarazo controlado con serologías negativas. Permaneció en luminoterapia 3 días por hiperbilirrubinemia, con buen estado general y lactancia materna a libre demanda. Examen físico: Tumoración abdominal en flanco derecho (Figura 1) asociada a hipertensión arterial (HTA) (121/79 mm Hg, TAM 97 mm Hg). Laboratorio: Normal incluyendo catecolaminas, ácido vainillin mandélico en orina de 24 horas y marcadores tumorales AFP y BHCG.
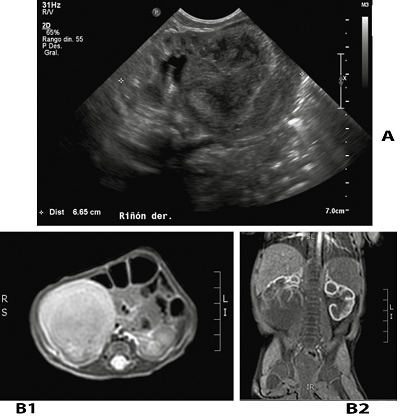
Ecografía abdominal: Riñón derecho aumentado de tamaño con una masa sólida, voluminosa, de 4,4 x 4,3 x 4,8 cm, heterogénea y vascularizada al Doppler, ubicada en polo inferior, sin compresión vascular ni dilatación de la vía urinaria (Figura 2A).
Tomografía computada de abdomen con contraste: Voluminosa formación nodular de 5,0 x 4,1 x 5,1 cm, heterogénea, en polo inferior del riñón derecho, de aspecto atípico primario. Excreción urinaria conservada en polo superior (Figura 2B).
Tratamiento quirúrgico: Ingresando en celda renal derecha, se libera riñón con el tumor. Se ligan arteria renal y vena renal y uréter distal (Figura 3).
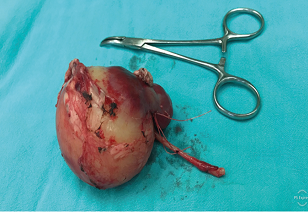
Tratamiento quirúrgico: Ingresando en celda renal derecha, se libera riñón con el tumor. Se ligan arteria renal y vena renal y uréter distal (Figura 3).
Posoperatorio inmediato con requerimiento de asistencia ventilatoria mecánica, analgesia con morfina y control de HTA con amlodipina. Anatomía patológica: Tumor renal de 5.4 x 4.5 x 4.5 cm, en polo inferior, que compromete el seno renal y la cápsula renal (Figura 4 A1). Microscópicamente, se observa una proliferación neoplásica con un patrón de crecimeinto en haces largos, con vasos sanguíneos de fina pared (Figura 4 B1), con células ovoides afusadas, núcleos de cromatina fina y citoplasma escaso eosinófilo, con ocasionales mitosis (Figura 4 B2). Los túbulos y glomérulos del parénquima renal se encuentran atrapados por el tumor (Figura 4 B3), que se expande y ocupa la grasa perirenal, alcanzando los márgenes circunferenciales de la resección de la pieza quirúrgica (Figura 4 B4). El patrón de infiltración es característico, en “dedos de guante”, quedando elementos del parénquima renal entre los haces que infiltran, sin pseudocápsula que los separe (Figura 4 B5).
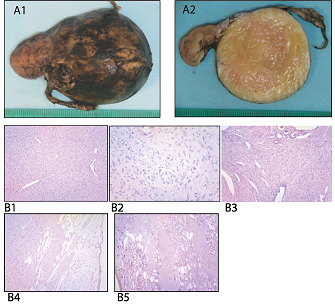
A. Características macroscópicas del tumor: A1 pieza quirúrgica: Tumor renal de 5.4 x 4.5 x 4.5 cm, en polo inferior, que compromete el seno renal y la cápsula renal. A2 al corte: Sólido, firme, blanco-amarillento, de bordes bien definidos. B. Hallazgos histopatológicos: B1 Patron de crecimeinto en haces largos, con vasos sanguíneos de fina pared y aspecto hemangiopericitoide. B2 Proliferación neoplásica de células ovoides a fusadas, núcleos de cromatina fina y citoplasma escaso eosinófilo, con ocasionales mitosis. B3 Tumor fusocelular, con túbulos y glomérulos del parénquima renal atrapados. B4 Expansión del tumor y ocupación de la grasa perirenal, alcanzando los márgenes circunferenciales de la resección de la pieza quirúrgica. B5 Patrón de infiltración característico, en “dedos de guante”, quedando elementos del parénquima renal entre los haces que infiltran, sin pseudocápsula que lo separe.
En conclusión, se trata de un nefroma mesoblástico congénito clásico, que compromete el seno, cápsula y vena renal y uréter libres de lesión. Estadío local III (SIOP). Estudio de FISH para el gen ETV6 negativo. Evolución posterior satisfactoria, sin recidiva del tumor ni metástasis en los controles clínicos y radiológicos mensuales efectuados en los últimos veinte meses.
Discusión
El NMC, es muy infrecuente1-4, aunque es el tumor más común en neonatos5,6 seguido por el tumor de Wilms en el primer año de vida3,4. Supone el 5% de todos los tumores renales pediátricos y el 50% de los tumores sólidos en recién nacidos3,4.
En el diagnóstico diferencial de tumor renal en el primer año de vida, se debe considerar al NMC, tumor de Wilms y otras lesiones también poco frecuentes como el tumor rabdoide o el sarcoma de células claras3,4.
Se presenta habitualmente como una masa renal descubierta en una ultrasonografía obstétrica como en nuestro caso o en el examen físico al nacimiento1,2,4. Al contrario de lo observado por nosotros, es más frecuente en el sexo masculino1,2. En todas las series, así como en nuestra paciente, el lado más afectado es el derecho y siempre es unilateral1,2. La asociación con hipertensión arterial observada en el caso descrito, es bien conocida5-7. Se debe a una compresión tumoral sobre el parénquima renal sano con aumento en la secreción de renina o a una producción para neoplásica de renina por las células tumorales. En la serie de casos realizada por Tejedor Sanchez dos de sus pacientes tuvieron hipertensión arterial que se corrigió con la cirugía19.
Los pacientes se presentan habitualmente con una masa abdominal antes de los 3 meses de vida1-4; de cualquier forma, el NMC puede ser diagnosticado antes del nacimiento con la ultrasonografía obstétrica11-16, tal como sucedió con nuestra paciente y las características del tumor pueden identificarse con la resonancia magnética prenatal11-16. Hasta un 40% de los NMC detectados prenatalmente, pueden presentar polihidramnios, como en nuestro caso12-15. En la serie de Tejedor Sanchez, la mitad de los pacientes tuvieron diagnóstico prenatal al igual que en nuestra paciente19. Esto obliga a efectuar en todos los casos en los que la ecografía obstétrica muestra una masa abdominal, una resonancia magnética11-14.
El NMC aumenta el tamaño y peso del riñón. Es circunscrito y bien delimitado y la superficie al corte es firme, amarillo-grisácea y parecida al leiomioma uterino17,18. Macroscópicamente afecta al parénquima renal. Las calcificaciones son infrecuentes pero hasta un 20% de los tumores presentan quistes o áreas multiquísticas. En general es una lesión benigna pero puede haber recurrencia local, invasión al retro peritoneo y metástasis pulmonares y cerebrales en la variante celular20,21.
En la histología, el NMC presenta haces entrelazados de células fusiformes con aspecto fasciculado, rodeando a túbulos y glomérulos17-18 como en nuestro caso. En la periferia, el tumor carece de cápsula, a diferencia del tumor de Wilms. En la variante clásica, la densidad celular es moderada y las mitosis son escasas como en el caso descrito. Sin embargo, los NMC celulares tienen hipercelularidad, importante actividad mitótica y focos de necrosis o hemorragia. Esta variante, se asocia a recurrencia local en el 7% de los casos, invasión al retro peritoneo y metástasis en pulmón o cerebro20,21.
Las células del NMC se parecen a las células musculares lisas, fibroblastos o miofibroblastos. Los focos de cartílago hialino como en nuestro caso, o la extensión extrarenal ocurre hasta en el 20% de los casos17,18.
Se ha asociado a prematuridad y polihidramnios15 como en la paciente descrita. También se ha relacionado con hemihipertrofia y síndrome de Wiedemann Beckwith, sugiriendo una relación pato-genética con el tumor de Wilms23.
En la variedad celular se ha encontrado la translocación t (12; 15) (p13; q25) que resulta en la fusión ETV6-NTRK3, alteración que se presenta también en los fibrosarcomas infantiles o congénitos, sugiriendo que pueden tratarse de una misma neoplasia23-26con patogenia similar y que la variante celular del NMC podría eventualmente responder a la quimioterapia. Las anomalías genéticas en el cromosoma 11que caracterizan al tumor de Wilms, han sido también asociadas al NMC23-26.
El tratamiento es la nefrectomía radical asegurando márgenes libres19. La cirugía abierta ha sido la técnica tradicional. La laparoscopía sin embargo, ofrece la ventaja de una mejor visión, menor tiempo de internación y morbilidad y permitiendo una extirpación con buenos márgenes de seguridad19. La cirugía laparoscópica debería ser la primera elección siempre que se practique por cirujanos expertos19.
El NMC tiene un buen pronóstico en general3,4,27. Las características microscópicas con valor pronóstico en otros tumores, en el NMC carecen de significación. Los factores pronósticos más relevantes y con mayor importancia que las características morfológicas3,4,27 son la edad menor a tres meses en el momento del diagnóstico y la resección completa del riñón. En los tumores inoperables o con recurrencia, la quimioterapia puede ser beneficiosa21.
Referencias
1. Bolande RP, Brough AJ, Izant RJ Jr. Congenital Mesoblastic Nephroma of Infancy. Pediatrics. 1967; 40: 272-8.
2. Gooskens SL, Houwing ME, Vujanic GM, Dome JS, Diertens T, Coulomb-l’HerminéA, Godzinski J, Pritchard-Jones K, Graf N, van den Heuvel-Eibrink MM. Congenital mesoblastic nephroma 50 years after its recognition: A narrative review. Pediatr Blood Cancer. 2017.
3. England RJ, Haider N, Vujanic GM, Kelsey A, Stiller CA, Pritchard-Jones K, Powis M. Mesoblastic nephroma: a report of the United Kingdom Children’s Cancer and Leukaemia Group (CCLG). Pediatr Blood Cancer. 2011; 56(5):744-8.
4. Lamb MG, Aldrink JH, O’Brien SH, Yin H, Arnold MA, Ranalli MA. Renal Tumors in Children Younger Than 12 Months of Age: A 65-Year Single Institution Review. J Pediatr Hematol Oncol. 2017; 39(2):103-107.
5. Isaacs H Jr. Fetal and neonatal renal tumors. J Pediatr Surg. 2008; 43(9):1587.
6. Glick R, Hicks J, Nuchtern JG, Wesson DE, Olutoye OO, Cass DL. Renal tumours in infants less than 6 months of age. J Pediatr Surg. 2004; 39(4): 522-525.
7. Malone PS, Duffy PG, Ransley PG, Ridson RA, Cook T, Taylor M. Congenital mesoblastic nephroma, renin production and hypertension. J Pediatr Surg. 1989; 24: 599-0.
8. Miller OF, Kolon TF. Hyperreninemia and congenital mesoblastic nephroma: case report and review of the literature. Urology. 2000; 55(5):775.
9. Khashu M, Osiovich H, Sargent MA. Congenital mesoblastic nephroma presenting with neonatal hypertension. J Perinatol. 2005; 25(6):433-435.
10. Jayabose S, Iqbal K, Newman L, San Filippo JA, Davidian MM, Noto R, Sagel I. Hypercalcemia in childhood renal tumors. Cancer 1988; 61(4):788.
11. Leclair MD. The outcome of prenatally diagnosed renal tumours. J Urol. 2005; 173: 1373-1379.
12. Chen WY, Lin CN, Chao CS, Yan-Sheng Lin M, Mak CW, Chuang SS, Tzeng CC, Huang KF. Prenatal diagnosis of congenital mesoblastic nephroma in mid-second trimester by sonography and magnetic resonance imaging. Prenat Diagn. 2003; 23(11): 927.
13. Irsutti M, Puget C, Baunin C, Duga I, Sarramon MF, Guitard J. Mesoblastic nephroma: prenatal ultrasonographic and MRI features. Pediatr Radiol. 2000; 30(3):147.
14. Murthi GV, Carachi R, Howatson A. Congenital cystic mesoblastic nephroma. Pediatr Surg Int. 2003; 19(1-2):109.
15. Liu YC, Mai YL, Chang CC, Chen KW, Chow SN. The presence of hydropsfetalis in a fetus with congenital mesoblastic nephroma. Prenat Diagn. 1996; 16(4):363.
16. Miniati D, Gay AN, Parks KV, Naik-Mathuria BJ, Hicks J, Nuchtern JG, Cass DL, Olutoye OO. Imaging accuracy and incidence of Wilms’ and non-Wilms’ renal tumors in children. J Pediatr Surg. 2008;43(7):1301-7.
17. Arias Santos M.D, Pavcovich Ruiz M, Andújar Sánchez M, Martínez Lanao D, León Arancibia L: Nefroma mesoblástico congénito. Rev Esp Patol. 2006;39: 243-5.
18. Ordoñez NG and Rosai J. Urinary tract. En: Rosai J, editor. Ackerman´s Surgical Pathology 9th ed Philadelphia. Ed Mosby. 2004; 1163-360.
19. Tejedor Sánchez R, López Díaz M, Cabezalí Barbancho D, Gómez Fraile A, López Vázquez F, Aransay Bramtot A, Cano Novillo I. Tratamiento quirúrgico del nefroma mesooblástico congénito. Cir Pediatr. 2009; 22: 201-204.
20. Heidelberg KP, Ritchey ML, Dausser RC, McKeever PE, Beckwith. Congenital mesoblastic nephroma metastatic to the brain. Cancer. 1993; 72: 2499-50.
21. Jehangir S, Kurian JJ, Selvarajah D, Thomas RJ, Holland AJA. Recurrent and metastatic congenital mesoblastic nephroma: where does the evidence stand?. Pediatr Surg Int. 2017;33(11):1183-1188.
22. Isaacks H Jr. Tumors, Gilbert-Barnes E editor. Potter´s Pathology of the Fetus and Infant. Mosby. 1996; 1242-339.
23. Roberts P, Lockwood LR, Lewis IJ, Bailey CC, Batcup G, Willians J. Cytogenetic abnormalities in mesoblastic nephroma: a link to Wilms’ tumour?. Med Pediatr Oncol. 1993; 21: 416-20.
24. Schofield DE, Yunis EJ, Fletcher JA. Chromosome aberrations in mesoblastic nephroma. Am J Pathol. 1993; 143: 714-24.
25. Vokuhl C, Nourkami-Tutdibi N, Furtwängler R, Gessler M, Graf N, Leuschner I. ETV6-NTRK3 in congenital mesoblastic nephroma: A report of the SIOP/GPOH nephroblastoma study. Pediatr Blood Cancer. 2018; 65(4).
26. Zhao M, Yin M, Kuick CH, Chen H, Aw SJ, Merchant K, et al. Congenital mesoblastic nephroma is characterised by kinase mutations including EGFR internal tandem duplications, the ETV6-NTRK3 fusion, and the rare KLHL7-BRAF fusion. Histopathology. 2020; 77(4):611-621.
27. van den Heuvel-Eibrink MM, Grundy P, Graf N, Pritchard-Jones K, Bergeron C, Patte C, et al. Characteristics and survival of 750 children diagnosed with a renal tumor in the first seven months of life: A collaborative study by the SIOP/GPOH/SFOP, NWTSG, and UKCCSG Wilms tumor study groups. Pediatr Blood Cancer. 2008; 50(6):1130.

