



Cultivo In Vitro Y Preservación De Macrohongos Silvestres: Salvando Las Potenciales Especies Comestibles Y Medicinales
Scientia. Revista de Investigación de la Universidad de Panamá
Universidad de Panamá, Panamá
ISSN: 0258-9702
Periodicidad: Semestral
vol. 31, núm. 1, 2021
Recepción: 02 Septiembre 2020
Aprobación: 09 Diciembre 2020
Resumen:
Los
macrohongos tienen un gran número de propiedades de interés biotecnológico,
convirtiéndolos en un importante recurso biótico para la sociedad. El objetivo
de este trabajo fue cultivar in vitro macrohongos con potencial
comestible y medicinal. Se realizaron 26 muestreos desglosados de la
siguiente manera: Parque Natural Metropolitano (15), Parque Nacional Soberanía
(7) y Campus de la Universidad de Panamá (4). Se hallaron un total de 249
especímenes. Las recolectas de estos hongos fueron realizadas en cuatro meses
de la temporada lluviosa, desde junio hasta octubre del 2019. Para el cultivo se utilizaron Platos Petri con
agar MEA incubados por 48
h a 27 °C. De los
macrohongos revisados se determinaron 7 órdenes, 17 familias, 25 géneros y 16
especies. Las especies encontradas con mayor frecuencia fueron Cookeina
speciosa y Trogia cantharelloides. Se lograron cultivar y preservar
con éxito un total de 101 especímenes; su preservación fue mediante el método de suspensión en
agua destilada estéril. Según
revisión de literatura científica de los especímenes recolectados, 41.58% fueron clasificados
como medicinales, 27.7% como comestibles y medicinales, 23.72% sin registros de
propiedades de interés para el estudio y 6.9% en categoría de comestibles. Las colecciones
de cultivos son un método efectivo de conservación ex situ de la biodiversidad
y representan un importante elemento estratégico y económico para el
desarrollo de las investigaciones científicas biotecnológicas y biomédicas.
Nuestra investigación contribuyó a estos objetivos con macro hongos de Panamá.
Palabras clave: Cookeina speciosa, Trogia cantharelloides, biotecnología, biodiversidad, Panamá.
Abstract:
Macro-fungi have a large number of interesting biotechnological properties making them an important biotic resource for society. The objective of this work was to cultivate macro-fungi with edible and medicinal potential in vitro. Twenty six (26) samplings were made: Parque Natural Metropolitano (15), Parque Nacional Soberanía (7) and The Campus of the University of Panama (4). A total of 249 specimens were found. The collections of these fungi were carried out in rainy season, from July to December 2019. Petri dishes with AEM Agar were used for cultivation at 27°C for 48 h in darkness. From the reviewed macro-fungi, 7 orders, 17 families, 25 genera and 16 species were determined. The most frequently species were Cookeina speciosa and Trogia cantharelloides. A total of 101 specimens were successfully cultured and preserved using the sterile distilled water suspension method. According to scientific literature review of the specimens collected, 41.58% were classified as medicinal, 27.7% as edibles and medicinal, 23.72% without records of properties of interest to the study and 6.9% in the category of edibles. Culture collections are an effective method of ex situ conservation of biodiversity and represent an important strategic and economic element for the development of biotechnological and biomedical scientific research. This research contributed toward these goals with macrofungi of Panama.
Keywords: Cookeina speciosa, Trogia cantharelloides, biotechnology, biodiversity, Panamá.
Introducción
Los macrohongos con propiedades comestibles y medicinales son un importante recurso biótico para la sociedad (Fox, 1993). A pesar de su gran importancia, el reino de los hongos es uno de los grupos menos estudiados y en el que hay menos especialistas. Se considera que a nivel mundial apenas se conoce de 2.2 a 3.8 millones de especies (Hawksworth y Lücking, 2017).
Debido a esto y a que los trópicos incluyen las áreas de mayor diversidad en la tierra, existe un amplio margen para el descubrimiento de nuevas especies de hongos en Panamá y por lo tanto, de nuevas fuentes potenciales de alimento y de aplicaciones biotecnológicas. Por esta razón, es necesario la exploración, preservación y conservación de los macrohongos silvestres pues muy probablemente comprenden cepas con propiedades aun no conocidas, pero de interés para la humanidad (Fox, 1993).
La demanda de los hongos comestibles silvestres ha aumentado considerablemente ya que representa una nueva tendencia alimenticia (Martínez et al., 2007). Los hongos tienen alto valor nutricional y energético, además que brindan propiedades benéficas para la salud, por lo que se le considera alimentos funcionales de alto valor culinario (Trigo et al., 2010). Medicinalmente, poseen sustancias como polisacáridos, glicoproteínas, triterpenoides, esteroides, ácidos nucleicos y un grupo particular de proteínas fúngicas inmunomodulatorias (FIPS). Estas sustancias son conocidas hoy como sustancias funcionales y nutraceúticas, además que tienen un rol en la prevención de enfermedades y en algunos casos, en su supresión (Ikekawa, 2001).
El aspecto más innovador de este proyecto es el cultivo in vitro de macrohongos silvestres y la preservación viable a largo plazo de sus micelios. Su preservación hace posible que éstos macrohongos puedan ser producidos en grandes cantidades, basado en su micelio, la principal estructura de cualquier hongo (Haneef et al., 2017). Al ser los macrohongos de gran uso en diversos procesos industriales, en investigaciones aplicadas y estudios de biodiversidad, es necesario mantener una fuente viable de sus micelios, asegurando su almacenamiento por largos períodos de tiempo (Homolka, 2014).
Al ser una investigación pionera sobre los macrohongos reportados como comestibles y medicinales de la Ciudad de Panamá, buscamos incentivar a las futuras generaciones de seguir realizando investigaciones sobre los beneficios que puedan aportar los macrohongos a la sociedad panameña. Además de promover la explotación medida de los recursos bióticos que puedan ser aprovechados por la industria, a través de la comercialización de cepas nativas de macrohongos comestibles que traería un crecimiento en el sector agroindustrial y económico del país.
Los hongos silvestres comestibles también constituyen un elemento relevante en la alimentación, así como también una fuente de ingresos económicos en todo el mundo, por lo que gobiernos e instituciones han comenzado a valorar su importancia dentro de las comunidades rurales (Zamora y Nieto, 1995; Mariaca et al., 2001) por su aporte a la autosuficiencia alimentaria y obtención de ingresos (Pastor, 2002; Pérez et al., 2010).
Parte Experimental
Descripción del área de estudio
1. Parque Natural Metropolitano
2. Parque Nacional Soberanía
3. Campus central de la Universidad de Panamá
Este trabajo fue realizado en ocho senderos de dos parques nacionales de la Ciudad de Panamá y en algunas áreas verdes del Campus Central de la Universidad de Panamá. El Parque Natural Metropolitano abarca un área de 265 hectáreas, cubiertas en su mayor parte de bosques seco tropical del Pacífico Centroamericano (PNM, s.f.). Este parque se encuentra localizado en el distrito de Panamá, corregimiento de Ancón, entre el camino la Amistad y el río Curundú, las coordenadas del parque son: 8°59’37.1" N 79°32’46.7" O.
Según el sistema de clasificación de Holdridge (Holdridge, 1967), el Parque Natural Metropolitano cae dentro de la categoría de bosque húmedo tropical, con una humedad relativa del 70%, temperatura anual promedio de 28ºC y una precipitación pluvial anual de 1500-2000 mm. Dentro de este parque se colectó en un total de cuatro senderos: Los Caobos, La Cienaguita, Momótides y Los Robles. El sendero más visitado durante las colectas fue Los Caobos, el cual posee una trayectoria de 0.9 km y una altura de 72 metros sobre el nivel del mar (m.s.n.m).
El Parque Nacional Soberanía comprende una zona boscosa que abarca un área aproximadamente de 22,104 hectáreas (Flores y Vergara, 2013). La temperatura en el Parque es casi uniforme a lo largo del año, con una media anual de 26ºC, aunque se registran cambios mayores durante los ciclos diarios (Ibáñez et al., 1999). Éste presenta clima típico de tierras bajas en el trópico (Flores y Vergara, 2013). El parque está a 25 km de la ciudad de Panamá y se encuentra situado a lo largo de la ribera este del canal de Panamá. Las coordenadas del parque son 9°04’30.1" N 79°39’33.1” O.
Según el plan de manejo del Parque, la precipitación anual promedio en el área de estudio es de 2000 mm anuales, con una temperatura máxima promedio 30 ºC y la mínima promedio de 23.5ºC (ANAM, 1999). La zona de vida, según el sistema de clasificación de Holdridge (Holdridge, 1967), corresponde a un bosque húmedo tropical (IGTG, 2007). Dentro de este parque se colectó en un total de cuatro senderos: Camino de Plantación, El Camino el Oleoducto, El Charco y El Espíritu del Bosque.
Metodología de Campo
Se realizaron un total de 26 muestreos que estuvieron distribuidos en siete colectas en el Parque Nacional Soberanía, 15 en el Parque Natural Metropolitano y cuatro en el Campus central de la Universidad de Panamá, las colectas fueron realizados durante 5 meses dentro de la época lluviosa (desde junio hasta octubre del 2019). El muestreo fue basado en la búsqueda y colecta de aquellos géneros y especies que han sido reportados en la literatura con características comestibles y medicinales. Los hongos con estos atributos se clasifican en Ascomycota y Basidiomycota, principalmente (Guzmán, 1977).
Se empleó el muestreo oportunista observando cuidadosamente el suelo a ambos lados del camino, buscando encontrar cuerpos fructíferos de macrohongos carnosos y leñosos aún frescos. Una vez encontrados los cuerpos fructíferos, fueron fotografiados in situ y recolectados, teniendo mucha precaución de no dañar la estructura y asegurándose de tener la base de este. Los especímenes fueron envueltos en papel cera y depositados en la canasta de colecta. Se tomaron notas del hábitat y substratos en que se encuentre cada macrohongo. A cada espécimen se le asignó un código numérico distintivo. Los macrohongos recolectados fueron transportados al Laboratorio de Biotecnología Microbiana (Lab 214) de la Vicerrectoría de Investigación y Postgrado para su procesamiento taxonómico y cultivo in vitro. Para identificar el género del hongo recolectado, se utilizaron las claves taxonómicas de dos libros: Identificación de los hongos: comestibles, venenosos y alucinantes (Guzmán, 1979) y Los Hongos de Panamá (Guzmán y Piepenbring, 2010).
Resultados Y Discusión
Identificación de Macrohongos
En los 26 muestreos realizados en temporada lluviosa, desde junio hasta octubre del 2019 dentro del Parque Natural Metropolitano (15), el Parque Nacional Soberanía (7) y el Campus de la Universidad de Panamá (4), se lograron recolectar un total de 249 especímenes, de los cuales solo 101 fueron identificados taxonómicamente; 148 no fueron identificados. De los macrohongos identificados, el 53% fueron identificados hasta género, el 33% hasta especie y el 14% hasta orden.
Los 101 macrohongos identificados pertenecen principalmente a dos grandes divisiones: Ascomycota y Basidiomycota. Dentro de la División Ascomycota, se identificaron macrohongos pertenecientes a la Clase Pezizomycetes, del Orden Pezizales; y dentro de la División Basidiomycota se identificaron macrohongos pertenecientes a las Clases Agaricomycetes y Tremellomycetes. Encontrándose dentro de la primera clase los órdenes: Agaricales, Auriculariales, Geastrales, Hymenochaetales y Polyporales; y dentro de la segunda clase el Orden Tremellales. Los especímenes se reparten en un total de 7 órdenes, 17 familias, 25 géneros y 16 especies (Cuadro 1).
Es importante mencionar que los miembros de los órdenes Agaricales y Polyporales son los hongos que se encontraron con mayor frecuencia, esto dado a sus estrategias de adaptación a las condiciones cambiantes de temperatura, pluviosidad y humedad relativa, estas estrategias además le permiten la dispersión de sus esporas, las cuales se asocian a los cambios en el régimen de vientos y lluvias (Lodge et al., 2004). Los macrohongos encontrados poseen una preferencia por el sustrato de madera en descomposición, lo cual puede estar dado por que los hongos presentan un alto potencial enzimático para digerir este tipo de sustancias (Leonowicz et al., 1999).
Las especies con mayor frecuencia encontradas fueron Cookeina speciosa y Trogia cantharelloides. C. speciosa es lignícola, gregaria y dispersa, crece sobre madera en descomposición en bosques húmedo tropical y es muy fácil de ubicar por sus fuertes tonalidades naranjas. Además, posee importantes propiedades nutricionales (Van Vooren y Lopez, 2002). Nuestro trabajo confirma lo reportado por Guzman y Piepenbring (2010), que Cookeina speciosa es uno de los macrohongos más comunes del bosque panameño húmedo tropical y su distribución sobre madera muy podrida.
Del total de 249 macrohongos recolectados, se lograron cultivar in vitro exitosamente 101, que representa un 41% de éxito de las colectas. Además, se calculó un éxito de cultivo por cada uno de los parques visitados, obteniéndose un menor porcentaje en el Parque Natural Metropolitano que en el Parque Nacional Soberanía.
| División | Órdenes | Familia | Género | Especie | ||
| Ascomycota | Pezizales | Sarcoscyphaceae | Cookeina (8) | C. speciosa (7) | ||
| C. tricholoma (1) | ||||||
| Phillipsia (2) | P. dominguensis (1) P. lutea (1) | |||||
| Basidiomycota | Agaricales | Agaricaceae | Agaricus (1) | - | ||
| Bolbitaceae | Bolbitius (1) | B. marginatipes (1) | ||||
| Hygrophoraceae | Hygrocybe (1) | - | ||||
| Marasmiaceae | Marasmius (3) | M. cladophyllus (1) | ||||
| Gymnopus (1) | G. luxurians (1) | |||||
| Mycenaceae | Mycena (2) | - | ||||
| Physalacriaceae | Oudemansiella (2) | O. canarii (1) | ||||
| Pleurotaceae | Pleurotus (1) | P. cornucopiae (1) | ||||
| Schizophyllaceae | Schizophyllum (1) | S. commune (1) | ||||
| Tricholomataceae | Clitocybe (1) | - | ||||
| Trogia (5) | T. cantharelloides (5) | |||||
| Auriculariales | Auriculariaceae | Auricularia (2) | A. auricularia (1) | |||
| A. mesenterica (1) | ||||||
| Geastrales | Geastraceae | Geastrum (7) | - | |||
| Hymenochaetales | Repetobasidiaceae | Cotylidia (3) | - | |||
| Polyporales | Ganodermataceae | Ganoderma (2) | - | |||
| Amaouroderma (7) | - | |||||
| Polyporaceae | Daedaleopsis (3) | |||||
| Lentinus (1) | - | |||||
| Lenzites (3) | ||||||
| Polyporus (12) | P. teniculus (3) | |||||
| Trametes (16) | T. corrugata (3) | |||||
| T. elegans (4) | ||||||
| Steraceae | Stereum (1) | - | ||||
| Tremellales | Tremellaceae | Tremella (1) | - |
Considerando todas las colectas, se obtuvo un éxito de cultivo de 41%, mientras que para el Parque Natural Metropolitano (PNM) se logró un 38% y para el Parque Nacional Soberanía (PNS) 47%. Es interesante observar estos porcentajes, pues si bien se realizaron mayor número de visitas de campo al PNM, se obtuvo mayor porcentaje de éxito en el PNS con menos visitas. El hecho de que el PNM sea un bosque fragmentado (Murphy y Lugo, 1986) puede ser una diferencia clave con respecto al PNS. La respuesta de las especies a la fragmentación es específica (Hobbs y Yates, 2003; Hoehn et al., 2007). Por ello, la identificación de los factores que hacen que las especies sean más o menos sensibles a la fragmentación y la comprensión de cómo un hábitat fragmentado puede afectar a la viabilidad de las poblaciones.
Los cultivos mostraron diferentes patrones de crecimiento (Fig. 1 y Fig. 2), e incluso algunos poseían pigmentos. Los morfotipos de micelio observados no se mantenían constantes dentro del género, ni de la especie. Los patrones de crecimiento de Trametes y Ganoderma concordaron con los descritos por el estudio de Shahtahmasebi (2018). Así mismo, se puede observar diferentes patrones de micelio en especies del mismo género, lo que apoya la variedad morfológica que puede presentarse dentro de un mismo grupo.
Dentro de los géneros con pigmentos en cultivo sobresalen: Amauroderma, Marasmius, Geastrum y Trametes (Fig 1 y Fig 2). El color y los pigmentos varían con la cepa y los medios sobre los cuales se cultiva el micelio. Otro aspecto de la apariencia del micelio es su tipo de crecimiento, ya sea aéreo o deprimido, algodonoso o rizomórfico. El micelio aéreo puede estar relacionado a menudo con la alta humedad. El micelio comprimido también puede ser un carácter específico de la especie o puede ser el resultado de condiciones secas. Los patrones en los hongos pueden estar alterados por pH, temperatura, luz y humedad. Por esta razón, es que de una misma especie o género pueden existir patrones de micelio diferentes (Stamets y Chilton, 1983).
Del total de hongos identificados y preservados, 77 especímenes representando 24 géneros y 11 especies tienen referencias científicas sobre sus propiedades nutricionales (Cuadro 2) o medicinales (Cuadro 3) según la literatura señalada. Resaltan los géneros Agaricus y Auricularia pues representan dos de los cinco géneros (Agaricus, Lentinula, Pleurotus, Auricularia y Flammulina) más importantes en la producción mundial de hongos comestibles, comprendiendo el 85% de la industria. Auricularia contribuye con el 17% y Agaricus con el 15% de la producción. China es el principal productor de hongos comestibles, cuyo segundo género con más alta producción es Auricularia, mientras que es el productor número uno de Agaricus bisporus, por el 54% del total de la producción mundial en 2013 (Royse et al., 2017). Especies de hongos del género Clitocybe sp., constituyen una fuente viable de componentes con actividades biológicas de un amplio potencial de aplicación en biomedicina o biotecnología (Pohleven et al., 2016).
En C. speciosa se ha reportado que posee dos polímeros insolubles capaces de incrementar la microbiota intestinal de Clostridium cluster XIVa (Moro et al., 2018), taxón muy abundante e importante en el rumen y en el intestino largo humano por su eficiencia en la fermentación de polisacáridos vegetales. Así mismo, se logró preservar tres especies del genero Trametes (Cuadro 3); especies en este género, han sido utilizadas durante miles de años en la medicina tradicional y convencional para el tratamiento de diversas enfermedades (Knezevic et al., 2015).
| Género | Especie | Propiedad | Cita |
| Clitocybe sp. (1) | - | Comestible* | Ulloa y Herrera (1994) |
| Lentinus sp. (1) | - | Comestible* | Bisen et al. (2010) |
| Bolbitius sp. (1) | - | Comestible* | Pushpa et al. (2013) |
| Oudemansiella sp. (2) | Oudemansiella canarii | Comestible | Ruegger et al. (2001); Feng et al. (2016) |
| Hygrocybe sp. (1) | - | Comestible | Bon (1987) |
| Agaricus sp. (1) | - | Comestible | Stamets y Chilton (1983), Guzmán (1977) |
| Mycena sp. (2) | - | Comestible | Guzmán (1977) |
| Auricularia sp. (2) | Auricularia mesentérica Auricularia auricularia | Comestible* | Wei-Cai et al. (2012); Chang y Miles (2004) |
| Cookeina sp. (8) | Cookeina speciosa | Comestible* | Moro et al. (2018) |
| Marasmius sp. (3) | - | Comestible* | Kamalebo (2018) |
| Pleurotus sp. (1) | Pleurotus cornucopiae | Comestible | Stamets y Chilton (1983), Guzmán (1977) |
| Polyporus sp. (12) | Polyporus teniculus | Comestible* | Kamalebo et al. (2018) |
cuenta tanto con propiedades comestibles como medicinales. Los números en paréntesis corresponden a la cantidad especímenes preservados para cada género
| Género | Especie | Propiedad | Cita |
| Clitocybe sp. (1) | - | Medicinal* | Pohleven et al. (2016) |
| Marasmius sp. | - | Medicinal* | Shomali et al. (2019) |
| Bolbitius sp. (1) | - | Medicinal | Pushpa et al. (2013) |
| Lentinus sp. (1) | - | Medicinal* | Bisen et al. (2010) |
| Schizophyllum sp. (1) | Schizophyllum commune | Medicinal | Chandrawanshi et al. (2017) |
| Auricularia sp. (2) | Auricularia mesenterica Auricularia auricular | Medicinal* | Seung-Shi et al. (1997); Wei-Cai et al. (2012) |
| Geastrum sp. (7) | - | Medicinal | Panda et al. (2017) |
| Cookeina sp. (8) | Cookeina speciosa Cookeina tricholoma | Medicinal* | Moro et al. (2018); Moreno et al. (2016) |
| Amauroderma sp. (7) | - | Medicinal | Hapuarachchi et al. (2010) |
| Trametes sp. (16) | Trametes elegans Trametes corrugata | Medicinal | Stamets (1983); Guzmán (1977); Blagodatski (2018); Chhanda et al. (2006) |
| Polyporus sp. (12) | Polyporus tenuiculus | Medicinal* | Stamets (1983) y Guzmán (1977) |
| Ganoderma sp. (2) | - | Medicinal | Pushpa et al. (2013), Stamets y Chilton (1983) y, Guzmán (1977) |
| Stereum sp. (1) | - | Medicinal | Bong-Sik et al. (2001) |
| Lenzites sp. (3) | - | Medicinal | Yamac et al. (2009) |
| Daedaleopsis sp. (3) | - | Medicinal | Knezevic et al. (2015) |
| Tremella sp. (1) | - | Medicinal | De Baets y Vandamme, 2001) |
cuenta tanto con propiedades medicinales como comestibles. Los números en paréntesis corresponden a la cantidad especímenes preservados para cada género.
.
Dentro de los géneros identificados existen reportes de especies productoras de compuestos bioactivos de interés en medicina. Pushpa et al., (2013) demostró la presencia de metabolitos de interés que pueden tener importancia para la industria farmacéutica y alimentaria en Bolbitius vitellinus y de Ganoderma applanatum. En general, las especies de la Familia Ganodermataceae han sido ampliamente usadas como medicina tradicional en Asia por muchos siglos, así como también Ganoderma sp. y Amauroderma sp. son ampliamente estudiadas debido a sus propiedades medicinales (Hapuarachchi et al., 2010). Polyporus tenuiculus fue otra de las especies frecuentes durante las colectas; cuyo primer reporte de su cultivación fue dado en desperdicios lignocelulósicos, y es señalada como una prometedora especie tanto para la producción comercial como por su potencial uso en la degradación de biodesperdicios (Omarini et al., 2009). De igual forma, se han reportado una actividad antimicrobiana considerable de metabolitos de una rara especie de Geastrum sp. (Panda et al., 2007). A el hongo Lentinus edodes se le ha atribuido un alto valor nutricional, pero también un posible potencial para aplicaciones terapéuticas (Bisen et al., 2010).
Por otro lado, Schizophyllum commune es descrito como una fuente potencial de antioxidantes naturales y propiedades antidiabéticas (Chandrawanshi et al., 2017). Otro de los géneros de gran interés medicinal es Tremella sp., cuya principal propiedad es su aplicación en medicina para mejorar el sistema inmunológico (De Baets y Vandamme, 2001). El género Oudemansiella sp, es reportado como uno de los que incluye muchas especies consumidas a nivel mundial (Feng et al., 2016). En un estudio etnomicológico realizado en la República del Congo se reporta a Cookeina speciosa por su uso recreacional y alimenticio; de igual manera fueron reportadas como comestibles especies de Auricularia sp. tales como A. cornea y A. delicata, especies del género Agaricus sp. como A. bambusicola y A. crocopeplus, algunas especies del género Marasmius sp. y Polyporus tenuiculus (Kamalebo et al., 2018).
Los hongos no reportados con ninguna de estas propiedades son registrados como silvestres, ya sea por no reportar ninguna propiedad de interés para el hombre o por falta de investigaciones, entre estos macrohongos se encuentran los siguientes géneros y especies: Cotylidia, Mycena, Trogia cantharelloides, Marasmius cladophyllus, Gymnopus luxurians, Phillipsia dominguensis y Phillipsia lutea (Cuadro 1).
La micoteca de hongos preservados viablemente es un valioso recurso tanto para estudios futuros sobre sus propiedades biotecnológicos como para la conservación ex situ de estos organismos. La gran diversidad genética en el reino de los hongos ha motivado una justificada preocupación por su conservación desde hace varios años (Hawksworth, 1993). Se considera que el número de microorganismos formalmente nombrados y aceptados es de unas 150.000 especies, los hongos comprenden alrededor de la mitad de estos. Estas cifras crecen constantemente, unas 2000 de hongos se describen anualmente (Hawksworth y Lücking, 2017).
Las colecciones de microorganismos cumplen el papel de proporcionar el material biológico autenticado sobre el cual está basada la investigación de alta calidad (Sly, 1994). Estas adquieren cada vez mayor importancia como mecanismos o vías para la conservación ex situ de la biodiversidad y representan un importante elemento estratégico y económico para el desarrollo de las investigaciones científicas, con particularidad en las ramas biotecnológicas y biomédicas (Fernández y Rodríguez, 2016). El presente cepario de macrohongos silvestres fue depositado en la colección de cultivos de referencia del Proyecto Nacional de Microorganismos de la Universidad de Panamá. Este proyecto se realiza en el Laboratorio de Biotecnología Microbiana (Edificios de Laboratorios Científicos de la Vicerrectoría de Investigación y Postgrado) con financiamiento del Ministerio de Ambiente.


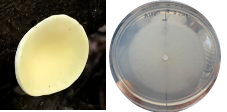
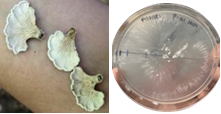

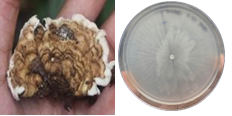




1-Lentinus2- Phillipsia dominguensis 3- Phillipsia lutea4- Schizophyllum commune 5- Pleurotus cornucopiae 6- Auricularia mesenterica7- Auricularia auricularia 8-Amauroderma9-Cotylidia10- Cookeina speciosa
Conclusiones
Se identificaron taxonómicamente un total de 101 especímenes. De los macrohongos revisados se determinaron 6 órdenes, 17 familias, 25 géneros y 16 especies.










11- Cookeina tricholoma12-Hygrocybe 13-Oudemansiella canarii 14-Marasmius cladophyllus15-Lenzites16- Polyporus tenuiculus17-Trametes elegans18- Ganoderma19- Geastrum20- Agaricus
Dentro de los Ascomycota se encontraron representantes del Orden Pezizales, mientras que en Basidiomycota se encontraron órdenes como: Agaricales, Polyporales, Hymenochaetales, Tremellales, Geastrales y Auriculariales.
Los miembros de los órdenes Agaricales y Polyporales fueron los hongos que se encontraron con mayor frecuencia.
Las especies que encontramos con mayor frecuencia fueron: Cookeina speciosa y Trogia cantharelloides.
De todos los especímenes recolectados y según revisión de literatura, 41.58% fueron como medicinales, 27.7% comestibles y medicinales, 23.72% sin registros de propiedades de interés para el estudio y 6.9% comestibles.
Hubo mayor éxito de cultivo in vitro con los especímenes que fueron recolectados en el PNS (47%) que el PNM (38%).
Dentro de este estudio se logró cultivar dos (Agaricus y Auricularia) de los cinco géneros (Agaricus, Lentinula, Pleurotus, Auricularia y Flamulina) más importantes de la producción mundial de hongos comestibles.
Se confeccionó una micoteca con un total de 101 especímenes preservados en crioviales de 2 mL.
Agradecimientos
Agradecemos a la VIP (Vicerrectoría de Investigación y Posgrado) por beca de financiamiento para este proyecto. Agradecemos al Instituto Eagle Hill de Estados Unidos por las becas de entrenamiento en identificación de hongos medicinales y comestibles otorgadas a Lou Ashley y Samantha López.
Referencias Bibliográficas
ANAM (Autoridad Nacional del Ambiente). 1999. Informe Ambiental Panamá. Panamá, pp. 100.Panamá Informe Ambiental 104 pág.
BISEN P., BAGHEL R., SANODIYA B., THANKUR G. Y PRASAD G. 2010. Lentinus edodes: a macrofungi with pharmacological activities. Current Medicinal Chemistry, 17 (22): 2419-2430.
BLAGODATSKI A., YATSUNSKAYA M., MIKHAILOVA V., TIASTO V., KAGANSKY A., AND KATANAEV V. 2018. Medicinal mushrooms as an attractive new source of natural compounds for future cancer therapy. Oncotarget. 9(49): 29259–29274.
BON M. 1987. The Mushrooms and Toadstools of Britain and North Western Europe, pub. Editorial Hodder & Stoughton
BONG-SIK Y., YANGRAE C., IN-KYOUNG L., SOO-MUK C., TAE H. Y ICK-DONG Y. 2001. Sterins A and B, New Antioxidative Compounds from Stereum hirsutum. The Journal of Antibiotics, 55 (2): 208-210.
CHANDRAWANSHI N., TANDIA D. Y JADHAV S. 2017. Nutraceutical Properties Evaluation of Schizophyllum commune. Indian J. Sci. Res. 13: 57-62.
CHHANDA B., SARMISHTHA D., ANANYA B., MAITREYEE B., SNIGDHA M. Y SAMAJPATI, N. 2006. Antimicrobial activities of some Basiomycetous fungi. Journal of Mycopathological Research, 44 (1): 129-135.
DE BAETS S. Y VANDAMME E. 2001. Extracellular Tremella polysaccharides: structure, properties and applications. Biotechnology Letters, 23: 1361-1366.
ELLSTRAND N. Y ELAM D. 1993. Population genetic consequences of small population size: implications for plant conservation. Annual Review of Ecology. Evolution and Systematics, 24(10): 217-242.
FLORES R. Y VERGARA R. 2013. Composición Florística y Estructura Arborea de una parcela de bosque en el Parque Nacional Soberanía, Panamá. Universidad de Panamá, p. 80. 26/06/2019, De Herbario de la Universidad de Panamá, p. 84. Asesor de tesis: Jorge Mendieta.
FENG X., ZHIMING L., YU L., CHENGBO R. Y SHOUXIAN W. 2016. Evaluation of edible mushroom Oudemansiella canarii cultivation on different lignocellulosic substrates. Saudi J Biol Sci. 23: 607-613.
FERNÁNDEZ U. Y RODRÍGUEZ A. 2016. Aplicaciones de la biotecnología en el desarrollo de la medicina personalizada. MEDISAN. Vol.20.
FOX F. 1993. Tropical fungi: their commercial potential. In Aspects of Tropical Mycology, (ed. S. Isaac, J.C. Frankland, R. Watling, A.J.S. Whalley) pp. 253-263. Cambridge University Press.
FRANCESCHI L. Y MORENO T. 1999. Principales Aphyllophorales con poros del Parque Natural Metropolitano, p.114. 21/06/2019, De SIBIUP Base de datos. Asesor de tesis: Cecilio Puga.
GUZMÁN G. 1977. Identificación de los hongos: comestibles, venenosos, alucinantes y destructores de la madera. México D.F.: Editorial LIMUSA S.A.
GUZMÁN G. Y PIEPENBRING M. 2010. Los hongos de Panamá. México D.F.: Instituto de Ecología, A.C.
HAPUARACHCHI K., KARUNARATHNA S., PHENGSINTHAM P., KAKUMYAN P., HYDE K. Y WEN T. 2010. Amauroderma (Ganodermataceae, Polyporales) - bioactive compounds, benefical properties and two new records from Laos. Asian Journal of Mycology, 1:121-136.
HANEEF M., CESERACCIU L., CANALE C., BAYER C., HEREDIA J. Y ATHANASSIOU A. 2017. Advanced Materials from Fungal Mycelium: Fabrication and Tuning of Physical Properties. Sci Rep. 7.
HAWKSWORTH D. Y LÜCKING R. 2017. Fungal Diversity Revisited: 2.2 to 3.8 million Species. Microbiology Spectrum, 5 (4): FUNK-0052-2016.
HAWKSWORTH D. 1993. The tropical fungal biota: census, pertinence, prophylaxis and prognosis. In: Aspects of Tropical Mycology (eds. S. Isaac, J.C. Frankland, R. Watling and A.J.S. Whalley). Cambridge: Cambridge University Press, UK: 265-293.
HOBBS R. Y YATES C. 2003. Impacts of Ecosystem Fragmentation on Plant Populations: Generalizing the Idiosyncratic. Australian Journal of Botany, 51:471-488.
HOEHN M., SARRE S. Y HENLE K. 2007. The tales of two geckos: does dispersal prevent extinction in recently fragmented populations? Molecular ecology, 16(16):3299-3312.
HOLDRIDGE, L.R. 1967. Life Zone Ecology. Tropical Science Center, San José, Costa Rica, pp. 206.
HOMOLKA L. 2014. Preservation of live cultures of basidiomycetes. Fungal Biology. 118 (2):107-125 pp.
IBÁÑEZ D., AGUILAR S., SANJUR A., MARTÍNEZ R., CONDIT R., STALLARD R., HECKADON S. Y LAO S. 1999. Proyecto Monitoreo de la Cuenca del Canal: Reporte Anual y Técnico. United Agency for Development, Autoridad Nacional del Ambiente (Panamá) y Smithsonian Tropical Research Institute. Panamá, Panamá.
IKEKAWA T. 2001. Beneficial effects of edible and medicinal mushrooms on health care. Int. J. Med. Mush. 3: 291-298.
KAMALEBO H., MALALE W. Y KESEL A. 2018. Macrofungal diversity in Yangambi Biosphere reserve and Yoko reserve rainforests of the Democratic Republic of the Congo. International Journal of Biodiversity and Conservation, 10: 348-356.
KNEZEVIC A., ZIVKOVIC L., STAJIC M., VUKIJEVIC J., MILOVANOVIC I. Y SPREMO B. 2015. Antigenotoxic Effect of Trametes spp. Extracts against DNA Damage on Human Peripheral White Blood Cells. Scientific World Journal, 2015: 146378.
LEONOWICZ, A., MATUSZEWSKA, A., LUTEREK, J., ZIEGENHAGEN, D., WOJTAŚ-WASILEWSKA, M., CHO, N. S., ... Y ROGALSKI, J. 1999. Biodegradation of lignin by white rot fungi. Fungal genetics and biology, 27(2-3):175-185.
LODGE D., AMMIRAT J., O’DELL T., MUELLER G., HUHNDORF S., WANG C., STOKLAND J., SCHMIT J., RYVARDEN L., LEACOCK P., MATA M., UMAÑA L., WU Q., CZEDERPILTZ D. 2004. Terrestrial and lignicolous macrofungi, In: Biodiversity of fungi: inventory and monitoring methods. Elsevier Inc., San Diego, pp 127-172.
MARIACA R., SILVA L., CASTAÑOS C. 2001. Proceso de recolección y comercialización de hongos comestibles silvestres en el Valle de Toluca, México. Ciencia Ergo Sum 8: 30-40.
MARTÍNEZ D., MORALES P., SOBAL M., BONILLA M. Y MARTÍNEZ W. 2007. México ante la globalización en el siglo XXI: el sistema de producción-consumo de los hongos comestibles. Capítulo 6.1, 20 pp. In: El Cultivo de Setas Pleurotus spp. en México. J. E. Sánchez J.E., Martínez-Carrera D., Mata G. & Leal H. (Eds.) ECOSUR-CONACYT, México, D.F. ISBN 978-970-9712-49-7.
MORENO R., RUTHES A., BAGGIO C., VILAPLANA F., KOMURA D. Y LACOMINI M. 2016. Structure and antinociceptive effects of beta-D-glucans from Cookeina tricholoma. Carbohydrate Polymers, 141: 220-228.
MORO T., RUTHES A., EL-HINDAWY M., MORENO R., ZHANG X., CORDEIRO L., HAMAKER B. Y LACOMINI M. 2018. In vitro fermentation of Cookeina speciosa glucans stimulates the growth of the butyrogenic Clostridium cluster XIVa in a targeted way. Carbohydrate Polymers, 183: 219-229.
MUELLER G., BILLS G. Y FOSTER M. 2004. Biodiversity of Fungi: Inventory and Modeling Methods. Elsevier Academic Press, Amsterdam. p. 777.
MURPHY P. Y LUGO A. 1986. Ecology of Tropical Dry Forest. Ann Rev. Ecol. Syst. 17:67-88.
OMARINI A., LECHNER B. Y ALBERTÓ E. 2009. Polyporus tenuiculus: a new naturally occurring mushroom that can be industrially cultivated on agricultural waste. J and Microbiology Biotechnology. 36: 635-642.
PANDA M., THATOI H. Y TAYUNG K. 2017. Antimicrobial potentials of spore culture of Geastrum so., a rare wild edible mushroom of similipal biosphere reserve, Odisha, India against some significant human pathogens. International Journal of Advanced Research, 5 (9): 1508-1516.
PASTOR B. 2002. Los productos forestales no maderables, una fuente de materia prima para el desarrollo de la industria eléctrica en Cuba. Revista Chapingo serie Ciencias Forestales y del Ambiente, 8(2):147-152.
PÉREZ J., LORENZANA A., CARRASCO V. Y YESCAS A. 2010. Los hongos comestibles silvestres del parque nacional Izta-Popo, Zoquiapan y anexos. Montecillo, Texcoco, Estado de México. Colegio de Post-graduados, SEMARNAT, CONACYT. p. 167
PNM. (s.f.). Conoce el Parque. Julio 13, 2020, de Parque Natural Metropolitano Sitio web: https://www.parquemetropolitano.org/el-parque/superficie.html.
POHLEVEN J., KOS J. Y SABOTIČ J. 2016. Medicinal Properties of the Genus Clitocybe and of Lectins from the Clouded Funnel Cap Mushroom, C. nebularis (Agaricomycetes): A Review. International Journal of Medicinal Mushrooms, 18: 965-975.
PUSHPA H., ANAND M., KASIMAIAH P. Y PENUGONDA J. 2013. Evaluation of antimicrobial activity of some of the selected basidiomycetous fungi. International Journal of Pharma and Bio Sciences, 4: 964-971.
ROYSE D., BAARS J. Y TAN Q. 2017. Current Overview of Mushroom Production in the World. Edible and Medicinal Mushrooms: Technology and Applications, First Edition.
RUEGGER M., TAUK S., RAMOS V. Y CAPELARI M. 2001. Cultivation of the edible mushroom Oudemansiella canarii. Brazilian Journal of Microbiology, 32: 211-214.
SEUNG-SHI HAM, D. H. K., CHOI, K. P., Y LEE, D. S. 1997. Antigenotoxic effects of methyl alcohol extracts from Auricularia mesenterica and Gyrophora esculenta. J. Korean Soc. Food Sci. Nutr, 26(6): 57-62.
SHAHTAHMASEBI SH., POURIANFAR HR., MAHDIZADEH V., SHAHZADEH FAZELI SA., AMOOZEGAR MA., NASR SH., ZABIHI SS., REZAEIAN SH., MALEKZADEH KH. Y JANPOOR J. 2018. A preliminary study on domestication of wild-growing medicinal mushrooms collected from Northern Iran. Current Research in Environmental & Applied Mycology. 21/06/2019, Sitio web: www.creamjournal.org.
SHOMALI N., ONAR O., KARACA B., DEMIRTAS N., CIHAN AC., AKATA I. Y YILDIRIM O. 2019. Antioxidant, Anticancer, Antimicrobial, and Antibiofilm Properties of the Culinary-Medicinal Fairy Ring Mushroom, Marasmius oreades (Agaricomycetes). International Journal of Medicinal Mushrooms, 21: 571-582.
SLY L. 1994. Culture Collections World-wide, in, Kirsop B. y Hawksworth D. (1994). The Biodiversity of Microorganisms and the role of microbial resource centres. World Federation of Culture Collections.
STACKEBRANDT E. 1994. The Uncertainties of Microbial Diversity in Kirsop B. y Hawksworth D. (1994) The Biodiversity of Microorganisms and the role of the microbial resoiurce centres. World Federation of Culture Collections.
STAMETS P. Y CHILTON J. 1983. The Mushroom Cultivator: A Practical Guide to Growing Mushrooms at Home. Agarikon Press. p. 415
TRIGO, R.M., J.M. VAQUERO, Y R.B. STOTHERS. 2010. Witnessing the impact of the 1783-1784 Laki eruption in the Southern Hemisphere. Climatic Change, 99: 535-546.
ULLOA M. Y HERRERA T. 1994. Etimología e iconografía de géneros de Hongos. Universidad Nacional Autónoma México, México.
VAN VOOREN N. Y LOPEZ F. 2002. Deux discomycètes intéressants récoltés à La Martinique. Bull. Mens. Soc. Linn. Lyon, 71 (4) : 152-156.
WEI-CAI Z., ZENG Z., HONG G., LI-RONG J. ET WU-YONG, C. 2012. Characterization of antioxidant polysaccharides from Auricularia auricular using microware-assited extraction. Carbohydrate Polymers, 89 (2): 694-700.
YAMAC M., ZEYTINOGLU M, KANBAK G., BAYRAMOGLU G. Y SENTURK H. 2009. Hypoglycemic effect of crude exopolysaccharides produced by Cerrena unicolor, Coprinus comatus, and Lenzites betulina isolates in streptozotocin- induced diabetic rats. Pharmaceutical Biology, 47:2, 168-174.
ZAMORA M. Y NIETO DE PASCUAL-POLA, C. 1995. Natural Production in The Southwestern rural territory of Mexico City, Mexico. Forest Ecology Management, 72 :13-20.

