Resumen: Se realizó el aislamiento de un triterpeno y cuatro diterpenos de tipo cassano a partir del fraccionamiento del extracto de AcOEt/CH3OH de hojas maduras de Myrospermum frutescens. El estudio de los valores espectroscópicos de IR, 1H-RMN, 13C-RMN, DEPT 135 y experimentos de correlación hetereonuclear (HSQC y HMBC) permitieron establecer las estructuras de los compuestos: Estigmasterol (1), 6β-hidroxi-18-acetoxycassano-13,15-diene (2), 6β,-18-dihidroxicassano-13,15-dieno (3), 6β,13-dihidroxi-18-acetoxi-cassano-15-eno (4) y 6β,18,17-trihidroxicassano-14,15-dieno (5).
Palabras clave: Triterpeno, diterpeno, Myruspermum frutecens, cassano.
Abstract: The isolation of a triterpene and four diterpenes of the cassano type was performed from the fractionation of the AcOEt / CH3OH extract of mature leaves of Myrospermum frutescens. The study of the spectroscopic values of IR, 1H-NMR, 13C-NMR, DEPT 135 and hetereonuclear correlation experiments (HSQC and HMBC) allowed us to establish the structures of the compounds: Stigmasterol (1), 6β-hydroxy-18-acetoxycassan- 13,15-diene (2), 6β, -18-dihydroxycassan-13,15-diene (3), 6β, 13-dihydroxy-18-acetoxy-cassan-15-ene (4) and 6β, 18, 17-trihydroxycassan-13,14-diene (5).
Keywords: Triterpene, diterpen, Myruspermum frutecens, cassano.
AISLAMIENTO E IDENTIFICACIÓN DE TERPENOS PRESENTES EN EXTRACTOS DE HOJAS MADURAS DE MYROSPERMUM FRUTESCENS
ISOLATION AND IDENTIFICATION OF TERPENES PRESENT IN EXTRACTS OF MATURE LEAVES OF MYROSPERMUM FRUTESCENS
Recepción: 09 Mayo 2018
Aprobación: 15 Diciembre 2018
Las plantas continúan siendo una fuente importante de nuevas entidades químicas. Por ello, durante las últimas décadas, se ha practicado la bioprospección, que implica "la búsqueda sistemática de compuestos naturales, diseños genéticos y organismos completos en la vida silvestre con potencial para el desarrollo de productos". (Mateo et al., 2001).
Los grupos que desarrollan actividades de investigación en bioprospección trabajan y publican sobre una gran variedad de temas; uno de ellos pertenece a los dirigidos hacia fases primarias del proceso bioprospectivo como la identificación y caracterización de principios que se podrían considerar bioactivos (actividad antiparasitaria, actividad antiinflamatoria, actividad antioxidante, producción de fitoalexinas, actividad citotóxica, actividad antifúngica, actividad antibacteriana y actividad antitumoral). (Duarte, 2009).
Entre estas investigaciones se encuentran los trabajos realizados en el laboratorio de Biorgánica Tropical de la Universidad de Panamá, cuyo enfoque fue el aislamiento e identificación de compuestos terpénicos con posible bioactividad contra enfermedades parasitarias tales como la enfermedad de Chagas y Leishmaniasis a partir de extractos orgánicos de Myrospermum frutescens. (Torres et al., 2003), (Torres et al., 2004).
Entre los compuestos aislados a partir de esta planta se encuentran 18-hydroxycassan-13,15-diene y 6β,18-dihydroxycassan-13,15-diene los cuales se sometieron a un programa de diseño de fármacos para identificar nuevos anti-tripanosomales. Los estudios de acoplamiento de los 110 metabolitos de plantas seleccionados contra Trypanosoma cruzi trypanotion reductasa (TcTR), revelaron que los compuestos antes mencionados se encuentran entre los cuatro inhibidores más potentes y que cumplen con los requisitos farmacofóricos según lo predicho por Pharmagist. Lo que contribuye así a nuevas vías de investigación que podrían mejorar el éxito terapéutico relacionado con la enfermedad de Chagas. (Saha y Sharma, 2015).
Dados los interesantes resultados obtenidos en previas investigaciones de esta planta y siendo los terpenoides los productos naturales más abundantes y estructuralmente diversos, que han mostrado múltiples propiedades bioactivas, se ha realizado en el presente trabajo el aislamiento e identificación de 5 compuestos terpenoides a partir de un extracto de acetato de etilo/metanol de las hojas maduras de Myrospermum frutescens (Figura 1).
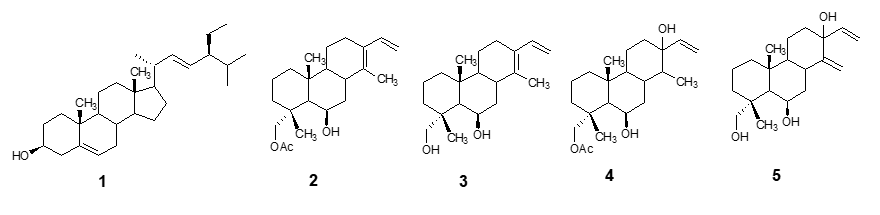
Figura 1
Estructuras de los terpenos aislados de hojas maduras de Myrupermum frutescens
Las hojas maduras de Myrospermum frutescens se colectaron en el Monumento Natural de Barro Colorado, en el Lago Gatún, Panamá, en mayo de 2014 y se encuentran en el herbario de la Universidad de Panamá, bajo los números PMA 50913 y PMA 48733.
Se colectaron 2.0 kg de hojas maduras, se trituraron y se extrajeron con metanol y posteriormente con acetato de etilo en fracciones de 30 g. El extracto se filtró y se evaporó a sequedad a 36 °C.
Se hizo fraccionamiento de 15.0 g de extracto crudo (AcOEt/CH3OH) por cromatografia de columna corta (CCG), sobre gel de sílice y se eluyó por gravedad con un gradiente de polaridad utilizando mezclas de n-hexano, éter de petróleo, acetato de etilo y metanol de diferente polaridad, obteniéndose ocho fracciones. La fracción 7 (284 mg), obtenida de la columna anterior se separó por CCG, sobre gel de sílice y se desarrolló mediante gradiente, utilizando mezclas de n-hexano y acetato de etilo, obteniéndose un total de doce fracciones. La fracción 7 (197 mg) de la columna anterior se separó por CCG utilizando las mismas condiciones, obteniéndose un total de once fracciones. De esta separación se obtuvieron 16.5 mg de la fracción 4 que corresponde al compuesto (1) el cual fue caracterizado por RMN.
Columna 1: Se hizo la separación de 17.5 g de extracto crudo (metanol/acetato de etilo), utilizando cromatografía líquida al vacío (CLV), en un sistema compuesto por un embudo de vidrio fritado (grado de porosidad: medio) provisto con papel filtro y en el cual posteriormente se depositó gel de sílice y se eluyó con un gradiente de polaridad, utilizando mezclas de diclorometano, acetato de etilo y metanol, obteniéndose un total de siete fracciones.
Columna 2: La fracción 2 (3.5 g), obtenida de la columna 1, se separó mediante CCG y se desarrolló mediante elución con gradiente, utilizando mezclas de diclorometano, acetato de etilo y metanol, obteniéndose un total de quince fracciones. Las fracciones 6 (531 mg) y 11 (403 mg) exhibieron señales características de diterpenos por 1H-RMN y se trabajaron posteriormente.
Columna 3: Se realizó la separación de la fracción 6 (531 mg), de la columna 2, por CCG y se desarrolló mediante la técnica de elución con gradiente, utilizando mezclas de n-hexano, acetato de etilo y metanol, obteniéndose un total de cinco fracciones. Las fracciones 2 y 4 ostentaron señales características de diterpenos por 1H-RMN y se trabajaron posteriormente.
Columna 4: Se realizó la purificación de las fracciones 2 (531 mg) y 4 (73 mg), de la columna 3 utilizando las mismas condiciones, obteniéndose cinco fracciones. La separación de la fracción 2 (117 mg) obtenida de la columna anterior, y utilizando las mismas condiciones, proporcionó 61 mg de la fracción 3 que corresponde al compuesto (2), el cual fue caracterizado por RMN.
La fracción 11 de la columna 2 con masa de 403 mg se separó mediante CCG utilizando las mismas condiciones, obteniéndose cinco fracciones. La purificación de la fracción 2 (160 mg) de la columna anterior, se realizó mediante CCG y bajo las mismas condiciones, proporcionando 103 mg de la fracción 5 que corresponde al compuesto (3), la cual fue caracterizada por RMN.
La fracción 4 (73 mg), de la columna 3, se separó mediante CCG, utilizando las mismas condiciones, obteniéndose cuatro fracciones. La fracción 3 (17 mg), de la columna anterior, se purificó mediante CCG, bajo las mismas condiciones, la cual proporcionó 4.9 mg de la fracción 2 que corresponde al compuesto (4) el cual fue caracterizado por RMN.
Se realizó el fraccionamiento de 17.0 g adicionales de extracto crudo mediante CLV, y se eluyó con gradiente, utilizando mezclas de diclorometano, acetato de etilo y metanol, obteniéndose siete fracciones. La separación de la fracción 2 (2.7 g) de la columna CLV, mediante CCG y utilizando las mismas condiciones de la columna anterior, condujo a la obtención de doce fracciones. La fracción 7 (367 mg) de la columna anterior se separó por CCG, utilizando las mismas condiciones, llevando a la obtención de diez fracciones. La fracción 8 (53 mg) de la columna anterior se separó mediante CCG, utilizando elución con gradiente, utilizando mezclas de n-hexano, acetato de etilo y metanol, llevando a la obtención de tres fracciones. La fracción 2 de la columna anterior se purificó mediante CCG, utilizando las mismas condiciones. Este proceso proporcionó 23 mg de una fracción que corresponde al compuesto (5) el cual fue caracterizado por RMN.
Todas las fracciones obtenidas de las separaciones cromatográficas se analizaron mediante cromatografía en capa fina (CCF), se revelaron con p-anisaldehído y se reunieron por la similitud en su factor (Rf ) mostrado en el análisis en CCF.
El compuesto 1 presentó en el espectro infrarrojo bandas de absorción a 3547,41 cm-1 y 2960.78 cm-1, que indican la presencia de grupo -OH y estructura de olefina cíclica -HC=CH-, respectivamente. Mientras la banda de absorción en 1504.47 cm-1 es característica de estiramiento C=C. El espectro 1H-RMN presentó dos singletes en 0.69 ppm y 1.01 ppm con integración para tres hidrógenos para cada singlete, un doblete en 0.78 ppm con integración para seis hidrógenos (J = 7.2 Hz), un doblete en 1.01 ppm con integración para tres hidrógenos (J = 7.6 Hz) y un triplete en 0.83 ppm con integración para tres hidrógenos (J = 6.0 Hz). De la misma manera, mostró dos doble dobletes a 5.00 (J = 15.2 y 8.8 Hz) y 5.14 ppm (J = 15.2 y 8.8 Hz) con integración para un hidrógeno y un triplete en 5.34 ppm (J = 5.2 Hz) con integración para un hidrógeno que sugiere la presencia de tres protones olefínicos en la molécula. Se observó también un triplete doblete doblete a 3.52 ppm (J = 4.8, 4.4 y 3.6 Hz) con integración para un hidrógeno, característicos de un protón conectado a un carbono que está unido a un grupo hidroxilo.
El espectro 13C-RMN mostró señales para 29 carbonos en los que se confirmó la presencia de carbonos metilos angulares a 12.26 y 19.40 ppm. También se observaron las señales en 140.76, 138.34, 129.27 y 121.73 ppm indicativas de enlaces dobles; y la señal correspondiente a carbono unido a grupo hidroxilo a 71.82 ppm. Estos datos se confirmaron mediante experimentos DEPT 135 donde se observó señales para 26 carbonos distribuidos de la siguiente forma: seis carbonos metilos, nueve carbonos metilénicos y diez carbonos metínicos.
La confirmación de la estructura se efectuó a través de los espectros bidimensionales HSQC y HMBC y por comparación con los datos reportados en la literatura (Tabla 1). (Chaturvedula y Prakash, 2012). Se determinó la estructura del compuesto (1), como Estigmasterol (Figura 1).
Para el compuesto 2, se observó en el espectro IR bandas de absorción a 3500.00 cm-1 y 1735.00 cm-1, que indican la presencia de grupo -OH y del grupo carbonilo del éster R-C-O-O-R, respectivamente. Además, presentó una banda de absorción en 2900.00 cm-1 debido a la frecuencia de estiramiento de C-H saturado; la banda de absorción débil en 1642.00 cm-1 sugiere la presencia del estiramiento del enlace doble C=C conjugado y la banda de absorción intensa en 1220.00 cm-1 es característica del estiramiento del enlace sencillo C-O lo que evidencia la presencia de un grupo éster en la molécula.
El espectro 1H-RMN presentó un singlete en 1.19 ppm con integración para tres hidrógenos, un singlete en 1.25 ppm con integración para tres hidrógenos, un singlete en 1.75 ppm con integración para tres hidrógenos, indicativo de un grupo metilo unido a un alqueno y un singlete en 2.04 ppm con integración para tres hidrógenos que sugiere un grupo metilo adyacente a un grupo carbonilo.
Los dobletes en 3.70 (J = 10.8 Hz) y 4.02 ppm (J = 11.2 Hz) con integración para un hidrógeno son indicativos de protones diastereotópicos de metileno enlazado a oxígeno.
El doblete en 4.29 ppm (J = 2.4 Hz) con integración para un hidrógeno sugiere un protón enlazado a un carbono que tiene un grupo –OH y las señales de un doble doblete en 6.81 ppm (J = 11.2 y 17.6 Hz), y dos dobletes con integración para un hidrógeno en 4.96 ppm (J = 11.2 Hz) y 5.12 ppm (J = 17.2 Hz), son características de un grupo vinilo.
El espectro 13C-RMN mostró señales para 22 carbonos en los que se confirmó la presencia de carbonos de metilo a 15.89, 17.10 y 19.62 ppm. De manera similar, el desplazamiento químico del carbono del metilo en 20.89 ppm corresponde a un átomo de carbono enlazado a un grupo carbonilo. También se observaron las señales en 136.41, 135.46, 129.26 y 110.74 ppm indicativas de enlaces dobles en la molécula. Además, de la señal en 171.42 ppm que corresponde a carbono de grupo carbonilo C=O, una señal en 67.61 ppm para un átomo carbono enlazado a hidroxilo -OH y la señal en 72.86 ppm correspondiente a un carbono de metileno adyacente a un átomo de oxígeno (-CH2-O-).
Los valores de 1H-RMN y 13C-RMN para todos los protones y carbonos se asignaron sobre la base de las correlaciones HSQC y HMBC presentados en la Tablas 2 y 3. Los datos espectroscópicos nos permitieron establecer por comparación con los datos reportados en la literatura, la estructura del compuesto (2), asignado como 6β-hidroxi-18-acetoxicassan-13,15-dieno (Figura 1). (Torres et al., 2003).
Valores de desplazamientos químicos 1H y 13C RMN para el compuesto (1)
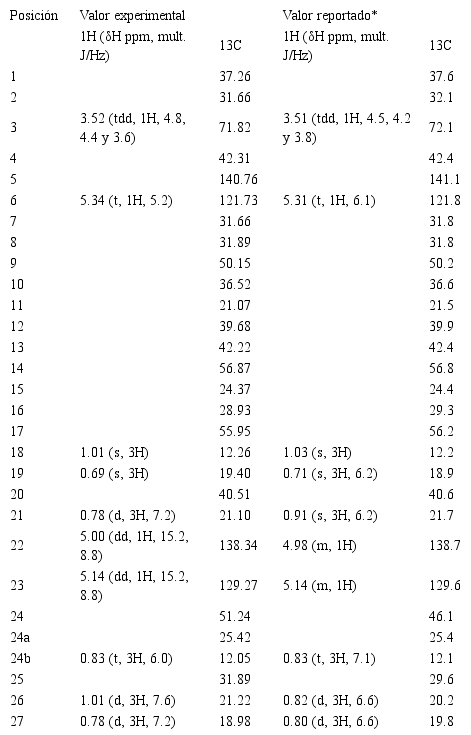
Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Chaturvedula, V. S. P., Prakash, I. 2012.
Para el compuesto 3, en el espectro IR se observó una banda de absorción a 3450.00 cm-1 que indican la presencia de grupo –OH, una banda de absorción en 2900.00 cm-1 debido a la frecuencia de estiramiento de C-H saturado y una banda de absorción débil en 1620.00 cm-1 que sugiere la presencia del estiramiento del enlace doble C=C conjugado en la molécula.
Valores de desplazamientos químicos 1H-RMN para los compuestos 2 - 5
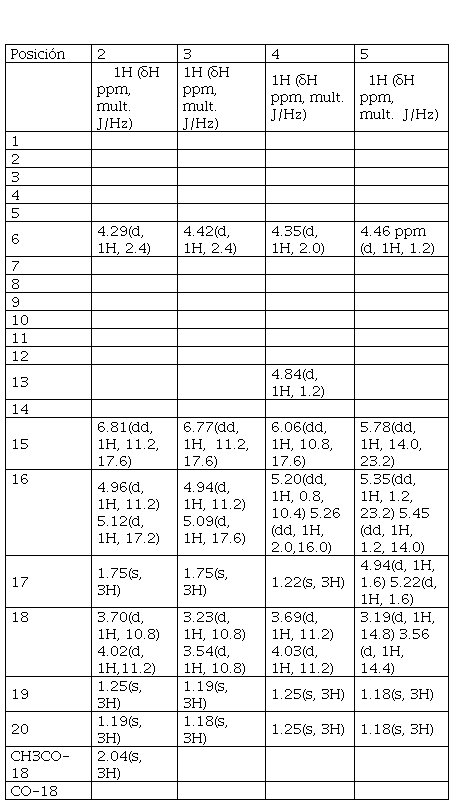
Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Torres, D., Ureña, L., Ortega, E., Capson, T. y Cubilla, L., 2003.
El espectro 1H-RMN presentó un singlete en 1.18 ppm con integración para tres hidrógenos, un singlete en 1.19 ppm con integración para tres hidrógenos y un singlete en 1.75 ppm con integración para tres hidrógenos, indicativo de un grupo metilo unido a un alqueno.
Los dobletes en 3.23 (J = 10.8 Hz) y 3.54 ppm (J = 10.8 Hz), con integración para un hidrógeno son indicativos de protones diastereotópicos de metileno enlazado a oxígeno. El doblete en 4.42 ppm (J = 2.4 Hz) con integración para un hidrógeno sugiere un protón enlazado a un carbono que tiene un grupo –OH y las señales de un doble doblete en 6.77 ppm (J = 17.6 y 11.2 Hz) con integración para un hidrógeno y dos dobletes con integración para un hidrógeno en 4.94 ppm (J = 11.2 Hz) y 5.09 ppm (J = 17.6 Hz) son características de un grupo vinilo.
El espectro 13C-RMN mostró señales para 20 carbonos en los que se confirmó la presencia de carbonos de metilo a 16.15, 17.36 y 20.03 ppm. También se observó las señales en 136.55, 135.67, 129.49 y 110.83 ppm indicativas de enlaces dobles en la molécula. Además, de la señal en 68.55 ppm que corresponden a un átomo carbono enlazado a un hidroxilo -OH y la señal en 72.83 ppm correspondiente a un carbono de metileno adyacente a un átomo de oxígeno (-CH2-O-).
Los valores de 1H-RMN y 13C-RMN para todos los protones y carbonos se asignaron sobre la base de las correlaciones HSQC y HMBC y se presentan en las Tablas 2 y 3. El estudio de los datos espectroscópicos nos permitieron establecer por comparación con los datos reportados en la literatura, la estructura del compuesto (3), asignado como 6β,-18-dihidroxicassan-13,15-dieno. (Figura 1). (Torres et al., 2003).
Para el compuesto 4, en el espectro IR se observaron bandas de absorción a 3300.00 cm-1 y 1735.00 cm-1, que indican la presencia de grupo -OH y del grupo carbonilo del éster R-C-O-O-R, respectivamente. Además, presentó una banda de absorción en 2920.00 cm-1 debido a la frecuencia de estiramiento de C-H saturado y la banda de absorción débil en 1050.00 cm-1 característica del estiramiento del enlace sencillo C-O lo que evidencia la presencia de un grupo éster en la molécula.
Valores de desplazamientos químicos 13C-RMN para los compuestos 2 - 5

Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Torres, D., Ureña, L., Ortega, E., Capson, T. y Cubilla, L., 2003.
El espectro 1H-RMN presentó un singlete en 1.22 ppm con integración para tres hidrógenos, un singlete en 1.25 ppm con integración para seis hidrógenos y un singlete en 2.07 ppm con integración para tres hidrógenos que sugiere un grupo metilo adyacente a un grupo carbonilo.
Los dobletes en 3.69 (J = 11.2 Hz) y 4.03 ppm (J = 11.2 Hz) con integración para un hidrógeno son indicativos de protones diastereotópicos de metileno enlazado a oxígeno. Los dobletes en 4.35 (J = 2 Hz) y 4.84 ppm (J = 1.2 Hz) con integración para un hidrógeno sugieren dos protones de carbonos unidos a grupo –OH en la molécula. Los tres grupos de señales de doble doblete con integración para un hidrógeno en 5.20 (J = 0.8 y 10.4 Hz), 5.26 (J = 2.0 y 16.0 Hz) y 6.06 ppm (J = 10.8 y 17.6 Hz) son características de un doble enlace terminal que presenta sistema de tres espines de segundo orden, ABX.
El espectro 13C-RMN mostró señales para 22 carbonos en los que se confirmó la presencia de carbonos de metilo a 18.11, 18.39 y 20.06 ppm. De manera similar, el desplazamiento químico del carbono del metilo en 21.14 ppm corresponde a un átomo de carbono enlazado a un grupo carbonilo. También se observaron las señales en 143.45 y 113.90 ppm indicativas de enlaces dobles en la molécula. Además, de la señal en 171.46 ppm que corresponde a carbono de grupo carbonilo C=O, dos señales en 67.71 y 75.05 ppm para dos átomos de carbono enlazados a hidroxilo -OH y la señal en 72.97 ppm correspondiente a un carbono de metileno adyacente a un átomo de oxígeno (-CH2-O-).
Estos datos se confirmaron mediante experimentos DEPT-135 y se observaron señales para 17 carbonos distribuidos de la siguiente forma: cuatro carbonos metilos, ocho carbonos metilénicos y cinco carbonos metínicos.
El espectro HSQC mostró la correlación del protón en 6.06 ppm (H-15) con el carbono en 143.26 ppm (C-15), la correlación de los protones del metileno en 5.02 y 5.26 ppm (H-16) con el carbono en 113.70 ppm (C-16) que permite la asignación del doble enlace. También reveló la correlación del protón en 4.35 ppm (H-6) con el carbono en 67.56 ppm (C-6). De igual forma presentó la correlación de los protones metilenos en 3.69 y 4.03 ppm (H-18) con el carbono en 72.84 ppm (C-18) y la correlación de los protones en 2.07 ppm (H-22) con el carbono en 21.66 ppm (C-22). Además, de la correlación de los protones de metilo en 1.22 ppm (H-17) con el carbono en 17.97 ppm (C-17) (Figura 2a).
El espectro HMBC presentó la correlación de los protones en 6.06 (H-15), 5.20 (H-16) y 5.26 ppm (H-16) con el carbono en 74.91 ppm (C-13). Se observaron también la correlaciones de los protones en 5.20 (H-16) y 5.26 ppm (H-16) con el carbono en 143.26 ppm (C-15). De manera similar se observó la correlación del protón en 4.35 ppm (H-6) con los carbonos en 37.09 (C-4) y 37.23 ppm (C-10). Por otro lado, mostró la correlación de los protones metilénicos en 3.69 (H-18) y 4.03 ppm (H-18) con los carbonos en 37.09 (C-4), 37.59 (C-1), y 171.30 ppm (C-21)
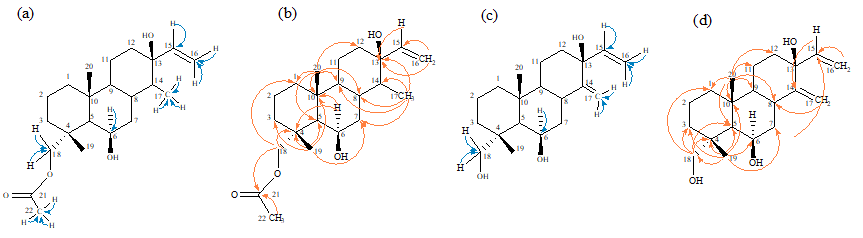
Figura 2
Correlaciones presentadas en los experimentos HSQC (a), HMBC (b) para el compuesto 4 HSQC (c), HMBC (d) para el compuesto 5.
Los valores de 1H-RMN y 13C-RMN para todos los protones y carbonos se asignaron sobre la base de las correlaciones HSQC y HMBC y se registraron en las Tablas 2 y 3.
El estudio de los valores espectroscópicos de IR, 1H-RMN, 13C-RMN, DEPT 135 y experimentos de correlación hetereonuclear (HSQC y HMBC) permitieron establecer la estructura del compuesto (4), asignado como 6β,13-dihidroxi-18-acetoxi-cassano-15-eno (Figura 1). Para este caso, no se ha encontrado concordancia con los valores reportados por estudios previos realizados a esta planta; es por ello que adjudicamos el aislamiento de este nuevo compuesto a Myrospermum frutescens.
Para el compuesto 5 en el espectro IR se observó una banda de absorción a 3400.00 cm-1 que indican la presencia de grupo –OH, una banda de absorción en 2900.00 cm-1 debido a la frecuencia de estiramiento de C-H saturado y una banda de absorción en 1700.00 cm-1 que sugiere la presencia del estiramiento del enlace doble C=C.
El espectro 1H-RMN presentó un singlete en 1.18 ppm con integración para seis hidrógenos. Los dobletes en 3.19 ppm (J = 14.8 Hz) y 3.56 ppm (J = 14.4 Hz) con integración para un hidrógeno son indicativos de protones diastereotópicos de metileno enlazado a un carbono que tiene oxígeno. Por otra parte, el doblete en 4.46 ppm (J = 1.2 Hz) con integración para un hidrógeno es característico de un protón unido a un carbono que se encuentra enlazado a un oxígeno.
Los dobletes en 4.94 (J = 1.6 Hz) y 5.22 ppm (J = 1.6 Hz) con integración para un hidrógeno son característicos de un doble enlace terminal que presenta sistema AB.
Los tres grupos de señales de doble doblete con integración para un hidrógeno en 5.35 ppm (J = 1.2 y 23.2 Hz), 5.45 ppm (J = 1.2 y 14.0 Hz) y 5.78 ppm (J = 14.0 y 23.2 Hz) caracterizan a un doble enlace terminal que presenta sistema de tres espines de segundo orden, ABX.
El espectro 13C-RMN mostró señales para 20 carbonos en los que se confirmó la presencia de carbonos de metilo a 17.76 y 21.34 ppm. También se observaron las señales en 106.60, 120.62, 138.49 y 151.16 ppm indicativas de enlaces dobles en la molécula. Además, de las señales en 67.58 y 72.52 ppm que corresponden a un carbono de metino y metilo enlazado a un grupo hidroxilo –OH, respectivamente. Análogamente, se observó la señal en 86.92 ppm correspondiente a un carbono cuaternario unido a un grupo hidroxilo.
El espectro HSQC mostró la correlación del protón en 4.46 ppm (H-6) con el carbono en 67.58 ppm (C-6), la correlación de los protones del metileno en 5.35 y 5.45 ppm (H-16) con el carbono en 120.62 ppm (C-16) y la correlación del protón en 5.78 ppm (H-15) con el carbono en 138.49 ppm (C-15) que permite la asignación de un doble enlace. De igual forma presentó la correlación de los protones en 4.94 y 5.22 ppm (H-17) con el carbono en 106.60 ppm (C-17) que permite la asignación de un segundo doble enlace. También se observó la correlación de los protones de metileno en 3.19 y 3.56 ppm (H-18) con el carbono en 72.52 ppm (C-18) y la correlación de los protones en 1.18 ppm (H-19 y H-20) con los carbonos en 17.76 y 21.34 ppm (C-20 y C-19) que indican la presencia de dos grupos metilo (Figura 2c).
El espectro HMBC presentó la correlación de los protones en 4.94 y 5.22 ppm (H-17) con los carbonos en 34.09 (C-8) y 138.49 ppm (C-15). De manera similar se observó la correlación del protón en 5.78 ppm (H-15) con el carbono en 151.16 ppm (C-14).
Por otro lado, mostró la correlación de los protones metilénicos en 3.19 (H-18) y 3.56 ppm (H-18) con los carbonos en 38.52 (C-1), 37.43 (C-3), 37.60 (C-4) y 50.10 ppm (C-5). También se pudo determinar la correlación de los protones en 5.35 (H-16) y 5.45 (H-16) con el carbono en 138.49 ppm (C-15) (Figura 2d).
Los valores de 1H-RMN y 13C-RMN para todos los protones y carbonos se asignaron sobre la base de las correlaciones HSQC y HMBC y se indican en las Tablas 2 y 3.
El estudio de los valores espectroscópicos de IR, 1H-RMN, 13C-RMN y experimentos de correlación hetereonuclear (HSQC y HMBC) permitieron establecer la estructura del compuesto (5), asignado como 6β,18,17-trihidroxicassano-14,15-dieno (Figura 1). Para este caso, no se ha encontrado concordancia con los valores reportados por estudios previos realizados a esta planta; por ello adjudicamos el aislamiento de este nuevo compuesto a Myrospermum frutescens. (Torres et al., 2003), (Torres et al., 2004).
El estudio del extracto crudo de acetato de etilo/metanol de hojas maduras de Myrospermum frutescens condujo al aislamiento de cinco compuestos, de los cuales el compuesto (1) es un triterpeno identificado como estigmasterol, y los cuatro restantes, corresponden al grupo de diterpenos tipo cassano; dos de ellos, (2 y 3), se reportan previamente en la literatura y los otros dos, (4 y 5) no registran valores que indiquen concordancia con los que se consignan en estudios previos realizados a Myrospermum frutescens.
Deseamos expresar nuestro agradecimiento al Laboratorio de Bioorgánica Tropical de la Universidad de Panamá y a SENACYT por el financiamiento de esta investigación.

Figura 1
Estructuras de los terpenos aislados de hojas maduras de Myrupermum frutescens
Valores de desplazamientos químicos 1H y 13C RMN para el compuesto (1)

Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Chaturvedula, V. S. P., Prakash, I. 2012.
Valores de desplazamientos químicos 1H-RMN para los compuestos 2 - 5

Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Torres, D., Ureña, L., Ortega, E., Capson, T. y Cubilla, L., 2003.
Valores de desplazamientos químicos 13C-RMN para los compuestos 2 - 5

Los espectros se registraron en CDCl3, 300 MHz a 27 °C, utilizando TMS como referencia interna (δ en ppm.). * Torres, D., Ureña, L., Ortega, E., Capson, T. y Cubilla, L., 2003.

Figura 2
Correlaciones presentadas en los experimentos HSQC (a), HMBC (b) para el compuesto 4 HSQC (c), HMBC (d) para el compuesto 5.


