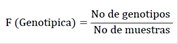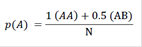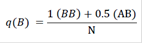El ganado criollo ha sido importante en el desarrollo de la ganadería en Latinoamérica, en principio constituyó el hato fundador de la misma. El ganado Reyna, es una raza adaptada a las condiciones tropicales de Nicaragua seleccionada por Joaquín Reyna, en una finca ganadera ubicada en San Juan del Sur en el año de 1920. Surgió de bovinos procedentes de España durante la conquista en los años 1500 (Rubio, 2008).
Se caracteriza por ser eminentemente un ganado lechero, pero puede ser utilizado como doble propósito. En 1988 por medio de un decreto presidencial fue declarado patrimonio nacional (Núñez, 2005). Esta raza representa un potencial genético de incalculable valor, sometido a más de 500 años de selección natural, por tal razón es importante conservarlo y multiplicarlo para evitar su reducción poblacional o desaparición (Hernández, 2014).
Las características sobresalientes de esta raza, con relación a índices productivos son, la reducción que sufren los intervalos entre partos cuando estas se cruzan con razas europeas de alta especialización, mejor en la precocidad y fertilidad de las hembras y el fortalecimiento de la productividad de los hatos (Hernández, 2014).
La proteína κ-caseína está relacionada con características de producción y calidad de la leche, tales como, rendimiento en queso, tiempo de coagulación, firmeza de micela y niveles altos de lactoferrina. La leche derivada de animales CASκ AA tiene menor porcentaje de κ-caseína, por el contrario, la leche de animales CASκ BB presenta mayor proporción de κ-caseína y micelas más pequeñas (Requena et al., 2007).
Esta investigación tiene por objetivo determinar la frecuencia genotípicas y alélicas del gen de la kappa caseína en el ganado Reyna propiedad de la Facultad de Ciencia Animal, en la Universidad Nacional Agraria, resultados que pueden ser de utilidad para evaluar en otras investigaciones la factibilidad de la raza Reyna, la producción y el rendimiento de leche y sus derivados, así como la selección de genotipos deseados en la población estudiada.
MATERIALES Y MÉTODOS
Ubicación del área de estudio.
El
estudio se realizó en el laboratorio de microbiología de la Universidad
Nacional Agraria, ubicado en el km 12 carretera norte Managua, Nicaragua a una
altitud de 56 m.s.n.m entre las coordenadas 86°09′36″ de longitud Oeste y
12°08′15″ de latitud norte.
Tipo de
estudio.
El tipo de
estudio fue descriptivo de corte transversal.
Toma de muestra sanguínea.
La unidad de producción de bovinos de la Facultad
de Ciencia Animal cuenta con una población de 22 bovinos de la raza Reyna a los
que se les realizo toma de muestra sanguínea la que consistió en localizar la vena coccígea, luego se desinfectó esta área con alcohol al 70 % y se extrajo 3
ml de sangre total con una jeringa de 5 ml , posteriormente se depositó la sangre en un tubo de
ensayo que contenía 50 µl del anti-coagulante
ácido etilendiaminotetraacético (EDTA) en concentración de 10.8 mg. Las
muestras fueron trasladadas en un recipiente térmico a temperatura de 6-8 oC
al laboratorio de microbiología de la facultad de agronomía. Los criterios de inclusión de los bovinos fueron:
hembras bovinas en edades entre 1-6 años, clínicamente sanos (no hay alteración
de la tríada clínica), hembras en producción y libres de enfermedades como la brucelosis
y la tuberculosis.
Extracción del ADN.
Para la extracción de ADN se utilizó el método CTAB (Bromuro de hexadeciltrimetilamonio) descrito por Doyle y Doyle (1990) el que consiste en calentar el buffer de extracción CTAB por 30 minutos a 65 ºC. En vez de tejido vegetal se colocó 50µl de sangre total con EDTA 10.8 mg en un tubo Eppendorf y se adiciono 500 μl de CTAB 2% (buffer) y 1 μl de RNasa y se incubo 65oC por 30 minutos. Posterior a la incubación, se adicionaron 400 μl de cloroformo-alcohol isoamílico (24:1), se centrifugó por 10 minutos a 14 000 rpm. El sobrenadante se transfirió a un nuevo tubo Eppendorf de 1.5 ml, se agregó nuevamente cloroformo-alcohol isoamílico (24:1) y se centrifugó por 5 minutos a 14 000 rpm. El sobrenadante fue transferido a un nuevo tubo Eppendorf de 1.5 ml, se adicionaron 200 μl de isopropanol, se incubó por 15 minutos a -20 °C, se centrifugó a 14 000 rpm por 15 minutos y se eliminó el sobrenadante. Al pellet resultante se le adicionaron 100 μl de etanol mezclando por inversión, se centrifugó a 14 000 rpm por 4 minutos, se eliminó el sobrenadante y se dejó secar a temperatura ambiente. Posteriormente, el pellet fue suspendido en 100 μl de agua calidad molecular o Tris-EDTA (TE) buffer, se adicionó 1μl de la ribonucleasa ARN-asa y se incubó por 20 minutos a 37 ºC. El ADN extraído se mantuvo a una temperatura de -20 oC hasta su uso.
Amplificación
del gen de К-caseína.
La
amplificación del gen de la Kappa caseína se realizó mediante la técnica de PCR
convencional con reacciones de 25 µl de volumen, la que consistió en mezclar 2 µl
de la muestra a estudiar 12.5 µl de Master Mix (PROMEGA), 7.5 µl de agua libre
de nucleasas y 2 µl del par de cebadores BLKC delantero 5`- ATT
AGCCCATTTCGCCTTCT-3` y BLKC-reverso 5`-ATT TATGGCCATTCCACCAA-3`,
respectivamente que producen un amplicón de 351 pb
(Rojas, 2009).
Desarrollo de la
PCR
Se realizó en un termociclador Eppendorf bajo las siguientes condiciones:
Desnaturalización inicial 94 °C
durante 5 minutos, 35 ciclos a 94 °C durante 45 segundos 52.4 °C por 45
segundos seguido de 72 °C por 60 segundos y una extensión final a 72 °C durante
7 minutos. Para visualizar los
fragmentos se colocaron 8 µl del producto PCR con 1.5µl del colorante de carga
6x loading Dye en un gel de agarosa al 1% teñido con Gel red. El gel se colocó en una cámara de
electroforesis con buffer TBE 1X. La
electroforesis se llevó a cabo por un periodo de una hora a 80 voltios y luego
se procedió a visualizar en el transluminador registrándose los resultados
fotográficamente.
Genotipificación
del gen de К-caseína.
La genotipificación se realizó mediante la técnica PCR-FRLP usando el producto de la amplificación de la PCR con los iniciadores BLKC delantero y BLKC-reverso. El producto de la PCR se sometió a digestión con la enzima Hinf I en un volumen final de 10 µl. El procedimiento consistió en adicionar 8 µl del producto amplificado PCR, 2 µl de la enzima de restricción. Posteriormente se incubo a 37 °C por una hora en un termociclador Eppendorf. Después de la incubación se procedió a realizar la separación de los fragmentos en un gel de agarosa al 1 % en solución de Tris-Borato-EDTA buffer 1X. Los genotipos AA mostraron dos fragmentos de 134/132 pb y 84 pb, los genotipos BB presentaron dos fragmentos de 266 pb y 84 pb, mientras que los genotipos AB presentaron tres fragmentos de 266 pb 134/132pb y 84 pb.
Cálculo de frecuencia genotípicas y
alélicas.
La frecuencia
génica o frecuencia alélica consiste en la proporción de cada alelo en
un locus dado en una población específica. La suma de las frecuencias alélicas
en una población siempre es 1 o 100% (Griffiths et al., 1990). Se calculó la frecuencia genotípica y alélica
mediante las fórmulas propuestas por Hernández y Trejo (2014).
Frecuencia
genotípica
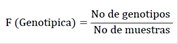
Frecuencia alélica
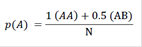
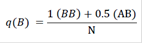
Donde:
N: Número de muestra
p(A): Frecuencia del alelo A
q(B): Frecuencia del alelo B
AB: Heterocigotos de los alelos A y B
0.5: Constante de la mitad de cada alelo
RESULTADOS Y DISCUSIÓN
Amplificación y
genotipificación del gen de la kappa caseína.
Se amplificaron
fragmentos de 351pb correspondiente al gen de la К-caseína con el par de cebadores específicos
BLKC delantero 5`- ATT AGCCCATTTCGCCTTCT-3` y BLKC-reverso 5`-ATT
TATGGCCATTCCACCAA-3`, en veintidós muestras
procedentes de hembras bovinos (Figura 1). Las
veintidós muestras procesadas, presentaron buena calidad del ADN genómico, lo que
significa que estaban aptas para ser digeridas por la enzima de restricción Hinf I.
 Figura 1.
Producto PCR amplificado con los cebadores BLKC-delantero/ BLKC-reverso
del gen de la к-caseína en muestras de hembras bovinas identificadas por los números
(1,2,3,4,5,7,8 y 9). Con la letra M se indica el marcador molecular de 100pb.
Figura 1.
Producto PCR amplificado con los cebadores BLKC-delantero/ BLKC-reverso
del gen de la к-caseína en muestras de hembras bovinas identificadas por los números
(1,2,3,4,5,7,8 y 9). Con la letra M se indica el marcador molecular de 100pb.
El producto PCR de las veintidós muestras amplificadas con los cebadores BLKC-delantero / BLKC-reverso, para el gen de la к-caseína fueron sometidos a digestión con la enzima de restricción Hinf I, determinándose patrones de bandas de 134/132 pb y 84 pb para el genotipo homocigótico AA en dos muestras, dos fragmentos de 266 pb y 84 pb para el genotipo homocigótico dominante BB en una muestra y tres fragmentos de 266 pb 134/132 pb, y 84pb correspondiente al genotipo heterocigótico AB en 19 muestra (Figura 2). Estos resultados son parecidos a los encontrados por Cortés-López et al., (2012) quienes obtuvieron 37 individuos homocigóticos dominantes (AA), 70 heterocigóticos (AB) y un individuo homocigótico recesivo (BB).
Requena et al. (2007); Uffo et al. (2006) y Benavides, (2003), platean que el genotipo homocigótico BB del gen de Kappa caseína estudiada en bovinos, presenta un contenido proteico más alto, posee mayor estabilidad al calor y a la congelación, menor tiempo de coagulación y un cuajo más consistente, trayendo consigo un rendimiento quesero entre el 5 y el 10%, lo cual hace que la leche sea más rentable para la industria quesera.
Estudio realizado por Rojas (2009), indican que el alelo A es el que prevalece en las razas Holstein, Friesian, Ayrshire, Danés Rojo y Cebú Índico, a diferencia del alelo B que predomina en las razas Jersey, Normando y Cebú Africano. En estudios de caracterización molecular de razas bovinas, se ha observado que el alelo B presenta mayores frecuencias en las razas Bos taurus en comparación con las razas Bos indicus (Golijow et al., 1999; Kemenes et al., 1999; Tambasco, 1998 y Del Lama y Zago, 2002).
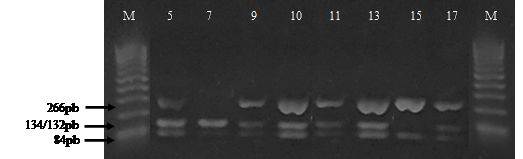 Figura
2
Patrones de bandas del gen de la kappa
caseína obtenidos después de la digestión del producto PCR con la enzima de
restricción Hinf I. Con la letra M se indica el marcador molecular de
100pb. las muestras números 5,9,10,11,13 y 17 corresponden a los individuos con
genotipos AB, mientras que el número 7 al genotipo AA y el numero 15 al
genotipo BB.
Figura
2
Patrones de bandas del gen de la kappa
caseína obtenidos después de la digestión del producto PCR con la enzima de
restricción Hinf I. Con la letra M se indica el marcador molecular de
100pb. las muestras números 5,9,10,11,13 y 17 corresponden a los individuos con
genotipos AB, mientras que el número 7 al genotipo AA y el numero 15 al
genotipo BB.
Frecuencia alélica y
genotípica del gen de la Kappa caseína.
Las frecuencias
genotípicas obtenidas fueron 0.090 (2/22), 0.045 (1/22) y 0.0863 (19/22) para
los genotipos AA, BB y AB, respectivamente, siendo el genotipo más frecuente el
AB seguido del AA y el menos frecuente el BB, mientras que la frecuencia
alélica fue 0.52 y 0.48 para los alelos A y B, respectivamente, siendo el más
frecuente el alelo A (Cuadro 1). Estos resultados son similares a los obtenidos
por (Almeyda et al., 2016) los cuales obtuvieron una frecuencia alélica de 0.55 para el
alelo A y 0.44 para el alelo B.
La leche producida por bovinos con el genotipo CASK BB presentan propiedades de interés para la manufactura del queso por presentar menor tiempo de renina, cuajo más firme y mayor contenido de proteínas y sólidos. Es importante conocer el estatus actual de los alelos de la kappa caseína en la raza estudiada, lo que permitirá determinar los genotipos predominantes y sus frecuencias, para realizar selección de aquellos genotipos deseados en la población Eenennaam y Medrano (1991).
En este estudio los resultados obtenidos fueron diferentes a los de Dogru y Ozdemir (2009), quien estudió bovinos de la raza Pardo Suizo, identificando frecuencias genotípicas de 0.1935, 0.2043 y 0.6022 para los genotipos AA, BB y AB, respectivamente. La frecuencia alélica fue de 0.495 y 0.505 para los alelos A y B respectivamente, indicando mayor número de genotipos AB y BB, mientras tanto la frecuencia de alelos predomino el B, un factor determinante puede ser la raza bovina estudiada.
Cuadro 1.
Frecuencia alélica y genotípica para el gen de la Kappa
caseína en hembras del ganado bovino de la raza Reyna de la UNA

A: Alelo A, B: Alelo
B, AA: Homocigotos A, BB:
Homocigotos B y AB: Heterocigotos AB.
|
Raza
|
Proteína
|
Frecuencias alélicas
|
Frecuencias
genotípicas
|
|
Reyna
|
Kappa caseína
|
A
|
B
|
AA
|
BB
|
AB
|
|
0.52
|
0.48
|
0.090
|
0.045
|
0.863
|
La leche derivada de animales CASκ AA tiene menor porcentaje de κ-caseína y como consecuencia de esto, una mayor proporción de micelas grandes, por el contrario, la leche de animales CASκ BB presenta mayor proporción de κ-caseína y micelas más pequeñas. Esta característica explica la formación de un cuajo más firme y una mayor retención de sólidos, lo que resulta en un rendimiento superior durante la producción de queso, comparada con la leche producida por animales con genotipo CASκ AA (Requena et al., 2007).
Eenennaam y Medrano (1991) demostraron que la leche de los animales con genotipo CASκ AB contiene una mayor proporción de κ-CN B, esto sugiere que dicho alelo tiene un mayor nivel de expresión con respecto a la variante A en la glándula mamaria de los bovinos.
CONCLUSIONES
El genotipo más frecuente en las hembras bovinas
de la raza Reyna fueron las heterocigótas AB con 0.863 (19/22), mientras que el
genotipo de mayor rendimiento quesero BB es poco frecuente La frecuencia del alelo
A predomino sobre el alelo B. El alelo A está presente en un
0.52 y el alelo B en un 0.48 de los gametos de esta población muestreada, estos
resultados sugieren hacer una mejora genética para obtener resultados
favorables en la producción de leche.
Referencias
Almeyda, M., Rosadio, R., Maturrano, L. (2016). Genotipos del Gen Kappa-Caseína en Ganado bovino Criollo del Distrito de Bambamarca, Cajamarca. Revista de Investigaciones Veterinarias del Perú, 27(1), 82-90.
Benavides Castro, T.A. (2003). Efecto de las variantes genéticas A y B de
k-caseína y β-Lactoglobulina sobre las propiedades de coagulación de la leche [Tesis
de pregrado, Universidad Astral de Chile]. Tesis electrónicas UACH. http://cybertesis.uach.cl/tesis/uach/2003/fab456e/doc/fab456e.pdf
Cortés López, N.G., Del Moral Ventura, S. T, Rueda Barrientos, J. A., Luna Palomera, C., Meza Herrera, C. A., y Abad-Zavaleta, J. (2012). Allelic and genotypic frequency of kappa casein gene in double purpose cattle. Tropical and Subtropical Agroecosystems, 15, 47-55.
Del Lama, S. N y Zago, M. A. (2002). Identification of kappa casein and beta lactoglobulin genotype in Brazilian Bos indicus and Bubalus bubalis population. Brazilian Journal of Genetics, 19(1), 73-77.
Dogru, U., Ozdemir, M. (2009). Genotyping of kappa-casein locus by PCR-FRLP in Brown Swiss cattle breed. Journal of animal and veterinary advances, 8 (4), 779-781.
Doyle, J. J., y Doyle, J. L. (1990). Isolation of plant DNA from fresh tissue. Focus, 12(1), 13-15.
Golijow, C. D., Giovambattista G., Ripoli M. V., Dulout, F. N., y Lojo M. M. (1999). Genetic variability and population structure in loci related to milk production traits in native Argentine Creole and commercial Argentine Holstein cattle. Brazilian Journal of Genetics, 22(3), 395-398. https://doi.org/10.1590/S1415-47571999000300018
Griffiths, A. J., Miller, J. H., Suzuki, D. T., Lewontin, R. C., Gelbart, W. M. (1990). Genética. 7a Edición, McGraw-Hill, Interamericana, 715 p.
Hernández-Rodríguez, A.W. y Trejo-Mendilla, F. (2014). Estudio Genético Poblacional de Frecuencias Alélicas para 15 marcadores STR presentes en la Población del Estado de Zacatecas Aplicado a la Práctica Forense. MedPub Journals, 10 (1), 1-24. https://dialnet.unirioja.es/descarga/articulo/4635959.pdf
Hernández, M. B. (2014). Estado poblacional del ganado Reyna en Nicaragua: distribución, manejo, producción y cualidades. La Calera, 14(22), 38-43.
Kemenes, P. A., Reginato, L. C. D., Rosa, A. J. D., Parker, I. U., Razook, A. G., de Figuereido, L. A., Silva, N. A., Etchegaray, M. A. L., y Coutinho, L. L. (1999). κ-casein, β-Lactoglobulin and growth hormone allele frecuencies and genetic distances in Nelore, Gyr, Guzerá, Camcu, Charolais, Canchin and Santa Gertrudis cattle. Genetics and Molecular Biology, 22 (4), 539-541.
Núñez, L. (02 de febrero 2005). Ganado Reyna patrimonio nacional. La Prensa. https://www.laprensa.com.ni/2005/02/02/economia/953118-ganado-reyna-patrimonio-nacional
Requena, F. D., Agüera, E. I. y Requena, F. (2007). Genética de la caseína de la leche en el bovino frisón (Milk of casein of genetic in the Frison bovine). Revista electrónica de Veterinaria, 8(1), 1-9. https://www.redalyc.org/pdf/636/63613304013.pdf
Rojas, I., Aranguren-Méndez, J., Portillo, M., Villasmil-Ontiveros, Y., Valbuena, E., Rincón, X., Contreras, G., y Yañez, L. (2009). Polimorfismo genético de la kappa-caseína en ganado criollo limonero. Revista científica, 19(6), 645-649. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0798-22592009000600012
Rubio Bryan, L. A. (2008). Caracterización técnica y económica de la raza de ganado Reina en la Finca El Pino, Rivas, Nicaragua. Zamorano, Honduras [Tesis de pregrado, Universidad Zamorano]. Repositorio Institucional Zamorano. https://bdigital.zamorano.edu/bitstream/11036/5458/1/CPA-2008-T061.pdf
Tambasco, M. D. (1998). Detecao de polymorphism dos genes de κ-casina, β-lactoglobulina em animais da raca Jersey. [Monografía, Universidad Federal de Sao Carlos. S.P.]
Uffo, O., Martín-Burriel, I., Martínez, S., Ronda, R., Osta, R., Rodellar, C., y Zaragoza, P. (2006). Caracterización genética de seis proteínas lácteas en tres razas bovinas cubanas. Animal Genetic Resources Information, 39, 15-24. https://doi.org/10.1017/S1014233900002108
Eenennaan, A. y Medrano, J.F. (1991). Milk Protein Polymorphisms in California Dairy Cattle. Journal of dairy
science, 74(5), 1730-1742. https://doi.org/10.3168/jds.S0022-0302(91)78336-7
Notas de autor
1 Médico
veterinario. Graduado Universidad Nacional Agraria
1 Médico
veterinario. Graduado Universidad Nacional Agraria
2 MV. MSc. en Biotecnología,
Facultad de Ciencia Animal
3 MSc.
en Sanidad vegetal, Facultad de Agronomía