Investigación clínica
Defectos óseos segmentarios infectados en huesos largos: tratamiento con técnica de Masquelet
Masquelet technique for the treatment of infected segmental long-bone defects
Defectos óseos segmentarios infectados en huesos largos: tratamiento con técnica de Masquelet
Revista de la Asociación Argentina de Ortopedia y Traumatología, vol. 84, núm. 1, 2019
Asociación Argentina de Ortopedia y Traumatología
Recepción: 10 Mayo 2018
Aprobación: 22 Agosto 2018
Resumen:
Resumen
Introducción: Los defectos óseos segmentarios infectados son entidades de complejo tratamiento. La técnica de Masquelet representa una alternativa para estos casos. El objetivo de este estudio retrospectivo multicéntrico fue mostrar los resultados clínicos y radiográficos obtenidos con esta técnica de reconstrucción en defectos óseos segmentarios infectados de fémur y tibia, caracterizar los defectos tratados y describir los diferentes aspectos de la técnica quirúrgica. Materiales y Métodos: Analizamos a 24 pacientes (14 hombres y 10 mujeres; edad promedio 36.16 años [rango 18-67]) tratados con la técnica de Masquelet, operados entre 2011 y 2016. El seguimiento promedio fue de 16.5 meses (rango 12-27) desde el segundo tiempo quirúrgico. Se analizaron el hueso afectado, la longitud del defecto (en cm), el tiempo de consolidación y el control del proceso infeccioso. Resultados: La longitud del defecto óseo tratado fue, en promedio, de 5,7 cm (rango 3-12), fue superior a 4 cm en el 50% de los casos, el defecto óseo segmentario de mayor tamaño en la tibia fue de 12 cm y de 10 cm en el fémur. Se logró la consolidación ósea, en todos los casos, en 4.5 meses. Un paciente presentó una recidiva del proceso infeccioso a los 12 meses de la consolidación. Conclusiones: La técnica de Masquelet o de la membrana inducida ofrece una alternativa razonable y sencilla para un problema altamente desafiante como son los defectos óseos segmentarios infectados. La tasa de consolidación es superior al 90% aun en casos complejos. Palabras clave: Defecto óseo segmentario; defecto óseo infectado; fémur; tibia; técnica de Masquelet.
Nivel de Evidencia: IV
Palabras clave: Defecto óseo segmentario, defecto óseo infectado, fémur, tibia, técnica de Masquelet.
Abstract:
Abstract
Introduction: Infected segmental bone defects are challenging conditions, which require a complex treatment. The Masquelet technique is an alternative for these cases. The aim of this retrospective, multicenter study was to show clinical and radiological outcomes achieved with the use of this reconstruction technique in infected femoral and tibial segmental defects in order to characterize the defects treated and describe different aspects of this surgical approach. Methods: We analyzed 24 patients (14 men and 10 women; average age 36.16 years [range 18-67]) treated with the Masquelet technique between 2011 and 2016. The average follow-up was 16.5 months (range 12-27) from the second surgical stage. We analyzed the affected bone, defect length (cm), consolidation time and infection control. Results: Average length of treated bone defect was 5.7 cm (range 3-12), exceeding 4 cm in 50% of the cases. The largest segmental bone defect was 12 cm at the tibia and 10 cm at the femur. Bone consolidation was achieved in all cases, on an average of 4.5 months. One patient presented a recurrent infection 12 months after the successful consolidation. Conclusions: The Masquelet technique, or induced membrane technique offers a reasonable and simple alternative to a highly challenging problem, such as infected segmental bone defects, achieving a consolidation rate greater than 90% even in complex cases. Key words: Segmental bone defect; infected bone defect; femur; tibia; Masquelet technique.
Level of Evidence: IV
Keywords: Segmental bone defect, infected bone defect, femur, tibia, Masquelet technique.
Introducción
Entre las entidades más complejas que puede enfrentar el cirujano ortopédico en su práctica se encuentran los defectos óseos segmentarios (DOS). La complejidad de estos casos se centra en que su resolución requiere de tratamientos prolongados, múltiples procedimientos quirúrgicos y genera una considerable tasa de complicaciones.1-5 Algunos de los procedimientos más conocidos para estas reconstrucciones óseas son la utilización de injerto óseo autólogo de cresta ilíaca o aloinjerto molido,6 las técnicas de callotasis2,5,7-10y los injertos óseos vascularizados.11 Se caracterizan por ser técnicamente demandantes, en ocasiones, poco predecibles y no están exentos de complicaciones.
La técnica de Masquelet se comenzó a realizar a fines de la década de 1980, pero recién fue descrita en el 2000. Es una técnica relativamente sencilla que permite reconstruir DOS diafisarios y metafisarios de múltiples etiologías y tamaños, sin necesidad de habilidades microquirúrgicas ni de infraestructura hospitalaria de alta complejidad.12-14 Se basa en la colocación de un espaciador de cemento de polimetilmetacrilato (PMMA), el cual provoca una reacción de cuerpo extraño, con la consecuente generación de una membrana biológica inducida. Secuencialmente, en un segundo tiempo, se retira el espaciador y se rellena esta cavidad (revestida por la biomembrana) con injerto óseo, preferiblemente autólogo
La biomembrana previene la reabsorción del injerto, evita la interposición de tejido fibroso y secreta factores de crecimiento que contribuyen a la consolidación ósea.15-18
Este procedimiento se utiliza actualmente en adultos y niños para seudoartrosis infectadas y no infectadas de huesos largos,17 reconstrucciones oncológicas19-21 o defectos congénitos.21,22
Los objetivos de este estudio multicéntrico, retrospectivo son mostrar los resultados clínicos y radiográficos obtenidos con esta técnica de reconstrucción en DOS infectados de fémur y tibia, caracterizar los defectos tratados y describir los diferentes aspectos de la técnica quirúrgica.
Materiales y Métodos
Este estudio retrospectivo multicéntrico incluyó pacientes con reconstrucciones de DOS infectados, tratados con la técnica de Masquelet, en tres Centros de cirugía ortopédica de alta complejidad de la Ciudad Autónoma de Buenos Aires, entre marzo de 2011 y diciembre de 2016.
Los criterios de inclusión fueron: 1) pacientes >18 años, 2) DOS de tibia o fémur, 3) diagnóstico clínico o microbiológico de infección en el defecto y 4) seguimiento >12 meses a partir del segundo tiempo quirúrgico.
La serie quedó conformada por 24 pacientes (14 hombres y 10 mujeres; edad promedio: 36.16 años [rango 18- 67]). El seguimiento promedio fue de 16.5 meses (rango 12-27) a partir del segundo tiempo del tratamiento quirúrgico.
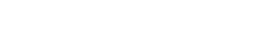
La lesión inicial estaba en la tibia en 13 casos (54%) y, en el fémur, en 11 (46%). En 16 pacientes (66,6%), las fracturas eran expuestas y la presentación más frecuente, según la clasificación de Gustilo, fue el subtipo IIIB en siete casos (29%). En ocho (33,3%), las fracturas eran cerradas (Tabla 1).
El tiempo promedio transcurrido entre el accidente y el tratamiento del DOS con la técnica en estudio fue de nueve meses (rango 1-24). Todos presentaban defectos infectados con diagnóstico clínico o bacteriológico.
La evaluación preoperatoria del DOS se realizó con radiografías de frente y perfil del hueso por tratar (Figura 1). El índice de reconstrucción ósea (IRO) se expresó según la descripción de Gouron22 (longitud del defecto óseo/ longitud total del hueso).
Todos los pacientes fueron operados por cirujanos entrenados en patología traumática de miembros inferiores, siguiendo los mismos lineamientos terapéuticos, en dos tiempos quirúrgicos separados, tal como lo describió Masquelet.12
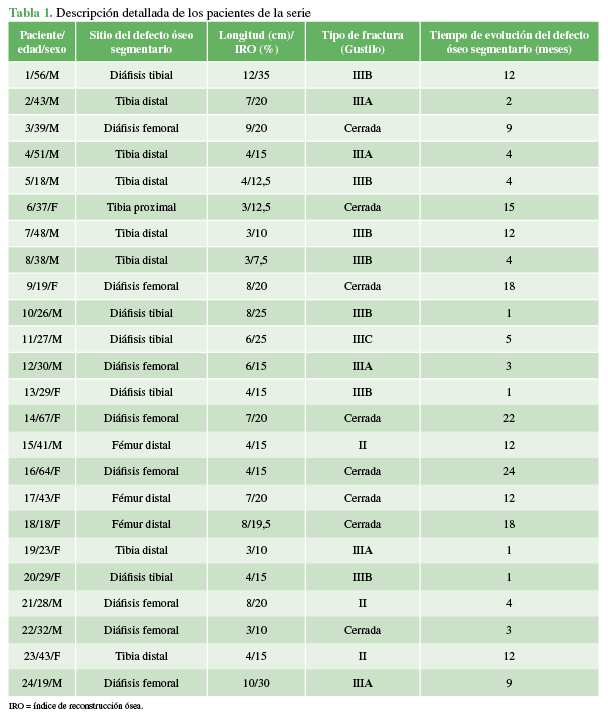
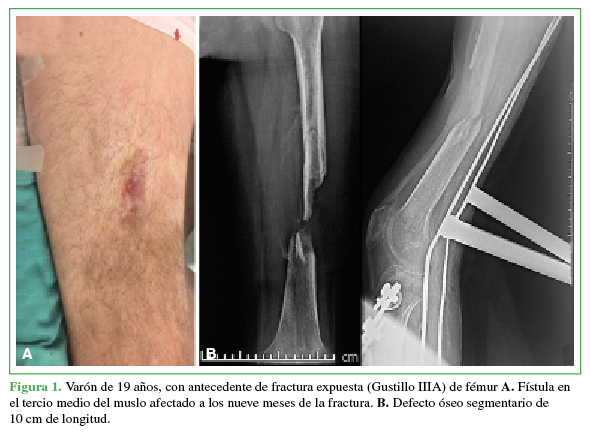
A. Fístula en el tercio medio del muslo afectado a los 9 meses de la fractura. B. Defecto óseo segmentario de 10 cm de longitud.
PropiaTécnica quirúrgica
El fundamento de la técnica quirúrgica consiste en provocar una reacción inflamatoria por un cuerpo extraño mediante la colocación de un espaciador de cemento de PMMA alrededor de la cual se forma una membrana que es activa biológicamente.
Primer tiempo quirúrgico: consiste en realizar un desbridamiento agresivo, resecando todo el tejido desvitalizado y comprometido por el cuadro infeccioso subyacente utilizando criterio oncológico de resección; de esta forma, se limita el riesgo de persistencia de la infección. También se realizan el cruentado de corticales y el fresado del canal endomedular para promover el sangrado. Luego se procede a la estabilización ósea con el método de osteosíntesis más adecuado para cada caso (de acuerdo con el criterio del especialista a cargo), seguida de la colocación de un espaciador tubular de PMMA con antibiótico en el DOS (Figura 2). El PMMA se mezcla con antibióticos y se moldea a mano. Si, antes de la cirugía, se identificó algún germen, se utiliza un antibiótico dirigido a ese microorganismo. Si es necesaria una cobertura tegumentaria, este también es el momento para efectuar los procedimientos correspondientes.
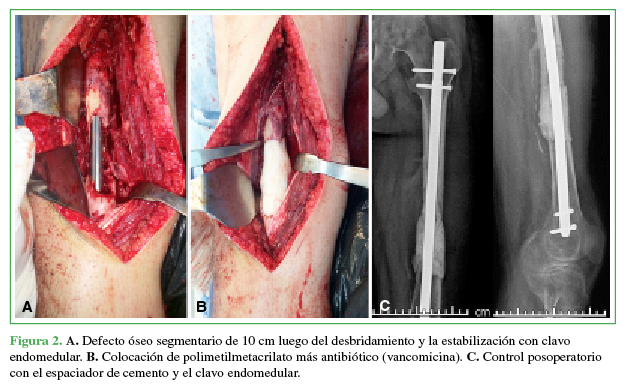
valores humorales y el cuadro clínico se hayan estabilizado. Se identifica y se abre longitudinalmente la membrana inducida, se extrae el espaciador de cemento fragmentándolo, con cuidado, para evitar un mayor daño en el DOS y especialmente en la membrana. Se cruentan las corticales para mejorar el flujo vascular en el foco de seudoartrosis y luego se rellena la cavidad con autoinjerto molido de cresta ilíaca por sus propiedades osteoconductivas, osteoinductivas y osteogénicas (Figura 3); sin embargo, si no es suficiente, existe la posibilidad de utilizar sustituto óseo o aloinjerto molido/estructural sin superar una proporción 1:3 (suplemento:autoinjerto).5,12,16,22
El implante para la fijación ósea en la primera etapa fue un clavo endomedular (CEM) en 20 casos, un tutor externo híbrido en un paciente, una placa en dos y un tutor externo más CEM en otro. Fue elegido según el criterio del cirujano de acuerdo con la localización del DOS. En la segunda etapa de la técnica, se preservó la fijación primaria en 18 pacientes y se modificó en seis casos. Se efectuaron recambios por fallos en el material (rotura del cemento, de los cerrojos) y, en otros casos, por aflojamiento de la osteosíntesis.
El antibiótico utilizado fue elegido antes del aislamiento del cultivo. En 21 casos, fue vancomicina y, en tres casos, gentamicina.
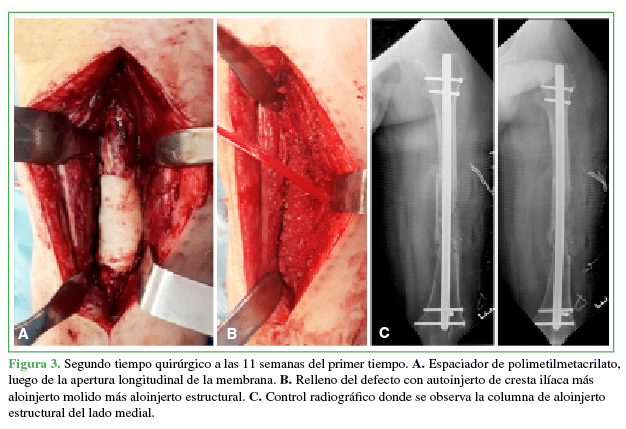
A. Espaciador de polimetilmetacrilato luego de la apertura longitudinal de la membrana. B. Relleno del defecto con autoinjerto de cresta iliaca más aloinjerto molido más aloinjerto estructural. C. Control radiográfico donde se observa la columna de aloinjerto estructural del lado medial.
PropiaEl injerto para la reconstrucción fue autólogo de cresta ilíaca en seis pacientes y asociado en el resto. En ocho casos, se combinó con aloinjerto molido de banco de huesos; en dos casos, con aloinjerto molido más estructural; en tres casos, con sustituto óseo y, en cinco casos, se utilizó el sistema RIA (fresado, aspiración, irrigación) femoral más aloinjerto molido (elegido según el tamaño del DOS y la disponibilidad de los diferentes tipos de aloinjerto en estos tres Centros ortopédicos). En ningún caso, se usaron factores de crecimiento (Tabla 2).
A la semana, se controló la herida quirúrgica. En la tercera semana, se retiraron los puntos de sutura. Luego los controles continuaron en las semanas 4, 8 y 12, y mensualmente hasta la consolidación ósea. De acuerdo con dicha evaluación, se avanzó en la carga progresivamente, según el caso.
La evaluación posoperatoria consistió en la revisión de las historias clínicas y los controles radiográficos de los 24 pacientes. Se registraron las complicaciones, reoperaciones y el momento de carga total sin asistencia.
Para la evaluación radiográfica se tomaron radiografías de frente y perfil del segmento afectado donde se evaluó el tiempo de consolidación ósea, interpretándolo como la presencia de consolidación radiográfica de, por lo menos, tres corticales. Además, se evaluó la presencia de reabsorción del injerto, fracturas de la columna de injerto o signos de fatiga del material de osteosíntesis (Figura 4).
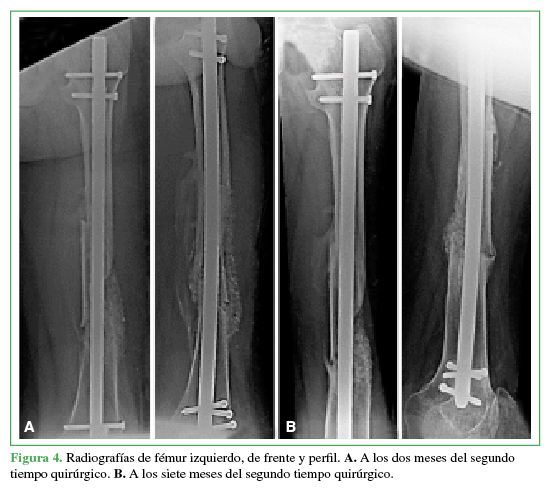
A. A los dos meses del segundo tiempo quirúrgico. B. A los siete meses del segundo tiempo quirúrgico
PropiaResultados
En el último control, todos los pacientes tenían signos clínicos y radiográficos de consolidación ósea. Ninguno fue perdido en el seguimiento. El intervalo entre las dos etapas quirúrgicas fue, en promedio, de nueve semanas (rango 6-20).
La longitud del defecto óseo tratado fue, en promedio, de 5,7 cm (rango 3-12), lo que representó un 17,5% (rango 7,5-30) de la longitud total del hueso. En el 50% de los casos, fueron superiores a 4 cm. El DOS de mayor tamaño fue de 12 cm (IRO 35%) en la tibia y de 10 cm en el fémur (IRO 30%).
En cuanto a la evaluación radiográfica, no se observaron casos de reabsorción masiva del injerto, ni fracturas de la columna de injerto, ni complicaciones mayores relacionadas con el implante (Figura 5).
Se constató la consolidación ósea a los 4.5 meses, en promedio (rango 1.5-8), del segundo tiempo, que permitió una marcha con carga total a los tres meses (rango 2-4). Al final del seguimiento, ninguno de los pacientes marchaba con asistencia.
No se observaron diferencias en el tiempo de consolidación entre los pacientes que sufrieron fracturas expuestas y aquellos con fracturas cerradas, ni respecto del hueso afectado (tibia/fémur), así como tampoco en el tipo de autoinjerto empleado para rellenar el DOS (RIA/cresta ilíaca). Estos factores no influyeron cuando los pacientes realizaron la carga total del miembro sin asistencia.
Un paciente tuvo una recidiva del proceso infeccioso 12 meses luego de la consolidación. Fue tratado con retiro del CEM, fresado, limpieza quirúrgica y CEM con antibiótico, antibioticoterapia por vía endovenosa, con lo que se logró la remisión de la osteomielitis.
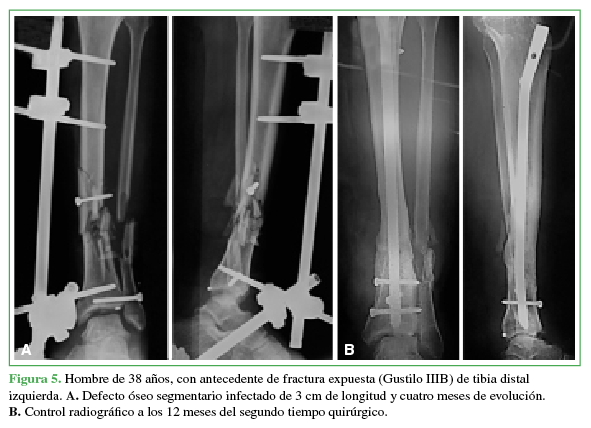
A. Defecto óseo segmentario infectado de 3 cm de longitud y cuatro meses de evolución. B. Control radiográfico a los 12 meses del segundo tiempo quirúrgico.
PropiaDiscusión
El tratamiento de los DOS es desafiante, complejo y continúa siendo objeto de debate. Tradicionalmente requería de cirujanos altamente entrenados en técnicas microquirúrgicas, una infraestructura quirúrgica de alta complejidad y también de pacientes colaboradores y tolerantes a tratamientos prolongados y tediosos, como las técnicas de callotasis.
La técnica de la membrana inducida desarrollada por Masquelet ofrece una alternativa terapéutica novedosa, simple y eficaz para la reconstrucción ósea. Originalmente fue descrita para rellenar defectos óseos postraumáticos infectados. Masquelet tardó 16 años en publicar su técnica, ya que los hallazgos accidentales y los excelentes resultados en su serie de pacientes infectados lo llevaron a profundizar el estudio de los procesos histopatológicos de la membrana, hasta comprender el fundamento de los resultados obtenidos.5,12 En la actualidad, encontramos referencias bibliográficas justificando su uso en defectos óseos no infectados,17 reconstrucciones oncológicas19-21 y defectos congénitos.21,22
La formación de granulomas como respuesta a un cuerpo extraño es una parte esencial de la cicatrización tisular. Se producen como consecuencia de la lesión causada por un material extraño en una zona vascularizada.23 El primer estadio es la fase inflamatoria, en torno al hematoma y los detritus del cuerpo extraño, que estimulan la regeneración tisular y la maduración del tejido de granulación hacia una membrana biológica con potencial de proliferación hacia tejido fibroso denso, óseo o cualquier otra línea mesenquimática, culminando por el englobado del cuerpo extraño.23
Esta membrana inducida por el espaciador de cemento es una estructura ricamente vascularizada, formada por colágeno tipo I, una densa matriz extracelular con células fibroblásticas, macrófagos y una alta concentración de factores de crecimiento, como factor de crecimiento del endotelio vascular, factor de crecimiento transformante beta 1 y proteína morfogénica ósea-2, los cuales poseerían la capacidad de diferenciar células estromales mesenquimáticas en un linaje celular específico, a la vez que aumentan la neovascularización circundante.4,5,13,15,18,24 También se encontraron niveles incrementados de factor alfa1, un factor crítico de desarrollo celular osteoblástico, en las células fibroblásticas de la membrana.5,25 Producto de este microambiente biológico favorable es que se potencian la neovascularización, la diferenciación celular a una estirpe ósea y la incorporación y corticalización precoces de la columna de injerto.23
A su vez, se le adjudican a la membrana funciones mecánicas, ya que previene la reabsorción del injerto, la interposición de partes blandas a nivel del defecto óseo, y sirve como una barrera que evita la difusión de factores de crecimiento y factores osteoinductores.5,16,24,26 Woon y cols. postularon que la membrana es impermeable, hipervascularizada y tiene un espesor de 0,5-1 mm.27 Taylor y cols., por otra parte, afirman que, a la sexta semana, la membrana tiene 1-2 mm de espesor, es hipervascularizada y no presenta adherencias con el espaciador subyacente.5 Cabe destacar que, en caso de realizar la fijación con CEM en el primer tiempo, se forma una segunda membrana entre el clavo y el espaciador. Consideramos que esta debe ser conservada para maximizar el potencial de consolidación.
El espaciador, además de las funciones ya mencionadas, cuenta con la ventaja adicional de poder ser construido con una dosis elevada de antibióticos, que permite la liberación gradual de los agentes al tejido circundante, obteniendo concentraciones tisulares de antibiótico que superan varias veces la concentración inhibitoria mínima, sin elevar los niveles sistémicos de antibiótico y sin efectos tóxicos sistémicos.5,23 Los antibióticos que suelen usarse son gentamicina, tobramicina, vancomicina y otras cefalosporinas.28-30 No se recomiendan más de 8 g de antibiótico cada 40 g de PMMA, ya que las propiedades del cemento se alteran dificultando su fraguado y moldeado.31
Karger, Masquelet y Begue postulan que el injerto óseo autólogo molido de cresta ilíaca por sus propiedades osteoconductivas, osteoinductivas y osteogénicas es el patrón de referencia.12,14,16 Recomiendan utilizar chips de no más de 1-2 mm³.16 Afirman que utilizando ambas crestas se puede obtener injerto como para defectos de hasta 15-20 cm;8,14,16,32 sin embargo, si es insuficiente, existe la posibilidad de recurrir a sustituto óseo o aloinjerto molido de banco de tejidos, sin superar una proporción 1:3.5,12,16 Sin embargo, esta proporción se determina de forma netamente empírica, no hay estudios que la avalen. Incluso existen registros bibliográficos en los que se han obtenido buenos resultados con una proporción 1:1.14 En nuestro caso, con una muestra heterogénea en cuanto a la elección del injerto utilizado, creemos que obtuvimos una consolidación completa en todos los pacientes, debido a que la fortaleza de este procedimiento no depende estrictamente del autoinjerto molido de cresta ilíaca.
El IRO, según Gouron y cols., muestra que la técnica es exitosa en la reconstrucción de defectos óseos de un tercio de la longitud, en aquellos casos con mayor extensión, utilizan, de forma empírica, una tabla de cortical como aloinjerto. De esta manera, pretenden aumentar la estabilidad y el volumen de la columna de injerto.22 Masquelet, sin embargo, afirma que se puede usar su técnica en defectos óseos de hasta 25 cm, sin necesidad de injertos estructurales.12,13En nuestra serie, se utilizó injerto estructural en dos pacientes con un DOS >30% de la longitud del hueso afectado.
Otro de los aspectos sin consenso bibliográfico es el intervalo entre los dos tiempos quirúrgicos. Empíricamente se describió como óptimo un intervalo de 6-8 semanas, fundamentando esto con hallazgos histopatológicos en animales.5,12,16,24 Aho y cols. mostraron que la vascularización de la membrana es máxima a la cuarta semana y desciende a menos del 60% al tercer mes.23 Las muestras a la cuarta semana tienen también la máxima expresión de factor de crecimiento vascular endotelial, interleucina-6, colágeno tipo I, mientras que, al segundo mes, estos valores son inferiores al 40% de la concentración.23 Pelissier y cols. estudiaron la técnica en conejos y hallaron un pico de proteína morfogénica ósea-2 a la cuarta semana de implantación del espaciador, seguido de una declinación gradual.15 Al sexto mes de la cirugía, ya no se observa ninguna reacción inflamatoria; de esta forma, se pierden las ventajas biológicas teóricas de la membrana inducida.5,33,34
Siguiendo los hallazgos de Pelissier y Aho, el momento óptimo para el segundo tiempo de la técnica de Masquelet es la cuarta semana; no obstante, los resultados siguen siendo exitosos con un intervalo mayor.22 Donegan y cols. obtuvieron una tasa de consolidación del 90% cuando efectuaron la segunda etapa, en promedio, a los 58 días (rango 32-92).35 Tratándose nuestra serie de DOS infectados, el intervalo hasta la curación clínica y humoral del proceso infeccioso suele tomar no menos de seis semanas y, según nuestra experiencia, los resultados operando en promedio a la novena semana siguen siendo satisfactorios. En concordancia con los hallazgos de Donegan y cols., en un paciente, se registró un intervalo de 20 semanas (por motivos no médicos), en el cual se logró una consolidación similar a la del resto de los pacientes de esta serie.
La descripción inicial de la técnica preconiza el tutor externo como método de estabilización y la Société Française de Chirurgie Orthopédique et Traumatologie (SoFCOT) lo prefiere para tratar seudoartrosis infectadas.14 Sin embargo, existen otras alternativas válidas y, en nuestra serie, avalados por la bibliografía, utilizamos un CEM, en 20 pacientes, como método de fijación, y obtuvimos una consolidación del 100%, con solo un caso de recidiva del cuadro séptico una vez lograda la consolidación. Creemos que se debió a una extensión del proceso infeccioso mayor que el DOS, no atribuimos la recidiva al uso de CEM. Stafford y Noris corroboran nuestros resultados y afirman que, en caso de utilizar un CEM en el primer tiempo, se han registrado excelentes resultados manteniendo el clavo original en el segundo tiempo.17
Con respecto al análisis focalizado en la longitud del defecto óseo, observamos, al igual que la SoFCOT, que no parece condicionar el tiempo de consolidación,12,14,23 ni la tasa de seudoartrosis,14 así como tampoco el tiempo requerido para realizar la carga total del miembro.23 La técnica de Masquelet se ha empleado en defectos óseos >20 cm con éxito,5 en nuestro caso, observamos esta misma tendencia, ya que la evolución de nuestro DOS de mayor magnitud fue comparable a la de los defectos de menor envergadura.
Las tasas reportadas en la bibliografía mencionan una tasa de consolidación del 82% al 100%.4 En 2000, Masquelet y cols. reportaron la primera serie de 35 pacientes con una tasa de consolidación del 100% en defectos de hasta 25 cm.12 Stafford y Norris obtuvieron una tasa de consolidación del 90% en 27 casos, con la variante de haber utilizado injerto de fémur obtenido con el sistema RIA.7 McCall y cols. lograron una tasa de consolidación del 85% con la misma técnica.36 Apard y cols. comunicaron una tasa de consolidación del 90,9% en 12 pacientes utilizando CEM como método de fijación, y permitiendo una carga total del miembro a los cuatro meses de la segunda etapa.37 En 2012, Karger y cols. publicaron, en conjunto con la SoFCOT, la serie más grande hasta la fecha, de 84 pacientes con DOS >5 cm, y obtuvieron una tasa de consolidación del 90%, a los 14.4 meses de la primera etapa del tratamiento.14 Gouron y cols., por otra parte, describen un 35% de seudoartrosis en reconstrucciones pediátricas y atribuyen los fallos a errores de la técnica y a la curva de aprendizaje,22 no se observó este suceso en el resto de las series evaluadas. En nuestra serie, obtuvimos resultados comparables con los de la bibliografía internacional, se logró la consolidación en los 24 pacientes del grupo, sin variaciones entre los pacientes tratados con injerto de cresta ilíaca o con el sistema RIA, tampoco hubo diferencias entre aquellos con autoinjerto puro y con aloinjerto o sustituto óseo.
Se identifica como fortaleza del trabajo ser el primero de su tipo a nivel nacional, su carácter multicéntrico (3 centros de trauma de alta complejidad de la Ciudad Autónoma de Buenos Aires), sobre una patología con escaso número de publicaciones internacionales. Las debilidades se centran en su carácter retrospectivo, el bajo número de pacientes y la heterogeneidad de las variables en estudio. Sin embargo, consideramos prometedor el futuro análisis de las variables, ya que logramos resultados satisfactorios en todos los escenarios afrontados. Consideramos necesario prolongar este estudio incorporando un mayor número de casos para, de esta forma, obtener hallazgos que permitan lograr un consenso terapéutico aún no alcanzado en la literatura internacional.
Bibliografía
1. Ronga M, Ferraro S, Fagetti A, Cherubino M, Valdatta L, Cherubino P. Masquelet technique for the treatment of a severe acute tibial bone loss. Injury 2014;45:111-5. https://doi.org/10.1016/j.injury.2014.10.033
2. DeCoster TA, Gehlert RJ, Mikola EA, Pirela-Cruz MA. Management of posttraumatic segmental bone defects. J Am Acad Orthop Surg 2004;12:28-38. https://insights.ovid.com/pubmed?pmid=14753795
3. Obremskey WT, Molina CS, Collinge C, Tornetta P, Sagi C, Schmidt A, et al. Current practice in the management of segmental bone defects among orthopaedic trauma surgeons. J Orthop Trauma 2013;28:203-7. https://doi. org/10.1097/BOT.0000000000000034
4. Giannoudis PV, Faour O, Goff T, Kanakaris N, Dimitriou R. Masquelet technique for the treatment of bone defects: Tips-tricks and future directions. Injury 2011;42:591-8. https://doi.org/10.1016/j.injury.2011.03.036
5. Taylor BC, French BG, Fowler TT, Russell J, Poka A. Induced membrane technique for reconstruction to manage bone loss. J Am Acad Orthop Surg 2012;20:142-50. https://doi.org/10.5435/JAAOS-20-03-142
6. Mitchell SE, Keating JF, Robinson CM. The treatment of open femoral fractures with bone loss. J Bone Joint Surg Br 2010;92:1678-84. https://doi.org/10.1302/0301-620X.92B12.25190
7. Gaskill TR, Urbaniak JR, Aldridge JM. Free vascularized fibular transfer for femoral head osteonecrosis: donor and graft site morbidity. J Bone Joint Surg Am 2009;91:861-7. https://doi.org/10.2106/JBJS.H.01105
8. Myeroff C, Archdeancon M. Autogenous bone graft: donor sites and techniques. J Bone Joint Surg Am 2011;93:222-7. https://doi.org/10.2106/JBJS.J.01513
9. Khan SN, Cammisa FP, Jr, Sandhu HS, Diwan AD, Girardi FP, Lane JM. The biology of bone grafts. J Am Acad Orthop Surg 2003;26:923-4. https://doi.org/10.5435/00124635-200501000-00010
10. Cattaneo R, Catagni M, Johnson EE. The treatment of infected nonunions and segmental defects of the tibia by the methods of Ilizarov. Clin Orthop Relat Res 1992;280:143-52. https://doi.org/10.1097/00003086-199207000-00017
11. Pelissier P, Casoli V, Demiri E, Martin D, Baudet J. Soleus-fibula free transfer in lower limb reconstruction. Plast Reconstr Surg 2000;105:567-73. https://doi.org/10.1097/00006534-200002000-00014
12. Masquelet AC, Fitoussi F, Begue T, Muller GP. [Reconstruction of the long bones by the induced membrane and spongy autograft]. Ann Chir Plast Esthet 2000;45:346-53
13. Micev AJ, Kalainov DM, Soneru AP. Masquelet technique for treatment of segmental bone loss in the upper extremity. J Hand Surg Am 2015;40:593-8. https://doi.org/10.1016/j.jhsa.2014.12.007
14. Karger C, Kishi T, Schneider L, Fitoussi F, Masquelet AC. Treatment of posttraumatic bone defects by the induced membrane technique. Orthop Traumatol Surg Res 2012;98:97-102. https://doi.org/10.1016/j.otsr.2011.11.001
15. Pelissier P, Masquelet AC, Bareille R, Mathoulin Pelissier S, Amedee J. Induced membranes secrete growth factors including vascular and osteoinductive factors and could stimulate bone regeneration. J Orthop Res 2004;22:73-9. https://doi.org/10.1016/S0736-0266(03)00165-7
16. Masquelet AC, Begue T. The concept of induced membrane for reconstruction of long bone defects. Orthop Clin North Am 2010;41:27-37. https://doi.org/10.1016/j.ocl.2009.07.011
17. Stafford PR, Norris BL. Reamer-irrigator-aspirator bone graft and bi Masquelet technique for segmental bone defect nonunions: A review of 25 cases. Injury 2010;41:S72-7. https://doi.org/10.1016/S0020-1383(10)70014-0
18. Bosemark P, Perdikouri C, Pelkonen M, Isaksson H, Tägil M. The Masquelet induced membrane technique with BMP and a synthetic scaffold can heal a rat femoral critical size defect. J Orthop Res 2015;33:488-95. https://doi. org/10.1002/jor.22815
19. Biau DJ, Pannier S, Masquelet AC, Glorion C. Case report: Reconstruction of a 16-cm diaphyseal defect after ewing’s resection in a child. Clin Orthop Relat Res 2009;467:572-7. https://doi.org/10.1007/s11999-008-0605-9
20. Fitoussi F, Ilharreborde B. Is the induced-membrane technique successful for limb reconstruction after resecting large bone tumors in children? Clin Orthop Relat Res 2015;473(6):2067-75. https://doi.org/10.1007/s11999-015-4164-6
21. Amouyel T, Deroussen F, Plancq M-C, Collet L-M, Gouron R. Successful treatment of humeral giant aneurysmal bone cyst: value of the induced membrane reconstruction technique. J Shoulder Elb Surg 2014;23:212-6. https://doi. org/10.1016/j.jse.2014.05.028
22. Gouron R, Deroussen F, Plancq MC, Collet LM. Bone defect reconstruction in children using the induced membrane technique: A series of 14 cases. Orthop Traumatol Surg Res 2013;99:837-43. https://doi.org/10.1016/j. otsr.2013.05.005
23. Aho OM, Lehenkari P, Ristiniemi J, Lehtonen S, Risteli J, Leskelä HV. The mechanism of action of induced membranes in bone repair. J Bone Joint Surg Am 2013;95:597-604. https://doi.org/10.2106/JBJS.L.00310
24. Ren L, Kang Y, Browne C, Bishop J, Yang Y. Fabrication, vascularization and osteogenic properties of a novel synthetic biomimetic induced membrane for the treatment of large bone defects. Bone 2014;64:173-82. https://doi. org/10.1016/j.bone.2014.04.011
25. Viateau V, Guillemin G, Yang YC, Bensaïd W, Reviron T, Oudina K, et al. A technique for creating critical-size defects in the metatarsus of sheep for use in investigation of healing of long-bone defects. Am J Vet Res 2004;65:1653-7. https://doi.org/10.2460/ajvr.2004.65.1653
26. Wong TM, Lau TW, Li X, Fang C, Yeung K, Leung F. Masquelet technique for treatment of posttraumatic bone defects. Sci World J 2014;2014:1-5. https://doi.org/10.1155/2014/710302. eCollection 2014
27. Woon CY-L, Chong K-W, Wong M-K. Induced membranes—A staged technique of bone-grafting for segmental bone loss. A report of two cases and a literature review. J Bone Joint Surg Am 2010;92:196-201. https://doi. org/10.2106/JBJS.I.00273
28. Joseph TN, Chen AL, Di Cesare PE, Cesare PE Di, Lindskog DM, Baumgaertner MR. Use of antibiotic-impregnated cement in total joint arthroplasty unstable intertrochanteric hip fractures in the elderly. J Am Acad Orthop Surg 2003;11:38-47. https://doi.org/10.5435/00124635-200301000-00006
29. Jaeblon T. Polymethylmethacrylate: properties and contemporary uses in orthopaedics. J Am Acad Orthop Surg 2010;18(5):297-305. https://doi.org/10.5435/00124635-201005000-00006
30. Kuehn K-D, Ege W, Gopp U. Acrylic bone cements: mechanical and physical properties. Orthop Clin North Am 2005;36:29-39. https://doi.org/10.1016/j.ocl.2004.06.011
31. Hsieh P-H, Shih C-H, Chang Y-H, Lee MS, Shih H-N, Yang W-E. Two-stage revision hip arthroplasty for infection: comparison between the interim use of antibiotic-loaded cement beads and a spacer prosthesis. J Bone Joint Surg Am 2004;86(9):1989-97. https://insights.ovid.com/pubmed?pmid=15342762
32. Masquelet AC, Obert L. La technique de la membrane induite pour les pertes de substance osseuse de la main et du poignet. Chir Main 2010;29:221-4. https://doi.org/10.1016/j.main.2010.10.007
33. Viateau V, Guillemin G, Calando Y, Logeart D, Oudina K, Sedel L, et al. Induction of a barrier membrane to facilitate reconstruction of massive segmental diaphyseal bone defects: An ovine model. Vet Surg 2006;35:445-52. https://doi.org/10.1111/j.1532-950X.2006.00173.x
34. Viateau V, Guillemin G, Bousson V, Oudina K, Hannouche D, Sedel L, et al. Long-bone critical-size defects treated with tissue-engineered grafts: A study on sheep. J Orthop Res 2007;25(6):741-9. https://doi.org/10.1002/jor.20352
35. Donegan DJ, Scolaro J, Matuszewski PE, Mehta S. Staged bone grafting following placement of an antibiotic spacer block for the management of segmental long bone defects. Orthopedics 2011;19104:730-5. https://doi. org/10.3928/01477447-20110922-16
36. McCall TA, Brokaw DS, Jelen BA, Scheid DK, Scharfenberger AV, Maar DC, et al. Treatment of large segmental bone defects with reamer-irrigator-aspirator bone graft: technique and case series. Orthop Clin North Am 2010;41(1):63-73. https://doi.org/10.1016/j.ocl.2009.08.002
37. Apard T, Bigorre N, Cronier P, Duteille F, Bizot P, Massin P. Two-stage reconstruction of post-traumatic segmental tibia bone loss with nailing. Orthop Traumatol Surg Res 2010;96(5):549-53. https://doi.org/10.1016/j. otsr.2010.02.010
Información adicional
Cómo citar este artículo: Pesciallo C, Garabano G,
Montero Vinces A, Gómez DJ, Bidolegui F, Cid Casteulani A. Defectos óseos
segmentarios infectados en huesos largos: tratamiento con técnica de Masquelet. Rev Asoc Argent Ortop Traumatol 2019;84(1):15-26. http://dx.doi.org/10.15417/issn.1852-7434.2019.84.1.853