Resumen: Introducción: El ácido hialurónico intrarticular se suele utilizar con diferentes esquemas para tratar la artrosis de rodilla. Nuestro objetivo fue analizar la eficacia y el uso del ácido hialurónico intrarticular en la práctica habitual. Materiales y Métodos: Cohorte retrospectiva observacional. Se evaluó a 1227 pacientes con artrosis de rodilla tratados con ácido hialurónico intrarticular 20 mg/2 ml/semana (76%, 20 mg) y 40 mg/2 ml (24%, 40 mg) según la práctica habitual. Seguimiento de 6 meses. Se evaluó la eficacia con la escala de Likert de 5 puntos y la proporción de respuesta ≥50%. Resultados: La mediana de aplicaciones fue de 5 (20 mg) y 3 (40 mg). El puntaje de Likert mejoró significativamente en ambos grupos a los 6 meses. La mediana del puntaje mejoró de 4 (media 3,77 ± 0,69) al inicio a 2 (media 1,99 ± 0,76) a los 6 meses con 20 mg (p <0,001) y de 4 (media 3,65 ± 0,65) a 2 (media 1,86 ± 0,72) con 40 mg (p <0,001). La proporción de respuesta ≥50% a los 6 meses fue del 61% y 66%, respectivamente. En el análisis multivariado, la tasa de respuesta ≥50% se asoció con un mayor puntaje inicial, edad más joven y menor duración de la enfermedad. Solo un paciente con 20 mg (0,1%) tuvo un episodio adverso serio (artritis séptica). Conclusión: Nuestro estudio en la práctica clínica común respalda la efectividad del ácido hialurónico intrarticular para tratar la artrosis de rodilla, con un beneficio clínico a los 6 meses de seguimiento.
Palabras clave:Intrarticular, ácido hialurónico, rodilla, artrosis, osteoartritis.
Abstract: Background: Treatment of knee osteoarthritis with intra-articular hyaluronic acid (IA-HA) is frequently used in Argentina, with diffe-rent dosing forms and injection regimens. Our main objective was to provide real world data on the use and effectiveness of IA-HA. Methods: In this observational retrospective cohort study we studied 1227 patients with knee osteoarthritis treated with IA-HA 20 mg/2 ml weekly (76%-20 mg group) and 40 mg/2 ml (24%-40 mg group) according to standard practice. Follow-up was 6 months and effectiveness was assessed by the 5-point Likert scale and a response of 50% or more. Results: Median number of injections was 5 (20 mg) and 3 (40 mg). Both groups had a significant improvement in the Likert scale from baseline to 6 months. Median sco-re improved from 4 (mean 3.77 ± 0.69) at baseline to a median of 2 (mean 1.99 ± 0.76) at 6 months (20 mg group, p<0.001) and from a median of 4 (mean 3.65 ± 0.65) to a median of 2 (mean 1.86 ± 0.72) in the 40 mg group, p<0.001. The percentages of patients with a response of 50% or more at 6 months were 61% and 66%, respectively. In the multivariate analysis, the 50% response rate was associated with a higher baseline score, younger age and shorter duration of disease. Only one patient in the 20 mg group (0.1%) experienced a serious treatment-related adverse event (septic arthritis) following injection. Conclusion: Our study carried out during routine clinical practice supports the effectiveness of IA-HA for the management of knee osteoarthritis with a clinical advantage observed at a 6-month follow-up.
Keywords: Intra-articular, hyaluronic acid, knee, arthrosis, osteoarthritis.
Investigación clínica
Registro de ácido hialurónico intrarticular en el tratamiento de la artrosis de rodilla, en la Argentina
Registry of intra-articular hyaluronic acid for the treatment of knee osteoarthritis in Argentina
Recepción: 20 Abril 2018
Aprobación: 17 Diciembre 2018
La artrosis es la afección más común de las articulaciones sinoviales, tiene una prevalencia creciente en paralelo al envejecimiento de la población, que produce una morbilidad significativa.1-3 La enfermedad se caracteriza por lesiones focales erosivas, destrucción del cartílago, esclerosis subcondral, formación de grandes quistes y osteofitos.1-3 El 10% de los hombres y el 13% de las mujeres de 60 años o más sufren artrosis de rodilla sintomática que produce dolor, deformidad, aumento del tamaño articular, pérdida de la estabilidad y movilidad limitada.1-3 Las estrategias de tratamiento con-servador son de tipo sintomático e incluyen antinflamatorios no esteroides, fármacos de acción lenta para la osteoartritis (symptomatic slow-acting drugs for osteoarthritis, SYSADOA), terapia física e inyecciones intrarticulares (IA) de corticoides o ácido hialurónico (AH).1-3 El AH es un componente natural del líquido sinovial que actúa como lubricante durante el estrés cizallante (“shear stress”) y como un amortiguador durante el esfuerzo de compresión.4,5 A nivel molecular, el AH disminuye la expresión de diversas citocinas, inclusive la interleucina 1ß, menor liberación de metalopro-teinasas de la matriz (MMP-1 y MMP-9), con los consiguientes efectos anti-nociceptivo y antinflamatorio, y la potencial modificación de la enfermedad a través de la preservación y restauración de la matriz extracelular.5,6
Luego de la administración IA, el AH se distribuye rápidamente en la membrana sinovial con concentraciones más altas en el líquido sinovial y la cápsula articular, seguido, en orden decreciente, por la membrana sinovial, los ligamentos y el músculo adyacente, donde permanece durante días y semanas contribuyendo a un efecto más prolongado después de su aplicación.7
El tratamiento IA con AH está aprobado y se usa con frecuencia en la Argentina, Estados Unidos, Europa y en muchos otros países para tratar la artrosis de rodilla. En la Argentina, el AH se prescribe en diferentes dosis y regímenes de inyección, que varían desde una dosis menor (20 mg/2 ml) hasta dosis más altas (40 mg/2 ml) por cada aplicación. La frecuencia de administración de estas dosis difiere y puede ser de inyecciones semanales de dosis más bajas (20 mg) durante cinco semanas a dosis más altas (40 mg) con intervalos más espaciados, según la práctica habitual de cada médico. El uso de medicamentos en la práctica clínica habitual, a menudo, difiere del escenario ideal de los ensayos clínicos controlados. Existe un interés creciente en llevar a cabo estudios observacionales que reflejen la práctica clínica habitual y permitan entender cómo se están utilizando los fármacos y cuál es la efectividad en el mundo real, lo que nos ha motivado a emprender el presente estudio.
Se trata de un subestudio del registro observacional (cohorte no intervencionista) MAX-ARG-13-01 de pacientes tratados con AH-IA (MaxiOstenil®/Ostenil®, TRB Pharma, Argentina) realizado en la Argentina, en el contexto de la práctica clínica habitual de ortopedia/reumatología y financiado por TRB Pharma en Argentina. Este registro incluyó a 1402 pacientes con diagnóstico de artrosis (de cualquier localización) que recibieron AH-IA entre enero de 2012 y diciembre de 2015, con una visita de seguimiento a los seis meses documentada en la historia clínica. Los pacientes que estaban participando en cualquier estudio experimental fueron excluidos del registro. Este sub-estudio incluye el subgrupo de 1227 pacientes con artrosis de rodilla que contaban con una evaluación completa inicial y un seguimiento documentado seis meses luego de iniciar el tratamiento. De los 1227 pacientes con artrosis de rodilla incluidos en el estudio, 953 (76%) fueron tratados con AH-IA 20 mg/semana y 274 (24%), con 40 mg, a diferentes intervalos de frecuencia, según la práctica habitual de cada médico. Este registro se basó en la recolección de datos secundarios obtenidos por análisis retrospectivo de las historias clínicas de aproximadamente 400 especialistas en ortopedia y reumatología de las principales ciudades de la Argentina.
El objetivo principal fue estudiar las diferencias en el patrón de uso (características de la población, frecuencia y número de inyecciones) de la dosis de 20 mg/2 ml (MaxiOstenil®/Ostenil®) en relación con la dosis de 40 mg/2 ml (MaxiOstenil Plus®/OstenilPlus®) de AH-IA, en la práctica clínica habitual. El objetivo secundario fue analizar la eficacia y la seguridad de las dosis de 20 mg y 40 mg de AH-IA a los seis meses de tratamiento. La eficacia fue evaluada por los investigadores antes de iniciar el tratamiento (basal) y a los seis meses, mediante una escala de tipo Likert de 5 puntos, con la cual se valoraron el dolor y la limitación funcional (puntajes de 1 = asintomáti-co a 5 = muy severo) y también por la proporción de pacientes con una respuesta del 50% o más en la escala de Likert. Los pacientes recibieron AH-IA 20 mg/semana (grupo de 20 mg) o 40 mg administrados de acuerdo con los intervalos de la práctica habitual de cada médico (grupo de 40 mg). La seguridad se evaluó mediante la revisión de los episodios adversos relacionados con el tratamiento registrados en la historia clínica de los pacientes.
El estudio (MAX-ARG-13-01) fue aprobado por un comité central de ética independiente y se realizó según las buenas prácticas de farmacoepidemiología y las regulaciones locales de nuestro país para investigación clínica observacional (resolución 1480/10 del Ministerio de Salud de Argentina) y de conformidad con la Declaración de Helsinki.
Todas las variables continuas se resumieron como media y desviación estándar o mediana y cuartil (Q1-Q3), según la distribución. Las variables categóricas se resumieron utilizando el recuento de pacientes, porcentajes e intervalos de confianza del 95% (IC95%) donde aplicase. Para la comparación de los grupos que recibieron 20 mg y 40 mg de AH-IA, se utilizó la prueba adecuada paramétrica o no paramétrica, según la distribución de las variables cuantitativas y de ji al cuadrado o la prueba exacta de Fisher (según corresponda) para las variables categóricas. Los factores predictivos del 50% o más de respuesta se estudiaron mediante el análisis de regresión logística (modelo lineal generalizado, familia binomial) con el cálculo del cociente de posibilidades (odds ratio, OR), si correspondía. La significancia estadística se consideró en p <0,05.
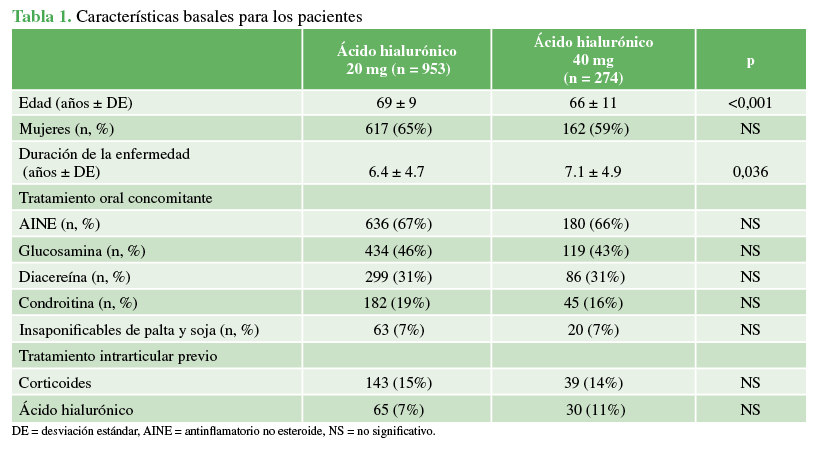
Los pacientes de ambos grupos tenían características basales similares con la particularidad de mayor edad (69±9 años y 66 ± 11 años, p <0,001) y menor duración de la enfermedad (6.4 ± 4.7 y 7.13 ± 4.9 años, p 0,036) en el grupo de 20 mg en relación con el grupo de 40 mg. No se observaron diferencias en el sexo, el tratamiento concomitante oral o IA previo (Tabla 1).
Tal como se definió en el protocolo de registro, todos los pacientes tratados con 20 mg recibieron inyecciones semanales. Los del grupo de 40 mg recibieron inyecciones con diferente frecuencia, según la práctica habitual de cada médico: semanal (23%), cada dos semanas (23%), mensual (36%) y otra frecuencia (18%). La cantidad total de inyecciones también difirió en ambos grupos. Los pacientes tratados con 20 mg/semana recibieron más inyecciones (5,7 ± 3,1 inyecciones; mediana 5; Q1-Q3: 5-5) que los del grupo de 40 mg (3,7 ± 2,1 inyecciones; mediana 3; Q1-Q3: 3-4) (p <0,01).
El investigador evaluó la eficacia mediante el cambio en la escala de Likert de 5 puntos para dolor y deterioro funcional, antes de comenzar el tratamiento (basal) y seis meses después. La mediana de la escala de Likert mejoró significativamente desde el inicio hasta los seis meses, en ambos grupos de tratamiento: 20 mg (mediana 4; media 3,77 ± 0,69 y mediana 2; media 1,99 ± 0,76, respectivamente, p <0,001); 40 mg (mediana 4; media 3,65 ± 0,65 y mediana 2, media 1,86 ± 0,72, respectivamente, p <0,001) (Tabla 2). No hubo diferencia entre ambos grupos en la proporción de pacientes que tenían una mejoría del 50% o más a los seis meses en la escala de síntomas. En el grupo de 20 mg, el 61% (IC95% 58-64) tuvo una mejoría del 50% o más en la escala de síntomas a los seis meses comparado con el 66% (IC95% 60-71) del grupo de 40 mg (p 0,159).
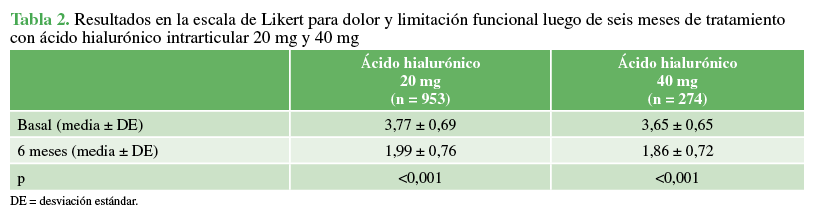
Resultados en la escala de Likert para dolor y limitación funcional luego de 6 meses de tratamiento con ácido hialurónico intrarticular 20 mg y 40 mg.
PropiaLos pacientes que lograron una mejoría del 50% o más eran más jóvenes (68 ± 10 años frente a 70 ± 9 años, p <0,001), tenían una enfermedad de evolución más corta (6 ± 5 años frente a 7 ± 5, p <0,001) y un puntaje basal más alto en la escala de Likert (mediana 4 y 3, p <0,001) que los no respondedores. Los pacientes que experimentaron una mejoría del 50% o más no mostraron diferencias en la frecuencia de indicación de la dosis más alta (24% y 20%, p 0,18) y en el número de inyecciones de AH-IA (5,2 ± 2,6 y 5,2 ± 3,2 aplicaciones, p 0,53) en relación con el grupo no respondedor.
Mediante regresión logística, se estudió la asociación potencial de una respuesta del 50% o más con edad avanzada, duración de la enfermedad, puntaje basal en la escala de Likert, tipo de tratamiento con AH (20 mg o 40 mg) y el número de aplicaciones. El análisis mostró que el puntaje basal de Likert (OR 2,41; IC95% 1,98-2,95, p<0,001) fue un factor predictivo independiente de la respuesta. También se encontraron asociaciones negativas débiles, aunque significativas, de la respuesta del 50% o más con la edad (OR 0,96; IC95% 0,95-0,98, p<0,001) y la duración de la enfermedad (OR 0,95; IC95% 0,92-0,97, p <0,001), con una tendencia no significativa hacia una mayor respuesta en el grupo tratado con 40 mg (OR 1,31; IC95% 0,97-1,77, p 0,07). En la regresión logística, no se halló una asociación independiente con el número de aplicaciones de AH-IA.
La valoración de la mejoría general del paciente después de seis meses de tratamiento también fue evaluada mediante una escala de Likert de 5 puntos (de 1 = sin mejoría a 5 = muy buena mejoría). La mejoría general buena o muy buena (4/5 o 5/5 en la escala de Likert) fue del 75% (IC95% 72-77%) en el grupo de 20 mg y del 81% (IC95% 77-86) en el grupo de 40 mg.
Los episodios adversos más frecuentes registrados relacionados con el tratamiento fueron: reacciones de grado leve o moderado en el sitio de la inyección (11/953, 1,2%) en el grupo de 20 mg y 1/274 (0,36%) en el otro grupo. El único episodio adverso serio relacionado con la aplicación del tratamiento fue un caso de artritis séptica (1/953, 0,1%) en el grupo de 20 mg.
La artrosis de rodilla es un problema clínico creciente en nuestra práctica que aumenta en paralelo con el enve-jecimiento de la población.1-3 Las características de nuestra población de estudio fueron: pacientes de edad avanzada, predominio del sexo femenino y proporción elevada del tratamiento concomitante con antinflamatorios no esteroides y SYSADOA (en ambos grupos, 20 mg y 40 mg), representativas de la población esperada en la práctica clínica habitual. El AH-IA se administra, a menudo, a pacientes sintomáticos con enfermedad moderada que no responden al tratamiento oral inicial.1-3
Las dosis más bajas semanales (20 mg) fueron la forma más frecuente (76%) de administrar el AH-IA en este estudio, lo que refleja la práctica habitual en nuestro país. La eficacia evaluada seis meses después del tratamiento mostró una mejoría significativa en la escala de Likert para ambos grupos de 20 mg y 40 mg: el 61% y el 66%, respectivamente, tuvieron una mejoría del 50% o más con respecto al inicio del tratamiento. Los resultados muestran un efecto clínicamente relevante que es consistente con los resultados obtenidos por ensayos controlados aleatorizados y varios metanálisis.8-14 Los estudios incluidos en los metanálisis tienen diferentes períodos de seguimiento (desde un día de la última inyección hasta el año) y diversos tipos de rama de control (placebo, corticoides IA y antinflamatorios no esteroides). Los análisis combinados de los efectos del AH comparado con el placebo respaldan la eficacia del AH para tratar la artrosis de rodilla, con efectos beneficiosos sobre el dolor, la función y la evaluación global del paciente. El beneficio se observó en diferentes períodos, pero especialmente a las 5-13 semanas de la inyección y, en menor medida, a las 14-26 semanas.8-14
En nuestro estudio, los pacientes tratados con la dosis semanal más baja (20 mg) recibieron significativamente más inyecciones (mediana 5) que aquellos tratados con la dosis más alta (40 mg) (mediana 3, p <0,001) que se aplicó a diferentes intervalos de acuerdo con la práctica habitual del médico. El puntaje de Likert basal fue el factor predictivo independiente más importante de la respuesta (OR 2,14) posiblemente relacionado con una regresión a la media en pacientes con artrosis de rodilla de grado moderado. La edad más joven y la menor duración de la enfermedad también se asociaron independientemente con la respuesta. Estos resultados son compatibles con los de otros estudios que han demostrado que la edad más joven y la enfermedad moderada (grado Kellgren-Lawrence 2) son factores pronósticos favorables asociados a la respuesta al tratamiento.15,16
El efecto del tratamiento con diferentes dosis y tipos de AH es controvertido y materia de investigación actual. En el análisis de regresión, no se hallaron diferencias significativas en la tasa de respuesta según la dosis (20 o 40 mg), solo se observó una tendencia hacia más beneficio en el grupo con la dosis más alta. Tampoco se encontraron diferencias en la respuesta según el número de aplicaciones de AH-IA después de controlar por otras variables (edad, duración de la enfermedad y puntaje inicial). La tendencia hacia una mayor respuesta en el grupo de dosis alta puede tener relevancia clínica y merece una investigación en ensayos prospectivos controlados con un seguimiento de tres y seis meses.
La evidencia de los metanálisis sugiere que existe una considerable heterogeneidad en la respuesta clínica que puede deberse a los efectos terapéuticos diferenciales de diversos productos de AH, las estrategias de dosificación y el diseño del estudio.17-19 Un estudio controlado de dosis única reciente ha demostrado una reducción mayor en el puntaje de dolor medido por una escala analógica visual y una mejoría en el puntaje de rigidez del WOMAC a los seis meses, con dosis altas de AH comparadas con dosis más bajas.20 Sin embargo, otro estudio aleatorizado controlado que comparó la administración frecuente (hasta 3 por semana) de dosis altas de AH no encontró diferencias en el puntaje de dolor del WOMAC a los seis meses en comparación con las dosis más bajas.21
Nuestros hallazgos están respaldados por el metanálisis de Concoff y cols.19 que estudió la eficacia de las inyecciones múltiples de AH comparando dosis únicas y solución salina IA. Este estudio mostró que las inyecciones de 2 a 4 y ≥5 de AH aliviaron el dolor en comparación con la solución salina IA, mientras que la inyección única no lo hizo. El mayor beneficio se logró con el régimen de dos a cuatro inyecciones, a los tres meses y, en menor medida, a los seis meses de seguimiento, sin diferencia de subgrupos en relación con la dosis total administrada.19
Se reportaron muy pocos episodios adversos relacionados con el tratamiento y episodios adversos serios asociados al tratamiento (todos fueron reacciones en el sitio de la inyección), muy probablemente debido al sesgo de información relacionado con la falta de registro en el documento fuente de los episodios adversos no serios asociados con el tratamiento en la revisión retrospectiva de las historias clínicas. Sin embargo, el análisis de los estudios controlados con AH ha demostrado consistentemente que la aplicación de AH-IA es segura con una baja incidencia de episodios adversos y episodios adversos serios (principalmente reacciones en el sitio de la inyección) y han concluido en que no preocupa la seguridad del tratamiento con AH-IA para la artrosis de rodilla.8-14,19
Una limitación de nuestro estudio es que se trata de un estudio de cohorte observacional retrospectiva no intervencionista, por lo que tiene múltiples sesgos, como el de selección e información, debido a la recolección de datos secundarios realizada en la práctica clínica habitual y al seguimiento limitado a seis meses. Puede existir un sesgo en la valoración de la respuesta de los pacientes y, al ser retrospectivo, no se puede descartar la presencia de variables de confusión que no se hayan recabado en la historia clínica o en el formulario de registro de casos. Tampoco hemos podido contar con una escala analógica visual y registros radiográficos con el sistema de clasificación de Kellgren-Lawrence, debido al gran número de médicos y la falta de registro sistemático de estas variables en las historias clínicas de la práctica habitual. Sin embargo y en línea con el objetivo de poder proporcionar datos de la práctica habitual local, el estudio tiene como potencial fortaleza el gran número de pacientes tratados por aproximadamente 400 especialistas en ortopedia y reumatología de las principales ciudades de la Argentina, lo que aumenta la generalización de los resultados.
A pesar de los sesgos inherentes al diseño retrospectivo, creemos que nuestro estudio agrega validez externa en la práctica clínica común a la evidencia antes publicada que apoya el uso de AH-IA en el manejo escalonado de la artrosis de rodilla. El AH-IA proporciona un efecto beneficioso sostenido que se prolonga seis meses después de un corto curso de 3-5 inyecciones semanales y coincide con las recomendaciones recientes de la práctica clínica.22
Nivel de Evidencia: IV
Conflicto de intereses: Los autores han recibido honorarios como
disertantes en eventos, simposios y talleres organizados por TRB Pharma SA en
Argentina. Financiamiento: Este estudio fue financiado a través de una beca de
investigación proporcionada por TRB Pharma SA en Argentina.
Cómo citar este artículo: Berenstein M, Tacus L, Kobrinsky P, Vaineras
D. Registro de ácido hialurónico intrarticular en el tratamiento de la artrosis
de rodilla, en la Argentina. Rev Asoc Argent Ortop Traumatol 2019;84(2):122-128. http://dx.doi.org/10.15417/issn.1852-7434.2019.84.2.846
A los investigadores del estudio MAX-ARG-13-01 y también al doctor Raúl Bozzo de IC-Projects que participó en la redacción y la revisión estadística de este artículo.


Resultados en la escala de Likert para dolor y limitación funcional luego de 6 meses de tratamiento con ácido hialurónico intrarticular 20 mg y 40 mg.
Propia
