Artículo especial
Hidrogeles de polimerización in situ para la regeneración de cartílago articular.
In-situ-forming hydrogels for articular cartilage repair
 http://orcid.org/0000-0001-7129-6791 Francisco Rodríguez-Fontán francisco.rodriguezfontan@cuanschutz.edu
http://orcid.org/0000-0001-7129-6791 Francisco Rodríguez-Fontán francisco.rodriguezfontan@cuanschutz.edu
Hidrogeles de polimerización in situ para la regeneración de cartílago articular.
Revista de la Asociación Argentina de Ortopedia y Traumatología, vol. 84, núm. 3, 2019
Asociación Argentina de Ortopedia y Traumatología
Recepción: 17 Enero 2019
Aprobación: 17 Enero 2019
Financiamiento
Fuente: Biomet-Zimmer
Beneficiario: Cecilia Pascual-Garrido
Financiamiento
Fuente: Orthopaedic Research and Education Foundation (OREF)
Beneficiario: Cecilia Pascual-Garrido
Financiamiento
Fuente: American Orthopaedic Society for Sports Medicine (AOSSM)-SANOFI.
Beneficiario: Cecilia Pascual-Garrido
Resumen: Una significativa cantidad de adultos jóvenes activos sufre lesiones condrales focales. Estas lesiones, si no se tratan, pueden progresar hacia la artrosis, que es una de las principales enfermedades musculoesqueléticas debilitantes y de gran carga económica que afectan a toda sociedad. Pese a los tratamientos quirúrgicos disponibles para la reparación de defectos condrales focales sintomáticos que mejoran la calidad de vida a mediano plazo, hay un mayor riesgo de progresión hacia la artrosis prematura. Los tratamientos biológicos (células madre, bioingeniería tisular) han avanzado a grandes pasos en los últimos años. La bioingeniería es un área que ha progresado en la regeneración de cartílago articular y que potencialmente podría progresar en el terreno de tratamientos articulares, promoviendo la regeneración y evitando la degeneración. Las células madre y los hidrogeles pueden proveer un tejido símil biológico de comportamiento dinámico-funcional equivalente que induce la regeneración tisular al ser degradado y reemplazado gradualmente. El abordaje consiste en colocar un hidrogel precursor o un biomaterial tridimensional impreso dentro del defecto condral por ocupar para inducir la regeneración. Esta revisión se focaliza en el uso actual y futuro de hidrogeles y bioimpresión tridimensional para la regeneración de cartílago articular en el tratamiento de lesiones condrales focales y proporciona datos preliminares de dos estudios piloto en animales.
Palabras clave: Lesiones condrales focales, artrosis, hidrogeles, bioimpresión, regeneración, células madre.
Abstract: A significant number of young active adults are affected by focal chondral lesions. These lesions, if left untreated, will progress to osteoarthritis (OA). OA is one of the main debilitating musculoskeletal diseases and leads to a high economic and social burden. Despite surgical cartilage repair for focal chondral lesions, which improve patient-reported outcomes at short- and mid-term, there is a risk of early OA progression. Biological treatments (i.e., stem-cell therapy, bioengineering) have made great progress in the last years. Tissue engineering is an evolving field for articular cartilage repair which could potentially be used for the treatment of focal chondral lesions, promoting regeneration and preventing joint surface degeneration. Stem cells and hydrogels may provide a functional, dynamic and biologically equivalent tissue that promotes tissue regeneration while being gradually degraded and replaced. The standard approach to tissue engineering consists in delivering cells within a hydrogel or a three-dimensional printed biomaterial scaffold into the chondral lesion to induce regeneration. This review focuses on the current and future use of hydrogels and tissue scaffold bioprinting for the treatment of focal chondral lesions, and provides preliminary data from two pilot animal studies.
Keywords: Focal chondral lesions, osteoarthritis, hydrogels, bioprinting, regeneration, stem cells.
Introducción
El cartílago articular tiene la función de soportar peso y fricción. Está compuesto principalmente por matriz extracelular (MEC) y, en menor medida, por condrocitos (~5% del peso), cuya principal función es mantener la MEC a través de la síntesis y degradación de sus componentes, el cual está orquestado por el módulo compresivo que el tejido recibe.1 La MEC está compuesta principalmente por colágeno II y proteoglicanos, como el agrecano y el sulfato de condroitina (SC).2 Lamentablemente al ser un tejido avascular (su único aporte vascular es subcondral) y de baja celularidad, su poder regenerativo intrínseco es bajo. Las lesiones condrales no suelen regenerarse tanto así como las osteocondrales cuyo aporte vascular subcondral sí lo permite. Pero estas últimas tienden a formar fibrocartílago, cuya composición es predominantemente colágeno I, y tiene menor resistencia a la compresión
y a la fricción.3
Las lesiones de cartílago articular son más comunes en atletas y personas activas que en la población general.4,5
La mayoría de estas lesiones progresan hacia la artrosis si no son tratadas prontamente.6,7 Ciertos factores de riesgo se han asociado a la progresión de la artrosis, como el alto índice de masa corporal, el sexo femenino, los traumatismos, la predisposición genética y la desalineación mecánica articular, entre otros.8 Además, ciertos deportes parecen predisponer más a la artrosis, como el fútbol, la lucha, las carreras de larga distancia, los deportes de contacto y el levantamiento de pesas.9 Los tratamientos quirúrgicos para las lesiones de cartílago han avanzado de la microfractura hacia el trasplante celular y los implantes osteocondrales viables. Aún ninguna de estas terapias permite la regeneración de cartílago hialino normal y nativo, y menos aún en lesiones grandes. La microfractura permite reclutar células madre provenientes del hueso subcondral, pero suele utilizarse para defectos <2 cm2 y tiene potencial limitado al cicatrizar con un tejido fibroso. La transferencia de autoinjerto o aloinjerto osteocondral puede restaurar el hueso subcondral y el cartílago articular con más eficiencia en un paso quirúrgico, pero sus mayores desventajas son la disponibilidad del autoinjerto o aloinjerto, su morbilidad (no, si se utiliza aloinjerto) y la congruencia de superficies irregulares para defectos grandes. En el caso de los aloinjertos, hay que agregar también que existe el riesgo de transmisión de enfermedades, de rechazo del injerto y de incorporación parcial o incompleta a la articulación.6,10 La implantación de condrocitos autólogos es un procedimiento de superficie, que se realiza en dos pasos quirúrgicos, que posee capacidad limitada para: restaurar el hueso subcondral, mantener los condrocitos diferenciados en cultivo (los condrocitos suelen desdiferenciarse) y para ser utilizado en defectos >6-8 mm de profundidad.11Cabe mencionar que este procedimiento progresó y dio lugar a una nueva técnica: implantación de condrocitos autólogos inducida por la matriz (matrix-induced autologous chondrocyte implantation) en colágeno I/III. Esta técnica permitió prevenir la desdiferenciación que los condrocitos tienen con la mencionada técnica de implantación de condrocitos autólogos.12 Brittberg y cols. han obtenido buenos resultados clínicos a cinco años en el tratamiento de defectos osteocondrales de rodilla ≥3 cm2.12 Esta técnica fue aprobada en diciembre de 2016, por la Food and Drug Administration de los Estados Unidos para tratar defectos condrales de rodilla en pacientes <55 años.
Algunas de estas terapias dan lugar a fibrocartílago, poco apto para el rendimiento natural de la superficie articular. Los hidrogeles se pueden utilizar para tratar estos defectos al sortear estas limitaciones mencionadas, y además proveen un substrato condrogénico para la terapia celular (p. ej., células madre, condrocitos). Estudios clínicos de los últimos años, utilizando diferentes composiciones de polímeros y fuentes celulares, han tratado eficientemente defectos osteocondrales >2 cm2, pero en lesiones menores y singulares, los resultados suelen ser aún mejores.13
La ingeniería tisular a través del uso de polímeros, combinada con fuentes celulares podría proporcionar una herramienta terapéutica que avanzaría en el terreno permitiendo una regeneración del cartílago articular nativo o símil nativo.
Esta revisión está enfocada en el uso de hidrogeles para la ingeniería de cartílago articular y su potencial uso combinados con células madre para tratar lesiones condrales focales sintomáticas y la artrosis temprana; con algunos resultados preliminares en animales. El lector puede consultar revisiones más exhaustivas, si así lo desea.14,15
Bioingeniería tisular
Fuentes celulares
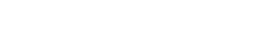
El uso de células en hidrogeles puede resultar en una regeneración del cartílago hialino más rápida y robusta.14 Se ha evaluado una gran cantidad de células para la reparación de cartílago y se las puede categorizar por su nivel de diferenciación: condrocitos completamente diferenciados o células madre indiferenciadas (pluripotentes o multipotentes) (Tabla).
Fuentes y factores a favor y en contra de su uso.
PropiaPolímeros y el comportamiento de los hidrogeles
La bioingeniería propone la combinación de células con polímeros en forma de hidrogeles o estructuras tridimensionales (3D) para promover la regeneración tisular. Avances recientes en bioimpresión han garantizado la habilidad para ensamblar hidrogeles en formas tisulares anatómicamente funcionales o en partes de órganos. Además, los hidrogeles pueden usarse como sistemas de administración de drogas, mediante una liberación controlada y sostenida intrarticular, por semanas y meses,47 para tratar enfermedades articulares inflamatorias, como la artrosis o la artritis reumatoide.
Los hidrogeles son polímeros reticulados insolubles, que se hidratan en medios acuosos. Se los puede dividir, de manera amplia, en naturales o sintéticos y en biodegradables o no.48 Los polímeros generan un microambiente que se asemeja a tejidos específicos y estimulan la regeneración nativa por la promoción de interacciones célula-matriz e intercelular, que regulan la diferenciación celular dirigida y el crecimiento tisular.43,49,50 Los polímeros sintéticos suelen tener propiedades mecánicas y de cizallamiento similares a las del cartílago articular.51,52 Ciertos estudios han demostrado la habilidad para embeber, con facilidad, células y factores de crecimiento en hidrogeles sintéticos.
Más prometedora aun es la combinación de polímeros sintéticos y naturales como un abordaje superior para crear hidrogeles biomiméticos o símil cartílago. Estos pueden diseñarse para mimetizar aspectos fundamentales del ambiente nativo, para proveer de señales apropiadas a las células que se siembran en él, mientras se ajustan precisamente las propiedades mecánicas, químicas y degradadoras del hidrogel.60,61,62,63,64 Por ejemplo, el porcentaje de hidratación también se puede regular para asemejarse al del cartílago nativo (~80%) y favorecer el intercambio celular de substratos, y productos peri- y extracelulares.14
Las ventajas de los polímeros naturales son su biocompatibilidad, su similitud bioquímica con el cartílago nativo y su facilidad para ser degradados (p. ej., ADN, ARN, ácido hialurónico, colágeno, fibrina, elastina, actina y miosina). En cuanto a ejemplos no biodegradables, se pueden mencionar: soja, alginato, seda, agarosa y celulosa.65 Su alta maleabilidad favorece a los polímeros sintéticos, lo que permite un mayor control sobre las propiedades macroscópicas, del microambiente y de su degradación. Algunos ejemplos de polímeros sintéticos que se han usado para la regeneración de cartílago son polietilenglicol (PEG) y alcohol de polivinilo (PVA).
Persiste el desafío de diseñar un hidrogel que soporte la carga articular y facilite el crecimiento tisular, de forma simultánea, a su degradación gradual. Un hidrogel ideal deberá: 1) ocupar el defecto, 2) soportar carga en la articulación (modulus compresivo símil cartílago: de 240 a 1000 kPa),66 3) integrarse al tejido circundante, 4) degradarse gradualmente y 5) transferir el estímulo de carga al nuevo tejido en formación, en un equilibrado proceso dinámico. Es posible emparejar la degradación con el crecimiento de nuevo tejido, si cuidadosamente se ajustan las propiedades y la formulación inicial del hidrogel. Diferentes factores pueden ser regulados y afectan el comportamiento del hidrogel y, por ende, del tejido por formar. El reticulado y la utilización de enlaces degradables afectan la velocidad de degradación del hidrogel (p. ej., a mayor reticulado, la degradación será más lenta). No obstante, se requiere una alta densidad de reticulado para soportar carga en la articulación. Aunque enlentecerá la degradación y afectará negativamente la difusión de moléculas grandes, inclusive factores de crecimiento y moléculas nuevas de MEC sintetizadas, especialmente agrecano y colágeno, que son demasiado grandes para ser transportadas a través del reticulado del hidrogel y, como resultado, de degradación debe ocurrir antes de que se forme un tejido.54,67,68 Esto se ha obtenido usando hidrogeles susceptibles de degradación por hidrólisis69,70 y enzimática (p. ej., metaloproteinasas y agrecanasa). 71,72
La integración óptima con el tejido circundante es otro factor crítico. El fenómeno de integración funciona a modo de ”nexo o puente” entre el tejido biomimético y la superficie del defecto, permitiendo a las células migrar hacia fuera de la plataforma o hidrogel, o hacia adentro, desde el tejido circundante.73 Esto se obtiene por polimerización molecular entrecruzada o química in situ entre el cartílago adyacente y el polímero, o bien con el agregado de grupos adhesivos (p. ej., aldehído).74 Sin una eficiente integración, el hidrogel no podrá transferir la carga apropiadamente al tejido en formación y, en consecuencia, aparece una solución de discontinuidad entre el tejido circundante y el tejido biomimético, derivando hacia la potencial falla de implante.65
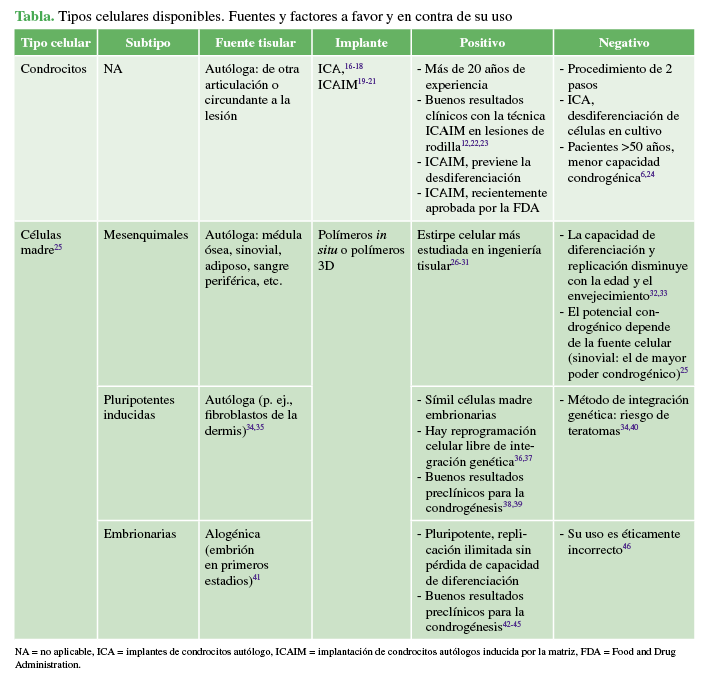
Una forma de aplicar hidrogeles in vivo que ofrece una gran ventaja por su fácil aplicación y su habilidad para llenar el defecto, es la de utilizar una solución prepolimerizada líquida del hidrogel que, luego, se polimeriza in situ (Figura 1). Esta polimerización in situ (termosensible o fotosensible) permite una mayor adhesión entre el hidrogel y el tejido circundante.
Bryant y cols. han desarrollado y trabajado con un prometedor hidrogel símil cartílago de aplicación y fotopolimerización (fotosensible) in situ.75 Este polímero natural/sintético está formado por PEG y análogos de MEC (SC y ácido de argininaglicina-aspártico [RGD])75 y permite la encapsulación de células (p. ej., células madre, condrocitos) durante su formación. El agregado de norborneno al PEG permite ser fotopolimerizable con luz visible azul de 405 nm (Figura 1). El SC es el principal glicosaminoglicano en cartílago y crea un microambiente hiperosmótico y promueve la síntesis tisular bajo compresión dinámica.76.77.78 El RGD es un péptido condrogénico que actúa sobre la integrina celular α5β1 y, a modo de mecanosensor, las células censan la rigidez del substrato y la compresión dinámica.79,80,81Las ventajas incluyen control temporal y espacial durante la formación del hidrogel, la habilidad de polimerizarlo a pH y temperatura fisiológicos, y de forma rápida, de segundos a minutos.82
Además, este hidrogel puede ser formado con múltiples capas que mimetizan las distintas propiedades de las capas nativas en los tejidos. Con el fin de ser empleado para el tratamiento de lesiones osteocondrales, que implica replicar distintas propiedades mecánicas, Steinmetz y cols., utilizando hidrogeles a base de PEG, y cambiando el tipo y la concentración de análogos de MEC, como también la rigidez local dentro de cada capa, han encontrado que, bajo carga compresiva, la variación en la rigidez del hidrogel dentro de cada capa produjo alta tensión en la capa blanda (símil cartílago), baja tensión en la capa rígida (símil óseo) y tensión moderada en la interfase. Esto brinda la posibilidad de dirigir la diferenciación de células madre embebidas en el hidrogel.83 Por ende, con vistas a tratar lesiones complejas que involucran la combinación de “capas” con diferentes propiedades estructurales, es posible combinar distintos polímeros con diferentes fuentes de células madre, y guiar estas hacia la diferenciación deseada.
En este caso, el hidrogel está compuesto de polietilenglicol (PEG), sulfato de condroitina (SC) y un péptido biodegradable para adhesión tisular (CRGDS). Primero se inocula el precursor del hidrogel en su forma líquida y, luego, bajo luz visible, la polimerización es iniciada y el hidrogel se gelifica in situ. Se pueden adicionar células o factores de crecimiento durante la preparación antes de la inoculación y la polimerización
PropiaResultados preliminares
Siguiendo las guías de la International Cartilage Repair Society (ICRS) propuestas por Hoemann y cols. para la evaluación histológica de la reparación de cartílago,84 hemos estudiado el hidrogel fotopolimerizable compuesto por PEG-SC-RGD, en modelos experimentales de lesiones condrales, en conejos y caballos. En dos recientes estudios piloto de Pascual-Garrido y cols., se han obtenido resultados prometedores con este mismo hidrogel para reparar lesiones condrales de rodilla.85
El primero fue en lesiones osteocondrales de rodilla críticas bilaterales de 3 mm de ancho x 2 mm de profundidad, en 10 conejos machos blancos adultos de Nueva Zelandia (n = 20). Tres grupos fueron tratados en forma aleatorizada: grupo 1, hidrogel (n = 5); grupo 2, hidrogel + células madre mesenquimales (CMM) (n = 5); grupo 3, controles, no tratados (n = 10). El grupo que fue tratado con hidrogel presentó mayor condrogénesis e integración parcial al cartílago adyacente a los seis meses de la cirugía (Figura 2). El hidrogel puede ser administrado y fotopolimerizado de forma estéril. Ocupa el defecto, sin mostrar signos inflamatorios y con buena condrogénesis en tres casos del grupo 1. Sorprendentemente, el agregado de CMM al hidrogel no potenció la condrogénesis del hidrogel y, en algunos casos, el resultado fue menor que el del grupo control. Esto sugiere que las CMM pueden estar tomando distintos estímulos del medio circundante, truncando su diferenciación condrogénica. Si bien no fue estadísticamente significativo, el grupo 1 fue el de mejor rendimiento condrogénico por la escala de O’Driscoll modificada (MODS)86 (grupo 1: 17,4 ± 4,7; grupo 2: 13 ± 3; grupo 3: 16,7 ± 2,9; p = 0,11), y cabe destacar que fue el que mayor tinción tuvo para los glicosoaminoglicanos (safranina-O, en porcentaje de tinción roja, grupo 1: 49,4% ± 20; grupo 2: 25,8% ± 16,4; grupo 3: 36,9% ± 25,2; p = 0,27).85
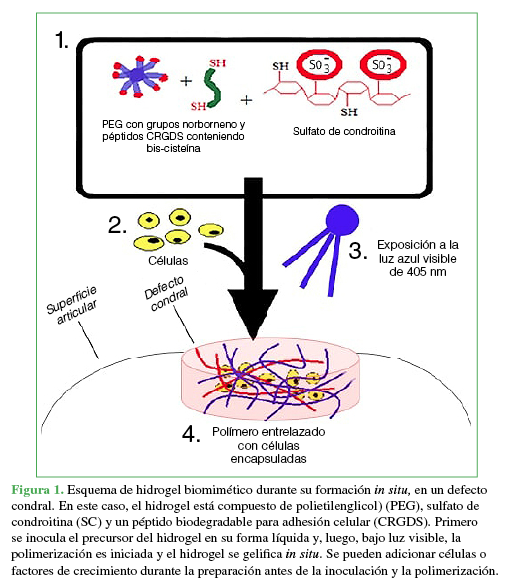
El segundo trabajo (no publicado aún) se llevó a cabo en lesiones osteocondrales de rodilla críticas (x2, uno proximal y uno distal) bilaterales, en el cóndilo femoral medial de 15 mm de ancho x 5 mm de profundidad, en tres yeguas adultas de 2.5 años (n = 12). Estas fueron divididas en cinco grupos: grupo 1, hidrogel (n = 3), grupo 2, hidrogel + CMM (n = 3); grupo 3, microfractura (n = 1); grupo 4: microfractura + hidrogel (n = 3) y grupo 5: microfractura + hidrogel + CMM (n = 2). A los seis meses de la intervención, las yeguas fueran humanamente sacrificadas. Nuevamente, el hidrogel pudo ser administrado y fotopolimerizado de forma estéril. En este caso, a pesar de no ser estadísticamente significativo, el grupo 5 tuvo mejores resultados en la MODS (grupo 1: 13 ± 3,6; grupo 2: 13,3 ± 5,8; grupo 3: 10 ± 0; grupo 4: 10 ± 2,6; grupo 5, 14 ± 2,8; p = 0,61). La microfractura no mostró signos inflamatorios y tuvo menos anomalías subcondrales (fibrosis, quistes, neovascularización). Por otro lado, el grupo tratado con hidrogel tuvo la mayor integración basal y lateral al tejido circundante, pero presentó una moderada inflamación. No así lo visto en el estudio realizado en conejos. Un defecto tratado con microfractura + hidrogel presentó más glicosoaminoglicanos, menos inflamación (vs. hidrogel solo) y menos anomalías subcondrales (vs. microfractura solo) (Figura 3).
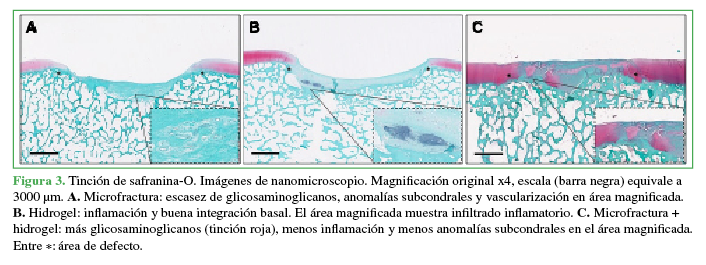
A. Microfractura: escasez de glicosaminocanos, anomalías subcondrales y vascularización en área magnificada. B. Hidrogel: inflamación y buena integración basal. El área magnificada muestra infiltrado inflamatorio. C. Microfractura+hidrogel: más glicosaminocanos (tinción roja), menos inflamación y menos anomalías subcondrales en el área magnificada. Entre*: área de defecto.
PropiaLa bioimpresión
Es un instrumento clave para futuros abordajes de terapia biológica, porque permite incorporar polímeros con células que mantienen su viabilidad y crear estructuras 3D para ser aplicadas en lesiones tisulares, ocupar la solución de continuidad y promover la regeneración tisular. Polímeros naturales, como colágeno, alginato, gelatina y ácido hialurónico, o sintéticos, como el PEG, se pueden utilizar y combinar ampliamente. La bioimpresión permite recrear interfases “capa por capa” o de forma continua, según que impresora se utiliza.87 Por ende, la creación de estructuras con diferentes gradientes de dureza que mejor reflejan el cartílago o hueso nativo permite recrear el microambiente tisular.
La habilidad de reproducir precisamente la plétora de formas condrales para luego limitar la resección de cartílago en las cirugías de reparación puede potencialmente rendir mayores resultados quirúrgicos con mínima remoción de cartílago sano. Al respecto, se han reportado defectos condrales focales tratados eficientemente por estos medios.88,89,90,91 En el caso de la artrosis, una de las principales enfermedades debilitantes y de mayor carga económica personal y social (rodilla y cadera las más afectadas), es una meta más ambiciosa para tratar.92,93,94La posibilidad de remodelar superficies articulares de manera completa, mimetizando la forma anatómica, con similares propiedades biomecánicas y de potenciación biológica es una tarea desafiante que se está llevando a cabo en estudios experimentales.95 Moutos y cols. describieron la formación de cartílago funcional basado en una estructura polimerizada 3D entrecruzada que puede utilizarse para remodelar la superficie total articular, con competencia biológica para proteger articulaciones enfermas de la inflamación por medio de expresión de moléculas antinflamatorias. Este abordaje podría dramáticamente cambiar el tratamiento actual para la enfermedad articular difusa.95
La combinación de hidrogeles condrogénicos con estructuras bioimpresas 3D antes de la inoculación del hidrogel dentro del defecto por tratar podría ser una terapia prometedora. Las estructuras 3D permiten aportar una plataforma más fuerte hasta que se regenere el defecto. Además, estas estructuras impresas 3D podrían ayudar a la integración del hidrogel al hueso subcondral y tejido circundante.95,96 La técnica propuesta consiste en inyectar el precursor del hidrogel entre las estructuras 3D impresas (Figura 4).
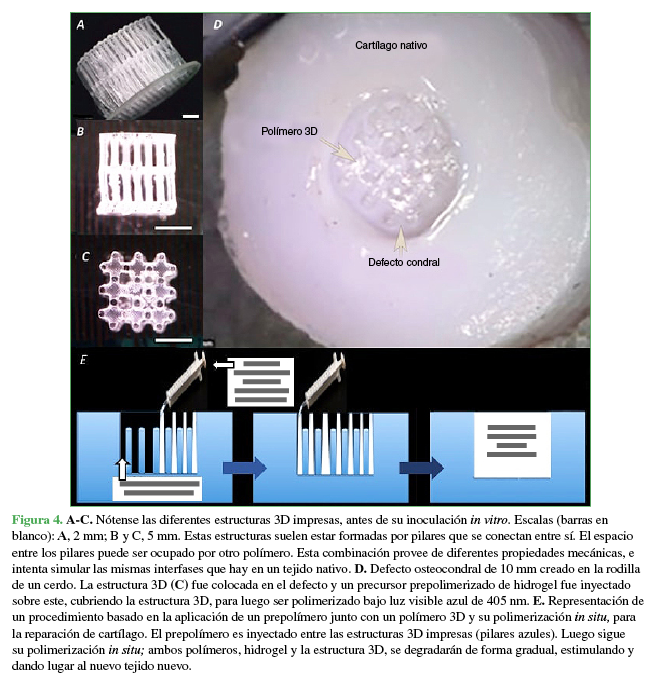
Estas estructuras suelen estar formadas por pilares que se conectan entre sí. El espacio entre los pilares puede estar ocupado por otro polímero. Esta combinación provee de diferentes propiedades mecánicas, e intenta simular las mismas interfases que hay en un tejido nativo. D. Defecto osteocondral de 10 mm creado en la rodilla de un cerdo. La estructura 3D (C) fue colocada en el defecto y un precursor prepolimerizado de hidrogel fue inyectado sobre este, cubriendo la estructura 3D, para luego ser polimerizado bajo luz visible azul de 405 nm. E. Representación de un procedimiento basado en la aplicación de un prepolímero junto a un polímero 3D y su polimerización in situ, para la reparación de cartílago. El prepolímero es inyectado entre las estructuras 3D impresas (pilares azules). Luego sigue su polimerización in situ; ambos polímeros, hidrogel y la estructura 3D, se degradarán en forma gradual, estimulando y dando lugar al nuevo tejido nuevo.
Hidrogeles en ortopedia y traumatología
Los hidrogeles eventualmente podrían utilizarse para reparar diferentes estructuras, por ejemplo, en el caso de rotura de meniscos,97 fracturas de cartílago de crecimiento98 y fracturas óseas,99 entre otras. Sin embargo, este reporte está focalizado en el uso de hidrogeles para la reparación de cartílago articular. Es importante recalcar que, para expandir el alcance del uso de hidrogeles en diferentes tejidos musculoesqueléticos, los principales componentes de este tendrían que adaptarse a las características biológicas del tejido por regenerar.
La aplicación más inmediata de los hidrogeles en ortopedia es para tratar lesiones condrales focales sintomáticas. Clínicamente, se han publicado reportes sobre el uso de hidrogeles condrogénicos en combinación con la microfractura para el tratamiento de lesiones de cartílago articular.74 La idea propuesta es utilizar estos hidrogeles a modo de sello en el sitio de la microfractura. Una vez que esta se realiza, los hidrogeles agregan un estímulo condrogénico y permiten mantener en el lugar el coágulo y las células madre endógenas.74,100
Se han llevado a cabo escasos estudios clínicos con estos hidrogeles condrogénicos nuevos para el tratamiento de lesiones condrales focales. Los resultados son alentadores en un estudio piloto utilizando microfractura e hidrogel para tratar una lesión condral localizada luego de seis meses.74 Por otro lado, en otro estudio aleatorizado que comparó el uso de microfractura frente a microfractura y BST-CarGel® (PiramalLife Sciences, Bio-Orthopaedics Division; Smith & Nephew plc, Londres, Reino Unido) para el tratamiento de lesiones condrales de rodilla, se lograron mejores resultados sintomáticos y regenerativos evaluados por resonancia magnética, en el segundo grupo.101 Es crucial entender que hay una necesidad enorme de avanzar en esta área de la bioingeniería. Numerosos puntos deben abordarse y estudiarse según la composición del hidrogel en cuestión: tiempo de biodegradación, tipo de polímero ideal para la regeneración de diferentes tejidos y la forma de reproducir el gel para rellenar morfológicamente el defecto. Además, es necesario optimizar el ambiente biológico con las líneas celulares más propicias, factores de crecimiento y agentes antinflamatorios.
Conclusiones
Los hidrogeles biodegradables y biomiméticos tienen múltiples ventajas para el tratamiento de lesiones condrales y la artrosis temprana, como también muestra el horizonte para otras patologías ortopédicas. Estas incluyen su capacidad de ser inyectados, la polimerización in situ controlada y tiempos de degradación controlada que equiparen los tiempos de formación de tejido nuevo. Un área prometedora y en exploración es su habilidad de aportar señales condrogénicas que influenciarían la diferenciación de células madre endógenas o exógenas. Dados los resultados prometedores, diferentes investigadores deberían continuar estudiando el potencial de células madre dentro de los hidrogeles, como sus múltiples formulaciones basadas en densidad celular, combinación de polímeros naturales y sintéticos, y el agregado de factores de crecimiento. Por último, la bioimpresión ofrece la oportunidad de imprimir estructuras que más se asemejan a la arquitectura nativa y que eventualmente permitirá formar la superficie de una articulación entera. Los hidrogeles continuarán evolucionando y hay esperanza de que su uso impactará en la reparación de cartílago articular y otras patologías ortopédicas.
Agradecimientos
El hidrogel mencionado fue desarrollado y es extensamente estudiado por Stephanie J. Bryant, PhD, con la colaboración de Aisenbrey A. Elizabeth, PhD (Department of Chemical & Biological Engineering, University of Colorado Denver, Boulder, CO, Estados Unidos). Agradecemos el aporte teórico y técnico de los siguientes autores para la realización de este artículo: Stephanie J. Bryant, PhD; Aisenbrey A. Elizabeth, PhD; Payne A. Karin, PhD (Department of Orthopedics, University of Colorado Anschutz Medical Campus, Aurora, CO, Estados Unidos); y Laurie R Goodrich, DVM, PhD (Department of Clinical Sciences and Orthopaedic Research Center, Colorado State University, Fort Collins, CO, Estados Unidos), con quienes trabajamos en conjunto con el hidrogel de SC, RGD y PEG en diferentes estudios animales que estamos desarrollando.
Bibliografía
1. Loeser R. Integrins and chondrocyte-matrix interactions in articular cartilage. Matrix Biol 2014;39:11-6. https://doi.org/10.1016/j.matbio.2014.08.007
2. Hunziker EB. Articular cartilage repair: basic science and clinical progress. A review of the current status and prospects.Osteoarthritis Cartilage 2002;10(6):432-63. https://doi.org/10.1053/joca.2002.0801
3. Vijayan S, Bentley G, Briggs T, Skinner J, Carrington R, Pollock R, et al. Cartilage repair: A review of Stanmore experience in the treatment of osteochondral defects in the knee with various surgical techniques. Indian J Orthop 2010;44(3):238-45. https://doi.org/10.4103/0019-5413.65136
4. Flanigan DC, Harris JD, Trinh TQ, Siston RA, Brophy RH. Prevalence of chondral defects in athletes’ knees: a systematic review. Med Sci Sports Exerc 2010;42(10):1795-801. https://doi.org/10.1249/MSS.0b013e3181d9eea0
5. Vigdorchik J, Nepple J, Eftekhary N, Leunig M, Clohisy J.What is the association of elite sporting activities with the development of hip osteoarthritis? Am J Sports Med 2017;45(4):961-4. https://doi.org/10.1177/0363546516656359
6. Cole BJ, Pascual-Garrido C, Grumet RC. Surgical management of articular cartilage defects in the knee. J Bone Joint Surg Am 2009;91(7):1778-90. PMID: 19571102
7. Heijink A, Gomoll AH, Madry H, Drobnic M, Filardo G, Espregueira-Mendes J, et al. Biomechanical considerations in the pathogenesis of osteoarthritis of the knee. Knee Surg Sports Traumatol Arthrosc 2012;20(3):423-35. https://doi.org/10.1007/s00167-011-1818-0
8. Loeser RF, Goldring SR, Scanzello CR, Goldring MB. Osteoarthritis: a disease of the joint as an organ. Arthritis Rheum 2012;64(6):1697-707. https://doi.org/10.1002/art.34453
9. Driban J, Hootman J, Sitler M, Harris K, Cattano N. Is participation in certain sports associated with knee osteoarthritis? A systematic review. J Athl Train 2017;52(6):497-506. https://doi.org/10.4085/1062-6050-50.2.08
10. Bedi A, Feeley BT, Williams RJ 3rd. Management of articular cartilage defects of the knee. J Bone Joint Surg Am 2010;92(4):994-1009. https://doi.org/10.2106/JBJS.I.00895
11. Park YB, Ha CW, Lee CH, Park YG. Restoration of a large osteochondral defect of the knee using a composite of umbilical cord blood-derived mesenchymal stem cells and hyaluronic acid hydrogel: a case report with a 5-year follow-up. BMC Musculoskelet Disord 2017;18(1):59. https://doi.org/10.1186/s12891-017-1422-7
12. Brittberg M, Recker D, Ilgenfritz J, Saris DBF. Matrix-applied characterized autologous cultured chondrocytes versus microfracture: five-year follow-up of a prospective randomized trial. Am J Sports Med 2018;46(6):1343-51. https://doi.org/10.1177/0363546518756976
13. Bornes TD, Adesida AB, Jomha NM. Mesenchymal stem cells in the treatment of traumatic articular cartilage defects: a comprehensive review. Arthritis Res Ther 2014;16(5):432. https://doi.org/10.1186/s13075-014-0432-1
14. Nicodemus GD, Bryant SJ. Cell encapsulation in biodegradable hydrogels for tissue engineering applications. Tissue Eng Part B Rev 2008;14(2):149-65. https://doi.org/10.1089/ten.teb.2007.0332
15. Vilela CA, Correia C, Oliveira JM, Sousa RA, Espregueira-Mendes J, Reis RL. Cartilage repair using hydrogels: a critical review of in vivo experimental designs. ACS Biomater Sci Eng 2015;1(9):726-39. https://doi.org/10.1021/acsbiomaterials.5b00245
16. Grande DA, Singh IJ, Pugh J. Healing of experimentally produced lesions in articular cartilage following chondrocyte transplantation. Anat Rec 1987;218(2):142-8. https://doi.org/10.1002/ar.1092180208
17. Grande DA, Pitman MI, Peterson L, Menche D, Klein M. The repair of experimentally produced defects in rabbit articular cartilage by autologous chondrocyte transplantation. J Orthop Res 1989;7(2):208-18. https://doi.org/10.1002/jor.1100070208
18. Peterson L, Vasiliadis HS, Brittberg M, Lindahl A. Autologous chondrocyte implantation: a long-term follow-up. Am J Sports Med 2010;38(6):1117-24. https://doi.org/10.1177/0363546509357915
19. Brittberg M. Cell carriers as the next generation of cell therapy for cartilage repair: a review of the matrix-induced autologous chondrocyte implantation procedure. Am J Sports Med 2010;38(6):1259-71. https://doi.org/10.1177/0363546509346395
20. Jacobi M, Villa V, Magnussen RA, Neyret P. MACI - a new era? Sports Med Arthrosc Rehabil Ther Technol 2011;3(1):10. https://doi.org/10.1186/1758-2555-3-10
21. Makris EA, Gomoll AH, Malizos KN, Hu JC, Athanasiou KA. Repair and tissue engineering techniques for articular cartilage. Nat Rev Rheumatol 2015;11(1):21-34. https://doi.org/10.1038/nrrheum.2014.157
22. Gille J, Behrens P, Schulz AP, Oheim R, Kienast B. Matrix-associated autologous chondrocyte implantation: a clinical follow-up at 15 years.Cartilage 2016;7(4):309-15. https://doi.org/10.1177/1947603516638901
23. Ebert JR, Fallon M, Wood DJ, Janes GC. A prospective clinical and radiological evaluation at 5 years after arthroscopic matrix-induced autologous chondrocyte implantation. Am J Sports Med 2017;45(1):59-69. https://doi.org/10.1177/0363546516663493
24. Pascual-Garrido C, Slabaugh MA, L’Heureux DR, Friel NA, Cole BJ. Recommendations and treatment outcomes for patellofemoral articular cartilage defects with autologous chondrocyte implantation: prospective evaluation at average 4-year follow-up. Am J Sports Med 2009;37(Suppl 1):33s-41s. https://doi.org/10.1177/0363546509349605
25. Rodriguez Fontan F, Piuzzi N, Chahla J, Payne K, LaPrade R, Muschler G, et al. Stem and progenitor cells for cartilage repair: source, safety, evidence and efficacy.Operative Techniques in Sports Medicine 2017;25(1):25-33. https://doi.org/10.1053/j.otsm.2016.12.005
26. Nuttelman CR, Tripodi MC, Anseth KS. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol 2005;24(3):208-18. https://doi.org/10.1016/j.matbio.2005.03.004
27. Zhu M, Feng Q, Sun Y, Li G, Bian L. Effect of cartilaginous matrix components on the chondrogenesis and hypertrophy of mesenchymal stem cells in hyaluronic acid hydrogels. J Biomed Mater Res B Appl Biomater 2017;105(8):2292-300. https://doi.org/10.1002/jbm.b.33760
28. Masuoka K, Asazuma T, Hattori H, Yoshihara Y, Sato M, Matsumura K, et al. Tissue engineering of articular cartilage with autologous cultured adipose tissue-derived stromal cells using atelocollagen honeycomb-shaped scaffold with a membrane sealing in rabbits. J Biomed Mater Res B Appl Biomater 2006;79(1):25-34. https://doi.org/10.1002/jbm.b.30507
29. Dragoo JL, Carlson G, McCormick F, Khan-Farooqi H, Zhu M, Zuk PA, et al. Healing full-thickness cartilage defects using adipose-derived stem cells. Tissue Eng 2007;13(7):1615-21. https://doi.org/10.1089/ten.2006.0249
30. Park YB, Song M, Lee CH, Kim JA, Ha CW. Cartilage repair by human umbilical cord blood-derived mesenchymal stem cells with different hydrogels in a rat model. J Orthop Res 2015;33(11):1580-6. https://doi.org/10.1002/jor.22950
31. de Girolamo L, Niada S, Arrigoni E, Di Giancamillo A, Domeneghini C, Dadsetan M, et al. Repair of osteochondral defects in the minipig model by OPF hydrogel loaded with adipose-derived mesenchymal stem cells. Regen Med 2015;10(2):135-51. https://doi.org/10.2217/rme.14.77
32. Muschler GF, Nitto H, Boehm CA, Easley KA. Age- and gender-related changes in the cellularity of human bone marrow and the prevalence of osteoblastic progenitors. J Orthop Res 2001;19(1):117-25. https://doi.org/10.1016/S0736-0266(00)00010-3
33. Payne KA, Didiano DM, Chu CR. Donor sex and age influence the chondrogenic potential of human femoral bone marrow stem cells. Osteoarthritis Cartilage 2010;18(5):705-13. https://doi.org/10.1016/j.joca.2010.01.011
34. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 2007;131(5):861-72. https://doi.org/10.1016/j.cell.2007.11.019
35. Lietman SA. Induced pluripotent stem cells in cartilage repair. World J Orthop 2016;7(3):149-55. https://doi.org/10.5312/wjo.v7.i3.149.
36. Liu J, Verma PJ. Synthetic mRNA reprogramming of human fibroblast cells. Methods Mol Biol 2015;1330:17-28. https://doi.org/10.1007/978-1-4939-2848-4_2
37. Choi HY, Lee TJ, Yang GM, Oh J, Won J, Han J, et al. Efficient mRNA delivery with graphene oxide-polyethylenimine for generation of footprint-free human induced pluripotent stem cells. J Control Release 2016;235:222-35. https://doi.org/10.1016/j.jconrel.2016.06.007
38. Uto S, Nishizawa S, Takasawa Y, Asawa Y, Fujihara Y, Takato T, et al. Bone and cartilage repair by transplantation of induced pluripotent stem cells in murine joint defect model. Biomed Res 2013;34(6):281-8. https://doi.org/10.2220/biomedres.34.281
39. Ko JY, Kim KI, Park S, Im GI. In vitro chondrogenesis and in vivo repair of osteochondral defect with human induced pluripotent stem cells. Biomaterials 2014;35(11):3571-81. https://doi.org/10.1016/j.biomaterials.2014.01.009
40. Kuroda T, Yasuda S, Kusakawa S, Hirata N, Kanda Y, Suzuki K, et al. Highly sensitive in vitro methods for detection of residual undifferentiated cells in retinal pigment epithelial cells derived from human iPS cells. PLoS One 2012;7(5):e37342. https://doi.org/10.1371/journal.pone.0037342
41. Itskovitz-Eldor J, Schuldiner M, Karsenti D, Eden A, Yanuka O, Amit M, et al. Differentiation of human embryonic stem cells into embryoid bodies compromising the three embryonic germ layers. Mol Med 2000;6(2):88-95. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1949933/
42. Cheng A, Kapacee Z, Peng J, Lu S, Lucas RJ, Hardingham TE, et al. Cartilage repair using human embryonic stem cell-derived chondroprogenitors. Stem Cells Transl Med 2014;3(11):1287-94. https://doi.org/10.5966/sctm.2014-0101
43. Elisseeff J, Puleo C, Yang F, Sharma B. Advances in skeletal tissue engineering with hydrogels.Orthod Craniofac Res 2005;8(3):150-61. https://doi.org/10.1111/j.1601-6343.2005.00335.x
44. Jukes JM, Moroni L, van Blitterswijk CA, de Boer J. Critical steps toward a tissue-engineered cartilage implant using embryonic stem cells. Tissue Eng Part A 2008;14(1):135-47. https://doi.org/10.1089/ten.a.2006.0397
45. Toh WS, Cao T. Derivation of chondrogenic cells from human embryonic stem cells for cartilage tissue engineering. Methods Mol Biol 2014. https://doi.org/10.1007/7651_2014_89
46. Thomson JA, Itskovitz-Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS, et al. Embryonic stem cell lines derived from human blastocysts. Science 1998;282(5391):1145-7. https://doi.org/10.1126/science.282.5391.1145
47. Bedouet L, Pascale F, Moine L, Wassef M, Ghegediban SH, Nguyen VN, et al. Intra-articular fate of degradable poly(ethyleneglycol)-hydrogel microspheres as carriers for sustained drug delivery. Int J Pharm 2013;456(2):536-44. https://doi.org/10.1016/j.ijpharm.2013.08.016
48. Griffith LG, Naughton G.Tissue engineering--current challenges and expanding opportunities. Science 2002;295(5557):1009-14. https://doi.org/10.1126/science.1069210
49. Castagnini F, Pellegrini C, Perazzo L,Vannini F, Buda R. Joint sparing treatments in early ankle osteoarthritis: current procedures and future perspectives. J Exp Orthop 2016;3(1):3. https://doi.org/10.1186/s40634-016-0038-4
50. Chen C, Bang S, Cho Y, Lee S, Lee I, Zhang S, et al. Research trends in biomimetic medical materials for tissue engineering: 3D bioprinting, surface modification, nano/micro-technology and clinical aspects in tissue engineering of cartilage and bone. Biomater Res 2016;20:10. https://doi.org/10.1186/s40824-016-0057-3
51. Li F, Su Y, Wang J, Wu G, Wang C. Influence of dynamic load on friction behavior of human articular cartilage, stainless steel and polyvinyl alcohol hydrogel as artificial cartilage. J Mater Sci Mater Med 2010;21(1):147-54. https://doi.org/10.1007/s10856-009-3863-5
52. Villanueva I, Hauschulz DS, Mejic D, Bryant SJ. Static and dynamic compressive strains influence nitric oxide production and chondrocyte bioactivity when encapsulated in PEG hydrogels of different crosslinking densities. Osteoarthritis Cartilage 2008;16(8):909-18. https://doi.org/10.1016/j.joca.2007.12.003
53. Elisseeff J, Anseth K, Sims D, McIntosh W, Randolph M, Yaremchuk M, et al. Transdermal photopolymerization of poly(ethylene oxide)-based injectable hydrogels for tissue-engineered cartilage. Plast Reconstr Surg 1999;104(4):1014-22. PMID: 10654741
54. Bryant SJ, Anseth KS.Hydrogel properties influence ECM production by chondrocytes photoencapsulated in poly(ethylene glycol) hydrogels. J Biomed Mater Res 2002;59(1):63-72. https://doi.org/10.1002/jbm.1217
55. Martens PJ, Bryant SJ, Anseth KS.Tailoring the degradation of hydrogels formed from multivinyl poly(ethylene glycol) and poly(vinyl alcohol) macromers for cartilage tissue engineering. Biomacromolecules 2003;4(2):283-92. https://doi.org/10.1021/bm025666v
56. Sharma B, Williams CG, Khan M, Manson P, Elisseeff JH. In vivo chondrogenesis of mesenchymal stem cells in a photopolymerized hydrogel. Plast Reconstr Surg 2007;119(1):112-20. https://doi.org/10.1097/01.prs.0000236896.22479.52
57. Sontjens SHM, Nettles DL, Carnahan MA, Setton LA, Grinstaff MW. Biodendrimer-based hydrogel scaffolds for cartilage tissue repair. Biomacromolecules 2006;7:310. https://doi.org/10.1021/bm050663e
58. Tatara AM, Mikos AG.Tissue engineering in Orthopaedics. J Bone Joint Surg Am 2016;98(13):1132-9. https://doi.org/10.2106/JBJS.16.00299
59. Vo TN, Tabata Y, Mikos AG. Effects of cellular parameters on the in vitro osteogenic potential of dual-gelling mesenchymal stem cell-laden hydrogels. J Biomater Sci Polym Ed 2016;27(12):1277-90. https://doi.org/10.1080/09205063.2016.1195157
60. Bryant SJ, Arthur JA, Anseth KS. Incorporation of tissue-specific molecules alters chondrocyte metabolism and gene expression in photocrosslinked hydrogels. Acta Biomater 2005;1:243. https://doi.org/10.1016/j.actbio.2004.11.003
61. Varghese S, Hwang NS, Canver AC, Theprungsirikul P, Lin DW, Elisseeff J. Chondroitin sulfate based niches for chondrogenic differentiation of mesenchymal stem cells. Matrix Biol 2008;27(1):12-21. https://doi.org/10.1016/j.matbio.2007.07.002
62. Smeriglio P, Lai JH, Yang F, Bhutani N. 3D hydrogel scaffolds for articular chondrocyte culture and cartilage generation. J Vis Exp 2015;(104). https://doi.org/10.3791/53085
63. Barros D, Amaral IF, Pego AP. Biomimetic synthetic self-assembled hydrogels for cell transplantation. Curr Top Med Chem 2015;15(13):1209-26. https://doi.org/10.2174/1568026615666150330111057
64. Han F, Yang X, Zhao J, Zhao Y, Yuan X. Photocrosslinked layered gelatin-chitosan hydrogel with graded compositions for osteochondral defect repair. J Mater Sci Mater Med 2015;26(4):160. https://doi.org/10.1007/s10856-015-5489-0
65. Spiller KL, Maher SA, Lowman AM. Hydrogels for the repair of articular cartilage defects.Tissue Eng Part B Rev 2011;17(4):281-99. https://doi.org/10.1089/ten.TEB.2011.0077
66. Beck EC, Barragan M, Tadros MH, Gehrke SH, Detamore MS. Approaching the compressive modulus of articular cartilage with a decellularized cartilage-based hydrogel. Acta Biomater 2016;38:94-105. https://doi.org/10.1016/j.actbio.2016.04.019
67. Nicodemus GD, Skaalure SC, Bryant SJ. Gel structure has an impact on pericellular and extracellular matrix deposition, which subsequently alters metabolic activities in chondrocyte-laden PEG hydrogels. Acta Biomater 2011;7(2):492-504. https://doi.org/10.1016/j.actbio.2010.08.021
68. Chung C, Beecham M, Mauck RL, Burdick JA.The influence of degradation characteristics of hyaluronic acid hydrogels on in vitro neocartilage formation by mesenchymal stem cells. Biomaterials 2009;30(26):4287-96. https://doi.org/10.1016/j.biomaterials.2009.04.040
69. Bryant SJ, Bender RJ, Durand KL, Anseth KS. Encapsulating chondrocytes in degrading PEG hydrogels with high modulus: engineering gel structural changes to facilitate cartilaginous tissue production. Biotechnol Bioeng 2004;86(7):747-55. https://doi.org/10.1002/bit.20160
70. Roberts JJ, Nicodemus GD, Greenwald EC, Bryant SJ. Degradation improves tissue formation in (un)loaded chondrocyte-laden hydrogels. Clin Orthop Relat Res 2011;469(10):2725-34. https://doi.org/10.1007/s11999-011-1823-0
71. Bahney CS, Hsu CW, Yoo JU, West JL, Johnstone B. A bioresponsive hydrogel tuned to chondrogenesis of human mesenchymal stem cells. FASEB J 2011;25(5):1486-96. https://doi.org/10.1096/fj.10-165514
72. Skaalure SC, Chu S, Bryant SJ. An enzyme-sensitive PEG hydrogel based on aggrecan catabolism for cartilage tissue engineering. Adv Healthc Mater 2015;4(3):420-31. https://doi.org/10.1002/adhm.201400277
73. Liebesny PH, Byun S, Hung HH, Pancoast JR, Mroszczyk KA, Young WT, et al. Growth factor-mediated migration of bone marrow progenitor cells for accelerated scaffold recruitment. Tissue Eng Part A 2016;22(13-14):917-27. https://doi.org/10.1089/ten.TEA.2015.0524
74. Sharma B, Fermanian S, Gibson M, Unterman S, Herzka D, Cascio B, et al. Human cartilage repair with a photoreactive adhesive-hydrogel composite. Sci Transl Med 2013;5(167):167ra6. https://doi.org/10.1126/scitranslmed.3004838
75. Aisenbrey EA, Bryant SJ. Mechanical loading inhibits hypertrophy in chondrogenically differentiating hMSCs within a biomimetic hydrogel. J Mater Chem B Mater Biol Med 2016;4(20):3562-74. https://doi.org/10.1039/c6tb00006a
76. Urban JP, Bayliss MT. Regulation of proteoglycan synthesis rate in cartilage in vitro: influence of extracellular ionic composition. Biochim Biophys Acta 1989;992(1):59-65. https://doi.org/10.1016/0304-4165(89)90050-0
77. Villanueva I, Gladem SK,Kessler J, Bryant SJ. Dynamic loading stimulates chondrocyte biosynthesis when encapsulated in charged hydrogels prepared from poly(ethylene glycol) and chondroitin sulfate. Matrix Biol 2010;29(1):51-62. https://doi.org/10.1016/j.matbio.2009.08.004
78. Farnsworth NL, Mead BE, Antunez LR, Palmer AE, Bryant SJ. Ionic osmolytes and intracellular calcium regulate tissue production in chondrocytes cultured in a 3D charged hydrogel. Matrix Biol 2014;40:17-26. https://doi.org/10.1016/j.matbio.2014.08.002
79. Villanueva I, Weigel CA, Bryant SJ. Cell-matrix interactions and dynamic mechanical loading influence chondrocyte gene expression and bioactivity in PEG-RGD hydrogels. Acta Biomater 2009;5(8):2832-46. https://doi.org/10.1016/j.actbio.2009.05.039
80. Salinas CN, Cole BB, Kasko AM, Anseth KS. Chondrogenic differentiation potential of human mesenchymal stem cells photoencapsulated within poly(ethylene glycol)-arginine-glycine-aspartic acid-serine thiol-methacrylate mixed-mode networks. Tissue Eng 2007;13(5):1025-34. https://doi.org/10.1089/ten.2006.0126
81. Liu SQ, Tian Q, Wang L, Hedrick JL, Hui JH, Yang YY, et al. Injectable biodegradable poly(ethylene glycol)/RGD peptide hybrid hydrogels for in vitro chondrogenesis of human mesenchymal stem cells. Macromol Rapid Commun 2010;31(13):1148-54. https://doi.org/10.1002/marc.200900818
82. Hoyle CE, Bowman CN. Thiol-ene click chemistry. Angew Chem Int Ed Engl 2010;49(9):1540-73. https://doi.org/10.1002/anie.200903924
83. Steinmetz NJ, Aisenbrey EA, Westbrook KK, Qi HJ, Bryant SJ. Mechanical loading regulates human MSC differentiation in a multi-layer hydrogel for osteochondral tissue engineering. Acta Biomater 2015;21:142-53. https://doi.org/10.1016/j.actbio.2015.04.015
84. Hoemann C, Kandel R, Roberts S, Saris DB, Creemers L, Mainil-Varlet P, et al. International Cartilage Repair Society (ICRS) Recommended Guidelines for Histological Endpoints for Cartilage Repair Studies in Animal Models and Clinical Trials. Cartilage 2011;2(2):153-72. https://doi.org/10.1177/1947603510397535
85. Pascual-Garrido C, Aisenbrey EA, Rodriguez-Fontan F, Payne KA, Bryant SJ, Goodrich LR. Photopolymerizable injectable cartilage mimetic hydrogel for the treatment of focal chondral lesions: aproof of concept study in a rabbit animal model. Am J Sports Med 2019;47(1):212. https://doi.org/10.1177/0363546518808012
86. Orth P, Madry H. Complex and elementary histological scoring systems for articular cartilage repair. Histol Histopathol 2015;30(8):911-9. https://doi.org/10.14670/HH-11-620
87. He Y, Yang F, Zhao H, Gao Q, Xia B, Fu J. Research on the printability of hydrogels in 3D bioprinting. Sci Rep 2016;6:29977. https://doi.org/10.1038/srep29977
88. Guo X, Park H, Young S, Kretlow JD, van den Beucken JJ, Baggett LS, et al. Repair of osteochondral defects with biodegradable hydrogel composites encapsulating marrow mesenchymal stem cells in a rabbit model. Acta Biomater 2010;6(1):39-47. https://doi.org/10.1016/j.actbio.2009.07.041
89. Lim CT, Ren X, Afizah MH, Tarigan-Panjaitan S, Yang Z, Wu Y, et al. Repair of osteochondral defects with rehydrated freeze-dried oligo[poly(ethylene glycol) fumarate] hydrogels seeded with bone marrow mesenchymal stem cells in a porcine model. Tissue Eng Part A 2013;19(15-16):1852-61. https://doi.org/10.1089/ten.TEA.2012.0621
90. Lam J, Lu S, Lee EJ, Trachtenberg JE, Meretoja VV, Dahlin RL, et al. Osteochondral defect repair using bilayered hydrogels encapsulating both chondrogenically and osteogenically pre-differentiated mesenchymal stem cells in a rabbit model. Osteoarthritis Cartilage 2014;22(9):1291-300. https://doi.org/10.1016/j.joca.2014.06.035
91. Saxena V, Kim M, Keah NM, Neuwirth AL, Stoeckl BD, Bickard K, et al. Anatomic mesenchymal stem cell-based engineered cartilage constructs for biologic total joint replacement. Tissue Eng Part A 2016;22(3-4):386-95. https://doi.org/10.1089/ten.tea.2015.0384
92. Lespasio MJ, Piuzzi NS, Husni ME, Muschler GF, Guarino A, MA M. Knee osteoarthritis: A primer. Perm J 2017;21:16-183. https://doi.org/10.7812/TPP/16-183
93. Lespasio MJ, Sultan AA, Piuzzi NS, Khlopas A, Husni ME, Muschler GF, et al. Hip osteoarthritis: A primer. Perm J 2018;22:17-084. https://doi.org/10.7812/TPP/17-084
94. Iorio R, Robb WJ, Healy WL, Berry DJ, Hozack WJ, Kyle RF, et al. Orthopaedic surgeon workforce and volume assessment for total hip and knee replacement in the United States: preparing for an epidemic. J Bone Joint Surg Am 2008;90(7):1598-605. https://doi.org/10.2106/JBJS.H.00067
95. Moutos FT, Glass KA, Compton SA, Ross AK, Gersbach CA, Guilak F, et al. Anatomically shaped tissue-engineered cartilage with tunable and inducible anticytokine delivery for biological joint resurfacing. Proc Natl Acad Sci USA 2016;113(31):E4513-22. https://doi.org/10.1073/pnas.1601639113
96. Rowland CR, Colucci LA, Guilak F. Fabrication of anatomically-shaped cartilage constructs using decellularized cartilage-derived matrix scaffolds. Biomaterials 2016;91:57-72. https://doi.org/10.1016/j.biomaterials.2016.03.012
97. Rey-Rico A, Cucchiarini M, Madry H. Hydrogels for precision meniscus tissue engineering: a comprehensive review. Connect Tissue Res 2017;58(3-4):317-328. https://doi.org/10.1080/03008207.2016.1276576
98. Shaw N, Erickson C, Bryant SJ, Ferguson VL, Krebs MD, Hadley-Miller N, et al. Regenerative medicine approaches for the treatment of pediatric physeal injuries. Tissue Eng Part B Rev 2018;24(2):85-97. https://doi.org/10.1089/ten.TEB.2017.0274
99. Gibbs DM, Black CR, Dawson JI, Oreffo RO. A review of hydrogel use in fracture healing and bone regeneration. J Tissue Eng Regen Med 2016;10(3):187-98. https://doi.org/10.1002/term.1968
100. Pot MW, Gonzales VK, Buma P, IntHout J, van Kuppevelt TH, de Vries RBM, et al. Improved cartilage regeneration by implantation of acellular biomaterials after bone marrow stimulation: a systematic review and meta-analysis of animal studies. Peer J 2016;4:e2243. https://doi.org/10.7717/peerj.2243
101. Shive MS, Stanish WD, McCormack R, Forriol F, Mohtadi N, Pelet S, et al. BST-CarGel(R) treatment maintains cartilage repair superiority over microfracture at 5 years in a multicenter randomized controlled trial. Cartilage 2015;6(2):62-72. https://doi.org/10.1177/1947603514562064
Información adicional
Conflicto de intereses: La doctora Pascual-Garrido
recibe apoyo para la investigación a través de Biomet-Zimmer, Orthopaedic
Research and Education Foundation (OREF) y la American Orthopaedic Society for
Sports Medicine (AOSSM)-SANOFI.
Cómo citar este artículo: Rodríguez-Fontán F,
Pascual-Garrido C. Hidrogeles de polimerización in situ para la regeneración de cartílago
articular. Rev Asoc Argent Ortop Traumatol 2019;84(3):296-308. http://dx.doi.org/10.15417/issn.1852-7434.2019.84.3.956