Introducción
Las membranas formadas alrededor de implantes y cuerpos extraños han sido estudiadas durante años. Se forman alrededor de balas, astillas o como reacción a intervenciones terapéuticas (marcapasos, artroplastias, osteosíntesis); en estos últimos casos, la membrana que se forma alrededor del implante es, en general, contraproducente para el propósito del implante.1,2Se han destinado muchos esfuerzos para controlar el espesor y la vascularización de estas membranas, y su formación; en general, el material del que está compuesto el implante, la topografía de su superficie, su porosidad, dimensiones, ubicación e hidrofobicidad pueden afectar la formación de la membrana.1,3
El desafío del cirujano ante pérdidas óseas consiste en seleccionar el método ideal de reconstrucción para cada paciente. La técnica de reconstrucción en dos etapas descrita por Masquelet, basada en la formación de una membrana inducida alrededor del cemento quirúrgico y el posterior agregado de injerto óseo, ha ganado gran popularidad por su simplicidad, bajo costo y por ser técnicamente simple y fácil de reproducir.4 Se han probado muchos métodos para incrementar la formación ósea y disminuir los tiempos hasta la consolidación con la técnica de Masquelet, entre los más destacados, se pueden mencionar la variación en el tiempo entre las dos etapas, la suplementación con factores de crecimiento o terapias celulares y el uso de diferentes polimetilmetacrilatos. En 2016, Masquelet remarcó que aún no se ha establecido la mejor combinación entre una membrana inducida por cemento, y el material osteoconductivo y osteoinductivo puesto dentro de la membrana. La bibliografía actual señala que las investigaciones deberían enfocarse en la adición de sustancias que ejerzan efectos beneficiosos en la constitución de la membrana, para mejorar la incorporación de los injertos óseos y disminuir el lapso entre la primera y segunda cirugía.5,6 Por otra parte, los argumentos de los cirujanos para usar el “metal preferido” en pérdidas óseas varían y, al elegir entre diferentes materiales para implantes, principalmente, deben balancear las ventajas y desventajas de usar acero o titanio.7,8,9
El propósito de este estudio experimental fue analizar y comparar las características de las membranas que se forman alrededor de espaciadores de cemento con antibióticos y espaciadores de cemento con antibióticos y corticoide; así como la que se desarrolla rodeando a implantes de titanio y acero.
Materiales y Métodos
Se llevó a cabo un estudio experimental utilizando 20 conejos neozelandeses, con un peso promedio de 2500 kg, divididos en dos grupos de 10 conejos cada uno. El procedimiento fue aprobado por el Comité Institucional de Ética de Investigación en Salud de nuestra institución. Se trabajó sobre ambos fémures. En el grupo 1, se colocaron un espaciador de cemento con antibióticos (gentamicina más vancomicina) en el fémur derecho y una prótesis de titanio (clavo TEN de 2,0 mm) en el fémur izquierdo, y en el grupo 2, un espaciador de cemento con antibióticos (gentamicina más vancomicina) más un corticoide (hidrocortisona) en el fémur derecho y una prótesis de acero (clavija de 2,0 mm) en el fémur izquierdo. El procedimiento quirúrgico se llevó a cabo en el laboratorio de cirugía experimental de un centro universitario autorizado.
La inducción anestésica se realizó con ketamina por vía intramuscular (60 mg/kg) y diazepam 1/3 por vía intramuscular y 2/3 por vía intrarrectal (5 mg/kg). A todos los conejos, se les administró cefalomicina 20 mg/kg por vía intramuscular, antes de la cirugía y después de ella. Como analgesia posquirúrgica se administró ketorolac 1 mg/kg por vía intramuscular.
Se realizó un abordaje lateral longitudinal al eje del fémur, se disecó por planos hasta llegar al hueso y se elevó el periostio. En el grupo 1, se colocó una prótesis de titanio (fragmento de clavo TEN de 2,0 mm) de 4 cm de largo, en el fémur izquierdo y un espaciador de cemento de igual tamaño con antibióticos (gentamicina más vancomicina) en el fémur derecho (Figuras 1 y 2). En el grupo 2, se colocó una prótesis de acero (fragmento de clavija de acero) de 4 cm de largo, en el fémur izquierdo y un espaciador de cemento de igual tamaño con antibióticos (gentamicina más vancomicina) y corticoide en polvo (hidrocortisona), en el fémur derecho. Se cerró la herida quirúrgica por planos. Se utilizó cemento quirúrgico SUBITON® G (dosis de 40 g de polvo y 20 ml de líquido esterilizado más gentamicina), que fue moldeado durante el procedimiento quirúrgico, formando tacos cilíndricos de 4 cm de largo, con un peso promedio de 0,5 g. Durante su preparación, se incorporó vancomicina en polvo 2 g para el grupo 1 y vancomicina más hidrocortisona en polvo 2 g, para el grupo 2.
A las seis semanas, todos los conejos fueron sacrificados y se tomaron radiografías e imágenes por resonancia magnética y tomografía computarizada de ambos fémures (Figuras 3 y 4). Las radiografías y las imágenes por resonancia y tomografía fueron evaluadas por un radiólogo especialista en el sistema musculoesquelético, que midió la formación de puentes óseos e inflamación en los distintos materiales colocados en cada conejo. Las resonancias se efectuaron con un equipo Philips® Achieva 1,5 T; se utilizó una antena de rodilla de 8 canales. Las tomografías se realizaron con un tomógrafo Siemens SOMATOM Sensation multislice de 64 canales. Se determinó la formación de puentes óseos mediante cruces (x = 1/3, xx = 2/3, xxx = 3/3).
Al extraer los diferentes materiales se evaluaron: el espesor de la membrana, la adherencia de la membrana al material y la formación ósea alrededor del material; estos tres aspectos fueron clasificados por los autores mediante una escala de 0 a 3 cruces, según su magnitud, donde 0 indica ausente y 3, muy marcada. Las membranas que se formaron alrededor de los implantes y el cemento fueron luego meticulosamente disecadas para no dañarlas, y se conservaron en formalina al 10%.
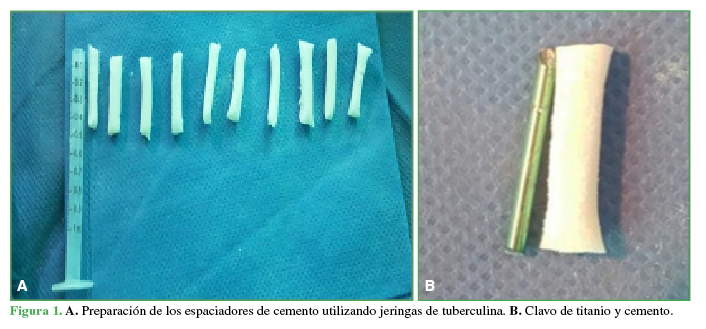 Figura 1
Figura 1.
Figura 1
Figura 1.
A. Preparación de los espaciadores de cemento utilizando jeringas de tuberculina. B. Clavo de titanio y cemento.
Propia
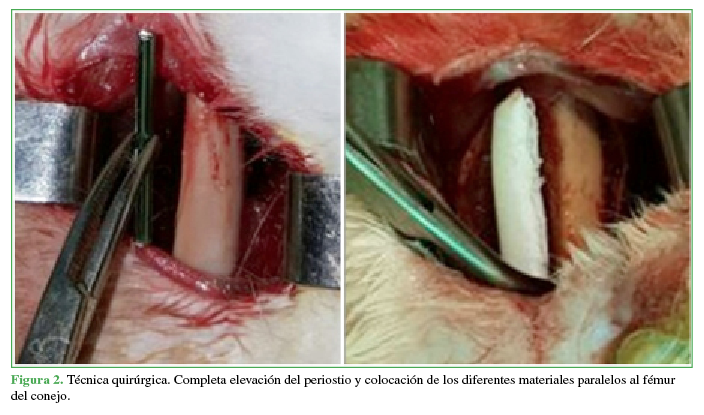 Figura 2
Figura 2. Técnica quirúrgica.
Figura 2
Figura 2. Técnica quirúrgica.
Completa elevación del periostio y colocación de los diferentes materiales paralelos al fémur del conejo.
Propia
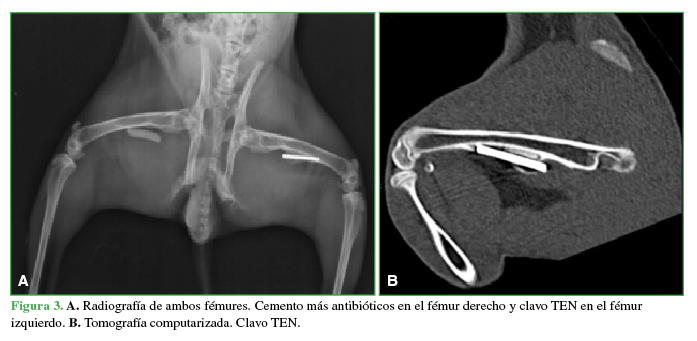 Figura 3
Figura 3.
Figura 3
Figura 3.
A. Radiografía de ambos fémures. Cemento más antibióticos y en el fémur derecho y clavo TEN en el fémur izquierdo, B. Tomografía computarizada. Clavo TEN.
Propia
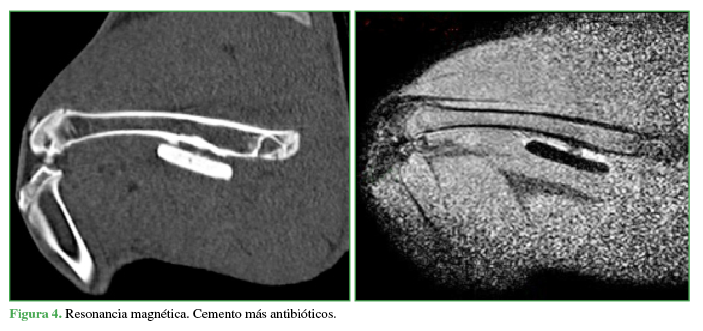 Figura 4
Resonancia magnética.
Figura 4
Resonancia magnética.
Cemento más antibióticos.
Para la evaluación
histológica los cortes se obtuvieron seccionando una muestra de 2 x 2 cm, que
luego se incluyó en parafina. Se efectuaron múltiples cortes de 6 mm de espesor
con micrótomo y se los tiñó con hematoxilinaeosina para observarlos mediante
microscopia de luz convencional. Se realizó la evaluación cualitativa y
cuantitativa de las muestras, y se determinaron la proliferación celular y
vascular, y el grado de fibrosis e inflamación. Todas estas variables fueron
expresadas en cruces según la actividad (- = ausente, + = leve, ++ = moderada,
+++ = intensa). Todas las muestras fueron evaluadas por el mismo patólogo.
Resultados
A la sexta semana de colocar los diferentes materiales, se evaluaron 17 conejos; 9 del grupo 1 y 8 del grupo 2 (3 murieron: 1 del grupo 1 y 2 del grupo 2).
Al extraer los diferentes materiales se observó macroscópicamente que: la membrana formada alrededor del cemento con antibióticos era significativamente más ancha que las del resto, seguida de la que rodeaba a las clavijas de acero, esta era muy fina en los grupos de cemento con corticoide y clavos de titanio; por el contrario, la membrana mostró mayor adherencia en el grupo de clavos de titanio y de cemento con corticoide. Solo se observó una significativa formación ósea alrededor de los clavos de titanio (Tabla y Figuras 5,6,7 y 8)
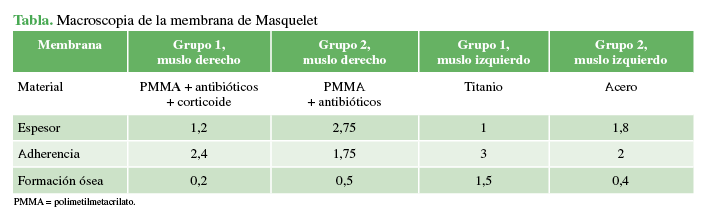 Tabla
Macroscopia de la membrana de Masquelet.
Propia
Tabla
Macroscopia de la membrana de Masquelet.
Propia
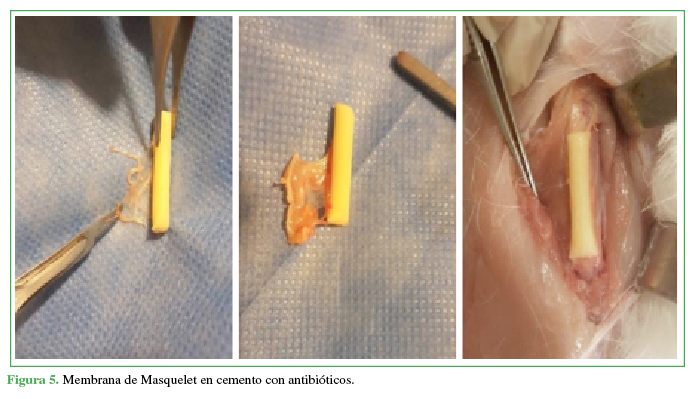 Figura 5
Figura 5
Membrana de Masquelet en cemento con antibióticos.
Propia
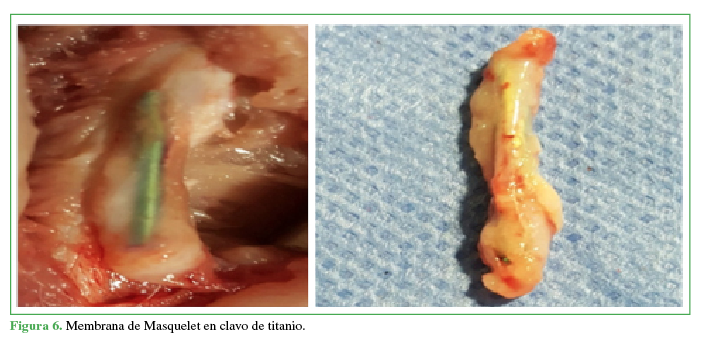 Figura 6
Membrana de Masquelet en clavo de titanio
Propia
Figura 6
Membrana de Masquelet en clavo de titanio
Propia
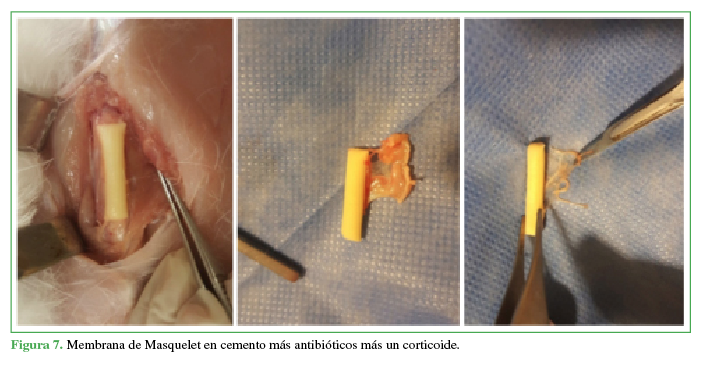 Figura 7
Figura 7
Membrana de Masquelet en cemento más antibióticos más un corticoide.
Propia
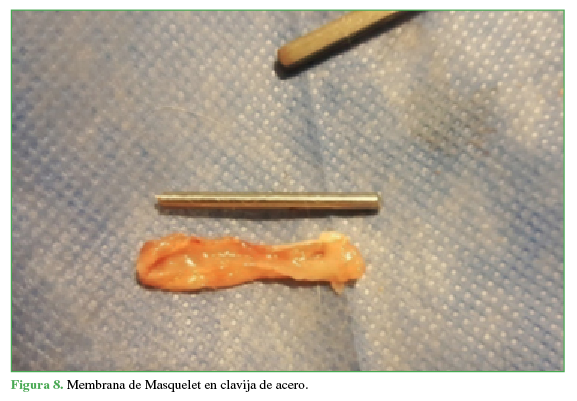 Figura 8
Figura 8
Membrana de Masquelet en clavija de acero.
Propia
Respecto a la anatomía patológica, en términos globales, el grupo con cemento más un corticoide presentó menos inflamación (p = 0,0502) que el grupo con cemento sin corticoide, sin diferencias con el que recibió una clavija (p = 0,322) (clavija vs. clavo; p = 0,365). Este último (clavija) se distinguió por presentar mayor actividad de proliferación epitelial (p = 0,026), la actividad fue mediana para los animales con cemento y escasa en aquellos con corticoide (p = 0,071).
La presencia de fibrosis y la proliferación vascular no difirieron en los grupos (p = 0,85 y p = 0,369, respectivamente), hubo una leve tendencia (p = 0,107) de menor actividad vascular en el grupo tratado con cemento más corticoide. Los grupos a los que se colocó una clavija y un clavo no se diferenciaron en este indicador (p = 0,737) (Figura 9).
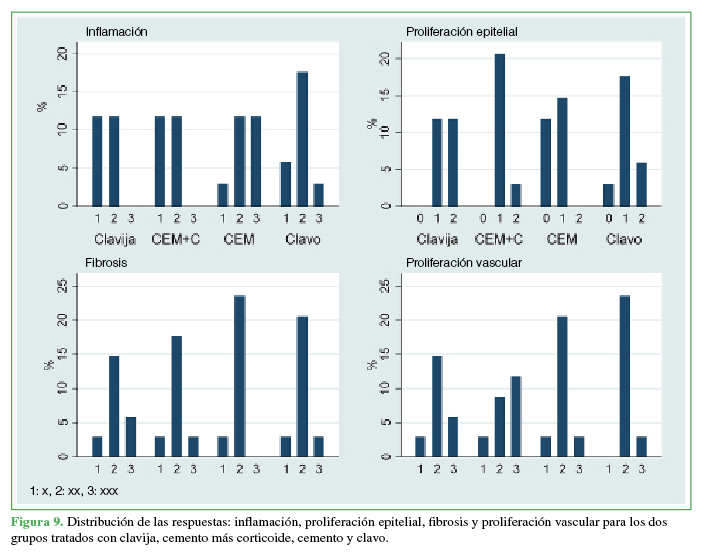 Figura 9
Figura 9
Distribución de las respuestas: inflamación, proliferación epitelial, fibrosis y proliferación vascular para los dos grupos tratados con clavijas, cemento más corticoide, cemento y clavo.
Propia
No hubo diferencias significativas entre los lados (derecho = cemento más corticoide, izquierdo = clavija) en las radiografías y las imágenes tomográficas (p = 0,310, p = 0,988, respectivamente). Respecto a la resonancia magnética, la mayoría de las respuestas indicaron sin osteointegración o una escala de valoración de hasta 1/3. Se destaca que el 87% de los animales a los que se les colocó clavijas no tuvieron observaciones de osteointegración debido a distorsión de la imagen o pérdida de señal producidas por la característica del material (metal), en tanto que ese mismo porcentaje mostró una respuesta de 1/3 y 2/3 de osteointegración en los animales con cemento más corticoide. Es esta tendencia la que se distinguió significativamente (p = 0,003) entre ambos (Figura 10).
La inflamación observada en la resonancia del primer grupo no mostró diferencias significativas (p = 0,592) entre cemento y clavo, lo que indica que su presencia no depende de la técnica utilizada, las proporciones de este síntoma son semejantes (3/8 vs. 2/8, respectivamente). Respecto al segundo grupo (cemento con corticoide vs. clavija de acero), se observaron proporciones iguales, sin diferencias significativas (p = 0,319).
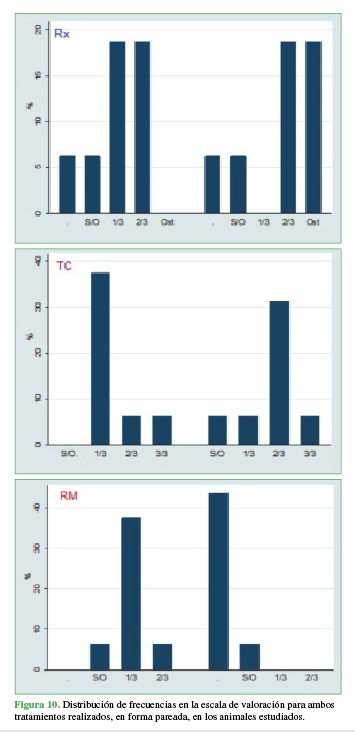 Figura 10
Figura 10
Distribución de frecuencias en la escala de valoración para ambos tratamientos realizados, en forma pareada, en los animales estudiados.
Propia
Discusión
Los defectos óseos segmentarios pueden ser secundarios a traumas de alta energía, resecciones tumorales, infecciones o cirugías de revisión.10,11,12 El objetivo del tratamiento es erradicar el tumor o la infección y el dolor, y lograr la consolidación manteniendo la longitud y alineación del hueso, con un rango articular funcional.13,14,15,16,17 Se han descrito distintas opciones de reconstrucción para pérdidas óseas segmentarias, la colocación de un espaciador de cemento con antibióticos (técnica conocida como membrana inducida de Masquelet) está entre las más utilizadas.12,13,14,15,16,17,18
Las limitaciones de este estudio son: no haber creado un defecto óseo y, por ende, los materiales no fueron sometidos a carga; no haber realizado la segunda etapa de la técnica (que consiste en la colocación del injerto óseo) y no haber realizado inmunohistoquímica de las muestras (para determinar los factores de crecimiento y el factor de crecimiento endotelial vascular). Nuestro estudio mostró que la membrana formada alrededor del cemento con corticoide fue fina y adherente, con una similitud macroscópica con la membrana formada alrededor del titanio, pero no evidenció formación ósea a su alrededor como lo hicieron los clavos de titanio, y presentó menos vascularización que el cemento con antibióticos, pero esta diferencia no fue estadísticamente significativa.
La membrana inducida por el cemento es una cápsula fibrosa, tiene algunas similitudes con el periostio.19 La técnica descrita por Masquelet combina la inducción de una membrana vascularizada por medio de un espaciador de cemento con posterior colocación de injerto óseo esponjoso. El primer papel del espaciador es mecánico, llena los espacios muertos, evita la invasión de tejido fibroso, mantiene el largo y el alineamiento del hueso, y prepara el lecho receptor para un futuro injerto óseo; además, libera altas concentraciones locales de antibióticos, con una mínima distribución sistémica. El segundo papel es biológico, por la inducción de la membrana circundante; la membrana formada tiene las características de un revestimiento sinovial, se compone principalmente de colágeno tipo I y fibroblastos, y su superficie interior es rica en vasos sanguíneos. Puede secretar proteína morfogenética ósea 2, factor de crecimiento endotelial vascular, factor de unión central α1, interleucina 6, colagenasa I, y otros factores de crecimiento para estimular la reconstrucción del defecto óseo.20,21,22La remoción de esta capa interna de la membrana inducida por el cemento genera el sangrado de un lecho vascular, mientras preserva la función mecánica del resto del envoltorio fibroso de la membrana inducida, enriqueciendo el ambiente biológico en el lecho, y así se incrementa la regeneración ósea.23 En nuestro estudio, obtuvimos las mismas características macroscópicas e histológicas de una membrana sinovial, con fibroblastos, proliferación vascular y epitelial.
Los cambios estructurales morfológicos y moleculares de la membrana inducidos por el paso del tiempo sugirieron que el momento óptimo para el injerto de hueso autólogo es de 6 a 8 semanas.20-24
Los injertos óseos deben estar cubiertos por tejidos sanos, para ser revascularizados. De acuerdo con Masquelet y cols.,6la función de la membrana inducida es, por lo tanto, proteger el injerto del medio ambiente para prevenir la reabsorción.
Pelissier y cols.25 encontraron altas concentraciones de estos factores osteogénicos desde la semana 4 después de la cirugía de la etapa 1. En nuestro estudio, aunque no pudimos realizar ningún ensayo cuantitativo de los factores osteogénicos, debido a restricciones por falta de reactivos, sí encontramos histológicamente gran proliferación vascular, lo que sugiere la presencia de factor de crecimiento endotelial vascular, con excepción del grupo 2 con cemento más corticoide, en el que se observó menor proliferación vascular, así como también menor proliferación epitelial y menos inflamación con respecto al grupo 1 y al miembro contralateral del mismo grupo. La membrana funciona así para evitar la protrusión del tejido blando en el sitio del defecto óseo, proporciona un armazón para la osteoconducción, mantiene una vascularización adecuada y crea un espacio cerrado donde se conservan células y sustancias osteogénicas.
El polimetilmetacrilato utilizado para rellenar defectos óseos suele prepararse con antibióticos, lo que aumenta la concentración local en el defecto, pero la adición de estos antibióticos afecta las propiedades de la membrana inducida alrededor del cemento.26 La proporción de antibiótico que se coloca al preparar el cemento no debe sobrepasar el 5% de su masa (p. ej., 2 g de antibiótico cada 40 g de cemento) para que no se debilite y aumente el riesgo de fractura del cemento. Utilizamos vancomicina para confeccionarlo, ya que posee ciertas características, según los criterios de Murray, que posibilita su empleo en los espaciadores (es un fármaco termoestable, hipoalergénico, hidrosoluble, con un espectro bactericida adecuado y se presenta en forma de polvo).27
La elección del material del que está compuesto el implante reviste importancia en cuanto a la resistencia a la infección. La adherencia de los tejidos al implante es el factor más importante en su resistencia a las infecciones; sin adherencia, la irritación mecánica induce la formación de una cápsula que engloba un espacio muerto, esta cápsula disminuye el acceso de células que protegen la colonización bacteriana, y favorece el crecimiento y la propagación de bacterias.7,8 En este aspecto, el titanio es biológicamente superior al acero, por su mayor resistencia a la infección, debida a su adherencia a los tejidos periféricos y la disminución de los espacios muertos.8 Está bien documentada la mayor tolerancia observada con implantes de titanio en animales y en seres humanos.28,29,30
Conclusiones
Las membranas que se formaron alrededor de los materiales de osteosíntesis no difirieron significativamente desde el punto de vista anatomopatológico. Sí, se hallaron diferencias entre las membranas del cemento con corticoide y el cemento con antibiótico. En el primer caso, se observó menos inflamación y fibrosis, pero a su vez, menos proliferación vascular y epitelial.
Con respecto a la osteointegración, mediante la evaluación radiográfica y tomográfica, no se observaron diferencias significativas entre los grupos (derecho = cemento más corticoide, izquierdo = clavija) (p = 0,310 y p = 0,988, respectivamente). Según las imágenes por resonancia magnética del grupo 2, la mayoría de las respuestas indicaron sin osteointegración o una escala de valoración de hasta 1/3 de los animales a los que se les colocó una clavija, debido a distorsión de la imagen o pérdida de señal producida por las características del material (metal); en tanto que, para el cemento con corticoide, la respuesta fue de 1/3 y 2/3 de osteointegración, con significancia estadística (p = 0,003).
En cuanto a la inflamación valorada por resonancia magnética, en el primer grupo, no hubo diferencias significativas (p = 0,592) entre cemento con antibiótico y clavo TEN. En el segundo grupo, se observaron proporciones iguales en cuanto a la presencia o no de inflamación en el grupo con cemento más corticoide (p = 0,319).
Bibliografía
1. McBride-Gagyi S, Toth Z, Kim D, Ip V, Evans E, Watson T, et al. Altering spacer material affects bone regeneration in the Masquelet technique in a rat femoral defect. J Orthop Res 2018. https://doi.org/10.1002/jor.23866
2. Ward K. A review of the foreign body response to subcutaneously implanted devices: the role of macrophages and cytokines in biofouling and fibrosis. J Diabetes Sci Technol 2008;2:768-77. https://doi.org/10.1177/193229680800200504
3. Aho OM, Lehenkari P, Ristiniemi J, Lehtonen S, Risteli J, Leskeiä HV. The mechanism of action of induced membranes in bone repair. J Bone Joint Surg Am 2013;95(7):597-604. https://doi.org/10.2106/JBJS.L.00310
4. Allende C. Cement spacers with antibiotics for the treatment of posttraumatic infected nonunions and bone defects of the upper extremity. Tech Hand Surg 2010;14:241-7. https://doi.org/10.1097/BTH.0b013e3181f42bd3
5. Nau C, Seebach C, Trumma A, Schaible A, Kontradowitz K, Meier S, et al. Alteration of Masquelet’s induced membrane characteristics by different kinds of antibiotic enriched bone cement in a critical size defect model in the rat’s femur. Injury 2016;47:325-34. https://doi.org/10.1016/j.injury.2015.10.079
6. Masquelet AC. The evolution of the induced membrane technique: current status and future directions. Tech Orthop 2016;31:3-8. https://doi.org/10.1097/BTO.0000000000000160
7. Richards RG, Quen GR, Rahn BA, Gwynn I. A quantitative method of measuring cell adhesion areas (review). Cells Mater 1997;7:15-30. https://digitalcommons.usu.edu/cgi/viewcontent.cgi?article=1156&context=cellsandmaterials
8. Perren SM, Regazzoni P, Fernandez AA. How to choose between the implant materials steel and titanium in orthopaedic trauma surgery: Part 2 – biological aspects. Acta Chir Orthop Traumatol Cech 2017;84:85-90. http://www.achot.cz/dwnld/achot_2017_2_085_090.pdf
9. Perren SM, Regazzoni P, Fernandez AA. How to choose between the implant materials steel and titanium in orthopaedic trauma surgery: Part 1 – biological aspects. Acta Chir Orthop Traumatol Cech 2017;84:9-12. http:// www.achot.cz/dwnld/achot_2017_1_009_012.pdf
10. Ring D, Jupiter JB, Quintero J, Sanders RA, Marti RK. Atrophic ununited fractures of the humerus with a bony defect: treatment by wave-plate osteosynthesis. J Bone Joint Surg Br 2000;82:867-71. https://doi.org/10.1302/0301-620X.82B6.0820867
11. Lasanianos NG, Kanakaris NK, Giannoudis PV. Current management of long bone large segmental defects. Orthop Trauma 2010;24:149-63. https://doi.org/10.1002/jor.23845
12. Mauffrey C, Barlow BT, Smith W. Management of segmental bone defects. J Am Acad Orthop Surg 2015;23:143-53. https://doi.org/10.5435/JAAOS-D-14-00018
13. Lazzarini L, Mader J, Calhoun J. Osteomyelitis in long bones. J Bone Joint Surg Am 2004;86:2305-18. https://jbjs.org/reader.php?
14. Agner J, Kyle B, Cierny G, Webb L. Diagnosis and management of chronic infection. J Am Acad Orthop Surg 2011;19:8-19. https://journals.lww.com/jaaos/Fulltext/2011/02001/Diagnosis_and_Management_of_Chronic_ Infection.3.aspx
15. Fleming M, Watson T, Gaines R, O’Toole R. Evolution of orthopaedic reconstructive care. Am Acad Orthop Surg 2012;20:74-9. https://doi.org/10.5435/JAAOS-20-08-S74
16. Pelissier P, Boireau P, Martin D, Baudet J. Bone reconstruction of the lower extremity: complications and outcomes. Plast Reconstr Surg 2003;111:2223-9. https://doi.org/10.1097/01.PRS.0000060116.21049.53
17. Riley EH, Lane JM, Urist MR, Lyons KM, Lieberman JR. Bone morphogenetic protein-2: biology and applications. Clin Orthop Relat Res 1996;324:39-46. PMID: 8595775
18. Pipitone PS, Rehman S. Management of traumatic bone loss in the lower extremity. Orthop Clin North Am 2014;45:469-82. https://doi.org/10.1016/j.ocl.2014.06.008
19. Cuthbert RJ, Churchman SM, Tan HB, McGonagle D, Jones E, Giannoudis PV. Induced periosteum a complex cellular scaffold for the treatment of large bone defects. Bone 2013;57:484-92. https://doi.org/10.1016/j.bone.2013.08.009
20. Pelissier A, Masquelet R, Bareille S, Mathoulin Pelissier S, Amedee J. Induced membranes secrete growth factors including vascular and osteoinductive factors and could stimulate bone regeneration. J Orthop Research 2004;22:73-9. https://doi.org/10.1016/S0736-0266(03)00165-7
21. Gupta G, Ahmad S, Zahid M, Khan AH, Sherwani MK, Khan AQ. Management of traumatic tibial diaphyseal bone defect by “induced-membrane technique”. Indian J Orthop 2016;50:290-296. https://doi.org/10.4103/0019-5413.181780
22. Ambrose CG, Clyburn TA, Louden K, Joseph J, Wright J, Gulati P, et al. Effective treatment of osteomyelitis with biodegradable microspheres in a rabbit model. Clin Orthop Relat Res 2004;421:293-9. https://doi.org/10.1097/01.blo.0000126303.41711.a2
23. Luangphakdy V, Pluhar E, Piuzzi NS, D’Alleyrand JC, Carlson CS, Bechtold JE, et al. The effect of surgical technique and spacer texture on bone regeneration: A caprine study using the Masquelet technique. Clin Orthop Relat Res 2017;475:2575-85. https://doi.org/10.1007/s11999-017-5420-8
24. DeCoster T, Gehlert R, Mikola E, Pirela-Cruz M. Management of posttraumatic segmental bone defects. J Am Acad Orthop Surg 2004;12:28-38. https://journals.lww.com/jaaos/Fulltext/2004/01000/Management_of_Posttraumatic_ Segmental_Bone_Defects.5.aspx
25. Pelissier Ph, Masquelet AC, Lepreux S, Martin D, Baudet J. Behavior of cancellous bone graft placed in induced membranes. Br J Plast Surg 2002;55:598-600. https://doi.org/10.1054/bjps.2002.3936
26. Corona PS, Barro V, Mendez M, Cáceres E, Flores X. Industrially prefabricated cement spacers: do vancomycin and gentamicin-impregnated spacers offer any advantage? Clin Orthop Relat Res 2014;472:923-32. https://doi.org/10.1007/s11999-013-3342-7
27. Rathbone CR, Cross JD, Brown KV, Murray CK, Wenke JC. Effect of various concentrations of antibiotics on osteogenic cell viability and activity. J Orthop Res 2011;29:1070-4. https://doi.org/10.1002/jor.21343
28. Arens S, Schlegel U, Printzen G, Ziegler WJ, Perren SM, Hansis M. Influence of the materials for fixation implants on local infection. An experimental study of steel versus titanium DC-plates in rabbits. J Bone Joint Surg 1996;78:647-51. https://doi.org/10.1302/0301-620X.78B4.0780647
29. Hauke C, Schlegel U, Melcher GA, Printzen G, Perren SM. Local infection in relation to different implant materials. An experimental study using stainless steel and titanium solid, unlocked, intramedullary nails in rabbit. Orthop Trans 1997;21:835-83.
30. Ungersboeck A, Geret V, Pohler O, Schuetz M, Wuest W. Tissue reaction to bone plates made of pure titanium: a prospective, quantitative clinical study. J Mater Sci Mater Med 1995;6:223-9. https://doi.org/10.1007/BF00146860
Información adicional
Conflicto de intereses: Los autores no declaran conflictos de intereses
Cómo citar este artículo:: Lobos Centeno EA, Vanoli
F, López P, Mangupli M, Allende Nores CA. Diferencias entre las membranas
inducidas por diferentes implantes y cementos. Estudio experimental. Rev
Asoc Argent Ortop Traumatol 2019;84(3):285-295. http://dx.doi.org/10.15417/issn.1852-7434.2019.84.3.933















