



Artículos de revisión
Neosporosis bovina en Argentina: a 25 años del primer reporte en el país
Bovine neosporosis in Argentina: 25 years from the first report in the country
ANALECTA VETERINARIA
Universidad Nacional de La Plata, Argentina
ISSN: 1514-2590
Periodicidad: Semestral
vol. 41, núm. 1, e056, 2021
Recepción: 22 Mayo 2021
Revisado: 02 Julio 2021
Aprobación: 16 Julio 2021
Resumen: La neosporosis es una enfermedad de gran impacto en el ganado vacuno debido a que causa abortos en el segundo y último trimestre de la gestación. En esta revisión se resume y discute la información sobre la misma, recopilada de dos décadas y media de estudios en bovinos de Argentina. Se aportan datos sobre el diagnóstico, la prevalencia y los avances en el estudio de la enfermedad. Está dirigida a los médicos veterinarios dedicados al diagnóstico y a la investigación de la neosporosis y/o a la producción bovina.
Palabras clave: Neospora caninum, Argentina, diagnóstico, prevalencia.
Abstract: Neosporosis is a disease with great impact in cattle, responsible for abortions in the second and last trimester of gestation. The present revision summarizes and discusses information from two and a half decades of studies about the disease in cattle from Argentina, contributing data about prevalence, diagnosis and progress in the knowledge of the disease. This report will be of interest for veterinarians specialized in diagnosis and investigation of neosporosis and/or bovine production.
Keywords: Neospora caninum, Argentina, diagnosis, prevalence.
1. Generalidades
1.1. Introducción
Neospora caninum es un parásito protozoo del Phylum Apicomplexa causante de neosporosis en bovinos, enfermedad infecciosa caracterizada por la producción de abortos en vacas y lesiones neuromusculares en terneros recién nacidos (Dubey et al., 2017). Esta es una enfermedad global cuyo efecto negativo sobre la eficiencia reproductiva se manifiesta por las grandes pérdidas económicas que causa a la ganadería bovina. Un estudio reciente sobre fetos abortados de bovinos estableció que la neosporosis es la principal causa de abortos de origen infeccioso en la Argentina (Morrell et al., 2019). La neosporosis afecta en menor medida a otras especies animales incluyendo a los caninos, hospedadores definitivos (HD) naturales de N. caninum, en los que provoca con frecuencia cuadros neuromusculares (Bjerkas et al., 1984; Dubey et al., 1988; Thilsted & Dubey, 1989). En los pequeños rumiantes, la neosporosis también ha sido identificada como causa de abortos, tanto en Argentina como en el resto del mundo (Campero et al., 2018a; Dubey et al., 2017; Hecker et al., 2019a; Unzaga et al., 2014).
La presente revisión resume la información recopilada de dos décadas y media de estudios sobre la neosporosis en bovinos de Argentina; se aportan datos sobre el diagnóstico, la prevalencia y los avances en el estudio de esta enfermedad. El contenido de este trabajo es de interés para los médicos veterinarios dedicados al diagnóstico y a la investigación de la neosporosis y/o a la producción bovina.
1.2. Ciclo de vida
El ciclo de vida de N. caninum es heteroxeno, siendo el perro doméstico (Canis lupus familiaris), coyote (Canis latrans), dingo (Canis familiaris dingo) y lobo gris (Canis lupus) los HD, quienes descargan los ooquistes no esporulados al medio ambiente con la materia fecal (Basso et al., 2001; Dubey et al., 2011, 2014; Gondim et al., 2004; King et al., 2010; McAllister et al., 1998). Posteriormente los ooquistes esporulan bajo determinadas condiciones de temperatura y humedad, siendo infectivos para los hospedadores intermediarios (HI) cuando son ingeridos con el alimento y/o agua contaminada.
A diferencia de Toxoplasma gondii, protozoo filogenéticamente relacionado, N. caninum posee un repertorio de HI más limitado (Nolan et al., 2015; Reid et al., 2012) y no afecta al hombre (Dubey et al., 2017; McCann et al., 2008). Los rumiantes domésticos y algunas especies silvestres son los HI responsables de mantener el ciclo parasitario de N. caninum, actuando como reservorio (Dubey et al., 2017). El bovino es la especie en la que N. caninum alcanza su desarrollo óptimo, persistencia y transmisibilidad transplacentaria sin comprometer la vida del hospedador (Dubey et al., 2017; Reid et al., 2012).
Los estadios infectivos de N. caninum están representados por taquizoítos, bradizoítos (en el interior de los quistes tisulares) y esporozoítos (contenidos en los esporocistos dentro del ooquiste) (Fig. 1A). Los taquizoítos y los bradizoítos son estadios intracelulares de los hospedadores infectados. Los taquizoítos de N. caninum tienen forma de semiluna, miden aproximadamente 6 x 2 μm y carecen de gránulos de amilopectina; se caracterizan por su rápida división asexual intracelular, multiplicándose en la fase aguda de la enfermedad (Dubey et al., 2007).
Los quistes tisulares son redondos u ovoides y su tamaño varía considerablemente, dependiendo del número de bradizoítos que alojen en su interior (Dubey et al., 2007). En bovinos, los quistes tisulares se encuentran en el cerebro y en la médula espinal, poseen una pared < 2,5 μm de espesor y raramente exceden los 50 μm de diámetro (Dubey et al., 1989). También se han reportado quistes tisulares en el músculo esquelético (Peters et al., 2001). Los bradizoítos miden 8 x 2 μm, poseen un núcleo terminal y contienen algunos gránulos de amilopectina (Dubey et al., 2002). La presencia de quistes tisulares caracteriza la fase crónica de la enfermedad.
Los ooquistes, producto de la reproducción sexual en el HD, tienen forma esférica, miden 11,7 x 11,3 μm, tienen pared lisa de 0,6-0,8 μm de espesor y carecen de micrópilo. En su interior poseen 2 esporocistos elipsoidales (8,4 x 6,1 μm) y cada uno contiene 4 esporozoítos alargados de 6,5 μm x 2 μm (Lindsay et al., 1999b).
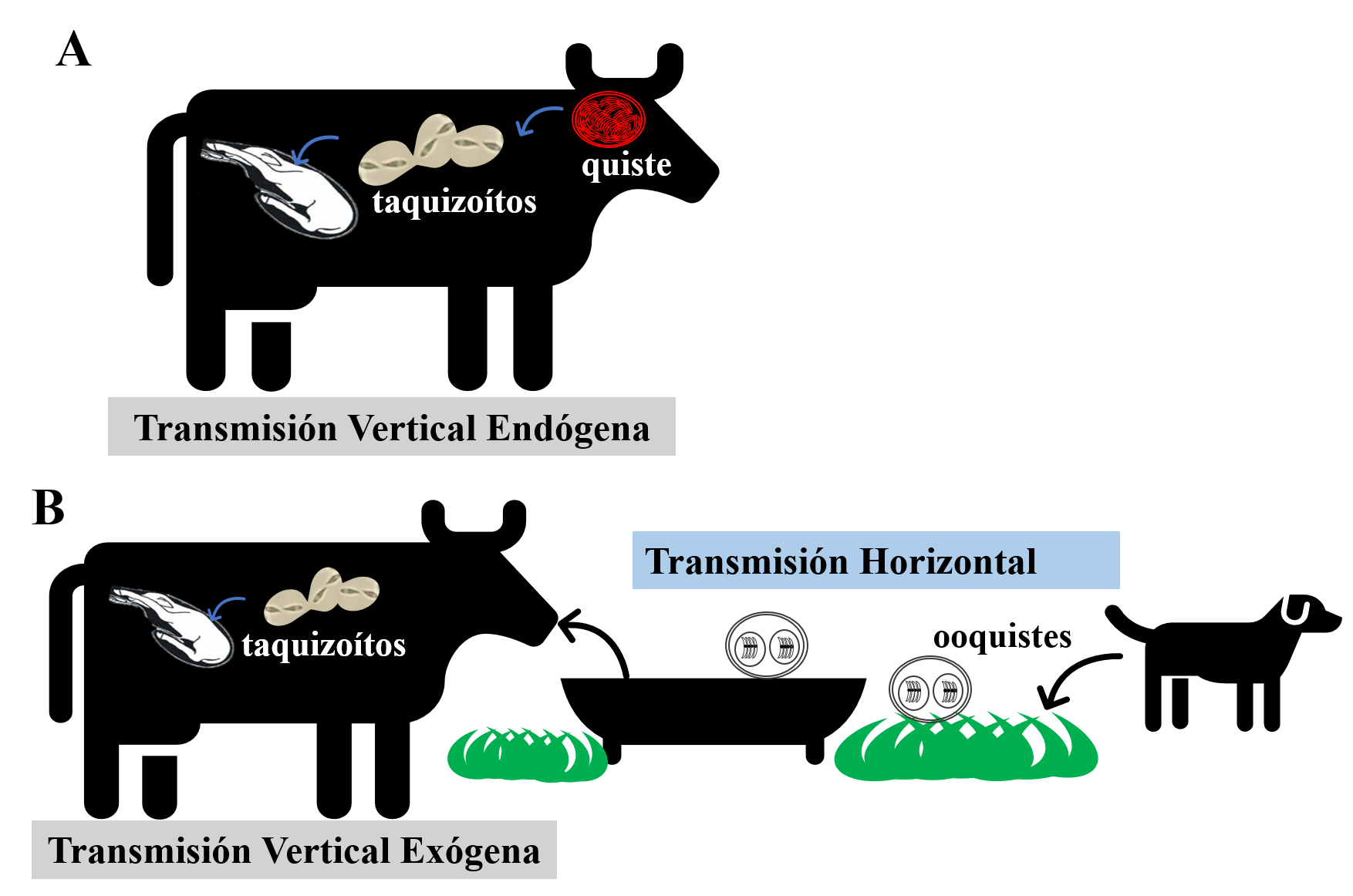
(A): Vía de transmisión transplacentaria endógena. Reactivación de quistes tisulares en la hembra preñada, crónicamente infectada, e infección del feto por pasaje transplacentario de taquizoítos. (B): vía transplacentaria exógena y transmisión horizontal. El perro elimina ooquistes a través de las heces, contaminado el agua y el alimento que consume el ganado (transmisión horizontal). Una hembra preñada adquiere la primoinfección por ingestión de ooquistes, produciéndose la infección fetal por pasaje transplacentario de taquizoítos (transmisión vertical exógena).
1.3. Modos de transmisión en el bovino
La placenta cotiledonaria sinepiteliocorial de los bovinos impide el pasaje de inmunoglobulinas maternales, por ello la transferencia de la inmunidad materna al neonato depende exclusivamente de la ingesta del calostro (Brambell, 1969; Dubey et al., 2017; Kruse, 1983).
La serología positiva a N. caninum en un neonato previo a la ingesta de calostro implica que dichos anticuerpos fueron producidos por el feto infectado in útero, confirmando la transmisión a través de la placenta (Trees & Williams, 2005). Se considera que la transmisión transplacentaria es endógena cuando la infección del feto es consecuencia de la reactivación de los quistes tisulares de una vaca portadora crónica (Fig. 1A). La transmisión transplacentaria es exógena cuando la hembra adquiere la primoinfección por vía oral durante la gestación (Fig. 1B).
La transmisión horizontal ocurre cuando un bovino se infecta después de ingerir alimentos o agua contaminados con ooquistes (Fig. 1B). Para evaluar la ocurrencia de la transmisión horizontal en un rodeo, se debe realizar un estudio serológico prospectivo (longitudinal) de los animales seronegativos durante un tiempo determinado. La detección de anticuerpos específicos contra N. caninum indicaría que en el transcurso de ese tiempo el animal se infectó por ingestión de ooquistes (Dubey et al., 2017). No obstante, se debería descartar la posibilidad de una eventual reactivación en un animal con infección silente o no detectable mediante pruebas serológicas convencionales.
1.4. Supuesto rol del zorro en el ciclo de N. caninum
Existe incertidumbre sobre el rol de los cánidos silvestres autóctonos como el zorro culpeo o zorro colorado (Lycalopex culpaeus) y el zorro gris pampeano (Lycalopex gymnocercus) en el ciclo biológico de N. caninum. Se cuestiona el concepto del perro doméstico como único HD de N. caninum en Argentina, debido a la ausencia de coyotes, dingos y lobos. De este modo, surge un interrogante respecto a las mencionadas especies de la fauna local y su eventual relación con la difusión de la enfermedad.
Se han hallado evidencias serológicas de la infección por N. caninum en el 44% de zorros de la Patagonia (Martino et al., 2004) y 10% en zorros grises pampeanos (Fuchs et al., 2007). No obstante, la prevalencia serológica en una especie determinada no es suficiente para establecer su rol como HD (Dubey et al., 2017). Estos hallazgos solamente permiten afirmar que hubo infección de la especie animal considerada, que podría incluirse entre los HI. Para asegurar el rol determinante de una especie animal como HD es necesario confirmar la ocurrencia de multiplicación sexual del parásito a través de la detección de ooquistes en la materia fecal. Hasta el momento, los ensayos experimentales efectuados con el zorro colorado europeo (Vulpes vulpes) alimentado con tejidos infectados experimentalmente con N. caninum, no confirmaron la eliminación de ooquistes en la materia fecal (Dubey et al., 2017; Schares et al., 2002).
La idea difundida de que los cánidos silvestres de nuestra fauna local pudieran actuar como posibles HD de N. caninum, carecen de evidencia científica. No obstante, es necesario continuar con los estudios experimentales que involucren especies de zorros autóctonos para establecer definitivamente el posible rol de estos cánidos como HD en el ciclo parasitario de N. caninum.
Por lo mencionado, y mientras no surjan evidencias concretas que demuestren lo contrario, es importante transmitir un mensaje claro, sin dar lugar a interpretaciones confusas respecto al rol del zorro y el ciclo parasitario de N. caninum.
2. Historia de la neosporosis bovina en Argentina
Los trabajos discutidos en la presente revisión demuestran un progresivo cambio sobre la evolución de la enfermedad en el país a lo largo del tiempo (Tabla 1).
En Argentina, al igual que en el resto del mundo, se realizaron estudios de N. caninum respondiendo a los principales interrogantes del momento (Reichel et al., 2020). Todos estos aportes serán presentados cronológicamente según su año de publicación en las secciones que se detallan a continuación.
Los reportes de aislamientos de N. caninum provenientes de distintos hospedadores y su importancia en la investigación se discuten en la sección 2.1. Datos casuísticos de la neosporosis bovina en Argentina se presentan en las secciones 2.2 y 2.3. También se presentan los avances locales en el desarrollo de diversas pruebas serológicas para el diagnóstico y se discute su rendimiento, validación e interpretación de resultados, puntos tratados en las secciones 2.4, 2.5 y 2.6, respectivamente. Finalmente, se mencionan las principales medidas de control de la enfermedad y los resultados de su implementación (2.7). Otros aspectos, como el desarrollo de vacunas experimentales locales, no se discutirán en la presente revisión.

Historia de la neosporosis en Argentina: principales hallazgos IFI: inmunfluorescencia indirecta, HP: histopatología, IHQ: inmunohistoquímica, PCR: reacción en cadena de la polimerasa
2.1. Aislamiento y caracterización de N. caninum: técnica, reportes y aplicaciones
El aislamiento de N. caninum de un animal confirma su indiscutible rol como hospedador; sin embargo, es poco frecuente, siendo limitada la cantidad de reportes en el mundo (Dubey et al., 2017). La reducida sensibilidad de dicha técnica se debe a que tanto la autolisis como la contaminación bacteriana de la placenta y los órganos de los fetos abortados afectan sustancialmente la viabilidad de los taquizoítos. La metodología de aislamiento es laboriosa, requiere personal entrenado y depende de materiales y equipamiento frecuentemente no disponibles en los laboratorios en los que se realiza el diagnóstico de rutina. Entre los factores que condicionan un aislamiento exitoso se incluyen el tipo de tejido/muestra seleccionada, su estado de conservación y la carga parasitaria presente. El protocolo estandarizado de elección debe incluir la multiplicación inicial de los taquizoítos de Neospora en ratones de laboratorio susceptibles a la enfermedad (ej: interferon gamma knockout nude mice) y el aislamiento in vitro utilizando medios de cultivo, líneas celulares y atmósferas adecuadas para su incubación.
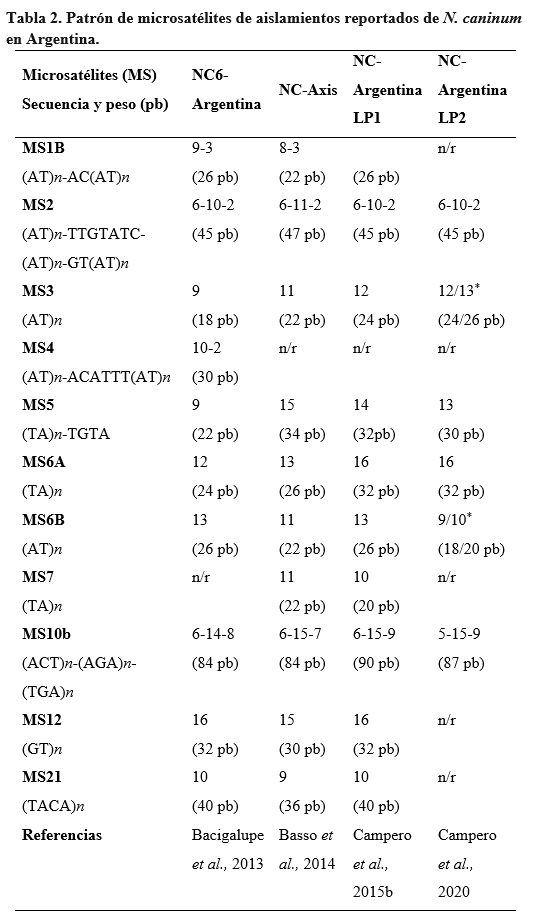
Neospora caninum fue aislado a partir de muestras provenientes de perros, bovinos, ovinos, búfalos de agua y ciervos de cola blanca (Dubey et al., 2017). Para confirmar el aislamiento de una nueva cepa de N. caninum, es necesaria la caracterización genética mediante marcadores moleculares (ej. microsatélites) y su comparación con los perfiles genéticos de las cepas reportadas. Los microsatélites permiten, además de caracterizar genéticamente las cepas aisladas o el ADN obtenido a partir de muestras infectadas, realizar estudios epidemiológicos (Basso et al., 2010). En forma similar facilitan los estudios de estructura poblacional, permitiendo evaluar la circulación de la cepa actuante y la relación filogenética entre cepas en diversas zonas geográficas (Dorsch et al., 2020; Medina-Esparza et al., 2016; Regidor-Cerrillo et al., 2006, 2013, 2020; Villa et al., 2021).
En Argentina, se han descripto hasta el presente 4 aislamientos de N. caninum, confirmados mediante microsatélites (Tabla 2). El primer aislamiento se denominó NC6-Argentina y adquirió relevancia por ser la primera vez en el mundo que se aisló el agente a partir de ooquistes provenientes de la materia fecal de un perro naturalmente infectado (Basso et al., 2001). Previamente se había demostrado el rol del perro como HD mediante ensayos experimentales (Lindsay et al., 1999ª; McAllister et al., 1998). Se han realizado múltiples estudios de caracterización in vitro (Dellarupe et al., 2014b) e in vivo de la mencionada cepa (Dellarupe et al., 2014a) efectuándose también ensayos experimentales en bovinos (Bacigalupe et al., 2013; Hecker et al., 2013, 2015).
El segundo aislamiento se obtuvo del cerebro de un ciervo moteado (Axis axis) del Jardín Zoológico y Botánico de La Plata, con signos clínicos neurológicos compatibles con lesiones en el sistema nervioso central y se denominó NC-Axis (Basso et al., 2014). Hasta ahora no se han profundizado estudios sobre su comportamiento biológico.
El tercer aislamiento nacional, y el primero efectuado a partir de un bovino, se denominó NC-Argentina LP1 y fue obtenido a partir del cerebro de un neonato asintomático, congénitamente infectado, proveniente de un tambo comercial de la provincia de Córdoba (Campero et al., 2015b). Recientemente se obtuvo un cuarto aislamiento a partir del cerebro de un feto bovino de un rodeo para carne, siendo la segunda cepa derivada de bovino y que se denominó NC-Argentina LP2 (Campero et al., 2020). Mediante diferentes ensayos in vitro se demostró la reducida tasa de invasión y proliferación para la cepa NC-Argentina LP1 y una elevada tasa de invasión con escasa proliferación para la cepa NC-Argentina LP2 (Campero et al., 2019). Hecker et al. (2019b) inocularon hembras bovinas prépuberes con taquizoítos vivos de NC-Argentina LP1 y detectaron una respuesta inmune humoral con producción de anticuerpos IgG y una respuesta celular caracterizada por una mayor expresión de interferón gamma y factor de necrosis tumoral alfa, lo que indicaría una respuesta protectora.
La disponibilidad de aislamientos locales de N. caninum permite conocer las características biológicas de las cepas circulantes asociadas a abortos en el país y abre la posibilidad de estudiar la fisiopatología de la enfermedad, evaluar los factores de virulencia y comportamiento biológico asociado, desarrollar antígenos para diagnóstico y estudiar posibles candidatos vacunales. Además, posibilita la comparación con respecto a cepas reportadas mundialmente, aportando información valiosa sobre la enfermedad en el país.
2.2. Estudios seroepidemiológicos
En la Tabla 3 se consignan los resultados de varios trabajos sobre estudios seroepidemiológicos realizados en el país y a continuación se discuten algunos aspectos relevantes. Los primeros resultados surgieron a partir del diagnóstico de problemas reproductivos presentados como tormentas de abortos en rodeos lecheros. Posteriormente se efectuaron reportes en rodeos para carne. Una vez constatada la enfermedad en nuestro país, se realizaron estudios de prevalencia, comprobando su distribución en diversas regiones. Finalmente, se analizaron las vías de transmisión y los principales mecanismos de propagación de la enfermedad en los bovinos.
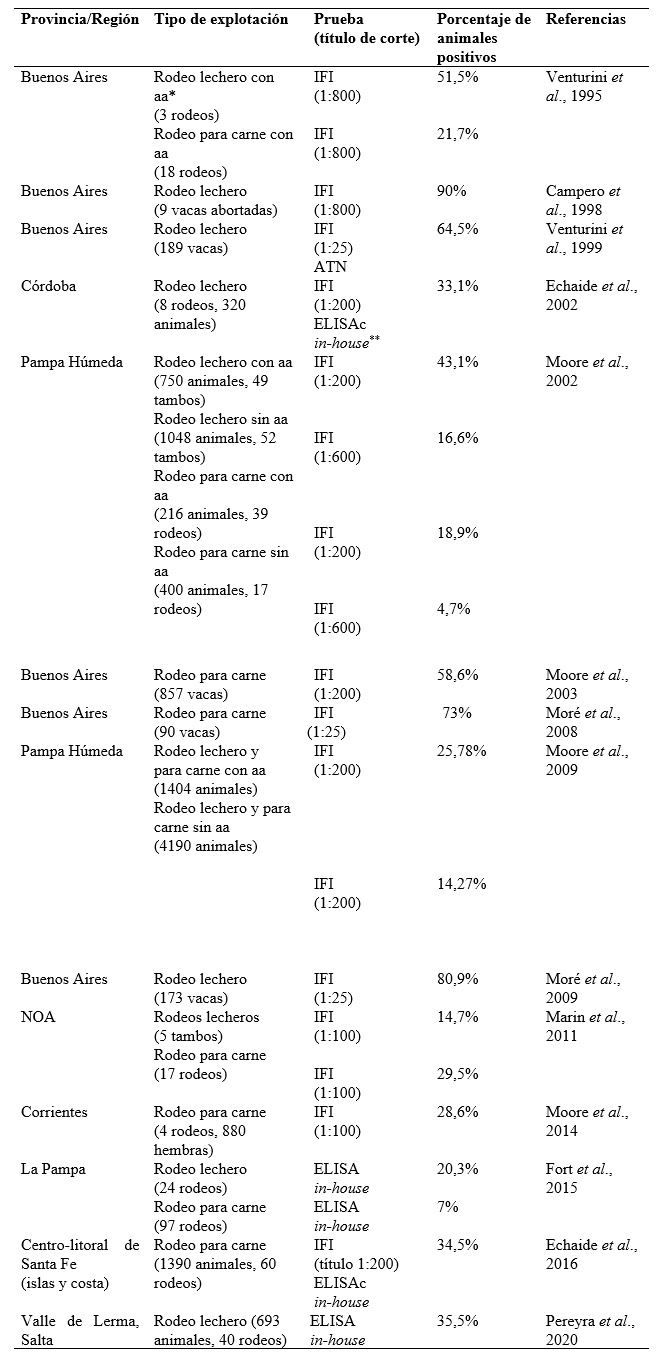
* aa: con antecedente de aborto; **Baszler et al., 1996
La primera detección de la enfermedad en Argentina se realizó en el año 1995 (Venturini et al. 1995) utilizando la técnica de inmunofluorescencia indirecta (IFI) como prueba diagnóstica y teniendo en cuenta un título de corte de 1:800 según Conrad et al. (1993). Este trabajo permitió constatar la presencia de N. caninum en explotaciones lecheras y de cría del país.
Campero et al. (1998) detectaron anticuerpos en un rodeo lechero que registró una tormenta de abortos en un período de 4 semanas, realizándose así la primera descripción de abortos epidémicos en bovinos lecheros del país. Considerando el elevado punto de corte seleccionado para la IFI en los hallazgos serológicos de Venturini et al. (1995 ) y Campero et al. (1998), es factible que algunos resultados hayan sido subestimados.
Moore et al. (2002) analizaron la prevalencia de N. caninum en rodeos lecheros y para carne con y sin antecedentes de abortos, mediante IFI y utilizando 2 puntos de corte distintos. Si bien la prevalencia de N. caninum en los rodeos con antecedentes de abortos fue superior respecto a rodeos sin abortos, en ambos grupos los rodeos lecheros registraron mayores valores de prevalencia. En dicho trabajo se evaluaron 1798 vacas lecheras y 616 vacas para carne, por lo que estos resultados fueron representativos. Sin embargo, no es recomendable la elección de distintos puntos de corte para evaluar una misma variable dado que dificulta la comparación de resultados.
En el año 2003, Moore et al. registraron una tormenta de abortos en un rodeo para carne de la provincia de Buenos Aires. En un período de 3 meses se registraron 69 abortos en un rodeo de 857 vaquillonas. Los autores incluyeron también en el análisis, los sueros de vacas que mantuvieron la gestación con el fin de asociar el aborto y la seropositividad a N. caninum. Esta estrategia de muestreo y análisis posibilitó un diagnóstico más certero de la situación epidemiológica en el rodeo. Este trabajo demostró la relevancia de la enfermedad y la ocurrencia de abortos epidémicos en rodeos para carne en el país, los que hasta entonces solo habían sido descriptos en rodeos lecheros (Campero et al., 1998).
Moré et al. (2008) analizaron muestras serológicas de vacas faenadas de frigoríficos y detectaron una prevalencia de 73 %. Sin embargo, el bajo valor del título de corte elegido (≥1:25), pudo haber sobreestimado la prevalencia real. Un aspecto interesante de este trabajo fue el análisis de coinfecciones con protozoos filogenéticamente cercanos a N. caninum, tales como Toxoplasma gondii y Sarcocystis cruzi. Los autores concluyeron que la IFI es una técnica útil para la identificación y para diferenciar las infecciones causadas por cada uno de dichos protozoarios. También reportaron la detección de ADN de T. gondii en el miocardio de 2 animales. Sin embargo, dicho hallazgo no guardó relación con su potencial rol como agente abortigénico.
Moore et al. (2009) evaluaron la relación entre seropositividad, edad, aborto y tipo de explotación. Los autores concluyeron que la transmisión horizontal fue más frecuente en las explotaciones lecheras. A través de un trabajo similar, Moré et al. (2009) evaluaron los modos de transmisión de N. caninum en un rodeo lechero de la provincia de Buenos Aires y detectaron tasas de 37,5 % y 47 % de transmisión vertical y horizontal, respectivamente.
En dos rodeos de carne de la provincia de Buenos Aires, Moré et al. (2010) hallaron tasas de transmisión vertical y horizontal de 18,5 % y 29 % (rodeo A) y 22 % y 25,5 % (rodeo B), respectivamente, valores menores que los recogidos por Moore et al. (2009), aunque igualmente relevantes. Estos hallazgos indican que no debería subestimarse la ocurrencia de la transmisión horizontal en rodeos para carne.
En rodeos para carne de la provincia de La Pampa (Fort et al., 2015), se detectaron anticuerpos anti-N. caninum y se cuantificó su avidez mediante un ELISA in-house. Este trabajo evaluó por primera vez la avidez (afinidad funcional), dada por la fuerza de unión de un anticuerpo a un antígeno. La avidez es utilizada como parámetro indicativo de una infección reciente, o bien crónica, basándose en el principio de que la avidez en una infección reciente es muy baja y progresivamente al madurar la respuesta inmune, los valores de avidez aumentan, siendo más elevados en infecciones crónicas (Björkman et al., 1999).
Rodríguez et al. (2016) evaluaron las tasas de transmisión vertical y horizontal en bovinos para carne de la E.E.A. Balcarce del INTA, bajo 3 sistemas de explotación pastoril con diferentes cargas/ha: 0,75 cabeza/ha, 1 cabeza/ha y 2 cabezas/ha. Si bien no se detectaron diferencias significativas entre los rodeos, se detectó transmisión horizontal en los 3 rodeos y una elevada tasa de transmisión vertical. También se evaluó la avidez de los anticuerpos mediante un ELISA comercial (Civtest, Hipra), detectándose valores elevados de inmunoglobulinas específicas en la totalidad de las madres paridas con crías seropositivas. Estos resultados indicarían una transmisión vertical producto de reactivaciones de infecciones crónicas en los 3 rodeos y presencia de infecciones horizontales.
Pereyra et al. (2020) evaluaron en la provincia de Salta la avidez mediante un ELISA in-house y determinaron que 56,3 % de los animales seropositivos poseían anticuerpos de baja avidez. Hallaron asociación positiva entre seropositividad e infecciones agudas, estableciendo que en la zona estudiada la transmisión horizontal fue considerable.
2.3. Reportes de abortos y enfermedad clínica en neonatos
El principal signo clínico de la neosporosis en el bovino es el aborto, que ocurre con mayor frecuencia entre los 5 y 7 meses de gestación (Dubey et al., 2017). Sin embargo, pueden observarse desde el segundo trimestre hasta el final de la gestación.
El primer diagnóstico de aborto ocurrido por N. caninum en el país se realizó en el año 1998 (Campero et al.). Tejidos de 2 fetos de bovinos raza Holando Argentino, abortados con 5-6 meses de gestación, se analizaron mediante histopatología e inmunohistoquímica (IHQ). Se observaron encefalomielitis multifocal no supurativa, miocarditis focal a difusa no supurativa, neumonía intersticial y hepatitis periportal, todas lesiones compatibles con las causadas por neosporosis. Se evidenciaron taquizoítos y un quiste tisular en cerebro y taquizoítos en pulmón e hígado. El hallazgo fue relevante porque se trató de la primera detección directa del parásito en el país utilizando IHQ como técnica confirmatoria para el diagnóstico de abortos causados por N. caninum.
Venturini et al. (1999) detectaron anticuerpos mediante IFI (título 1:80) en el 25 % (20/82) de líquidos fetales y en el 4,5 % (1/22) de fetos de bovinos lecheros y para carne, respectivamente, provenientes de frigoríficos de Santa Fe y Buenos Aires. Estos hallazgos constituyeron una nueva evidencia de la ocurrencia de la transmisión transplacentaria. La placenta sinepiteliocorial del bovino impide el pasaje de anticuerpos maternos al feto, y su detección es consecuencia de la respuesta humoral del sistema inmune fetal a la infección por Neospora después del cuarto mes de gestación (Dubey et al., 2017).
Moore et al. (2002) analizaron 240 fetos de diferentes rodeos lecheros y para carne con abortos esporádicos. En estudios histopatológicos de 188 fetos, 155 (27,7 %) resultaron con lesiones compatibles con enfermedades infecciosas. De estos últimos, 43 (27,7 %) presentaron lesiones características de neosporosis. A su vez, en el 67,4 % (29/43) se identificó N. caninum mediante IHQ, de los cuales el 17 % estuvo representado por quistes tisulares. Este trabajo reportó el primer hallazgo directo de N. caninum en abortos esporádicos en rodeos de cría del país. Las lesiones halladas coincidieron con las descriptas por Campero et al. (1998). Se detectaron anticuerpos mediante IFI (dilución 1:25), en el 25 % (30/122) de los líquidos fetales analizados.
Moore et al. (2003) evaluaron, mediante HP, IHQ y serología fetal, a 2 fetos abortados y 3 terneros prematuros provenientes de una tormenta de abortos en un rodeo de carne. Los autores hallaron lesiones compatibles con N. caninum y detectaron acumulaciones de taquizoítos (IHQ) en cerebro y anticuerpos específicos (título 1:25 mediante IFI) en un feto y un ternero prematuro.
Moore et al. (2009) investigaron las posibles causas de abortos esporádicos, incluyendo el diagnóstico diferencial con Toxoplasma gondii, utilizando la técnica de nested PCR, (nPCR) según (Collantes-Fernández et al., 2002). De los 666 fetos analizados, 70 presentaron lesiones compatibles con protozoarios. Con respecto a N. caninum, el 70 % (49/70) resultó positivo mediante IHQ y en el 56,4 % de los líquidos fetales se detectaron anticuerpos específicos. La extracción de ADN se realizó a partir de tejido fijado con formol (53/70) y tejido fresco (17/70). La totalidad de las muestras frescas positivas a IHQ también resultaron positivas a N. caninum mediante nPCR, mientras que de las muestras formoladas positivas a IHQ, solo la mitad fue positiva mediante nPCR. Este trabajo aporta hallazgos relevantes respecto al uso combinado de las técnicas diagnósticas serológicas, histopatológicas y moleculares, ya que sólo un 10 % de los fetos analizados resultaron positivos a las tres pruebas diagnósticas. Si bien se ponen en evidencia las ventajas de la implementación de técnicas de biología molecular para el diagnóstico del aborto por N. caninum, se advierte que la fijación con formol afecta sustantivamente la sensibilidad de estas técnicas (Dubey et al., 2017; Ellis et al., 1999; Sánchez et al., 2009), por lo que es recomendable el procesamiento de material fresco congelado. No se detectó ADN de T. gondii en las muestras analizadas, descartando así su implicancia como posible agente causal de abortos en bovinos en Argentina.
Calandra et al. (2014) caracterizaron abortos con sospecha de neosporosis en una explotación de bovinos de cría en Balcarce, Buenos Aires. Un 19 % (11/57) de las vaquillonas abortaron en un periodo de 45 días, y se recuperaron dos fetos. De modo complementario, se realizó la serología de las vaquillonas preñadas no abortadas y se analizó la asociación entre aborto y seropositividad. Los fetos presentaron lesiones compatibles con N. caninum, sin embargo, la IHQ resultó negativa. Se detectaron anticuerpos específicos (título 1:25 mediante IFI) para N. caninum en los fluidos fetales y las vaquillonas seropositivas presentaron cinco veces más probabilidad de abortar. Estos resultados describen un aborto epidémico en un rodeo para carne similar al descripto por Moore et al. (2003). Debe tenerse en cuenta que la presentación de la enfermedad puede ser esporádica siendo posible diagnosticarla en casos individuales, sin ser un problema poblacional (Calandra et al. 2014).
Si bien el aborto es el signo clínico más evidente de la neosporosis, hay algunos trabajos que describen casos de terneros nacidos con lesiones del sistema nervioso central (Dubey et al., 2017). Micheloud et al. (2015) citaron dos casos clínicos de neosporosis congénita, un ternero Holando Argentino prematuro (8 meses de gestación) débil y de bajo peso (15,5 kg), sin sentido de propiocepción y que fue sacrificado y un ternero Holando Argentino x Hereford que presentó ataxia y disfunción de los miembros posteriores. En ambos casos se detectaron anticuerpos específicos, lesiones histopatológicas en el cerebro compatibles neosporosis, quistes tisulares en el cerebro identificados a través de IHQ y secuencias específicas amplificadas con la técnica de PCR. Esta es la primera descripción de neosporosis congénita con signología clínica en el país, siendo lo más frecuente el nacimiento de terneros infectados asintomáticos (Campero et al., 2015b; Lagomarsino et al., 2016).
2.4. Pruebas serológicas de diseño local (in-house)
La IFI ha sido la prueba serológica más utilizada y difundida en el país. La primera detección de anticuerpos para N. caninum en bovinos se realizó aplicando dicha técnica (Venturini et al., 1995), siendo la más frecuentemente utilizada en los estudios iniciales de la neosporosis a nivel global (Dubey et al., 2017). Sin embargo, en la actualidad existe una marcada tendencia del uso de enzimoinmunoensayos (ELISA), dado que ofrecen la capacidad de evaluar una mayor cantidad de muestras en menor tiempo y con mayor objetividad en la lectura de los resultados (Campero et al., 2015a).
En Argentina se han desarrollado y evaluado diversas pruebas para diagnóstico (Tabla 4). A continuación, se resumen los principales aportes realizados.
Wilkowsky et al. (2011) desarrollaron una prueba inmunoenzimática en línea (applied printing immunoassay -APIA-) para la detección de anticuerpos anti-N. caninum en bovinos, con la proteína recombinante Nc-SAG1 como antígeno. Los autores propusieron su uso como prueba de screening, dada su especificidad diagnóstica (DSp) y facilidad en su lectura cualitativa dicotómica, que podría ser aplicable a estudios de prevalencia. Si bien los autores validaron la prueba respecto a una única prueba de referencia, la OIE (2019) recomienda validar una nueva prueba diagnóstica en ausencia de un gold standard, calculando la performance diagnóstica respecto a un panel de sueros con resultados concordantes de, al menos, a dos pruebas serológicas.
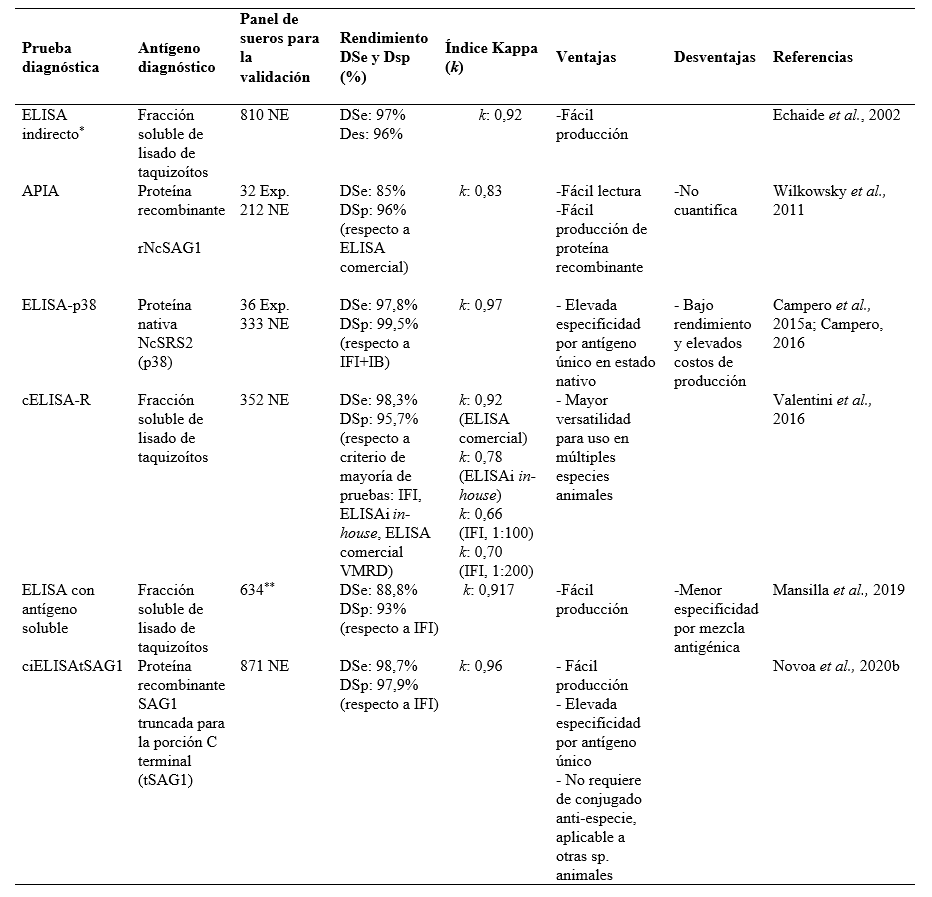
* Baszler et al., 1996; **origen no mencionado.
Campero et al. (2015a) y Campero (2016) evaluaron localmente una prueba de ELISA indirecto (ELISAi), basada en el antígeno de superficie NcSRS2 (antígeno proteico de peso molecular de 38 kDa) de N. caninum en su estado nativo, es decir, sin alterar la conformación proteica. Se conformó un Estándar Relativo de Comparación (ERC) con sueros con resultados serológicos concordantes con las pruebas de IFI e inmunoblot. El uso de un antígeno nativo aumenta la DSe respecto a antígenos recombinantes que pueden sufrir modificaciones post-traduccionales (Schares et al., 2000). Esta ventaja diagnóstica, sin embargo, tiene una limitante en su producción y rendimiento, siendo inferior y más costosa, respectivamente, comparada con la producción de proteínas recombinantes.
Mansilla et al. (2019) validaron un ELISA indirecto basado en la fracción soluble de un lisado de taquizoítos de N. caninum. En dicho trabajo, los autores no consignan la inclusión de sueros experimentales para la validación y la misma se basa en resultados obtenidos únicamente a partir de IFI con un título de corte 1:25.
Echaide et al. (2002) desarrollaron y evaluaron un ELISAi basado en antígenos nativos solubles de un lisado de taquizoítos de N. caninum purificado. La validación se realizó utilizando sueros de animales naturalmente expuestos y con resultados serológicos concordantes mediante IFI en dos a cinco muestreos consecutivos de los mismos bovinos en un período de tres años (testeo múltiple). Mediante análisis ROC se determinó una Dse de 97 % y una Des de 96 %. Este ELISAi mostró buen desempeño en un análisis interlaboratorios iberoamericanos realizado en conjunto con otras pruebas (Campero et al., 2018b).
Un ELISA de competición (ELISAc), utilizando un antígeno nativo similar al descripto anteriormente y un anticuerpo monoclonal (RafNeo5), fue desarrollado y validado utilizando también un testeo múltiple (Valentini et al., 2016). Para su validación se utilizó como gold standard el resultado serológico obtenido mediante la mayoría de las pruebas evaluadas (criterio de mayoría o majority criterium). La aplicación de este criterio para las validaciones es pertinente, ya que combina múltiples pruebas para definir el estatus serológico de un animal y, por lo tanto, le otorga un mayor soporte a la validación respecto a pruebas evaluadas exclusivamente a partir de una única prueba diagnóstica.
Novoa et al. (2020b) desarrollaron una novedosa versión de ELISA de competición con el antígeno recombinante SAG1 de N. caninum truncado para la porción C-terminal (tSAG1), utilizando el mismo anticuerpo monoclonal (RafNeo5) y sueros de la misma seroteca descripta por Valentini et al. (2016). Este diseño posee una gran versatilidad, pudiendo ser aplicable al diagnóstico de neosporosis en otras especies animales, ya que no requiere del uso de conjugados anti-especie. Así lo demostraron Novoa et al. (2020a) al validar dicha prueba para el diagnóstico de neosporosis en ovinos y caprinos. Por otro lado, la elección de un único antígeno recombinante truncado en su porción hidrofóbica hace del mismo un excelente candidato de fácil producción y cuyas características elevan la especificidad de la prueba. Si bien Valentini et al. (2016) obtuvieron similares valores de DSe en su ELISA de competición, el reemplazo de una mezcla antigénica por un único epitope elevaron los valores de DSp.
La serología a partir de leche de tanque es una alternativa diagnóstica muy difundida en Europa, sobre todo para estimar la prevalencia en los rodeos (Bartels et al., 2005; Björkman et al., 1997; Dubey & Schares, 2006) En Argentina, un relevamiento realizado en 200 tambos de la Cuenca Lechera Mar y Sierras evaluó la determinación de N. caninum a partir de leche con un kit de ELISA comercial (Cirone et al., 2019). De esta forma, el productor puede estimar si la prevalencia en su rodeo es mayor al 10 % (límite de detección del kit) a partir del análisis de una única muestra de leche de tanque. A partir de allí es posible profundizar con estudios serológicos complementarios para determinar la seroprevalencia real y las posibles vías de transmisión.
2.5. Validación, puntos de corte y consideraciones en la elección de una prueba serológica
Si bien los avances locales en el desarrollo de pruebas diagnósticas son alentadores y serían múltiples las ventajas de su aplicación (Tabla 4), aún no se dispone de un kit comercial de producción nacional para el diagnóstico de la neosporosis bovina. En Argentina, los laboratorios de diagnóstico utilizan kits de ELISA comerciales importados, de elevado costo (precio dólar/euro) e inconvenientes de logística. Además, se utilizan los puntos de corte sugeridos, los cuales fueron obtenidos para situaciones epidemiológicas de otras regiones y, por lo tanto, no refleja las de Argentina.
Campero et al. (2018b) evaluaron múltiples pruebas para diagnóstico utilizadas de rutina en laboratorios de referencia nacional e internacional a partir de una seroteca bovina bien caracterizada. Se evaluaron IFIs y ELISAs in-house y se incluyó un kit comercial de amplia distribución en el país. Los resultados sugieren realizar un reajuste del punto de corte de las pruebas evaluadas con el fin de maximizar los valores de DSe y DSp.
Son muy pocos los trabajos de evaluación comparativa interlaboratorial para el diagnóstico serológico de neosporosis bovina y la mayoría se realizaron en Europa y EE.UU. (Campero et al., 2018b; von Blumröder et al., 2004; Wapenaar et al., 2007). Dichas evaluaciones fueron realizadas por un único laboratorio (Alvarez-García et al., 2003; Alvarez-García et al., 2013; Björkman et al., 2006; da Silva Silveira et al., 2020; Frössling et al., 2003; Hall et al., 2006; Roelandt et al., 2015; Waldner et al., 2004; Wu et al., 2002). No obstante, los resultados sugieren la necesidad de evaluar los puntos de corte utilizados según los propósitos de las pruebas y las zonas geográficas donde se utilizarán. Esta observación también es válida para desarrollos in-house. De hecho, en un estudio de estandarización de pruebas serológicas realizado entre varios países europeos (von Blumröder et al., 2004) se determinó un punto de corte con un índice de ≥0,04 para la prueba in-house de ELISA-p38, obteniendo valores de DSe y DSp de 99 %. Sin embargo, una prueba similar desarrollada y evaluada en Argentina con sueros locales mostró un punto de corte y un rendimiento diferente. La aplicación del punto de corte sugerido en los trabajos europeos hubiera resultado en un descenso de la DSp relativa de ELISA-p38 a 92,6 % (Campero, 2016). Por ello, resulta clave evaluar si la población estudiada para las validaciones originales es representativa de la población destino (Greiner & Gardner, 2000; Jacobson, 1998; OIE, 2019).
Por lo mencionado, sería interesante reevaluar el verdadero rendimiento de kits validados para países europeos y/o norteamericanos, importados y utilizados en nuestro medio. Si bien los kits comerciales cuentan con determinados estándares regulatorios para su aprobación, no necesariamente implica que se deba asumir incuestionablemente que la aplicación del punto de corte sugerido por el fabricante asegure similar rendimiento si las muestras utilizadas para estimar dicho valor difieren respecto de la población destino (Alvarez-García et al., 2013; Jacobson, 1998). Más aún, cada laboratorio debería optimizar las pruebas diagnósticas a las condiciones de su propio entorno. Un error común es creer que existe un título de corte universal para la prueba de IFI, extrapolable a todos los laboratorios y aplicable a cualquier situación diagnóstica y que, además, brinde el mismo resultado (Dubey & Schares, 2006). Sin embargo, factores como la calidad del microscopio y tipo de luz utilizada, el tipo de anticuerpo secundario y la dilución empleada, sumados a la experiencia del operador, son factores que, sin lugar a duda, condicionarán los resultados y, por ende, la eficiencia de la IFI (Campero et al., 2018b).
Para ello, sería recomendable participar con periodicidad de estudios rigurosos interlaboratoriales diseñados con serotecas de referencia provenientes de laboratorios con amplia experiencia en el diagnóstico de la enfermedad. Más aún, la constante capacitación del personal técnico responsable de la ejecución y lectura de pruebas diagnósticas resulta fundamental para asegurar un resultado confiable.
Según el objetivo del diagnóstico podría ser más conveniente utilizar una determinada prueba serológica. Frente a un aborto con sospecha de N. caninum como agente causal y líquido fetal como material disponible, sería conveniente utilizar la prueba de IFI con un bajo título de corte, de modo de maximizar la sensibilidad, o bien, alternativamente el inmunoblot (Söndgen et al., 2001). Si se estudiara la prevalencia de la enfermedad en un rodeo con problemas de aborto, la prueba de ELISA sería adecuada para dicha estimación. Si se considera relevante una estimación cuantitativa de la seropositividad y el análisis de la fluctuación de anticuerpos, la IFI sería apropiada. Si los resultados fuesen sospechosos, sería recomendable utilizar la prueba de inmunoblot, dado que es considerada confirmatoria por su elevada especificidad (Dubey et al., 2017; Söndgen et al., 2001). En conclusión, para la correcta elección de una prueba para diagnóstico, se debe definir con claridad su objetivo para informar correctamente un resultado.
2.6. Diagnóstico de N. caninum: interpretación de resultados
Independientemente de la responsabilidad y confiabilidad del laboratorio, es imprescindible realizar una correcta interpretación de los resultados, basándose en la literatura científica publicada que orientará el diagnóstico para ofrecer soluciones concretas al productor.
En un rodeo con problemas de aborto y con sospecha de neosporosis, la situación ideal sería analizar tanto el suero de la madre como el del feto, evaluar las lesiones histopatológicas, realizar estudios de IHQ y detectar ADN específico mediante PCR. En los casos en que estas pruebas resulten negativas para el feto y la serología maternal también sea negativa, se debería buscar otro agente causal de abortos. Si la serología de la madre y del feto resultaran positivas y también se detectara ADN específico, se podría confirmar la infección por N. caninum, aunque no necesariamente indicaría la causa del aborto (Morrell et al., 2019). En síntesis, el hallazgo de lesiones histopatológicas fetales compatibles con la enfermedad (Anderson et al., 1991; Barr et al., 1991; Campero et al., 1998; Morrell et al., 2019; Wouda et al., 1997), junto con la detección molecular y la serología positiva en el feto acompañada de la detección de anticuerpos en la madre, confirman el aborto por N. caninum.
No obstante, una serología fetal negativa no necesariamente implica ausencia de infección, debiéndose evaluar los siguientes escenarios. Los anticuerpos fetales se pueden detectar a partir del 4to mes de gestación (Swift & Kennedy, 1972) cuando el sistema inmune fetal comienza a tener la capacidad de reaccionar frente a antígenos extraños. Si la infección por N. caninum ocurre previa a los 120 días de gestación, no sería probable encontrar niveles detectables de anticuerpos. Por otro lado, el período entre la infección y el aborto podría haber sido inferior al requerido para la producción de anticuerpos. Además, el tiempo transcurrido entre el aborto y la toma de muestra es relevante debido a que las inmunoglobulinas fetales podrían degradarse por la autólisis, reduciendo su concentración a niveles no detectables (Wouda et al., 1997).
Por último, si en los rodeos se registraran abortos y se sospechara de neosporosis, es recomendable el sangrado de todas o bien de una cantidad representativa de las hembras que abortaron y de una proporción similar de las hembras preñadas. Mediante análisis estadísticos como Chi2 o la prueba exacta de Fisher, es posible evaluar la asociación entre aborto y seropositividad. Disponer de muestras de suero de las vacas que abortaron y de las que tuvieron partos normales, permite fortalecer los diagnósticos presuntivos obtenidos mediante serología (Calandra et al., 2014; Dubey et al., 2017; Moore et al., 2003).
2.7. Medidas de control
Hasta el presente, no existen vacunas ni drogas que eviten el aborto ni la transmisión transplacentaria de N. caninum en bovinos. Por ello, las estrategias de control se basan en interrumpir el ciclo parasitario en sus 2 niveles de transmisión: horizontal y/o vertical. Dicha temática ha sido ampliamente revisada por múltiples autores internacionales (Dubey et al., 2007; Reichel & Ellis, 2002; Reichel et al., 2014, 2020) y localmente (Campero, 2014; Echaide, 2000; Moore et al., 2001, 2005;Moore, 2005).
A continuación, se enumeran las principales medidas de control sugeridas:
2- No alimentar perros con material proveniente de abortos y/o con vísceras crudas.
3- Controlar los posibles hospedadores que actúen como reservorios (ratones, peludos, liebres).
La implementación de estas medidas dependerá de la prevalencia de la enfermedad en el rodeo y su viabilidad debe considerarse teniendo en cuenta valores productivos y económicos, evaluando la relación costo/beneficio (Reichel et al., 2014, 2020). Se debe determinar la principal vía de transmisión en el rodeo a los fines de implementar cualquiera de las siguientes medidas de manejo.
1- Seleccionar mediante análisis serológicos las vaquillonas de reposición seronegativas a neosporosis antes del servicio, lo que permitirá disminuir progresivamente la prevalencia de la enfermedad en el rodeo. Esta estrategia será más exitosa cuando se pueda eliminar o minimizar la transmisión horizontal generada por los cánidos. La repetición de las pruebas serológicas permite aumentar su sensibilidad.
2- Evitar la incorporación al ciclo reproductivo de las hijas de vacas seropositivas en rodeos lecheros. La recomendación surge por la elevada tasa de transmisión transplacentaria. La estrategia se basa en el servicio de las vacas infectadas con toros para carne, para producir terneras cruza para carne. Este manejo utilizado en un tambo comercial de la provincia de Córdoba contribuyó a la gradual reducción de la prevalencia de la neosporosis y la disminución del riesgo de aborto por N. caninum (Lagomarsino et al., 2016, 2019).
3- Transferir embriones de madres seropositivas de alto valor genético cuando el valor del animal supere los costos de la técnica. Campero et al. (2003a) realizaron la transferencia de embriones de madres seropositivas a neosporosis a 15 hembras receptoras seronegativas. La totalidad de las crías nacidas de las vacas receptoras resultaron seronegativas.
4- Preñar vacas lecheras infectadas por N. caninum, mediante inseminación artificial, con semen de toros para carne para reducir la prevalencia de abortos. Se especula que algunas funciones placentarias, en preñeces de razas cruza, se cumplen de manera más eficiente probablemente debido al aumento en la expresión de glicoproteínas asociadas a la preñez (pregnancy associated-glycoproteins, PAG). En hembras que abortaron se detectó una disminución considerable en su expresión (López-Gatius et al., 2007; Mur-Novales et al., 2016; Serrano-Pérez et al., 2014, 2016; Wooding et al., 2005).
Consideraciones finales
La neosporosis es una enfermedad endémica presente en explotaciones lecheras y rodeos de cría de Argentina, produciendo grandes pérdidas económicas (Campero et al., 2003b; Moore et al., 2013). Los avances surgidos de los estudios llevados a cabo en los últimos 25 años contribuyeron sustancialmente a un mayor conocimiento de la enfermedad en el país. Sin embargo, aún existen desafíos a superar, como llevar al mercado nacional kits diagnósticos de producción local y, al igual que en el resto del mundo, desarrollar una vacuna para controlar el impacto de la enfermedad en el ganado bovino. Hasta entonces, debemos ofrecer un diagnóstico confiable y transmitir la relevancia del diagnóstico serológico como principal herramienta que contribuye al control de la enfermedad.
Agradecimientos
A Ignacio Gual por sus valiosos aportes en la presente revisión.
Conflicto de intereses
No existe conflicto de intereses, incluyendo entre estos últimos las relaciones financieras, personales o de otro tipo con otras personas u organizaciones que pudieran influir de manera inapropiada en el trabajo.
Bibliografía
Alvarez-García G, Collantes-Fernández E, Costas E, Rebordosa X, Ortega-Mora LM. 2003. Influence of age and purpose for testing on the cut-off selection of serological methods in bovine neosporosis. Veterinary Research. 34(3):341-52. https://doi.org/10.1051/vetres:2003009
Alvarez-García G, García-Culebras A, Gutiérrez-Expósito D, Navarro-Lozano V, Pastor-Fernández I, Ortega-Mora LM. 2013. Serological diagnosis of bovine neosporosis: a comparative study of commercially available ELISA tests. Veterinary Parasitology. 198(1-2):85-95. https://doi.org/10.1016/j.vetpar.2013.07.033
Anderson ML, Blanchard PC, Barr BC, Dubey JP, Hoffman RL, Conrad PA. 1991. Neospora-like protozoan infection as a major cause of abortion in California dairy cattle. Journal of the American Veterinary Medical Association. 198(2):241-4.
Bacigalupe D, Basso W, Caspe SG, Moré G, Lischinsky L, Gos ML, Leunda M, Campero L, Moore DP, Schares G, Campero CM, Venturini MC. 2013. Neospora caninum NC-6 Argentina induces fetopathy in both serologically positive and negative experimentally inoculated pregnant dams. Parasitology Research. 112(7):2585-92. https://doi.org/10.1007/s00436-013-3424-1
Barr BC, Anderson ML, Dubey JP, Conrad PA. 1991. Neospora-like protozoal infections associated with bovine abortions. Veterinary Pathology. 28(2):110-6. https://doi.org/10.1177/030098589102800202
Bartels CJ, van Maanen C, van der Meulen AM, Dijkstra T, Wouda W. 2005. Evaluation of three enzyme-linked immunosorbent assays for detection of antibodies to Neospora caninum in bulk milk. Veterinary Parasitology. 131(3-4):235-46. https://doi.org/10.1016/j.vetpar.2005.05.011
Basso W, Moré G, Quiroga MA, Balducchi D, Schares G, Venturini MC. 2014. Neospora caninum is a cause of perinatal mortality in axis deer (Axis axis). Veterinary Parasitology. 199(3-4):255-8. https://doi.org/10.1016/j.vetpar.2013.10.020
Basso W, Venturini L, Venturini MC, Hill DE, Kwok OC, Shen SK, Dubey JP. 2001. First isolation of Neospora caninum from the feces of a naturally infected dog. Journal of Parasitology. 87(3):612-8. https://doi.org/10.1645/0022-3395(2001)087[0612:FIONCF]2.0.CO;2
Basso W, Schares S, Minke L, Bärwald A, Maksimov A, Peters M, Schulze C, Müller M, Conraths FJ, Schares G. 2010. Microsatellite typing and avidity analysis suggest a common source of infection in herds with epidemic Neospora caninum-associated bovine abortion. Veterinary Parasitology. 173(1-2):24-31. https://doi.org/10.1016/j.vetpar.2010.06.009
Baszler TV, Knowles DP, Dubey JP, Gay JM, Mathison BA, McElwain TF. 1996. Serological diagnosis of bovine neosporosis by Neospora caninum monoclonal antibody-based competitive inhibition enzyme-linked immunosorbent assay. Journal of Clinical Microbiology. 34(6):1423-8. https://doi.org/10.1128/JCM.34.6.1423-1428.1996
Bjerkas I, Mohn SF, Presthus J. 1984. Unidentified cyst-forming sporozoon causing encephalomyelitis and myositis in dogs. Zeitschrift für Parasitenkunde. 70(2):271-4. https://doi.org/10.1007/BF00942230
Björkman C, Alvarez-Garcia G, Conraths FJ, Mattsson JG, Ortega-Mora LM, Sager H, Schares G. 2006. Neospora caninum IgG avidity tests: an interlaboratory comparison. Veterinary Parasitology. 140(3-4):273-80. https://doi.org/10.1016/j.vetpar.2006.04.030
Björkman C, Holmdahl OJ, Uggla A. 1997. An indirect enzyme-linked immunoassay (ELISA) for demonstration of antibodies to Neospora caninum in serum and milk of cattle. Veterinary Parasitology. 68(3):251-60. https://doi.org/10.1016/S0304-4017(96)01076-X
Björkman C, Näslund K, Stenlund S, Maley SW, Buxton D, Uggla A. 1999. An IgG avidity ELISA to discriminate between recent and chronic Neospora caninum infection. Journal of Veterinary Diagnostic Investigation. 11(1):41-4. https://doi.org/10.1177/104063879901100106
Brambell FW. 1969. The transmission of immune globulins from the mother to the foetal and newborn young. The Proceedings of the Nutrition Society. 28(1):35-41.
Calandra PM, Di Matía JM, Cano DB, Odriozola ER, García JA, Späth EJ, Odeón AC, Paolicchi FA, Morrell EL, Campero CM, Moore DP. 2014. Endemic and epidemic bovine neosporosis: description of two events in beef cattle. Revista Argentina de Microbiología. 46(4):315-9. https://doi.org/10.1016/S0325-7541(14)70089-6
Campero CM. 2014. Opciones para el control de la neosporosis bovina. Revista Taurus. 63:4-15.
Campero CM, Anderson ML, Conosciuto G, Odriozola H, Bretschneider G, Poso MA. 1998. Neospora caninum-associated abortion in a dairy herd in Argentina. The Veterinary Record. 143(8):228-9. https://doi.org/10.1136/vr.143.8.228
Campero CM, Moore DP, Lagomarsino H, Odeón AC, Castro M, Visca H. 2003a. Serological status and abortion rate in progeny obtained by natural service or embryo transfer from Neospora caninum-seropositive cows. Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health. 50(9):458-60. https://doi.org/10.1046/j.0931-1793.2003.00698.x
Campero CM, Moore DP, Odeón AC, Cipolla AL, Odriozola E. 2003b. Aetiology of bovine abortion in Argentina. Veterinary Research Communications. 27(5):359-69. https://doi.org/10.1023/A:1024754003432
Campero LM. 2016. El antígeno NcSRS2 de Neospora caninum: su aplicación en el diagnóstico y estrategias de prevención. Tesis de Doctorado en Ciencias Veterinarias, Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata. http://sedici.unlp.edu.ar/handle/10915/52168
Campero LM, Gos ML, Moore DP, Regidor-Cerrillo J, Unzaga JM, More G, Ortega-Mora LM, Venturini MC. 2018a. Microsatellite pattern analysis of Neospora caninum from a naturally infected goat fetus. Veterinary Parasitology. 255:58-60. https://doi.org/10.1016/j.vetpar.2018.03.024
Campero LM, Gual I, Dellarupe A, Schares G, Moré G, Moore DP, Venturini MC. 2020. Isolation of Neospora caninum from a beef cattle fetus from Argentina: Immunopathological and molecular studies. Veterinary Parasitology: Regional Studies and Reports. 21:100438. https://doi.org/10.1016/j.vprsr.2020.100438
Campero LM, Minke L, More G, Rambeaud M, Bacigalupe D, Moore DP, Hecker Y, Campero CM, Schares G, Venturini MC. 2015a. Evaluation and comparison of serological methods for the detection of bovine neosporosis in Argentina. Revista Argentina de Microbiología. 47(4):295-301. https://doi.org/10.1016/j.ram.2015.07.002
Campero LM, Moreno-Gonzalo J, Venturini MC, More G, Dellarupe A, Rambeaud M, Echaide IE, Valentini B, Campero CM, Moore DP, Cano DB, Fort M, Mota RA, Serrano-Martinez ME, Cruz-Vazquez C, Ortega-Mora LM, Alvarez-Garcia G. 2018b. An Ibero-American inter-laboratory trial to evaluate serological tests for the detection of anti-Neospora caninum antibodies in cattle. Tropical Animal Health and Production. 50(1):75-84. https://doi.org/10.1007/s11250-017-1401-x
Campero LM, Runco M, Basso W, Schares G, Gual I, Dellarupe A, De Felice L, Ortega-Mora LM, Moore DP, Moré G, Venturini MC. 2019. Molecular characterisation and in vitro virulence phenotypes of Argentinean Neospora caninum bovine isolates. 5th International Meeting on Apicomplexan Parasites in Farm Animals. Berlin, Alemania, p 10.
Campero LM, Venturini MC, Moore DP, Massola L, Lagomarsino H, García B, Bacigalupe D, Rambeaud M, Pardini L, Leunda MR, Schares G, Campero CM. 2015b. Isolation and molecular characterization of a new Neospora caninum isolate from cattle in Argentina. Experimental Parasitology. 155:8-12. https://doi.org/10.1016/j.exppara.2015.04.009
Cirone KM, Fiorani F, Hecker Y, Gual I, Moore DP. 2019. Prevalencia de Neospora caninum en la Cuenca Mar y Sierras. Revista Motivar. 198:38.
Collantes-Fernández E, Zaballos A, Álvarez-García G, Ortega-Mora LM. 2002. Quantitative detection of Neospora caninum in bovine aborted fetuses and experimentally infected mice by real-time PCR. Journal of Clinical Microbiology. 40(4):1194-8. https://doi.org/10.1128/JCM.40.4.1194-1198.2002
Conrad PA, Barr BC, Sverlow KW, Anderson M, Daft B, Kinde H, Dubey JP, Munson L, Ardans A. 1993. In vitro isolation and characterization of a Neospora sp. from aborted bovine foetuses. Parasitology. 106(3):239-49. https://doi.org/10.1017/S0031182000075065
da Silva Silveira C, Armendano JI, Moore DP, Cantón GJ, Macías-Rioseco M, Riet-Correa F, Giannitti F. 2020. A comparative study of commercial ELISAs for antibody detection in the diagnostic investigation of Neospora caninum-associated abortion in dairy cattle herds in Uruguay. Revista Argentina de Microbiología. 52(2):107-14. https://doi.org/10.1016/j.ram.2019.06.004
Dellarupe A, Regidor-Cerrillo J, Jiménez-Ruiz E, Schares G, Unzaga JM, Venturini MC, Ortega-Mora LM. 2014. Clinical outcome and vertical transmission variability among canine Neospora caninum isolates in a pregnant mouse model of infection. Parasitology. 141(3):356-66. https://doi.org/10.1017/S0031182013001479
Dellarupe A, Regidor-Cerrillo J, Jiménez-Ruiz E, Schares G, Unzaga JM, Venturini MC, Ortega-Mora LM. 2014b. Comparison of host cell invasion and proliferation among Neospora caninum isolates obtained from oocysts and from clinical cases of naturally infected dogs. Experimental Parasitology. 145, 22-8. https://doi.org/10.1016/j.exppara.2014.07.003
Dubey JP, Barr BC, Barta JR, Bjerkås I, Björkman C, Blagburn BL, Bowman DD, Buxton D, Ellis JT, Gottstein B, Hemphill A, Hill DE, Howe DK, Jenkins MC, Kobayashi Y, Koudela B, Marsh AE, Mattsson JG, McAllister MM, Modrý D, Omata Y, Sibley LD, Speer CA, Trees AJ, Uggla A, Upton SJ, Williams DJ, Lindsay DS. 2002. Redescription of Neospora caninum and its differentiation from related coccidia. International Journal of Parasitology. 32(8):929-46. https://doi.org/10.1016/S0020-7519(02)00094-2
Dubey JP, Hattel AL, Lindsay DS, Topper MJ. 1988. Neonatal Neospora caninum infection in dogs: isolation of the causative agent and experimental transmission. Journal of the American Veterinary Medical Association. 193(10):1259-63.
Dubey JP, Hemphill A, Calero-Bernal R, Schares G. 2017. Neosporosis in Animals.1° Ed. Boca Raton, CRC Press.
Dubey JP, Jenkins MC, Ferreira LR, Choudhary S, Verma SK, Kwok OC, Fetterer R, Butler E, Carstensen M. 2014. Isolation of viable Neospora caninum from brains of wild gray wolves (Canis lupus). Veterinary Parasitology. 201(1-2):150-3. https://doi.org/10.1016/j.vetpar.2013.12.032
Dubey JP, Jenkins MC, Rajendran C, Miska K, Ferreira LR, Martins J, Kwok OC, Choudhary S. 2011. Gray wolf (Canis lupus) is a natural definitive host for Neospora caninum. Veterinary Parasitology. 181(2-4):382-7. https://doi.org/10.1016/j.vetpar.2011.05.018
Dubey JP, Leathers CW, Lindsay DS. 1989. Neospora caninum-like protozoon associated with fatal myelitis in newborn calves. Journal of Parasitology. 75(1):146-8.
Dubey JP, Schares G. 2006. Diagnosis of bovine neosporosis. Veterinary Parasitology. 140:1-34. https://doi.org/10.1016/j.vetpar.2006.03.035
Dubey JP, Schares G, Ortega-Mora LM. 2007. Epidemiology and control of neosporosis and Neospora caninum. Clinical Microbiology Reviews. 20(2):323-67. https://doi.org/10.1128/CMR.00031-06
Echaide I, Aguirre N, Thompson C, Ferreira M, Pane J, Bugnón A, Signorini M, Valentini B, Primo E, Torioni de Echaide S. 2016. Relevamiento sanitario en bovinos para carne de islas y costas de tres departamentos de la zona centro-litoral de Santa Fe (E5). Primera Etapa. XXI Reunión Científico Técnica de la Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico, Jujuy, Argentina.
Echaide I, Valentini B, Torioni de Echaide S. 2002. Neosporosis bovina: análisis seroepidemiológico de un hato lechero mediante IFA y ELISA (P1). Memorias del XIV Reunión Científica Técnica de la Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico. Villa Gral. Belgrano, Argentina.
Echaide IE. 2000. La neosporosis bovina. Sitio Argentino de Producción Animal. [En línea] Disponible en: https://produccion-animal.com.ar/sanidad_intoxicaciones_metabolicos/enfermedades_reproduccion/14-la_neosporosis_bovina.pdf [Consultado 12/12/2020].
Ellis JT, McMillan D, Ryce C, Payne S, Atkinson R, Harper PA. 1999. Development of a single tube nested polymerase chain reaction assay for the detection of Neospora caninum DNA. International Journal of Parasitology. 29(10):1589-96. https://doi.org/10.1016/S0020-7519(99)00144-7
Fort M, Edelsten M, Maley S, Innes E. 2015. Seroepidemiological study of Neospora caninum in beef and dairy cattle in La Pampa, Argentina. Acta Parasitológica. 60(2):275-82. https://doi.org/10.1515/ap-2015-0039
Frössling J, Bonnett B, Lindberg A, Björkman C. 2003. Validation of a Neospora caninum iscom ELISA without a gold standard. Preventive Veterinary Medicine. 57(3):141-53. https://doi.org/10.1016/S0167-5877(02)00216-7
Fuchs L, Baldone V, Rojas M, Fort M, Bedotti D, Venturini M, Giménez H. 2007. Prevalencia serológica a toxoplasmosis y neosporosis en el zorro gris pampeano (Pseudalopex gymnocercus) en la provincia de La Pampa, Argentina. Sitio Argentino de Producción Animal. [En línea] Disponible en: https://produccion-animal.com.ar/fauna/Fauna_Argentina_general/99-zorro.pdf [Consultado 1/12/2020].
Gondim LF, McAllister MM, Pitt WC, Zemlicka DE. 2004. Coyotes (Canis latrans) are definitive hosts of Neospora caninum. International Journal of Parasitology. 34 (2):159-61. https://doi.org/10.1016/j.ijpara.2004.01.001
Greiner M, Gardner IA. 2000. Epidemiologic issues in the validation of veterinary diagnostic tests. Preventive Veterinary Medicine. 45(1-2):3-22. https://doi.org/10.1016/S0167-5877(00)00114-8
Hall CA, Reichel MP, Ellis JT. 2006. Performance characteristics and optimisation of cut-off values of two enzyme-linked immunosorbent assays for the detection of antibodies to Neospora caninum in the serum of cattle. Veterinary Parasitology. 140(1-2):61-8. https://doi.org/10.1016/j.vetpar.2006.03.016
Hecker YP, Canton G, Regidor-Cerrillo J, Chianini F, Morrell E, Lischinsky L, Ortega-Mora LM, Innes EA, Odeón A, Campero CM, Moore DP. 2015. Cell mediated immune responses in the placenta following challenge of vaccinated pregnant heifers with Neospora caninum. Veterinary Parasitology. 214(3-4):247-54. https://doi.org/10.1016/j.vetpar.2015.10.015
Hecker YP, Moore DP, Quattrocchi V, Regidor-Cerrillo J, Verna A, Leunda MR, Morrell E, Ortega-Mora LM, Zamorano P, Venturini MC, Campero CM. 2013. Immune response and protection provided by live tachyzoites and native antigens from the NC-6 Argentina strain of Neospora caninum in pregnant heifers. Veterinary Parasitology. 197(3-4):436-46. https://doi.org/10.1016/j.vetpar.2013.07.027
Hecker YP, Morrell EL, Fiorentino MA, Gual I, Rivera E, Fiorani F, Dorsch MA, Gos ML, Pardini LL, Scioli MV, Magarinos S, Paolicchi FA, Canton GJ, Moore DP. 2019. Ovine abortion by Neospora caninum: first case reported in Argentina. Acta Parasitologica. 64(4):950-5.
Hecker YP, Regidor-Cerrillo J, Fiorani F, Horcajo P, Soria I, Gual I, Torioni S, Campero LM, Echaide IE, Álvarez-García G, Ortega-Mora LM, Zamorano PI, Venturini MC, Odeón AC, Cantón GJ, Moore DP. 2019. Immune response to Neospora caninum live tachyzoites in prepubertal female calves. Parasitology Research. 118(10):2945-55. https://doi.org/10.1007/s00436-019-06447-y
Jacobson RH. 1998. Validation of serological assays for diagnosis of infectious diseases. Revue Scientifique et Technique (International Office of Epizootics). 17(2):469-526. http://dx.doi.org/10.20506/rst.17.2.1119
King JS, Slapeta J, Jenkins DJ, Al-Qassab SE, Ellis JT, Windsor P.A. 2010. Australian dingoes are definitive hosts of Neospora caninum. International Journal of Parasitology. 40(8):945-50. https://doi.org/10.1016/j.ijpara.2010.01.008
Kruse PE. 1983. The importance of colostral immunoglobulins and their absorption from the intestine of the newborn animals. Annales de Recherches Veterinaires. Annals of Veterinary Research 14(4):349-53.
Lagomarsino H, Campero LM, Cano D, Armendano JI, Massola L, Hecker Y, García B, Gual I, Bracho V, Pardini L, Leunda MR, Pereyra SB, Lischinsky L, Fiorani F, Rambeaud M, Moré G, Cantón G, Unzaga JM, Recalt V, Bence A, Rodríguez A, Odeón A, Venturini MC, Moore DP. 2016. Control de la neosporosis en un tambo comercial y primer aislamiento de Neospora caninum en bovinos. Veterinaria Argentina. 18:1-25.
Lagomarsino H, Scioli A, Rodríguez A, Armendano J, Fiorani F, Bence Á, García J, Hecker Y, Gual I, Cantón G, Odeón A, Campero C, Moore D. 2019. Controlling endemic Neospora caninum-related abortions in a dairy herd from Argentina. Frontiers in Veterinary Science. 6:446. https://doi.org/10.3389/fvets.2019.00446
Lindsay DS, Dubey JP, Duncan RB. 1999a. Confirmation that the dog is a definitive host for Neospora caninum. Veterinary Parasitology. 82(4):327-33. https://doi.org/10.1016/S0304-4017(99)00054-0
Lindsay DS, Upton SJ, Dubey JP. 1999b. A structural study of the Neospora caninum oocyst. International Journal of Parasitology. 29(10):1521-3. https://doi.org/10.1016/S0020-7519(99)00121-6
López-Gatius F, Garbayo JM, Santolaria P, Yániz JL, Almería S, Ayad A, de Sousa NM, Beckers JF. 2007. Plasma pregnancy-associated glycoprotein-1 (PAG-1) concentrations during gestation in Neospora-infected dairy cows. Theriogenology 67(3):502-8. https://doi.org/10.1016/j.theriogenology.2006.08.014
Mansilla FC, Gual I, Pereyra WR, Cardoso NP, Turco CS, Capozzo AV. 2019. Development and validation of a novel ELISA for the detection of Neospora caninum antibodies in bovine sera. Journal of Veterinary Science & Animal Husbandry. 7(2):1-10.
Marín RE, Ramos S, Luciani M, Odeón A, Brihuega B, Spath E, Campero CM. 2011. Relevamiento seroepidemiológico de enfermedades que afectan la reproducción en bovinos de la Provincia de Jujuy. Revista Veterinaria Argentina 18:1-7. [On-line]. Disponible en: https://veterinariargentina.com/revista/2011/08/relevamiento-seroepidemiologico-de-enfermedades-que-afectan-la-reproduccion-en-bovinos-de-la-provincia-de-jujuy/[Consultado 2/2/2021]
Martino PE, Montenegro JL, Preziosi JA, Venturini MC, Bacigalupe D, Stanchi NO, Bautista EL. 2004. Serological survey of selected pathogens of free-ranging foxes in southern Argentina, 1998-2001. Revue Scientifique et Technique (International Office of Epizootics). 23(3):801-6. http://dx.doi.org/10.20506/rst.23.3.1521
McAllister MM, Dubey JP, Lindsay DS, Jolley WR, Wills RA, McGuire AM. 1998. Dogs are definitive hosts of Neospora caninum. International Journal of Parasitology. 28(9):1473-78.
McCann CM, Vyse AJ, Salmon RL, Thomas D, Williams DJ, McGarry JW, Pebody R, Trees AJ. 2008. Lack of serologic evidence of Neospora caninum in humans, England. Emerging Infectious Diseases. 14(6):978-80. https://doi.org/10.3201/eid1406.071128
Micheloud JF, Moore DP, Canal AM, Lischinsky L, Hecker Y, Cantón G, Odriozola E, Odeón A, Campero CM. 2015. First report of congenital Neospora caninum encephalomyelitis in two newborn calves in the Argentinean Pampas. Journal of Veterinary Science and Technology. 6(5):251. https://doi.org/10.4172/2157-7579.1000251
Moore D, Reichel M, Spath E, Campero C. 2013. Neospora caninum causes severe economic losses in cattle in the humid pampa region of Argentina. Tropical Animal Health and Production. 45(5):1237-41. https://doi.org/10.1007/s11250-013-0353-z
Moore DP. 2005. Fate of Neospora-seropositive animals: an opinion. Parasitología latinoamericana. 60:192-5. http://dx.doi.org/10.4067/S0717-77122005000200018
Moore DP, Campero CM, Odeón AC, Chayer R, Bianco MA. 2003. Reproductive losses due to Neospora caninum in a beef herd in Argentina. Journal of Veterinary Medicine. B, Infectious Diseases and Veterinary Public Health. 50(6):304-8. https://doi.org/10.1046/j.1439-0450.2003.00673.x
Moore DP, Campero CM, Odeón AC, Posso MA, Cano D, Leunda MR, Basso W, Venturini MC, Späth E. 2002. Seroepidemiology of beef and dairy herds and fetal study of Neospora caninum in Argentina. Veterinary Parasitology. 107(4):303-16. https://doi.org/10.1016/S0304-4017(02)00129-2
Moore DP, Konrad JL, San Martino S, Reichel MP, Cano DB, Méndez S, Späth EJ, Odeón AC, Crudeli G, Campero CM. 2014. Neospora caninum serostatus is affected by age and species variables in cohabiting water buffaloes and beef cattle. Veterinary Parasitology. 203(3-4):259-63. https://doi.org/10.1016/j.vetpar.2014.04.011
Moore DP, Odeón A, Campero CM. 2001. Neosporosis bovina: una actualización. Veterinaria Argentina. 18(180):752-75.
Moore DP, Odeón AC, Venturini MC, Campero CM. 2005. Neosporosis bovina: conceptos generales, inmunidad y perspectivas para la vacunación. Revista Argentina de Microbiología. 37(4):217-28.
Moore DP, Pérez A, Agliano S, Brace M, Cantón G, Cano D, Leunda MR, Odeón AC, Odriozola E, Campero CM. 2009. Risk factors associated with Neospora caninum infections in cattle in Argentina. Veterinary Parasitology. 161(1-2):122-5. https://doi.org/10.1016/j.vetpar.2009.01.003
Moré G, Bacigalupe D, Basso W, Rambeaud M, Beltrame F, Ramírez B, Venturini MC, Venturini L. 2009. Frequency of horizontal and vertical transmission for Sarcocystis cruzi and Neospora caninum in dairy cattle. Veterinary Parasitology. 160(1-2):51-4. https://doi.org/10.1016/j.vetpar.2008.10.081
Moré G, Bacigalupe D, Basso W, Rambeaud M, Venturini MC, Venturini L. 2010. Serologic profiles for Sarcocystis sp. and Neospora caninum and productive performance in naturally infected beef calves. Parasitology Research. 106(3):689-93. https://doi.org/10.1007/s00436-010-1721-5
Moré G, Basso W, Bacigalupe D, Venturini MC, Venturini L. 2008. Diagnosis of Sarcocystis cruzi, Neospora caninum, and Toxoplasma gondii infections in cattle. Parasitology Research. 102(4):671-5. https://doi.org/10.1007/s00436-007-0810-6
Morrell EL, Campero CM, Cantón GJ, Odeón AC, Moore DP, Odriozola E, Paolicchi F, Fiorentino MA. 2019. Current trends in bovine abortion in Argentina. Pesquisa Veterinária Brasileira. 39(1):12-9. https://doi.org/10.1590/1678-5150-pvb-5668
Mur-Novales R, López-Gatius F, Serrano-Pérez B, García-Ispierto I, Darwich L, Cabezón O, de Sousa NM, Beckers JF, Almería S. 2016. Experimental Neospora caninum infection in pregnant dairy heifers raises concentrations of pregnancy-associated glycoproteins 1 and 2 in foetal fluids. Reproduction in Domestic Animals = Zuchthygiene. 51(2):282-6. https://doi.org/10.1111/rda.12678
Nolan SJ, Romano JD, Luechtefeld T, Coppens I. 2015. Neospora caninum recruits host cell structures to its parasitophorous vacuole and salvages lipids from organelles. Eukaryotic Cell. 14(5):454-73. http://dx.doi.org/10.1128/EC.00262-14
Novoa MB, Aguirre NP, Ormaechea N, Palmero S, Rouzic L, Valentini BS, Sarli M, Orcellet VM, Marengo R, Vanzini VR, Primo ME. 2020. Validation and field evaluation of a competitive inhibition ELISA based on the recombinant protein tSAG1 to detect anti-Neospora caninum antibodies in sheep and goats. Veterinary Parasitology. 284:109201. https://doi.org/10.1016/j.vetpar.2020.109201
Novoa MB, Valentini BS, Sarli M, Torioni-de-Echaide SM, Primo ME, Echaide IE. 2020b. Evaluation of a competitive inhibition ELISA based on the recombinant protein tSAG1 to detect anti-Neospora caninum antibodies in cattle. Journal Veterinary Diagnostic Investigation. 32(3):401-8. https://doi.org/10.1177/1040638720916711
Organización Mundial de Sanidad Animal (OIE). 2019. Principles and methods of validation of diagnostic assays for infectious diseases. En: Manual of Diagnostic Tests for Aquatic Animals, pp. 1-18.
Pedraza-Díaz S, Marugán-Hernández V, Collantes-Fernández E, Regidor-Cerrillo J, Rojo-Montejo S, Gómez-Bautista M, Ortega-Mora LM. 2009. Microsatellite markers for the molecular characterization of Neospora caninum: application to clinical samples. Veterinary Parasitology. 166(1-2):38-46. https://doi.org/10.1016/j.vetpar.2009.07.043
Pereyra WR, Suárez VH, Cardoso N, Gual I, Martínez GM, Capozzo AV, Mansilla FC. 2021. Prevalencia sérica de Neospora caninum y factores de riesgo asociados a su transmisión en tambos de la provincia de Salta, Argentina. Revista Argentina de Microbiología 53:145-53. https://doi.org/10.1016/j.ram.2020.06.011
Peters M, Lutkefels E, Heckeroth AR, Schares G. 2001. Immunohistochemical and ultrastructural evidence for Neospora caninum tissue cysts in skeletal muscles of naturally infected dogs and cattle. International Journal of Parasitology. 31(10):1144-8. https://doi.org/10.1016/S0020-7519(01)00221-1
Regidor-Cerrillo J, Álvarez-García G, Pastor-Fernández I, Marugán-Hernández V, Gómez-Bautista M, Ortega-Mora LM. 2012. Proteome expression changes among virulent and attenuated Neospora caninum isolates. Journal of Proteomics. 75(8):2306-18. https://doi.org/10.1016/j.jprot.2012.01.039
Regidor-Cerrillo J, Pedraza-Díaz S, Gómez-Bautista M, Ortega-Mora LM. 2006. Multilocus microsatellite analysis reveals extensive genetic diversity in Neospora caninum. Journal of Parasitology. 92(3):517-24. https://doi.org/10.1645/GE-713R.1
Regidor-Cerrillo J, Xia D, Jiménez-Pelayo L, García-Sánchez M, Collantes-Fernández E, Randle N, Wastling J, Ortega-Mora LM, Horcajo P. 2020. Proteomic characterization of hostpPathogen interactions during bovine trophoblast cell line infection by Neospora caninum. Pathogens. 9(9):749. https://doi.org/10.3390/pathogens9090749
Reichel MP, Ellis JT. 2002. Control options for Neospora caninum infections in cattle-current state of knowledge. New Zealand Veterinary Journal. 50(3):86-92. https://doi.org/10.1080/00480169.2002.36288
Reichel MP, McAllister MM, Pomroy WE, Campero C, Ortega-Mora LM, Ellis JT. 2014. Control options for Neospora caninum-is there anything new or are we going backwards? Parasitology. 141(11):1455-70. https://doi.org/10.1017/S0031182014000158
Reichel MP, Wahl LC, Ellis JT. 2020. Research into Neospora caninum-what have we learnt in the last thirty years? Pathogens. 9(6):505. https://doi.org/10.3390/pathogens9060505
Reid AJ, Vermont SJ, Cotton JA, Harris D, Hill-Cawthorne GA, Könen-Waisman S, Latham SM, Mourier T, Norton R, Quail MA, Sanders M, Shanmugam D, Sohal A, Wasmuth JD, Brunk B, Grigg ME, Howard JC, Parkinson J, Roos DS, Trees AJ, Berriman M, Pain A, Wastling JM. 2012. Comparative genomics of the apicomplexan parasites Toxoplasma gondii and Neospora caninum: Coccidia differing in host range and transmission strategy. PLoS pathogens. 8(3):e1002567. https://doi.org/10.1371/journal.ppat.1002567
Rodríguez AM, Maresca S, Cano DB, Armendano JI, Combessies G, Lopéz-Valiente S, Odriozola ER, Späth EJ, Odeón AC, Campero CM, Moore DP. 2016. Frequency of Neospora caninum infections in beef cow-calf operations under extensive management. Veterinary Parasitology. 219:40-3. https://doi.org/10.1016/j.vetpar.2016.02.002
Roelandt S, van der Stede Y, Czaplicki G, van Loo H, van Driessche E, Dewulf J, Hooyberghs J, Faes C. 2015. Serological diagnosis of bovine neosporosis: a Bayesian evaluation of two antibody ELISA tests for in vivo diagnosis in purchased and abortion cattle. The Veterinary Record. 176(23):598. https://doi.org/10.1136/vr.102872
Sánchez GF, Banda RV, Sahagun RA, Ledesma MN, Morales SE. 2009. Comparison between immunohistochemistry and two PCR methods for detection of Neospora caninum in formalin-fixed and paraffin-embedded brain tissue of bovine fetuses. Veterinary Parasitology. 164(2-4):328-32. https://doi.org/10.1016/j.vetpar.2009.05.007
Schares G, Heydorn AO, Cüppers A, Mehlhorn H, Geue L, Peters M, Conraths FJ. 2002. In contrast to dogs, red foxes (Vulpes vulpes) did not shed Neospora caninum upon feeding of intermediate host tissues. Parasitology Research. 88(1):44-52. https://doi.org/10.1007/s004360100496
Schares G, Rauser M, Söndgen P, Rehberg P, Bärwald A, Dubey JP, Edelhofer R, Conraths FJ. 2000. Use of purified tachyzoite surface antigen p38 in an ELISA to diagnose bovine neosporosis. International Journal of Parasitology. 30(10):1123-30. https://doi.org/10.1016/S0020-7519(00)00092-8
Serrano-Pérez B, García-Ispierto I, de Sousa NM, Beckers JF, Almería S, López-Gatius F. 2014. Gamma interferon production and plasma concentrations of pregnancy-associated glycoproteins 1 and 2 in gestating dairy cows naturally infected with Neospora caninum. Reproduction in Domestic Animals = Zuchthygiene. 49(2):275-80. https://doi.org/10.1111/rda.12267
Serrano-Pérez B, Hansen PJ, Mur-Novales R, García-Ispierto I, de Sousa NM, Beckers JF, Almería S, López-Gatius F. 2016. Crosstalk between uterine serpin (SERPINA14) and pregnancy-associated glycoproteins at the fetal-maternal interface in pregnant dairy heifers experimentally infected with Neospora caninum. Theriogenology. 86(3):824-30. https://doi.org/10.1016/j.theriogenology.2016.03.003
Söndgen P, Peters M, Bärwald A, Wurm R, Holling F, Conraths FJ, Schares G. 2001. Bovine neosporosis: immunoblot improves foetal serology. Veterinary Parasitology. 102(4):279-90. https://doi.org/10.1016/S0304-4017(01)00543-X
Swift BL, Kennedy PC. 1972. Experimentally induced infection of in utero bovine fetuses with bovine parainfluenza 3 virus. American Journal of Veterinary Research. 33(1): 57-63.
Thilsted JP, Dubey JP. 1989. Neosporosis-like abortions in a herd of dairy cattle. Journal of Veterinary Diagnostic Investigation. 1(3):205-09. https://doi.org/10.1177/104063878900100301
Trees AJ, Williams DJ. 2005. Endogenous and exogenous transplacental infection in Neospora caninum and Toxoplasma gondii. Trends in Parasitology. 21(12):558-61. https://doi.org/10.1016/j.pt.2005.09.005
Unzaga JM, Moré G, Bacigalupe D, Rambeaud M, Pardini L, Dellarupe A, De Felice L, Gos ML, Venturini MC. 2014. Toxoplasma gondii and Neospora caninum infections in goat abortions from Argentina. Parasitology International. 63(6):865-7. https://doi.org/10.1016/j.parint.2014.07.009
Valentini B, Caspe S, Primo E, Torioni de Echaide S, Echaide I. 2016. Comparación de diferentes pruebas serológicas para el diagnóstico de neosporosis bovina (I1). XXI Reunión Científico Técnica de la Asociación Argentna de Veterinarios de Laboratorios de Diagnóstico, Jujuy, Argentina.
Venturini L, Di Lorenzo C, Venturini MC, Romero J. 1995. Anticuerpos anti Neospora sp., en vacas que abortaron. Veterinaria Argentina. 12:167-70.
Venturini MC, Venturini L, Bacigalupe D, Machuca M, Echaide I, Basso W, Unzaga JM, Di Lorenzo C, Guglielmone A, Jenkins MC, Dubey JP. 1999. Neospora caninum infections in bovine foetuses and dairy cows with abortions in Argentina. International Journal of Parasitology. 29(10):1705-08. https://doi.org/10.1016/S0020-7519(99)00143-5
von Blumröder D, Schares G, Norton R, Williams DJ, Esteban-Redondo I, Wright S, Björkman C, Frössling J, Risco-Castillo V, Fernández-García A, Ortega-Mora LM, Sager H, Hemphill A, van Maanen C, Wouda W, Conraths FJ. 2004. Comparison and standardisation of serological methods for the diagnosis of Neospora caninum infection in bovines. Veterinary Parasitology. 120(1-2):11-22. https://doi.org/10.1016/j.vetpar.2003.12.010
Waldner CL, Cunningham G, Campbell JR. 2004. Agreement between three serological tests for Neospora caninum in beef cattle. Journal of Veterinary Diagnostic Investigation. 16(4):313-5. https://doi.org/10.1177/104063870401600409
Wapenaar W, Barkema HW, Vanleeuwen JA, McClure JT, O'Handley RM, Kwok OC, Thulliez P, Dubey JP, Jenkins MC. 2007. Comparison of serological methods for the diagnosis of Neospora caninum infection in cattle. Veterinary Parasitology. 143(2):166-73. https://doi.org/10.1016/j.vetpar.2006.08.007
Wilkowsky SE, Bareiro GG, Mon ML, Moore DP, Caspe G, Campero C, Fort M, Romano MI. 2011. An applied printing immunoassay with recombinant Nc-SAG1 for detection of antibodies to Neospora caninum in cattle. Journal of Veterinary Diagnostic Investigaion. 23(5):971-6. https://doi.org/10.1177/1040638711416845
Wooding FB, Roberts RM, Green JA. 2005. Light and electron microscope immunocytochemical studies of the distribution of pregnancy associated glycoproteins (PAGs) throughout pregnancy in the cow: possible functional implications. Placenta. 26(10):807-27. https://doi.org/10.1016/j.placenta.2004.10.014
Wouda W, Moen AR, Visser IJ, van Knapen F. 1997. Bovine fetal neosporosis: a comparison of epizootic and sporadic abortion cases and different age classes with regard to lesion severity and immunohistochemical identification of organisms in brain, heart, and liver. Journal of Veterinary Diagnostic Investigation. 9(2):180-5. https://doi.org/10.1177/104063879700900212
Wu JT, Dreger S, Chow EY, Bowlby EE. 2002. Validation of 2 commercial Neospora caninum antibody enzyme linked immunosorbent assays. Canadian Journal of Veterinary Research = Revue Canadienne de Recherche Veterinaire. 66(4):264-71.

