



Efecto de la concentración del H3O+ y Mg en el crecimiento inicial y la absorción de nutrimentos en plantas de banano cultivadas en solución hidropónica
Effect of concentration H3O+ and Mg in early growth and absorption of nutrients in banana plants grown in hydroponic solution
Siembra
Universidad Central del Ecuador, Ecuador
ISSN: 1390-8928
ISSN-e: 2477-8850
Periodicidad: Semestral
vol. 3, núm. 1, 2016
Recepción: 12 Noviembre 2015
Aprobación: 11 Enero 2016
Resumen: Se condujo un ensayo para evaluar el efecto de la concentración del ión H3O+ y del Mg en el crecimiento y absorción de agua y nutrimentos en plantas de banano. Se evaluaron 5 tratamientos que provienen con cuatro dosis de Mg (25, 50, 100, 200 mg l-1) y dos dosis de H3O+ (1x10-4 M y 1x10-6 M) de manera que la combinación de dosis de Mg- H3O+ produjo los siguientes tratamientos: 1) 25-pH 6; 2) 25-pH 4; 3) 50-pH 4; 4) 100-pH 4; y 5) 200-pH 4. Se utilizaron plantas provenientes de cultivo de tejidos del clon “Gran Naine” que se pusieron a crecer por 63 días en solución nutritiva en potes de 20 l de capacidad. Las variables evaluadas fueron: altura de planta, circunferencia de pseudo tallo, producción de biomasa, ritmo de emisión foliar, área foliar y absorción de nutrimentos. La concentración del ión H3O+ no afectó la absorción del agua, ni las variables de crecimiento. La absorción del N, K, Ca, Mg, S, Zn y B fue igual en las dos concentraciones de H3O+ evaluadas, mientras que el P, Fe, Cu fueron absorbidos en mayor cantidad por las plantas que crecieron en la solución con mayor concentración de H3O+ (pH 4) y el Mn se absorbió en mayor cantidad en la concentración menor de H3O+ (pH 6). Las dosis de Mg disminuyeron los valores de las variables de crecimiento y de materia seca producida, el efecto fue de tipo lineal a excepción de las variables número de hojas a cosecha y biomasa de la raíz de segundo orden que fue cuadrático. Las dosis de Mg redujeron la absorción de los nutrimentos en el siguiente orden Ca > N ≥ K ≥ S > P y Mn > Zn > Cu respectivamente, para el Fe y B el efecto fue positivo.
Palabras clave: Musa AAA, banano, Cavendish, pH, magnesio, hidronio.
Abstract: A hydroponic experiment was carried out with the objective of studying the effect of H3O+ and Mg concentration on the growth and water and nutrients absorption by banana plants. The five treatments evaluated consisted of the combination of four Mg rates (25, 50, 100, 200 mg l-1) and two concentrations of H3O+ (1x10-4 M y 1x10-6M) which produced the following treatments: 1) 25-pH 6; 2) 25-pH 4; 3) 50-pH 4; 4) 100-pH 4; and 5) 200-pH 4. Tissue culture plants of the Grand Naine clone between 7 and 10 cm height were grown in 20 L containers for 63 days. At the end of this time, plant height, pseudostem circumference, plant biomass, leaf emission rate, leaf area and nutrient absorption were measured. The concentration of H3O+ had no effect on water absorption or growth variables. The absorption of N, K, Ca, Mg, S, Zn, B was the same at both the H3O+ concentrations, while P, Fe and Cu absorption was greater in plants grown at a greater concentration of H3O+ (pH 4) while Mn was absorbed in greater quantities at the lower concentration of H3O+ (pH 6). The concentration of Mg affected the growth variables and dry matter accumulation by different plant parts. The effects were linear, except for leaf number at the end of the experiment and second order root biomass which were quadratic. An increasing concentration of Mg reduced the absorption of the macro and micro-nutrients in the following order: Ca > N ≥ K ≥ S > P y Mn > Zn > Cu, while the absorption of Fe and B was increased.
Keywords: Musa AAA, bananas, Cavendish, pH, magnesium, hydronium.
1. Introducción
La acidificación del suelo es un proceso natural que ocurre durante la pedogénesis de regiones donde la precipitación es superior a la evapotranspiración. En estas regiones, la continua meteorización provoca la pérdida de cationes alcalinos y alcalinotérreos (K+, Na+, Ca+2, Mg+2) e incrementa el contenido de cationes metálicos (Al+3, Fe+2, Mn+2) que pueden sufrir hidrólisis (Ayarza & Salinas, 1982; Baligar et al., 1988; Bertsch, 1995; Buol et al., 1989; Fassbender & Bornemisza, 1987; Matsumoto, 2002; Molina, 1998; Zapata, 2004). De esta forma, el suelo se acidifica, pierde su fertilidad natural (Molina 1998) y pierde silicio en forma de Si(OH)0, llegando a disminuir significativamente el pH del suelo (Zapata, 2004).
En el suelo debe distinguirse entre la acidez actual, que es la concentración de H+ en la solución del suelo, la acidez intercambiable que constituyen el H+ y Al+3 intercambiables retenidos en los coloides del suelo por fuerzas electrostáticas, la acidez no intercambiable que incluye H+ adsorbido en los coloides del suelo por enlaces covalentes en la superficie de los minerales arcillosos de carga variable y la acidez potencial que es la sumatoria de la acidez intercambiable y la no intercambiable (Fassbender & Bornemisza, 1987; Mengel & Kirkby, 2000; Molina, 1998).
La concentración de H+ de la solución del suelo tiene un efecto pronunciado sobre los minerales, microorganismos y raíces de las plantas (Fassbender & Bornemisza, 1987; Mengel & Kirkby, 2000). Concentraciones altas de H+ favorecen la meteorización de los minerales, resultando en la liberación de diversos iones como K+, Ca+2, Mg+2, Mn+2, Cu+2 y Al+3 (Bache, 1985; Mengel & Kirkby, 2000) dejando a las bases (K+, Ca+2, Mg+2) expuestas a lixiviación (Flores, 1996). Además, el pH controla la solubilidad de sales, incluyendo carbonatos, sulfatos y fosfatos, así como la dinámica de los compuestos hidroxi-alumínicos en el suelo (Bache, 1985; Fassbender & Bornemisza, 1987; Miyasaka et al., 2007).
La disponibilidad de nutrimentos en el suelo y la velocidad de absorción de éstos por la planta también dependen del pH (Barber, 1995; Lahav & Turner, 1992; Marschner, 1995; Rorison, 1980; Villalobos & Killorn, 2001). Generalmente, los aniones como nitratos y fosfatos se absorben en mayor medida a niveles de pH débilmente ácidos, pero, en el caso de los fosfatos, el pH regula la relación H2PO4-/HPO4-2. Por otro lado, la absorción de cationes es mayor cuando se incrementa el pH y se acerca a valores de neutralidad (Carvajal et al., 1963; Lahav & Turner, 1992; Rorison, 1980; Villalobos & Killorn, 2001).
El efecto del pH del sustrato en el crecimiento y la absorción de nutrimentos en diferentes cultivos ha sido ampliamente estudiado. El rango de pH óptimo para el crecimiento difiere según el cultivo y la variedad (Arnon et al. 1942, Klapp 1951, Ignatieff y Page (1959) citados por Fassberder y Bornemiza 1987, Spain et al. 1975). El rango puede ser estrecho como es el caso de la alfalfa (6,5-7,4) o amplio como en la papa (4,1-7,4) (Klapp, 1951).
Carvajal et al. (1963) estudiaron el efecto del pH del substrato en el crecimiento y absorción del café, en rangos de pH de 4 a 7,5, con intervalos de 0,5 unidades, y encontraron que las plantas que crecieron en pH 7,5 absorbieron 2,3 veces más Ca y 16,3 veces más P con respecto a las que crecieron en pH de 4,0. Además encontraron que la concentración del ión H+ del medio no afectaba la absorción de K, Mg y N-NO3. Cuando evaluaron el crecimiento, es- tos autores no encontraron diferencias estadísticas en la acumulación de biomasa de las plantas creciendo en el rango de pH 5,5-7,5.
El efecto del pH del suelo en la producción de banano no ha sido suficientemente estudiado, sin embargo, se conoce que crece en un amplio rango de pH en el suelo (3,5 a 9,0), pero el rango de pH más común esta entre 5,5 y 8,0 (Champion et al., 1958; Delvaux, 1995; Godefroy et al., 1978; Martin-prevel, 1980; Robinson, 1996; Stover & Simmonds, 1987). Se conoce que el pH se correlaciona positivamente con el rendimiento del cultivo del banano y se ha demostrado que los rendimientos de fruta a pH 4,5 son alrededor de la mitad de los rendimientos obtenidos a pH 6,0 (Champion et al., 1958). La planta de banano tolera pH bajo, pero la acidez afecta el vigor de la planta y los mayores rendimientos de fruta se obtienen a pH entre 5,5 y 6,5 (Serrano, 2003). El pH bajo limita el crecimiento de las plantas en forma indirecta por el efecto de factores secundarios, consecuencia del pH ácido, como la toxicidad de Al y/o Mn y las deficiencias de P, Ca, Mg y N (Ayarza & Salinas, 1982; Evers, 1963; Fassbender & Bornemisza, 1987; Foy, 1984; Matsumoto, 2002).
Godefroy et al. (1978) aplicaron CaCO3 en dosis de 0, 3, 6, 12 y 24 t ha-1 en un suelo de pH 3,4 cultivado con banano y evaluaron los cambios físicos y químicos del suelo, así como la productividad de 3 generaciones del cultivo. Estos autores encontraron que las dosis de 3, 6, 12 y 24 t ha-1 modificaron el pH a 4,2, 4,7, 5,9 y 6,7, respectivamente, sin embargo, no se hallaron diferencias estadísticamente significativas en el rendimiento de fruta. Un estudio conducido por García et al. (1976) encontró solamente una diferencia de 4% en la circunferencia del pseudo tallo en plantas de banano cultivadas en suelos con pH de 4,4 a 8,2, pero esta diferencia no tuvo impacto en los rendimientos. Lo anterior sugiere que la planta de banano es tolerante a un rango amplio de pH en el suelo.
Por otro lado, se han encontrado incrementos en la productividad del banano al aplicar enmiendas magnesianas en suelos ácidos que presentaban contenidos de Mg de 1 cmol(+) l (Caro-Costas et al. 1964). Los cantones de Sarapiquí, Pococí y Guácimo en la zona Atlántica Costa Rica se caracterizan por ser de pH bajo y tener contenidos de Ca y Mg de 5,61 y 1,61 cmol(+) l-1 , respectivamente (Lopez & Solís, 1992). Estos suelos podrían responder a enmiendas con Mg
Investigación conducida en soluciones nutritivas con varios cultivares de plátano y uno de banano demostraron que una concentración de 78,5 uM de Al en una solución ácida redujo la absorción de agua entre 30 y 40% con respecto al testigo. En las soluciones sin Al se observaron incrementos en la absorción de Ca, Mg, K, N-NO3, N-NH4, mientras que en presencia de Al la absorción de todos estos elementos se redujo, especialmente la del Mg que se redujo en 80% (Rufyikiri et al., 2000, 2001).
El Al compite con el Ca y Mg por los sitios de enlace en la membrana celular, condición que disminuye la absorción del Ca y Mg. La inhibición de la absorción estos dos cationes por el Al se debe a diferentes mecanismos. En el caso del Ca se debe a que el Al bloquea los canales de la membrana plasmática, mientras que la inhibición de la absorción del Mg se debe al bloqueo de la actividad de los transportadores de proteínas (Marschner, 1995). El incremento de la concentración externa de Al disminuye la absorción del Mg y la concentración de éste en diferentes partes de la planta. Se puede prevenir el efecto nocivo del Al en el crecimiento manteniendo altos niveles de Mg en la planta (alta relación Mg/Al), evitando así las deficiencias inducidas de este nutrimento por la presencia del Al (Marschner, 1995). Basándose en lo expuesto por Marschner (1995) y Rufyikiri et al. (2001), se puede pensar que el incremento de contenido de Mg en la solución puede llegar a compensar los efectos del Al en las plantas de banano. Por esta razón, el objetivo del presente trabajo fue determinar el efecto de diferentes concentraciones de Mg y diferentes valores de pH en el crecimiento y absorción de nutrimentos por plantas de banano creciendo en solución hidropónica.
2. Materiales y métodos
El experimento se condujo en el Centro de Investigación San Luis de la Compañía Bananera Atlántica (CISL-COBAL), en San Luis, distrito primero del cantón de Guácimo provincia de Limón. El CISL está ubicado a 82 m s. n. m, tiene una temperatura promedio anual de 27 ºC y una precipitación anual promedio de 3.970 mm. Se utilizaron plantas provenientes de cultivo de tejidos del clon “Gran Naine” de 7 a 10 cm de altura y con 4 a 5 hojas emitidas que tenían aproximadamente 4 semanas de edad y que estaban listas para iniciar la etapa de “endurecimiento”. Las plantas se pusieron a crecer en potes de 20.0 l de capacidad que contenían la solución nutritiva propuesta por Johnson y descrita por Lorenz & Maynard (1988). El volumen de solución nutritiva en cada pote fue de 19.0 l. La concentración de nutrimentos (mg l-1) de la solución base fue: N: 104; P: 33; K: 138; Mg: 25; Ca 90; S: 35; Fe: 2,6; Cu: 0,1; Zn: 0,3; Mn 1; B 0,3 y Mo: 0,01 y se la cambió dos veces por semana. Se evaluaron los siguientes tratamientos: 1) 25 mg l-1 de Mg, pH 6; 2) 25 mg l-1 de Mg, pH 4; 3) 50 mg l-1 de Mg, pH 4; 4) 100 mg l-1 de Mg, pH 4: y 5) 200 mg.l-1 de Mg, pH 4. Los tratamientos 1 y 2 sirvieron para evaluar el efecto del pH a una misma concentración de Mg, mientras que los tratamientos del 2 al 5 permitieron evaluar el efecto de las dosis de Mg a un mismo pH del medio. Para suplir el Mg adicional al suministrado en la solución nutritiva base (tratamientos 3, 4 y 5) se preparó una solución madre de 23.75 mg l-1 de Mg con MgSO47H2O y se adicionaron alícuotas de 20, 60, 140 ml a cada pote. Para lograr pH 6 fue necesario sustituir el 25% del KNO3 de la solución base con K2CO3 y NH4NO3, para esto se prepararon soluciones madre de 91.463 mg l-1 de K y 31.688 mg l-1 de N y se adicionaron alícuotas de 5 ml por pote. Se utilizó un diseño irrestricto al azar con 5 repeticiones, cada planta constituyó la unidad experimental respectiva. Al principio y a las 9 semanas de iniciado el experimento se evaluaron las siguientes variables: 1) ritmo de emisión foliar (REF) utilizando la siguiente fórmula: N° de hojas totales emitidas / N° de semanas evaluadas. Al momento de establecer el experimento se marcó la última hoja emitida completamente abierta y se tomó nota del estado de la hoja “candela”, a partir de ahí se contaron las hojas emitidas al final de las 9 semanas; 2) índice de incremento en altura (IIA) que se logró midiendo desde la base del cormo hasta la “V” formada entre la última hoja completamente abierta y la hoja candela. El IIA se obtuvo a partir de la fórmula (cm de altura final – cm altura inicial) / N° de semanas evaluadas; 3) área foliar (AF) medida al inicio y final del experimento solamente en las hojas completamente abiertas. Se procedió a dibujar las hojas en papel, luego se recortó el dibujo por el perímetro y se determinó la masa del papel. El área se obtuvo al comparar la masa del dibujo de la hoja contra la masa de un dibujo del mismo tipo de papel de área conocida (400 cm2); 4) producción de biomasa (PB) determinada a las 9 semanas de iniciados los tratamientos. Se dividió la planta en raíz de segundo orden, raíz de primer orden, cormo, pseudo tallo y nervadura (incluye pseudo peciolo) de hojas inferiores y superiores; 5) lámina foliar (LF) de las hojas inferiores y superiores. La división de hojas superiores e inferiores fue arbitraria y se consideró el grupo de hojas superiores a las últimas 5 hojas emitidas (hojas más jóvenes) y el grupo de hojas inferiores a las restantes hojas al momento de la cosecha. Todos estos tejidos se secaron en estufa a 70 °C hasta alcanzar masa constante. Se calcularon los siguientes índices fisiológicos y parámetros morfológicos de acuerdo a las fórmulas respectivas descritas por Turner (1972), Bertsch (1995) y Rodríguez y Leihner (2006): 1) índice de crecimiento absoluto (ICA) = (msf – msi )/ t2 – t1)) donde msf=masa seca final, msi= masa seca inicial, t2=tiempo final, t1= tiempo inicial; 2) índice de crecimiento relativo (ICR) = ((ln msf-ln msi)/ (t2- t1)), (ln=logaritmo natural); 3) índice de crecimiento foliar absoluto (ICFA): ((af2 - af1)/(t2-t1)), (af2 = área foliar final, af1 = área foliar inicial); 4) índice de crecimiento foliar relativo (ICFR): ((ln af -ln af )/ (t2 -t1)); 5) tasa de asimilación neta (TAN): (((msf-msi) x(ln af2 – ln af1))/ (t2-t1)x(af2-af1); 6) relación de área foliar (RAF): (af2/msf); 6) relación de masa foliar (RMF): (msfo/msf), (msfo = masa seca foliar); 7) área foliar específica (AFE): (af2/msfo); 7) razón de masa radicular (RMR): (msr/msf), (msr = masa seca de raíces); 8) relación de raíces a hojas (RRH): (msr/ mofo) y; 9) relación de raíces a parte aérea (RRPA): (msr/mspa), (mspa=masa seca parte aérea).
Debido a que el método de determinación de la biomasa fue destructivo, la masa seca inicial se determinó de manera indirecta, tomando 10 plantas de iguales características a las utilizadas en el experimento en el mismo momento del establecimiento y se determinó la masa fresca y seca para calcular el porcentaje de masa seca por planta. En cada planta se determinó el peso fresco antes de colocarse en el pote respectivo y se asumió que las mismas presentaban igual porcentaje de masa seca que el promedio de las 10 plantas utilizadas en la determinación del porcentaje de masa seca, obteniendo así la masa seca inicial de cada una de las plantas usadas en cada tratamiento. Al momento de la cosecha se determinó la concentración de nutrimentos en los diferentes órganos de la planta. El análisis químico se realizó por el método de digestión húmeda (Westerman, 1990), el material seco de cada tejido de la planta fue molido y se hizo una digestión con ácido nítrico y se determinaron los contenidos de P, K, Ca, Mg, S, Fe, Cu, Zn, Mn, y B por espectrometría de emisión de plasma, el N se determinó por el método de combustión en seco (Dumas) en analizador automático de N (Westerman, 1990). El análisis de la conductividad eléctrica se realizó por el método del puente eléctrico, utilizándose un conductímetro marca Beckman Instruments, Inc. Modelo RC-16C, el cual fue calibrado con una solución KCl 0,01M (Westerman, 1990). La absorción total de nutrimentos se calculó multiplicando la concentración de cada nutrimento por la masa seca de los diferentes componentes de la biomasa y se realizó la sumatoria para obtener la absorción total.
El consumo de agua se determinó aforando los potes a 19 litros con solución nutritiva, se determinó la masa del pote + solución nutritiva al inicio y final de cada ciclo de sustitución (3 y 4 días) y la diferencia de masa correspondió al consumo de agua en litros por la planta en dicho período. El consumo total de agua se obtuvo a partir de la sumatoria de agua consumida en cada ciclo de sustitución de la solución nutritiva. El pH de la solución se midió con el método del potenciómetro (Westerman, 1990) y se controló cada 24 horas y se ajustó siempre que la lectura presentara una desviación de -0,17 y + 0,3 de unidad de pH mediante la adición de KOH 0,5M y HCl concentrado, según fuera el caso.
Para el análisis estadístico se utilizó el modelo lineal general (GLM) procedimiento del programa S.A.S versión 8.1 (análisis de varianza) y pruebas de contraste. Se consideraron las diferencias significativas a valores de p ≤ 0,05, la separación de medias se realizó por la prueba de diferencia mínima significativa.
3. Resultados y discusión
3.1. Efecto de la concentración del H3O+ y Mg en la absorción de solución nutritiva
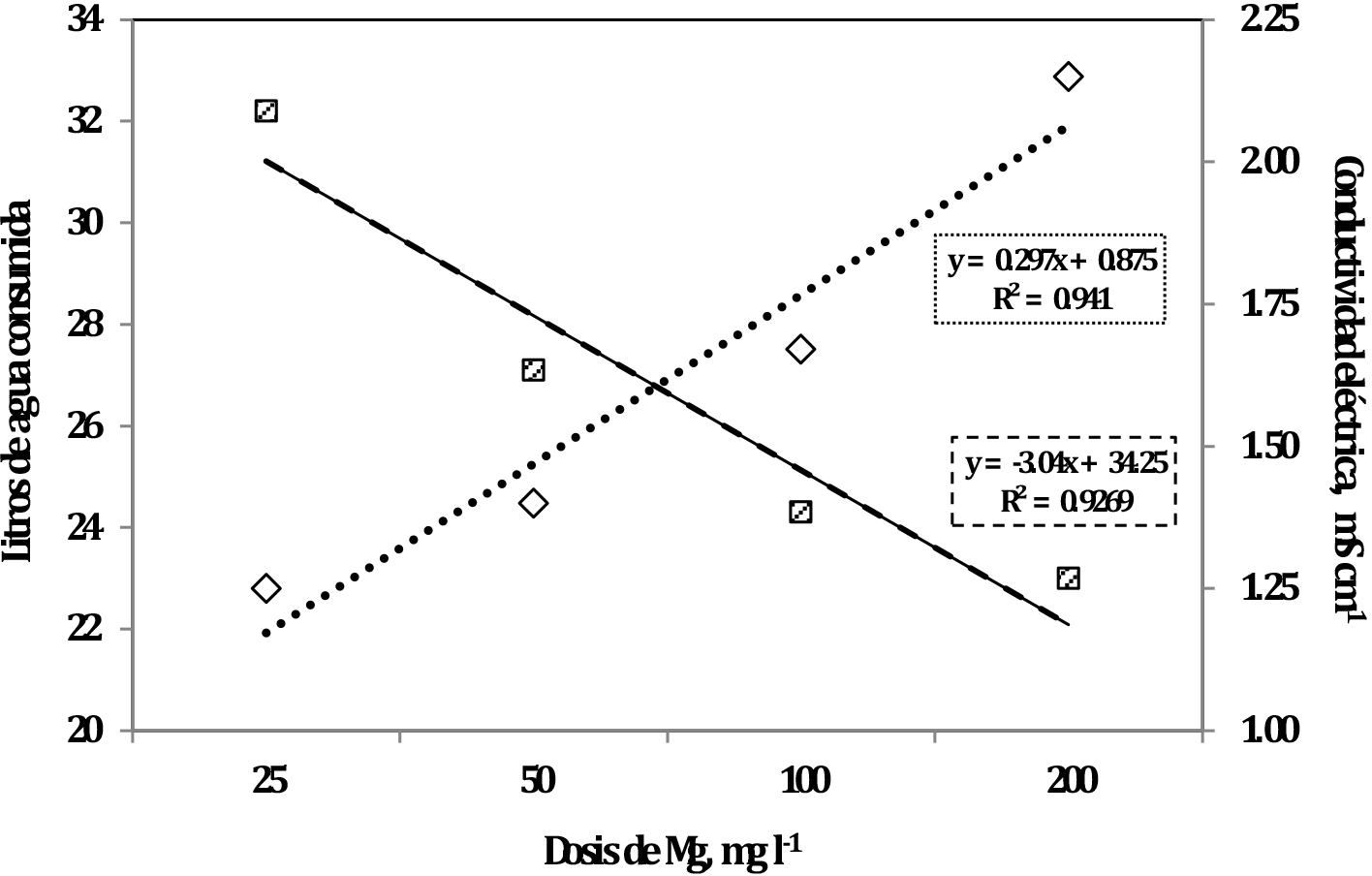
El consumo de solución nutritiva por la planta a lo largo del ensayo no fue afectado por la concentración de H3O+ (pH 4 y 6), pero sí se afectó por el incremento en la concentración de Mg en la solución. El consumo de solución nutritiva se redujo significativamente con la dosis de 200 mg l-1 de Mg (Tabla 1). El menor consumo de solución nutritiva por las plantas con la mayor concentración de Mg fue el primer efecto detectado. Se observaron diferencias estadísticamente significativas entre las plantas con menor dosis de Mg (25 mg l-1) y las con la dosis mayor (200 mg l-1) desde el inicio de la evaluación. El consumo de solución nutritiva con la dosis de 100 mg l-1 fue estadísticamente diferente del consumo con la dosis menor (25 mg l-1) a partir del día 31. No existieron diferencias estadísticamente significativas entre la dosis de 25 y 50 mg l-1. El consumo de solución nutritiva por las plantas fue inverso a la concentración de Mg (Figura 1), debido probablemente al aumento de conductividad eléctrica de la solución nutritiva al incrementar la concentración de Mg, condición que ocasionó un menor consumo por parte de la planta, coincidiendo con los resultados encontrados por De Oliveira et al. (2000).
| TRATAMIENTOS | Probabilidad > F | ||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Efecto concentración | Mg efeto lineal | Mg efecto cuadrático | |||||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | H3O+ | |||
| N° días | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | T2, 3, 4, 5 | T2, 3, 4, 5 |
| Litros solución absorbida por planta | |||||||||
| 3 | 0,36 ab | 0,37 a | 0,36 ab | 0,32 ab | 0,26 b | ns | 0,0314 | ns | |
| 7 | 0,77 ab | 0,38 a | 0,80 ab | 0,75 ab | 0,60 b | ns | 0,0320 | ns | |
| 10 | 1,00 ab | 1,23 a | 1,06 ab | 1,05 ab | 0,81 b | ns | 0,0308 | ns | |
| 14 | 1,60 ab | 2,05 a | 1,60 ab | 1,64 ab | 1,28 b | ns | 0,0282 | ns | |
| 17 | 2,05 ab | 2,50 a | 2.03 ab | 2,06 ab | 1,60 b | ns | 0,0205 | ns | |
| 21 | 2,64 ab | 2,92 a | 2,56 ab | 2,43 ab | 1,95 b | ns | 0,0172 | ns | |
| 24 | 3,08 a | 3,31 a | 2,90 ab | 2,71 ab | 2,19 b | ns | 0,0085 | ns | |
| 28 | 4,04 a | 4,07 a | 3,58 ab | 3,31 ab | 2,64 b | ns | 0,0027 | ns | |
| 31 | 4,86 a | 4,87 a | 4,30 ab | 3,96 ab | 3,17 c | ns | 0,0013 | ns | |
| 35 | 5,99 a | 6,05 a | 5,33 ab | 4,92 b | 3,94 c | ns | 0,0007 | ns | |
| 38 | 6,95 a | 7,00 a | 6,19 ab | 5,69 b | 4,58 c | ns | 0,0007 | ns | |
| 42 | 8,76 a | 8,79 a | 7,78 ab | 7,12 b | 5,73 c | ns | 0,0005 | ns | |
| 45 | 11,00 a | 11, 13 a | 9,78 ab | 8,99 b | 7,16 c | ns | 0,0004 | ns | |
| 49 | 13,83 a | 13,84 a | 12,02 ab | 11,08 b | 8,63 c | ns | 0,0001 | ns | |
| 52 | 16,39 a | 16,56 a | 14,28 ab | 13,20 b | 10,21 c | ns | 0,0001 | ns | |
| 56 | 19,70 a | 19,77 a | 18,30 ab | 16,35 b | 13,34 c | ns | <0,0001 | ns | |
| 59 | 24,74 a | 24,71 a | 22,73 ab | 20,03 b | 16,40 c | ns | <0,0001 | ns | |
| 63 | 30,94 a | 32,64 a | 29,45 ab | 26,69 b | 21,46 c | ns | <0,0001 | ns | |
| Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo.z | |||||||||
3.2. Efecto de la concentración del H3O+ y Mg en la solución hidropónica en el crecimiento total de la planta
Los resultados indican que las dos concentraciones de H3O+ (1x10-4 M y 1x10-6 M) con la misma concentración de Mg (25 mg l-1) no afectaron la producción de biomasa, la altura de planta, el ritmo de emisión foliar, el número de hojas a cosecha, el área foliar, la circunferencia en la base del pseudo tallo y número de brotes (hijos) emitidos (Tabla 2). Por otro lado, el incremento en la concentración de Mg causó un efecto lineal negativo en la producción de biomasa, la altura de la planta, la circunferencia en la base del pseudo tallo, el número de brotes emitidos (hijos) y el área foliar (Tabla 2). Es probable que la menor absorción de agua por las plantas se debiera al incremento en la concentración de Mg y su consecuente efecto en la conductividad eléctrica. Esto podría ser la causa de la reducción del área foliar, que a su vez afectó el comportamiento del crecimiento vegetativo, debido a que una menor área foliar produce una menor cantidad de fotoasimilados. Se conoce que el banano responde al déficit de agua con la reducción del tamaño de la hoja y la reducción en la distancia entre pseudo pecíolos (Turner, 1972; Turner & Lahav, 1983). También se ha observado una menor absorción de agua por plantas de banano al adicionar Al a la solución nutritiva, en consecuencia se reduce el área foliar, la altura de la planta y la distancia entre pseudo pecíolos (Rufyikiri et al., 2001).
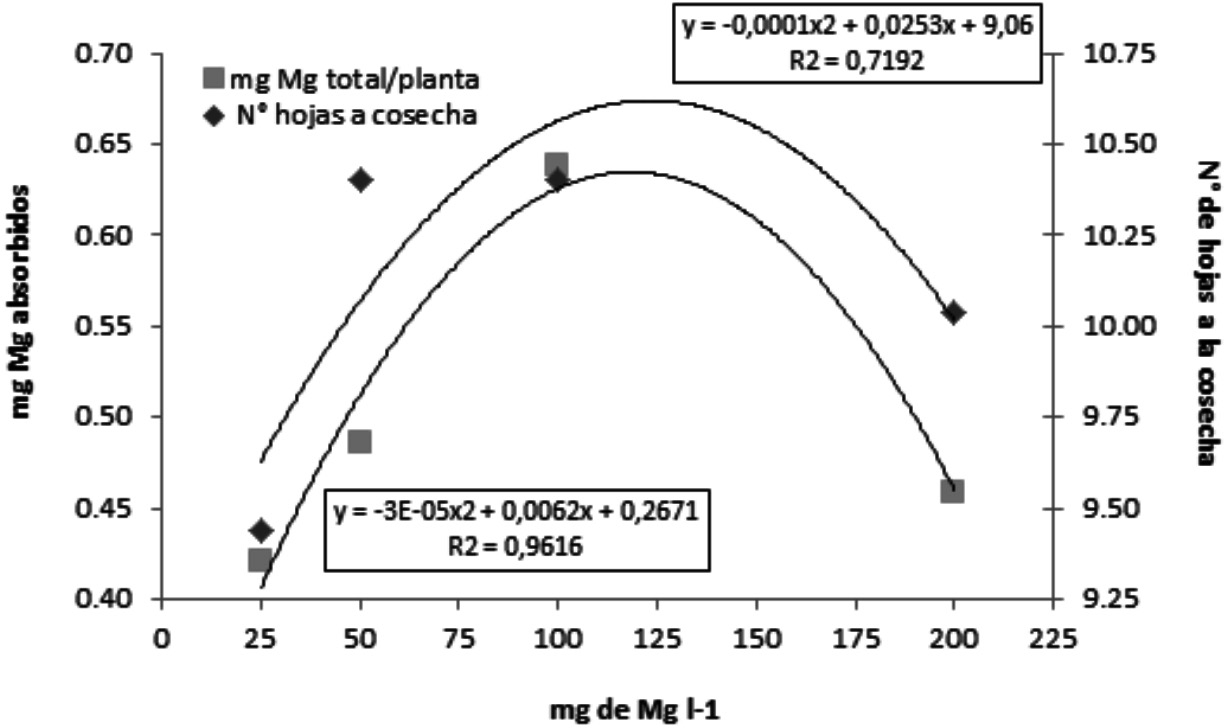
El incremento en la concentración de Mg de 25 a 50 mg l-1 afectó significativamente al número de hojas al momento de finalizar el experimento, posiblemente debido a que el incremento en concentración de Mg aumenta su absorción en toda la planta (Figura 2), particularmente en las hojas inferiores de mayor edad lo que evita la senescencia prematura que ocurre cuando no hay suficiente Mg para redistribución de las hojas viejas a las nuevas. El número de hojas disminuyó con la utilización de dosis de Mg mayores de 100 mg l-1 probablemente debido al efecto del incremento de la conductividad eléctrica de la solución sobre las variables de crecimiento de la planta. El Mg es muy móvil en el floema y se puede translocar desde las hojas más viejas a las más jóvenes o a los ápices en tiempos cortos (días), lo que permite que la planta no detenga su crecimiento y la redistribución de Mg de las hojas viejas a las nuevas favorece la senescencia normal de las hojas más viejas (Schimansky, 1973; Steucek & Koontz, 1970).
| TRATAMIENTOS Probabilidad > F | |||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Efecto concentración | Mg efecto lineal | Mg efecto cuadrático | |||||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | H3O+ | |||
| Variable | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | T2, 3,4, 5 | T2, 3, 4, 5 |
| m.s.f (g) | 141,73 a | 153,91 a | 140,26 a | 128,12 a | 83,93 b | ns | <0,0001 | ns | |
| a.f. (cm) | 70,10 ab | 74,40 a | 70,10 ab | 65,60 b | 55,60 c | ns | <0,0001 | ns | |
| r.e.f. (h sem1) | 1,09 a | 1,10 a | 1,07 a | 0,97 a | 0,92 a | ns | ns | ns | |
| n.h.c. | 99,66 b | 9,44 b | 10,40 a | 10,40 a | 10,04 ab | ns | ns | 0,0226 | |
| ar. fol. (cm2) | 12213 a | 13912 a | 13230 a | 11948 a | 83,55 b | ns | <0,0001 | ns | |
| c.b. pt (cm) | 21,93 ab | 23,70 a | 21,28 ab | 22,70 ab | 20,32 b | ns | <0,0001 | ns | |
| n.b.e. “hijos” | 2,40 a | 2,60 a | 2,2 ab | 2,20 ab | 1,00 b | ns | <0,0001 | ns | |
| m.s.f (masa seca final); a.f (altura final); r.e.f. (ritmo de emisión foliar, hojas por semana); n.h.c (número de hojas a cosecha); c.b. p.t. (circunferencia base del pseudo tallo); n.b.e (número de brotes emitidos). Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo. | |||||||||
3.3. Importar tabla Efecto de la concentración del H3O+ y Mg en los índices de crecimiento y parámetros morfológicos
En general, la tendencia de comportamiento de los índices de crecimiento fue la misma a la observada con los valores absolutos de las variables de crecimiento, la concentración de H3O+ a pH 4 y 6 no afectó los índices fisiológicos IIA, ICA, ICR, ICFA, ICFR y TAN (Tabla 3). Por otro lado, el incremento del contenido de Mg en la solución nutritiva afectó de forma negativa los índices fisiológicos, a excepción del TAN, debido a que hubo una menor absorción de agua conforme se incrementó el Mg en la solución, lo que redujo el área foliar y provocó una menor producción de materia seca.
Los parámetros morfológicos RAF, RMF, AFE, RMR, RRH y RRPA no cambiaron por efecto de la concentración de H3O+ (Tabla 3), probablemente debido a un efecto compensatorio en las relaciones (al disminuir el valor del numerador también disminuye el del denominador de la relación y viceversa), de esta forma los cocientes obtenidos resultaron iguales para los diferentes tratamientos. El incrementó de la concentración de Mg afectó solamente los parámetros RMR y RRPA en forma lineal y positiva, debido probablemente a la menor producción de materia seca aérea cuando se incrementó el Mg en la solución.
| TRATAMIENTOS Probabilidad > F | |||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Efecto concentración | Mg efecto lineal | Mg efecto cuadrático | |||||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | H3O+ | |||
| Variable | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | T2, 3, 4, 5 | T2, 3, 4, 5 |
| IIA (cm semana-1) | 6,20 ab | 6,82 a | 6,41 ab | 5,97 bc | 5,20 c | ns | < 0,0001 | ns | |
| ICA (g semana-1) | 14,53 a | 15,56 a | 14,19 a | 12,95 a | 8,98 b | ns | <0,0001 | ns | |
| ICR (g g semana-1) | 0,56 ab | 0,58 a | 0,59 a | 0,57 ab | 0,55 b | ns | 0,005 | ns | |
| ICFA (cm2 semana-1) | 1245 a | 14,01 a | 1331 a | 1202 a | 888 a | ns | < 0,0001 | ns | |
| ICFR (cm2 cm2-1 semana-1) | 0,48 ab | 0,49 a | 0,49 ab | 0,48 ab | 0,47 b | ns | 0,0292 | ns | |
| TAN (cm2 cm2-1 semana-1) | 0,0055 a | 0,005 a | 0,0052 ab | 0,0052 a | 0,0047 b | ns | ns | ns | |
| RAF (cm2 g-1) | 86,40 b | 90,57 ab | 94,06 ab | 93,11 ab | 99,62 a | ns | ns | ns | |
| RMF (g g-1) | 0,52 a | 0,49 a | 0,50 a | 0,50 a | 0,l52 a | ns | ns | ns | |
| AFE (cm2 g-1) | 167,32 b | 184,61 ab | 188,98 a | 194,44 a | 194,44 a | ns | ns | ns | |
| RMR (g g-1) | 0,13 b | 0,14 b | 0,15 ab | 0,17 a | 0,17 a | ns | 0,0095 | ns | |
| RRH (g g-1) | 0,32 b | 0,35 ab | 0,37 ab | 0,40 a | 0,40 a | ns | ns | ns | |
| RRPA (g g-1) | 0,15 b | 0,16 b | 0,17 b | 0,20 a | 0,20 a | ns | 0,0084 | ns | |
| IIA (índice de incremento de altura); ICA (índice de crecimiento absoluto); ICR (índice de crecimiento relativo); ICFA (índice de crecimiento foliar absoluto); ICFR (índice de crecimiento foliar relativo); TAN (tasa de asimilación neta); RAF (razón de área foliar); RMF (razón de masa foliar); AFE (área foliar específica); RMR (razón de masa radicular); RRH (relación raíces a hojas); RRPA (relación raíces a parte aérea). Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo. | |||||||||
3.4. Importar tabla Efecto de la concentración del H3O+ y Mg en la producción de biomasa en las diferentes partes de la planta
La mayor concentración de H3O+ no afectó el crecimiento de las raíces, cormo, pseudo tallo, láminas foliares y nervaduras de hojas (Tabla 4). Sin embargo, el incremento de la dosis de Mg afectó en forma lineal y negativa estos compartimentos de acumulación de biomasa, a excepción de las raíces de segundo orden (finas) que mostraron un efecto cuadrático positivo. El efecto negativo del aumento de la concentración de Mg sobre la producción de materia seca en las diferentes partes de la planta puede deberse a la menor absorción de agua por la planta (Figura 1), lo que redujo el área foliar (Tabla 2), reduciendo de esta forma la producción de materia seca.
3.5. Importar tabla Efecto de la concentración del H3O+ y Mg en la absorción de macronutrimentos
La concentración de H3O+ (T1 vs T2) no afectó significativamente la absorción de N. Por otro lado, la absorción de N se redujo significativamente con la dosis de 200 mg l-1 de Mg con respecto al resto de los tratamientos con Mg. Esto es consecuencia de la disminución significativa de la producción de biomasa con la misma dosis de Mg, conociendo que la absorción de nutrimentos está directamente relacionada con el peso de la planta.
El pH de solución nutritiva afectó la absorción de P. Se encontró que a pH 6 la absorción de P fue menor que a pH 4, probablemente por la preferencia de la planta por H2PO4-, especie que se hace más abundante a medida que se reduce el pH. La alta concentración de H3O+ a pH menor de 5 hace que el H2PO4- sea la especie dominante P (Fassbender & Bornemisza, 1987; Mengel & Kirkby, 2000; Sánchez, 2007). Solamente la dosis mayor Mg (200 mg l-1) afectó la absorción del P, debido a la significativa reducción en el peso de la materia seca. En las dosis intermedias de Mg, el conocido sinergismo entre el Mg-P (Gil, 1995; Lahav & Turner, 1992; Villalobos & Killorn, 2001) promovió la mejor absorción del P a pesar de la tendencia de menor producción materia seca conforme se incrementa el Mg en la solución (Tabla 5).
El comportamiento del K y Ca fue similar al del N, la concentración del H3O+ no afectó la absorción de K ó Ca. Sin embargo, al comparar la dosis mayor de Mg con la dosis menor se observó que el incremento de la concentración de Mg promovido por la mayor acumulación de biomasa con la dosis alta de Mg disminuyó la absorción de K hasta en 40% y las de Ca hasta 81%. La reducción en la absorción de K y Ca absorbidos al aumentar el Mg se debió, además de la reducción de la biomasa producida, posiblemente también al antagonismo en absorción entre cationes (K-Mg y Ca-Mg) (Grimme et al., 1974; Lacoeuilhe & Martin-Prevel, 1971; Lahav, 1974; Lahav & Turner, 1992; Marschner, 1995; Scharrer & Jung, 1955).
La magnitud de la reducción en la absorción de K por la planta (40%) en comparación con el Ca (81%) al aumentar el contenido de Mg en la solución nutritiva confirma la preferencia de la planta de banano por el K, esta situación, unida al hecho de que la absorción del Ca es únicamente pasiva por flujo de masas (Marschner, 1995; Mengel & Kirkby, 2000) y que la cantidad de H2O absorbida fue menor al incrementar el Mg, explicarían porque la absorción de Ca fue más afectada que la del K al incrementarse el Mg en la solución nutritiva.
La absorción de Mg tampoco fue afectada por la concentración del ión H3O+, confirmando que la disminución de la absorción de Mg no se debe a la mayor concentración H3O+ en la solución (Tabla 6) (Grimme, 1983). Este mismo autor señala que el Al+3 es el responsable de la reducción en la absorción del Mg cuando el pH del suelo es bajo. Por otro lado, como era de esperarse, el efecto de las dosis de Mg sobre la absorción de este nutrimento al incrementarse el contenido de Mg en la solución incrementa su absorción, pero a su vez se reprime la absorción de otros nutrimentos, en especial Ca y K, debido al antagonismo de estos cationes con el Mg.
| TRATAMIENTOS Probabilidad > F | |||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | Efecto toxicidad H3O+ | Mg efecto lineal | Mg efecto cuadrático | |
| Variables | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | T 2, 3, 4, 5 | T 2, 3, 4, 5 |
| r.s.o. | 5,7 a | 5,9 a | 6,2 a | 6,5 a | 4,2 b | ns | 0,0029 | 0,0122 | |
| r.p.o. | 12,9 a | 15,4 ab | 14,4 a | 15,0 a | 9,7 b | ns | 0,0095 | ns | |
| Cormo | 15,8 a | 16,5 a | 15,0 a | 12,3 a | 6,9 b | ns | < 0,0001 | ns | |
| ps. tallo | 34,2 a | 40,4 ab | 34,6 ab | 30,8 a | 19,8 c | ns | < 0,0001 | ns | |
| Ner. hojas inf. | 2,5 a | 2,6 a | 2,6 a | 2,1 ab | 1,4 d | ns | 0,0019 | ns | |
| Ner. hojas sup. | 11,8 a | 13,0 ab | 11,6 ab | 10,0 b | 7,2 c | ns | < 0,0001 | ns | |
| lámina hojas inf. | 10,6 a | 12,1 a | 11,7 a | 11,2 a | 6,8 b | ns | < 0,0001 | ns | |
| lámina hojas sup. | 48,1 a | 48,2 a | 44,2 a | 40,2 a | 27,9 b | ns | <0,0001 | ns | |
| Planta total | 141,7 a | 153,9 a | 140,3 a | 128,1 a | 83,9 b | ns | <0,0001 | ns | |
| r.s.o. (raíz de segundo orden); r.p.o. (raíz de primer orden), ps. (pseudo), nev. (nervadua), inf. (inferiores), sup.(superiores). Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo. | |||||||||
La concentración del H3O+ no afectó la asimilación del S por la planta, pero sí afectó la absorción de Fe que fue mayor a pH 4, debido a que la disponibilidad de Fe para las plantas aumenta a pH ácido (Marschner, 1995; Mengel & Kirkby, 2000). Al incrementarse el pH en una unidad, la actividad del Fe en solución disminuye 1.000 veces y a pH 7,4 se alcanza el mínimo de solubilidad del Fe (Lindsay & Schawab, 1982). La absorción de Cu, al igual que del Fe, aumentó a mayor concentración de H3O+, mientras que el pH no afectó la absorción de Zn. La absorción del Mn fue inversa a la de la absorción de Fe, posiblemente de bido al antagonismo existente entre ambos (Lindsay & Schawab, 1982; Lindsay, 1972; Marschner, 1995; Mengel & Kirkby, 2000). Se ha reportado que el nivel de Mg en el medio nutritivo influye en la absorción de Mn y que al incrementar el Mg es posible evitar la toxicidad del Mn (Maas et al., 1969). La absorción de B no se afectó con la concentración del H3O+ , pero la concentración de Mg sí la afectó, observándose un efecto cuadrático positivo, lo que sugiere un sinergismo entre B-Mg a pesar de la reducción en la acumulación de la materia seca cuando se incrementó el contenido de Mg en la solución (Tabla 6).
| TRATAMIENTOS Probabilidad > F | |||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Efecto concentración | Mg efecto lineal | Mg efecto cuadrático | |||||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | H3O+ | |||
| Nutrimento | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | T2, 3, 4, 5 | T2, 3, 4, 5 |
| N (g) | 5,97 ab | 6,46 a | 5,60 ab | 5,32 b | 3,70 c | ns | < 0,0001 | ns | |
| P (g) | 0,69 c | 0,84 ab | 0,80 abc | 0,88 a | 0,71 bc | 0,0496 | 0,0421 | ns | |
| K (g) | 11,70 a | 12,16 a | 10,42 ab | 9,67 b | 7,14 c | ns | < 0,0001 | ns | |
| Ca (g) | 1,45 a | 1,73 a | 1,29 b | 0,86 c | 0,33 d | ns | < 0,0001 | 0,0289 | |
| Mg (g) | 0,38 b | 0,42 b | 0,49 b | 0,64 a | 0,46 b | ns | ns | 0,0041 | |
| S (g) | 0,36 a | 0,41 a | 0,35 ab | 0,38 a | 0,25 b | ns | 0,0003 | ns | |
| Fe (mg) | 223 c | 465 b | 581 b | 780 a | 743 a | 0,0033 | < 0,0001 | 0.0011 | |
| Cu (mg) | 2,76 b | 3,98 a | 2,80 b | 2,23 bc | 1,68 c | 0,0103 | < 0,0001 | 0.002 | |
| Zn (mg) | 12,49 ab | 14,22 a | 9,46 bc | 7,11 c | 3,79 d | ns | < 0,0001 | 0,0080 | |
| Mn (mg) | 73 a | 42 b | 31 bc | 24 c | 11 d | < 0,0001 | < 0,0001 | 0,0008 | |
| B (mg) | 4 c | 6 bc | 7 ab | 9 a | 7 ab | ns | ns | 0,0150 | |
| Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo. | |||||||||
| TRATAMIENTOS Probabilidad > F | |||||||||
| 1 | 2 | 3 | 4 | 5 | |||||
| Efecto toxicidad H+ | Efecto Mg toxicidad H+ | ||||||||
| Mg, mg l-1 | 25 | 25 | 50 | 100 | 200 | ||||
| Variable | pH | 6 | 4 | 4 | 4 | 4 | T1-T2 | Lineal | Cuadrático |
| Mg en la biomasa (g) | |||||||||
| r.s.o. | 0,04 a | 0,03 a | 0,04 a | 0,04 a | 0,01 b | ns | 0,0023 | 0,0508 | |
| r.p.o. | 0,05 a | 0,04 ab | 0,04 a | 0,05 a | 0,03 b | ns | 0,0511 | 0,0363 | |
| Cormo | 0,04 b | 0,05 a | 0,05 ab | 0,07 a | 0,04 b | ns | ns | 0,0127 | |
| ps. tallo | O,06 b | 0,08 b | 0,10 ab | 0,14 a | 0,06 b | ns | ns | 0,0142 | |
| Ner. hojas inf. | 0,0024 b | 0,0025 b | 0,0037 ab | 0,0050 ab | 0,0054 a | ns | 0,0477 | ns | |
| Ner. hojas sup. | 0,01 c | 0,02 bc | 0,02 a | 0,02 ab | 0,02 ab | ns | ns | 0,0176 | |
| l. hojas inf. | 0,03 c | 0,04 bc | 0,06 b | 0,095 a | 0,095 a | ns | 0,0002 | 0,1900 | |
| l. hojas sup. | 0,15 b | 0,15 b | 0,17 ab | 0,22 a | 0,21 a | ns | 0,0374 | ns | |
| Planta total | 0,38 b | 0,42 b | 0,49 b | 0,64 a | 0,46 b | ns | ns | 0,0411 | |
| Valores con una misma letra en cada fila no difieren estadísticamente según prueba de diferencia mínima significativa al 5%; ns = no significativo. | |||||||||
4. Conclusiones
La concentración de H3O+ en la solución no afectó la absorción de agua ni el crecimiento de la planta de banano, lo que se reflejó en valores iguales en las variables de crecimiento vegetativo. El incremento de la concentración de Mg en la solución nutritiva afectó las variables de crecimiento, el efecto fue principalmente lineal y negativo. El número de hojas a cosecha y la biomasa de raíces de segundo orden fueron las únicas variables de las evaluadas en las cuales la dosis de Mg generó un efecto positivo de tipo cuadrático. El ritmo de emisión foliar no fue afectado por las concentraciones de H3O+ y Mg, mientras que el área foliar solo fue afectada en forma negativa por el incremento de la dosis de Mg. El incremento de la dosis de Mg produjo una disminución en la magnitud de las variables de crecimiento, debido al incremento de la conductividad eléctrica de la solución nutritiva, que ocasionó una menor absorción de agua por las plantas de los tratamientos con las dosis más altas de Mg. La absorción del N, K, Ca, Mg, S, Zn y B fue similar en las diferentes concentraciones de H3O+ evaluadas. El P, Fe y Cu fueron absorbidos en mayor cantidad por las plantas que crecieron en la solución con mayor concentración de H3O+ (pH 4), mientras que el Mn se absorbió en menor cantidad en esta misma concentración. Se considera que los efectos del incremento de la concentración del Mg en las variables de crecimiento y absorción de nutrimentos se debió a la asociación de diferentes factores que están interrelacionados, entre otros, menor consumo de agua, menor absorción de nutrimentos y menor área foliar que finalmente pro- movieron una menor producción de materia seca.
Referencias
Ayarza, M. A., & Salinas, J. G. (1982). Estudio comparativo de la tolerancia al aluminio en tres leguminosas forrajeras. Suelos Ecuatoriales, 12(1), 110-126.
Bache, B. W. (1985). Soil acidification and aluminium mobility. Soil use and management, 1(1), 10-13.
Baligar, V. C., Beaver, W. V., & Ahlrichs, J. L. (1988).Nature and distribution of acid soils in the world. Paper presented at the Workshop to development a strategy for collaborative research and dissemination of technology in sustainable crop production in acid savannas and other problem soils of the world, Indiana, USA.
Barber, S. A. (1995). Soil nutrient bioavailability: a mechanistic approach: John Wiley & Sons.
Bertsch, F. (1995). La fertilidad de los suelos y su manejo. San José, Costa Rica: ACCS.
Buol, S., Hole, F., & Mccraken, R. (1989). Soil genesis and classification (3rd ed.). Ames, USA: Iowa State University Press.
Carvajal, J., López, C., & Acevedo, A. (1963). Efecto del sustrato en el crecimiento y absorción del café. Biología Tropical, 11(2), 141-155.
Champion, J., Dugain, F., Maigmien, R., & Dommergues, Y. (1958). Les sols de bananeraies et leur amélioration en Guinée. Fruits, 13, 415-462.
De Oliveira, S., Coelho, E., & Borges, A. (2000). Irrigação e fertirrigação. In Z. J. Cordeiro (Ed.), Banana: produção, aspectos técnicos. Brasilia, Brasil: EMBRAPA Comunicação para Transferência de Tecnologia.
Delvaux, B. (1995). Soils. In S. Gowen (Ed.), Bananas and plantains (pp. 230-257). Londres, Inglaterra: Chapman & Hall.
Evers, F. (1963). Effect of ammonium and nitrate nitrogen on growth and mineral content of Picea and Populus. I. Growth at different acidity levels and Ca concentration in the nutrient medium. Z. f. Bot. Ges., 51, 61-79.
Fassbender, H., & Bornemisza, E. (1987). Química de suelos con énfasis en suelos de América Latina (2da ed.). San José, Costa Rica: IICA.
Flores, C. (1996). Pérdidas de cationes y aniones en los suelos bananeros de la zona atlántica de Costa Rica. Informe Anual 1995 (pp. 13-17). San José, Costa Rica: CORBANA, Dirección de Investigaciones y Servicios Agrícolas.
Foy, C. D. (1984). Physiological effects of hydrogen, aluminium and manganese toxicities in acid soils. In F. Adams (Ed.), Soil Acidity and Liming (2da ed., pp. 57-97). Madison, Wisconsin: ASA.
García, V., Díaz, A., Fernandez, C., & Robles, J. (1976). Factores que afectan la asimilación del potasio en los suelos de plátanos de Tenerife. Agrochimica, 12, 1-7.
Gil, F. (1995). Elementos de fisiología vegetal. Madrid, España: Mundi Prensa.
Godefroy, J., Lassoudiére, A., Lossois, P., & Pénel, J. (1978). Action du chaulage sur les carcterístiques physico-chimiques et la productivé d’un sol tour- beux en culture bananiére. Fruits, 33, 77-90.
Grimme, H. (1983). Aluminium induced magnesium deficiency in oats. Pflanzeneräha Bodenk Germany, 146, 666-676.
Grimme, H., von Braunschweig, L. C., & Nemeth, K. (1974). Potasium, calcium, and magnesium interactions as related to cation uptake and yield. Landw. Forcsch. Germany, 30(2), 93-110.
Klapp, E. (1951). Textbook of Husbandry and Crop Science (3rd ed.). Berlin, Germany: Parey-Verlag.
Lacoeuilhe, J., & Martin-Prevel, P. (1971). Culture sur milieu artificial. Carence en K, Ca, Mg, chez le bananier: analyse foliaire. Fruits, 26(243-253).
Lahav, E. (1974). The influence of potassium on the content of macro-elements in the banana sucker. Agrochimica, 18, 194-204.
Lahav, E., & Turner, D. (1992). Fertilización del banano para rendimientos altos (2da ed.). Berna, Suiza: International Potash Institute.
Lindsay, W., & Schawab, A. (1982). The chemistry of iron in soils and its availability to plants. Journal Plant Nutrition, 5, 821-840.
Lindsay, W. L. (1972). Inorganic phase equilibria of micronutrients in soils. In J. Morvedt (Ed.), Micronutrient in agriculture (2nd ed., pp. 41-75). Madison, USA: Soil Sci. Soc. America.
Lopez, A., & Solís, P. (1992). Contenidos e interacciones de los nutrimentos en tres zonas bananeras de Costa Rica. CORBANA, 15(36), 25-32.
Lorenz, O., & Maynard, D. (1988). Knotts handbook for vegetable growers (3rd ed.). New York, USA: Wiley.
Maas, E., Moore, D., & Mason, B. (1969). Influence of calcium and magnesium on manganese absorption. Plant physiology, 44, 796-800.
Marschner, H. (1995). Mineral nutrition of higher plants (2nd ed.). Londres, England: Academic Press.
Martin-prevel, P. (1980). La nutrition minerale du bananier dans le monde. Fruits, 35, 583-593.
Matsumoto, H. (2002). Plant root under aluminium stress: toxicity and tolerance. In Y. Waisel, A. Eshel, & U. Kafkafi (Eds.), Plant Roots (3rt ed., pp. 821-838). New York, USA: Hidden Half.
Mengel, K., & Kirkby, E. (2000). Principios de nutrición vegetal (4ta ed.). Berna, Suiza: International Potash Institute.
Miyasaka, S. C., Hue, N. V., & Dunn, M. A. (2007). Aluminium. In A. V. Baker & D. J. Pilbeam (Eds.), Handbook on plant nutrition (pp. 439- 498). Florida, USA: CRC Press.
Molina, E. (1998). Encalado para la corrección de la acidez del suelo. San José, Costa Rica: ACCS.
Robinson, J. C. (1996). Bananas and plantains. Oxon, Inglaterra: W.K.Kellogg.
Rorison, I. (1980). The effects of the soil acidity on nutrient availability and plant response. In T. Hutchinson & M. Havas (Eds.), Effects of acid precipitation on terrestrial ecosytems (pp. 283- 304). New York, USA: Plenum Press.
Rufyikiri, G., Nootens, D., Dufey, E., & Delvaux, B. (2000). Effect of aluminium on bananas (Musa ssp,) cultivated in acid solutions, Part I, Plant growth and chemical composition. Fruits, 55(6), 367-379.
Rufyikiri, G., Nootens, D., Dufey, E., & Delvaux, B. (2001). Effect of aluminium on bananas (Musa ssp,) cultivated in acid solutions, Part II, Water and Nutrient uptake. Fruits, 56(6), 5-16.
Sanchez, C. A. (2007). Phosphorus. In A. V. Baker & D. J. Pilbeam (Eds.), Handbook on plant nutrition (pp. 51-90). Boca Raton, USA: CRC Press.
Scharrer, K., & Jung, J. (1955). The influence of nutrition on the cation / anion ratio in plants. Pflanzenernähr. Düng. Bodenk, 7, 76-94.
Schimansky, C. (1973). Investigations into the translocation of magnesium (Mg 28) in sumflowers. Pflanzenernähr. Düng. Bodenk, 136, 68-81.
Serrano, E. (2003). Acidificación de los suelos bananeros de Costa Rica y su relación con la toxicidad de aluminio en las raíces del cultivo de banano. Paper presented at the Simposio Internacional del Sistema Radical del Banano: hacia un mejor conocimiento para su manejo productivo, San José, Costa Rica.
Steucek, C., & Koontz, H. (1970). Phloem mobility of magnesium. Plant physiology, 46, 50-52.
Stover, R. H., & Simmonds, N. W. (1987). Bananas (3rd ed.). New York, USA: Wiley.
Turner, D. (1972). Banana plant growth. 1. Gross morphology. 2. Dry matter production leaf area and growth analysis. Australian Journal Experimental Agric Anim. Husb., 12(209-224).
Turner, D., & Lahav, E. (1983). The growth of banana plants in relation to temperature. Australian Journal Plant Physiology, 10(1), 43-53.
Villalobos, E., & Killorn, R. (2001). Nutrición mineral. In E. Villalobos (Ed.), Fisiología de la producción de los cultivos tropicales (pp. 161- 196.). San José, Costa Rica: Editorial Universidad de Costa Rica.
Westerman, R. L. (1990). Soil Testingand Plant Analysis (3rd ed.). Madison, Wisconsin, USA: Soil Science Society of America.
Zapata, R. (2004). Química de la acidez del suelo. Medellín, Colombia: Universidad Nacional de Colombia.

