



Evaluación de deficiencias nutricionales en el cultivo de quinua (Chenopodium quinoa Willd.) bajo
Evaluation of nutritional deficiencies for a greenhouse quinua (Chenopodium quinoa Willd.) crop
Siembra
Universidad Central del Ecuador, Ecuador
ISSN: 1390-8928
ISSN-e: 2477-8850
Periodicidad: Semestral
vol. 4, núm. 1, 2017
Recepción: 30 Junio 2017
Aprobación: 11 Agosto 2017
Autor de correspondencia: spalvarado@uce.edu.ec
Resumen: La presente investigación evaluó las deficiencias nutricionales del cultivo quinua (Chenopodium quinoa Willd.); para el efecto se implementaron dos experimentos en invernadero, donde se trasplantaron plántulas en pomina y se mantuvieron durante 60 días. Las deficiencias nutricionales se indujeron mediante el uso de la técnica del elemento faltante con soluciones nutritivas bajo un diseño completamente al azar con catorce tratamientos y tres repeticiones para el primer experimento; y cuatro repeticiones para el segundo experimento. Las variables evaluadas en el primer experimento fueron altura de planta, diámetro del tallo, color y clorofila. En tanto que la producción de biomasa del cultivo fue evaluada en el segundo experimento. Los resultados indicaron que los tratamientos con omisión de nitrógeno (N), boro (B), y potasio (K) afectaron significativamente a todas las variables evaluadas y mostraron síntomas visuales de deficiencia en el cultivo de quinua. Sin embargo, las deficiencias de azufre (S) y fósforo (P) también fueron evidentes en las etapas de crecimiento más avanzadas.
Palabras clave: grano andino, INIAP-TUNKAHUAN, nutrientes esenciales, nutrición mineral, solución nutritiva.
Abstract: This research evaluated the nutritional deficiencies of the quinoa crop (Chenopodium quinoa Willd.). Two greenhouse experiments were implemented. Seedlings were transplanted in pomina and maintained for 60 days. The nutritional deficiencies were induced by using the missing element technique with nutrient solutions under a completely randomized design with fourteen treatments and three replicates for the first experiment and four replicates for the second experiment. The evaluated variables in the first experiment included plant height, stem diameter, color, and chlorophyll. The crop biomass production was evaluated in the second experiment. The results indicated that omission treatments for nitrogen (N), boron (B), and potassium (K) significantly affected all of the evaluated variables and presented visual symptoms of deficiency in the quinoa crop. Nevertheless, suphur (S) and phosphorus (P) deficiencies were also observed at the latest plant growth stages.
Keywords: Andean grain, INIAP-TUNKAHUAN, essential nutrients, mineral nutrition, nutritive solution.
1. Introducción
La quinua (Chenopodium quinoa Willd.) es un grano considerado estratégico para la soberanía alimentaria e históricamente es uno de los principales alimentos del hombre andino. Por alrededor de 7000 años ha sido cultivado en la región andina donde es apreciado por su adaptabilidad a condiciones ambientales difíciles y por su valor nutritivo; pues contiene proteína, carbohidratos, minerales (hierro, fósforo y zinc), fibra, isoflavonas y antioxidantes (Jacobsen & Sherwood, 2002; Peralta, Mazón, Murillo, Rivera, & Monar, 2012).
La quinua en el Ecuador se produce tradicionalmente en la región Sierra, tanto por las condiciones agroecológicas, como por la importancia de este grano en los sistemas de producción andina. En su mayoría, la quinua que se produce pertenece a la variedad INIAP Tunkahuan apetecida por su bajo contenido de saponina y uniformidad de grano (Proecuador, 2015).
Mayoritariamente, la quinua es sembrada por el agricultor pequeño (< 1 ha) y mediano (1 a 5 ha) en suelos con bajos contenidos de nutrientes, y comúnmente sin recibir fertilización. Esta falta de manejo adecuado de la fertilidad de los suelos y la nutrición del cultivo se constituye en uno de los factores críticos para los bajos rendimientos observados, considerando que se reporta respuestas significativas en el rendimiento del cultivo frente a la fertilización nitrogenada, fosforada y potásica en suelos con deficiencias de estos nutrientes (Fries & Tapia, 2007).
Sin embargo, para alcanzar planes de manejo nutricional que respondan a las necesidades del cultivo, evitando aplicaciones innecesarias de fertilizantes, cuyos excesos generalmente se traducen en pérdidas económicas, además de convertirse en contaminantes del suelo, de las fuentes de agua y del aire; se requiere un conocimiento profundo de las necesidades nutricionales de cada especie, el mecanismo de absorción y transporte de los diferentes nutrientes, y el efecto de las limitaciones nutricionales de cada elemento en el crecimiento y desarrollo de las plantas (Reuler & Prins, 1993).
En este contexto, el reconocimiento visual de los síntomas producidos por deficiencias nutricionales requiere experticia y puede convertirse en una herramienta poderosa de diagnóstico, capaz de detectar a los nutrientes que en un momento determinado están limitando el crecimiento y la producción de los cultivos (Consuegra, Maya, de Cantillo, & Marín, 1995).
La técnica del elemento faltante ha sido utilizada para caracterizar deficiencias nutricionales bajo condiciones de campo e invernadero; para lo cual las plantas reciben una fertilización completa con dosis adecuadas de macro y micro nutrientes; y además, una serie de tratamientos de fertilización en cada uno de los cuales se omite uno de los nutrientes, pudiendo observar las deficiencias nutricionales en ausencia de un determinado nutriente (Sánchez & Camacho, 1981). Investigaciones exitosas han sido reportadas con esta técnica en cultivos como el chocho (Rivadeneira Ruales, 1999), babaco (León, Viteri, & Mejía, 2004) y mora (Castaño, Morales, & Obando, 2008).
Con estos antecedentes, la presente investigación evaluó las deficiencias nutricionales y la curva de producción de biomasa del cultivo de quinua desde el trasplante hasta el inicio del panojamiento; utilizando la técnica del elemento faltante bajo condiciones hidropónicas en invernadero.
2. Materiales y métodos
La fase experimental se realizó en el invernadero de la Estación Experimental Santa Catalina (EESC) del Instituto Nacional de Investigaciones Agropecuarias (INIAP), ubicada en la provincia de Pichincha, cantón Mejía, parroquia Cutuglagua, a 3058 m.s.n.m, con una temperatura promedio de 20°C y una humedad relativa de 71%.
El material biológico empleado fue semilla de quinua, variedad INIAP-Tunkahuan. Se utilizó pomina tamizada a 0.5 mm, lavada, y autoclavada como sustrato. Se realizó un almácigo y al momento de la siembra se compactó suavemente y se regó con agua destilada dos veces al día. A partir de la emergencia de la plántula se regó diariamente, utilizando la solución nutritiva completa garantizando que la planta inicie con su crecimiento y desarrollo sin ningún tipo de déficit nutricional. Cuando la plántula tuvo 6 hojas verdaderas se realizó el trasplante a las macetas de tres litros de capacidad, las cuales tenían el mismo sustrato y se regaron con la solución nutritiva correspondiente a cada tratamiento evaluado. La pomina se mantuvo a capacidad de campo durante todo el tiempo de evaluación de los experimentos, para lo cual el riego se realizó diariamente.
Catorce tratamientos; omisión de N, omisión de fósforo (P), omisión de K, omisión de calcio (Ca), omisión de magnesio (Mg), omisión de azufre (S), omisión de zinc (Zn), omisión de cobre (Cu), omisión de hierro (Fe), omisión de manganeso (Mn), omisión de B, omisión de molibdeno (Mo), omisión de cobalto (Co) y fertilización completa, fueron evaluados en dos experimentos, de acuerdo con el detalle de la Tabla 1. Las soluciones nutritivas madres fueron preparadas por nutriente y sus respectivas diluciones se efectuaron cada 8 días para alcanzar cada una de las concentraciones indicadas en el Tabla 2 según los tratamientos evaluados. El pH de las soluciones finales para cada tratamiento fue ajustado en el rango de 6.3 a 7.0, y la conductividad eléctrica fue determinado; registrando valores en un rango de 2.0 a 4.0 dS m-1. Las fuentes utilizadas para la preparación de las soluciones nutritivas fueron nitrato de amonio (NH4NO3), ácido fosfórico (H3PO4), hidróxido de potasio (KOH), cloruro de calcio dihidratado (CaCl2.2H2O), cloruro de magnesio hexahidratado (MgCl2.6H2O), ácido sulfúrico (H2SO4), cloruro de zinc (ZnCl2), cloruro de cobre (CuCl2), hierro quelatado (Fe-EDTA), cloruro de manganeso (MnCl2), ácido bórico (H3BO3), molibdato de amonio tetra hidratado ((NH4)6Mo7O24.4H2O) y cloruro de cobalto hexahidratado (Cl2Co.6H2O).
En el primer experimento se evaluó el efecto del elemento faltante sobre las características agronómicas del cultivo, y estuvo bajo un diseño completamente al azar con tres repeticiones. La unidad experimental estuvo conformada por 3 plantas por maceta. Las variables evaluadas al trasplante y cada siete días durante ocho semanas consecutivas incluyeron: 1) altura de planta, medida desde la base del tallo hasta la hoja más alta con el uso de una regla y expresada en centímetros; 2) diámetro de tallo, medido a dos centímetros de altura desde el sustrato, utilizando un calibrador Vernier y expresado en milímetros; 3) clorofila determinada en la hoja del tercio medio con el uso de medidor SPAD CMM-200 y expresada en unidades SPAD (diferencia de densidad óptica en dos longitudes de onda); y 4) color determinado en la hoja del tercio medio con el uso de la tabla de comparación de colores (TCC) desarrollada por el IRRI (Witt, Pasuquín, Mutters, & Buresh, 2005). Los registros fotográficos se tomaron una vez por semana para documentar el crecimiento y presencia de deficiencias de los nutrientes evaluados
En el segundo experimento se evalúo la curva de producción de biomasa y estuvo bajo un diseño completamente al azar con cuatro repeticiones. La unidad experimental fue conformada por 5 plantas por maceta. La variable biomasa fue evaluada cada 15 días después del trasplante (ddt) hasta los 60 ddt; tomando una planta completa de cada tratamiento y de cada una de las repeticiones. El peso fresco fue registrado, luego se secó a 65 °C en una estufa hasta obtener un peso constante. Los resultados se expresaron en gramos por planta.
| Tratamiento | Código | Descripción |
| FC | T1 | Solución completa (N, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -N | T2 | Solución sin nitrógeno (_, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -P | T3 | Solución sin fósforo (N, , K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -K | T4 | Solución sin potasio (N, P, , Ca, Mg, S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -Ca | T5 | Solución sin calcio (N, P, K, , Mg, S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -Mg | T6 | Solución sin magnesio (N, P, K, Ca, , S, Zn, Cu, Fe, Mn, B, Mo, Co). |
| -S | T7 | Solución sin azufre (N, P, K, Ca, Mg, , Zn, Cu, Fe, Mn, B, Mo, Co). |
| -Zn | T8 | Solución sin zinc (N, P, K, Ca, Mg, S, , Cu, Fe, Mn, B, Mo, Co). |
| -Cu | T9 | Solución sin cobre (N, P, K, Ca, Mg, S, Zn, , Fe, Mn, B, Mo, Co). |
| -Fe | T10 | Solución sin hierro (N, P, K, Ca, Mg, S, Zn, Cu, , Mn, B, Mo, Co). |
| -Mn | T11 | Solución sin manganeso (N, P, K, Ca, Mg, S, Zn, Cu, Fe, _, B, Mo, Co). |
| -B | T12 | Solución sin boro (N, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, , Mo, Co). |
| -Mo | T13 | Solución sin molibdeno (N, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, , Co). |
| -Co | T14 | Solución sin cobalto (N, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, Mo, ). |
| Elemento | meq l-1 | mg l-1 |
| N | 12 | 168 |
| PO4 | 1 | 31.6 |
| K | 7 | 273.7 |
| Ca | 9 | 180.4 |
| Mg | 4 | 48.6 |
| SO4 | 2.3 | 112 |
| Zn | 0.0086 | 0.28 |
| Cu | 0.0035 | 0.11 |
| Fe | 0.1 | 3.0 |
| Mn | 0.05 | 1.40 |
| B | 0.07 | 0.26 |
| Mo | 0.0063 | 0.10 |
| Co | 0.0068 | 0.02 |
El análisis estadístico se realizó utilizando el paquete estadístico InfoStat (2016). Se realizó la prueba de normalidad de Shapiro Wilks para las variables altura de planta, diámetro del tallo, clorofila y biomasa. Se aplicó la prueba de Kruskal-Wallis (KW) para la variable color; y el análisis de varianza (ADEVA) y la separación de medias con la prueba de Bonferroni al 5% para las variables altura de planta, diámetro de tallo, clorofila, y biomasa. Se cuantificó la tasa de crecimiento para las variables altura de planta, diámetro del tallo y biomasa, éstas se calcularon a partir de la semana que presentaron diferencias significativas. Adicionalmente, se realizó una correlación múltiple de Pearson con todas las variables estudiadas.
El modelo de regresión logístico normal para la producción de biomasa fue generado a través de la fórmula detallada a continuación con el uso del programa estadístico Statistical Analysis System, 9.0 (SAS Institute, 1999).
Dónde:
Y=α/(1+ β x e^((-γ x t )) )
Y = Producción de biomasa en el tiempo (g). α = Valor límite de producción de biomasa (g).
β = No tiene significado biológico y solo toma lugar en el tiempo inicial cuando t = 0 (g).
γ = Tasa de la constante que determina la amplitud de la curva (g).
t = Tiempo (días).
3. Resultados y discusión
3.1 Primer Experimento
3.1.1 Altura de planta
La altura de planta mostró que a partir de los 28 ddt la diferencia entre los tratamientos evaluados fue altamente significativa (p-valor <0.0001) como se observa en el Tabla 3. El promedio de esta variable fue incrementando paulatinamente de 41.89 cm a 105.27 cm, desde los 28 hasta los 56 ddt; respectivamente.
| Cuadrado medio | ||||||
| F. V. | G.L. | |||||
| 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | ||
| Total | 41 | |||||
| Tratamientos | 13 | 131.18** | 375.79** | 896.21** | 1922.79** | 3233.65** |
| Error | 28 | 10.06 | 17.76 | 32.97 | 43.59 | 50.25 |
| C.V. (%) | 7.57 | 7.71 | 8.18 | 7.52 | 6.73 | |
| (cm) | 41.89 | 54.64 | 70.16 | 87.84 | 105.27 | |
| **= Diferencias estadísticas altamente significativas. ddt = Días después del trasplante. | ||||||
Los tratamientos carentes de N y B presentaron los menores valores de altura: 38.08 cm y 33.10 cm; respectivamente (Tabla 4); concordando con Latorre (2011), quien afirma que el N es el elemento más importante en el crecimiento y desarrollo de las plantas y una baja en el suministro de este nutriente disminuye la formación de protoplastos que son indispensables para el crecimiento vegetativo; además (Salisbury & Ross, 2000), mencionan que una baja cantidad de N, provoca una disminución consecuente en la síntesis de proteínas, lo que ocasiona a su vez una disminución del tamaño de las células y especialmente el ritmo de su división. De otra parte, (Wild & Jones, 1992) sostienen que la baja concentración de B en la planta genera una rápida disminución en el nivel de ARN y en consecuencia, cesa la división celular en los meristemos apicales por lo cual el crecimiento de la planta se ve afectado.
El bajo crecimiento de las plantas carentes de K especialmente observado a los 49 ddt, probablemente se debió a que este nutriente es un coactivador para más de 60 enzimas en el tejido meristemático (Samra & Arora, 1997). Para el caso del tratamiento de omisión P con valores bajos de altura de planta observados a partir de los 42 ddt se explicaría considerando que los fosfatos son esenciales para la división celular y para el desarrollo de los tejidos meristemáticos (Wild & Jones, 1992).
| Tratamiento | Altura de planta (cm) | ||||||||||
| 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | |||||||
| 1 | FC | 40.37 | ab | 54.43 | ab | 73.67 | abc | 95.38 | ab | 122.74 | a |
| 2 | -N | 23.96 | c | 27.34 | c | 31.58 | d | 35.07 | d | 38.08 | c |
| 3 | -P | 41.36 | ab | 53.77 | ab | 64.38 | c | 76.88 | bc | 91.83 | b |
| 4 | -K | 40.53 | ab | 51.13 | b | 66.36 | bc | 73.07 | c | 81.82 | b |
| 5 | -Ca | 45.43 | a | 59.91 | ab | 78.30 | abc | 102.99 | a | 125.41 | a |
| 6 | -Mg | 40.40 | ab | 53.96 | ab | 72.21 | abc | 92.52 | abc | 114.74 | a |
| 7 | -S | 47.61 | a | 63.52 | ab | 82.40 | abc | 100.48 | a | 115.22 | a |
| 8 | -Zn | 48.86 | a | 65.27 | a | 82.79 | ab | 110.69 | a | 132.93 | a |
| 9 | -Cu | 43.01 | ab | 57.18 | ab | 73.47 | abc | 93.70 | abc | 117.31 | a |
| 10 | -Fe | 48.48 | a | 64.60 | ab | 85.0 | a | 109.74 | a | 133.30 | a |
| 11 | -Mn | 45.09 | a | 61.46 | ab | 83.50 | ab | 106.78 | a | 128.48 | a |
| 12 | -B | 33.05 | bc | 33.59 | c | 32.59 | d | 32.88 | d | 33.10 | c |
| 13 | -Mo | 45.35 | a | 61.74 | ab | 80.38 | abc | 104.23 | a | 122.79 | a |
| 14 | -Co | 43.02 | ab | 57.17 | ab | 75.63 | abc | 95.31 | ab | 116.11 | a |
| Promedios con una letra común no son significativamente diferentes (p-valor > 0.05). ddt= Días después del trasplante. FC= Fertilización completa. | |||||||||||
3.1.2. Diámetro del tallo
El diámetro del tallo mostró diferencias altamente significativas desde los 14 ddt (p-valor <0.0001) entre los tratamientos evaluados (Tabla 5). El promedio aumentó de un valor de 3.89 mm hasta 8.09 mm, desde los 14 hasta los 56 ddt; respectivamente.
La prueba de Bonferroni al 5 % (Tabla 6) indicó que el tratamiento con la fertilización completa estuvo en franco contraste con los todos los tratamientos de omisión mostrando el diámetro más grande. Resultado que concuerda con lo esperado; considerando que las plantas al tener una adecuada nutrición presentan un óptimo crecimiento y desarrollo (Kováčik & Bačkor, 2007). De otra parte, los valores más bajos para el diámetro de tallo estuvieron asociados con los tratamientos de omisión de N, K, y B especialmente a partir de los 35 ddt. Estos resultados corroboran con lo observado para la variable altura de planta en cuanto a la omisión de N y B; pero no es el caso para la omisión de K. El diámetro del tallo reducido en ausencia de K, que alcanzó 6.24 mm a los 56 ddt se explicaría por lo esencialidad de este elemento para diversos procesos catalíticos de la planta; y corroboraría con lo reportado por (Azcón-Bieto & Talón, 2008), quienes indican que la deficiencia de este elemento provoca una debilidad de los tallos ocasionando que las plantas sean más sensibles a los factores climáticos. Con respecto a la omisión de P, se observó que a partir de los 35 ddt comenzó a detenerse el aumento del diámetro del tallo; resultados concordantes con las funciones reportadas para este nutriente con respecto a la división celular y síntesis de ATP (Alcántar González & Trejo-Téllez, 2007).
El análisis de correlación de Pearson para altura de planta y diámetro de tallo indicó que el coeficiente fue incrementándose desde 0.59 hasta 0.84 a los 14 hasta los 56 ddt; respectivamente, aunque sólo fue significativo a los 56 ddt. Estos resultados eran de esperarse, puesto que el crecimiento en altura de las plantas está respaldado por un aumento proporcional del diámetro del tallo (Martínez Teruel, Medina Blanco, & Gómez-Castro, 1985).
| F. V. | G.L. | Cuadrado medio | ||||||||||||
| 14 ddt | 21 ddt | 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | ||||||||
| Total | 41 | |||||||||||||
| Tratamiento | 13 | 0.45** | 1.18** | 2.41** | 3.47** | 5.09** | 7.29** | 8.42** | ||||||
| Error | 28 | 0.03 | 0.04 | 0.08 | 0.04 | 0.06 | 0.06 | 0.09 | ||||||
| C.V. (%) | 4.76 | 4.27 | 4.70 | 3.21 | 3.49 | 3.31 | 3.75 | |||||||
| (mm) | 3.89 | 4.84 | 5.91 | 6.48 | 7.11 | 7.69 | 8.02 | |||||||
| **= Diferencias estadísticas altamente significativas. ddt= Días después del trasplante. | ||||||||||||||
| Tratamiento | Diámetro del tallo (mm) | ||||||||||||||
| 14 ddt | 21 ddt | 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | |||||||||
| 1 | FC | 4.18 | a | 5.29 | a | 6.36 | a | 7.31 | a | 8.26 | a | 9.12 | a | 9.67 | a |
| 2 | -N | 2.75 | c | 2.82 | c | 3.00 | c | 3.07 | e | 3.21 | f | 3.22 | e | 3.23 | g |
| 3 | -P | 4.19 | a | 4.97 | a | 5.80 | ab | 6.13 | cd | 6.92 | cd | 7.00 | c | 7.26 | de |
| 4 | -K | 3.55 | b | 4.31 | b | 5.30 | b | 5.68 | d | 5.85 | e | 5.94 | d | 6.24 | f |
| 5 | -Ca | 3.96 | ab | 4.90 | ab | 6.01 | ab | 6.84 | ab | 7.45 | bc | 8.11 | b | 8.71 | bc |
| 6 | -Mg | 3.81 | ab | 4.98 | a | 6.36 | a | 6.91 | ab | 7.60 | abc | 8.36 | ab | 8.71 | bc |
| 7 | -S | 4.15 | a | 5.06 | a | 6.52 | a | 7.08 | a | 7.55 | abc | 8.02 | b | 8.21 | cd |
| 8 | -Zn | 4.17 | a | 5.18 | a | 6.41 | a | 7.08 | a | 7.80 | ab | 8.63 | ab | 8.86 | abc |
| 9 | -Cu | 4.08 | ab | 5.12 | a | 6.16 | ab | 6.80 | ab | 7.58 | abc | 8.42 | ab | 8.96 | abc |
| 10 | -Fe | 4.14 | ab | 5.09 | a | 6.15 | ab | 6.81 | ab | 7.67 | abc | 8.41 | ab | 8.72 | abc |
| 11 | -Mn | 4.04 | ab | 5.14 | a | 6.30 | a | 7.12 | a | 7.98 | ab | 8.81 | ab | 9.24 | ab |
| 12 | -B | 3.64 | ab | 4.80 | ab | 5.84 | ab | 6.27 | bcd | 6.28 | de | 6.73 | cd | 6.91 | ef |
| 13 | -Mo | 4.02 | ab | 5.13 | a | 6.32 | a | 6.95 | ab | 7.77 | ab | 8.46 | ab | 8.92 | abc |
| 14 | -Co | 3.86 | ab | 5.01 | a | 6.31 | a | 6.77 | abc | 7.77 | ab | 8.46 | ab | 8.67 | bc |
| Promedios con una letra común no son significativamente diferentes (p-valor > 0.05). ddt= Días después del trasplante. FC= Fertilización completa. | |||||||||||||||
3.1.3 Clorofila
Los valores de clorofila mostraron diferencias altamente significativas desde los 14 ddt (p-valor <0.0001) entre los tratamientos evaluados (Tabla 7). El promedio incrementó de 15.06 a
65.09 unidades SPAD, desde los 14 hasta los 56 ddt; respectivamente.
La prueba de Bonferroni al 5 % (Tabla 8), ubicó en el primer rango de significancia hasta los 35 ddt al tratamiento con omisión de K. Este resultado es contrario a lo esperado y mencionado por algunos investigadores como (Samra & Arora, 1997) y (Pier & Berkowitz, 1987), quienes afirman que el K se acumula en la superficie de los cloroplastos y durante el proceso de la fotosíntesis penetra en ellos, por lo cual una deficiencia de este elemento reduce la cantidad de clorofila que contiene las plantas. Sin embargo, (Dobermann & Fairhurst, 2000), señalan que un síntoma típico de deficiencia de K en las plantas de arroz es una coloración verde oscura con los márgenes de las hojas de color café amarillento o manchas necróticas, y a medida que avanza la deficiencia la necrosis cubre toda la hoja; síntomas que fueron similares a los presentados por las plantas de quinua en este estudio, donde la intensidad del color verde evidentemente aumentó desde los 28 hasta los 56 ddt determinados con la variable clorofila e incluso con la tabla de color.
De otra parte, los valores más bajos de clorofila desde los 14 a los 56 ddt siempre estuvieron asociados con el tratamiento de omisión de N. Sin embargo, a partir de los a los 35 ddt los tratamientos de omisión S y B también presentaron los valores más bajos para esta variable. Los bajos contenidos de clorofila en ausencia de N y S eran esperados; considerando que estos nutrientes son constituyentes esenciales de la molécula de clorofila y con su deficiencia la producción de clorofila se reduce (Dobermann & Fairhurst, 2000). De igual manera, el bajo contenido de clorofila en el tratamiento de omisión de B es explicado porque al haber deficiencia de B se ha reportado aumento en la acumulación de almidón en los cloroplastos, afectando negativamente la estructura y función de los mismos (Han et al., 2009) (Wimmer & Eichert, 2013).
| Cuadrado medio | ||||||||
| F. V. | G.L | |||||||
| 14 ddt | 21 ddt | 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | ||
| Total | 41 | |||||||
| Tratam | 13 | 29.8** | 72.1** | 274.57** | 434.8** | 994** | 1855.8** | 2576.8** |
| Error | 28 | 2.1 | 3.36 | 10.39 | 26.1 | 39.1 | 43.56 | 38.40 |
| C.V. (%) | 9.73 | 9.30 | 10.04 | 13.03 | 12.80 | 11.57 | 9.39 | |
| (SPAD) | 15.06 | 19.70 | 32.11 | 39.22 | 49.12 | 57.04 | 65.09 | |
| **= diferencias estadísticas altamente significativas. ddt= días después del trasplante. | ||||||||
| Tratamiento | Clorofila (unidades SPAD) | ||||||||||||||
| 14 ddt | 21 ddt | 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | |||||||||
| 1 | FC | 15.00 | b | 21.47 | b | 28.60 | c | 41.03 | bc | 56.00 | a | 68.41 | ab | 79.83 | ab |
| 2 | -N | 8.29 | c | 5.71 | c | 5.29 | d | 5.56 | d | 6.88 | b | 8.38 | c | 7.69 | d |
| 3 | -P | 16.07 | b | 22.39 | b | 38.96 | b | 49.43 | ab | 50.89 | a | 51.94 | b | 59.65 | c |
| 4 | -K | 23.58 | a | 28.69 | a | 50.70 | a | 59.41 | a | 63.91 | a | 68.30 | ab | 87.29 | ab |
| 5 | -Ca | 13.72 | b | 21.49 | b | 33.22 | bc | 40.39 | bc | 54.85 | a | 68.85 | ab | 81.06 | ab |
| 6 | -Mg | 14.72 | b | 16.67 | b | 35.10 | bc | 49.58 | ab | 64.92 | a | 77.96 | a | 81.35 | ab |
| 7 | -S | 13.98 | b | 22.33 | b | 31.84 | bc | 33.05 | c | 25.93 | b | 18.88 | c | 21.01 | d |
| 8 | -Zn | 15.18 | b | 20.32 | b | 28.00 | c | 40.64 | bc | 53.57 | a | 65.77 | ab | 85.31 | ab |
| 9 | -Cu | 13.03 | b | 18.19 | b | 29.96 | bc | 40.90 | bc | 61.44 | a | 77.53 | a | 84.36 | ab |
| 10 | -Fe | 15.44 | b | 20.32 | b | 33.74 | bc | 42.20 | bc | 58.52 | a | 71.92 | ab | 78.23 | abc |
| 11 | -Mn | 16.11 | b | 20.16 | b | 32.05 | bc | 34.90 | bc | 46.08 | a | 65.97 | ab | 83.20 | ab |
| 12 | -B | 16.19 | b | 19.62 | b | 37.65 | bc | 31.80 | c | 20.41 | b | 11.78 | c | 13.26 | d |
| 13 | -Mo | 14.55 | b | 20.48 | b | 32.67 | bc | 40.57 | bc | 62.17 | a | 64.55 | ab | 70.49 | bc |
| 14 | -Co | 15.10 | b | 18.05 | b | 31.77 | bc | 39.71 | bc | 62.21 | a | 78.39 | a | 91.26 | a |
| Promedios con una letra común no son significativamente diferentes (p-valor > 0.05). ddt= Días después del trasplante. FC= Fertilización completa. | |||||||||||||||
3.1.4 Color
La prueba no paramétrica de Kruskal Wallis para la variable color (Tabla 9) mostró diferencia significativa entre los tratamientos evaluados. En concordancia con lo observado para la variable clorofila, el rango más bajo para el color estuvo asociado con el tratamiento de omisión de N desde los 28 hasta los 56 ddt. Adicionalmente, los tratamientos de omisión de S y B también se ubicaron entre los valores más bajos de color a partir de los 35 ddt. Sin embargo, la variable color no pudo detectar diferencias significativas entre los tratamientos evaluados antes de los 28 ddt. Estos resultados ratifican que las limitaciones nutricionales en la planta afectan el contenido de clorofila y consecuentemente existe una disminución en la intensidad del color verde (Giri, Shrivastava, Deshmukh, & Dubey, 2013). Adicionalmente, estos resultados indican la ventaja del uso de la medición de clorofila como una mejor herramienta de diagnóstico especialmente en estados fenológicos iniciales del cultivo frente a la tabla de color. Aunque se debe destacar la correlación altamente significativa observada entre las variables clorofila y color desde los 28 ddt, con coeficientes de correlación en un rango entre 0.80 y 0.98 a 28 y 56 ddt; respectivamente. Estos resultados concuerdan con (Manrique Reol, 2003), quien menciona que una mayor intensidad del color verde en plantas más maduras es coherente con mayor presencia de la molécula de clorofila.
| Tratamiento | Color | ||||||||||
| 28 ddt | 35 ddt | 42 ddt | 49 ddt | 56 ddt | |||||||
| 1 | FC | 3.67 | ab | 4.0 | abc | 4.0 | abcd | 4.83 | ab | 5.0 | a |
| 2 | -N | 2.0 | b | 2.0 | d | 2.0 | d | 2.0 | c | 2.0 | c |
| 3 | -P | 4.0 | a | 4.17 | ab | 4.33 | ab | 4.0 | abc | 4.33 | abc |
| 4 | -K | 4.0 | a | 4.67 | a | 5.0 | a | 5.0 | a | 5.0 | a |
| 5 | -Ca | 4.0 | a | 4.0 | abc | 4.0 | abcd | 5.0 | a | 5.0 | a |
| 6 | -Mg | 3.83 | ab | 4.17 | ab | 4.17 | abc | 4.83 | ab | 5.0 | a |
| 7 | -S | 3.67 | ab | 3.33 | cd | 3.17 | bcd | 2.83 | bc | 2.50 | bc |
| 8 | -Zn | 3.83 | ab | 3.67 | bcd | 4.17 | abc | 4.83 | ab | 5.0 | a |
| 9 | -Cu | 3.83 | ab | 4.0 | abc | 4.33 | ab | 4.67 | ab | 5.0 | a |
| 10 | -Fe | 4.0 | a | 4.0 | abc | 4.0 | abcd | 5.0 | a | 4.83 | ab |
| 11 | -Mn | 4.0 | a | 3.5 | bcd | 4.0 | abcd | 4.67 | ab | 5.0 | a |
| 12 | -B | 3.67 | ab | 3.17 | cd | 2.83 | cd | 2.33 | c | 2.17 | bc |
| 13 | -Mo | 4.0 | a | 4.0 | abc | 4.67 | a | 4.67 | ab | 4.50 | abc |
| 14 | -Co | 4.0 | a | 4.0 | abc | 4.67 | a | 5.0 | a | 5.0 | a |
| Promedios con una letra común no son significativamente diferentes (p-valor > 0.05). ddt= Días después del trasplante. FC= Fertilización completa. | |||||||||||
3.1.5 Síntomas visuales de deficiencias nutricionales
Los síntomas visuales de deficiencias nutricionales en el cultivo de quinoa se manifestaron en el caso de la omisión de N, P, K, S y B.
Los síntomas de deficiencia de N se presentaron a los 15 ddt, iniciando con una clorosis en las hojas viejas para luego avanzar a las hojas jóvenes, hasta que la planta presentó una clorosis general. El crecimiento de la planta se redujo, además de presentar un tallo más delgado que las plantas del tratamiento con fertilización completa (Figura 1).

Los síntomas de deficiencias de P aparecieron a los 40 ddt; presentando una clorosis en los bordes de las hojas inferiores y en diferentes puntos de la lámina foliar, esta clorosis se trasformó en necrosis a los 49 ddt. Las plantas bajo la omisión de P fueron más pequeñas que las plantas bajo fertilización completa (Figura 2).
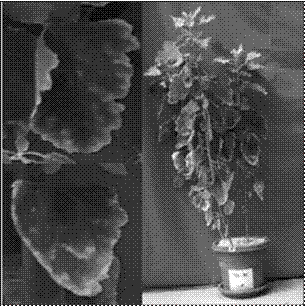
Los síntomas de deficiencia en K iniciaron a los 10 ddt; presentando una coloración verde más oscura. Los bordes de las hojas basales mostraron una clorosis a los 24 ddt para finalmente necrosarse y enrollarse. La planta inició la defoliación de las hojas que presentaron el necrosamiento, mientras las hojas superiores permanecían con la coloración verde oscura a los 40 ddt. En general, la planta presentó un tamaño más pequeño y el tallo era más delgado con respecto a las plantas con fertilización completa (Figura 3).
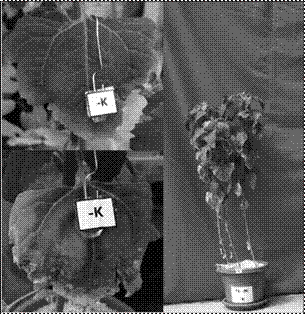
Los síntomas de deficiencia de S iniciaron a los 30 ddt. Las hojas bajeras fueron las primeras en presentar una clorosis en los bordes, para luego avanzar hasta las nervaduras de las mismas. Las hojas jóvenes se vieron afectadas mostrando una clorosis en toda la hoja a los 50 ddt. Sin embargo, el crecimiento de las plantas con omisión de S a los 60 ddt fue mayor comparada con las del tratamiento con fertilización completa (Figura 4).
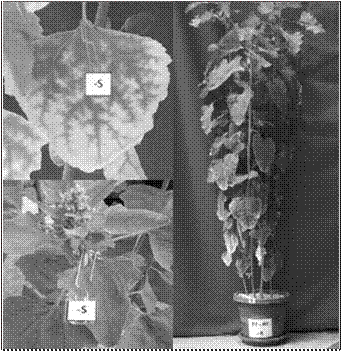
La deficiencia de B se presentó a los 20 ddt con la aparición de zonas cloróticas en las hojas jóvenes. Las yemas apicales iniciaron el marchitamiento a los 31 ddt, y por lo tanto el crecimiento se redujo. Las hojas se tornaron quebradizas y se defoliaron a los 40 ddt (Figura 5).
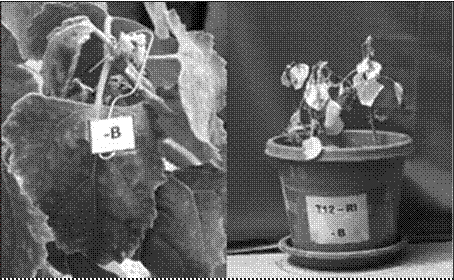
3.2 Segundo Experimento
3.2.1 Biomasa
Los valores de biomasa no mostraron diferencias estadísticas significativas a los 15 ddt. Sin embargo, diferencias estadísticas altamente significativas fueron observadas a partir de los 30 hasta los 60 ddt. El promedio de biomasa aumentó de 0.36 hasta 17.93 g/planta, desde los 15 hasta los 60 ddt; respectivamente (Tabla 10).
La prueba de Bonferroni al 5% (Tabla 11) ubicó al tratamiento con fertilización completa en el primer rango en todos los estados fenológicos evaluados; seguido por los tratamientos de omisión de Ca, Mg, S, Zn, Cu, Fe, Mn, Mo, y Co, cuya ausencia no afecto significativamente a la acumulación de biomasa hasta el estado fenológico estudiado. En contraste, el tratamiento de omisión de N estuvo ubicado en el último rango desde los 30 hasta los 60 ddt. La baja producción de biomasa asociada con plantas deficientes de N que solo llegó a 1.08 g/planta a los 60 ddt se explica puesto que este nutriente está integrado en la producción de compuestos como aminoácidos y proteínas; los cuales son indispensables en la división y elongación celular (Ehret, Menzies, & Helmer, 2005).
Los tratamientos de omisión de K y B se ubicaron en el último rango a partir de los 45 ddt. La deficiencia de K, según (del Amor & Marcelis, 2004) se refleja en una poca producción de biomasa, por ser un elemento que contribuye a regular la apertura y el cierre de las estomas; y en cuya ausencia la planta minimizará su tamaño y el número de hojas. Con respecto al valor bajo de biomasa asociado con el tratamiento de omisión de B, se explica considerando que es un nutriente que desempeña un rol primario en la biosíntesis, estructura y lignificación de la pared celular, en la integridad de la membrana plasmática, transporte de azúcares y síntesis de ácidos nucleicos; ligados directamente con la producción de biomasa (Marschner, 2011).
El tratamiento de omisión de P se hizo también evidente con un rango bajo de biomasa a los 60 ddt. Este resultado concuerda con lo mencionado por (Wang, Garvin, & Kochian, 2002) que si en las plantas existe deficiencias de P, las cantidades de fosfato inorgánico en el citosol son bajos y por lo tanto se ve restringida la síntesis de ATP, ocasionando la desactivación o inhibición de la enzima rubisco; el efecto final es un descenso de la tasa de carboxilación y, por tanto, menor cantidad de carbohidratos con menor acumulación de biomasa.
La correlación entre las variables biomasa y altura, fue estadísticamente significativa a partir de los 42 ddt, con el mayor coeficiente (0.85) a los 56 ddt. En el caso de la correlación entre las variables biomasa y clorofila no presentó significancia estadística para ningún estado fenológico evaluado; sin embargo, el coeficiente aumentó de 0.27 a 0.56 desde 14 a 56 ddt; respectivamente. Estos resultados confirman que la función primordial de la clorofila es la de absorber energía lumínica la cual en combinación con otros componentes permite una adecuada acumulación de biomasa en las plantas y por lo tanto, el crecimiento de éstas se ve afectado (Demmig-Adams & Adams Iii, 1992).
| Cuadrado medio | |||||
| F. V. | G.L. | ||||
| 15 ddt | 30 ddt | 45 ddt | 60 ddt | ||
| Total | 55 | ||||
| Tratamientos | 13 | 0.01ns | 1.48** | 53.34** | 282.29** |
| Error | 42 | 0.01 | 0.33 | 2.54 | 11.51 |
| C.V. (%) | 32.26 | 26.85 | 17.04 | 18.91 | |
| (g) | 0.36 | 2.15 | 9.35 | 17.93 | |
| **= Diferencias estadísticas altamente significativas. ns= Diferencias estadísticas no significativas. ddt = Días después del trasplante. | |||||
| Tratamientos | Biomasa (g) | |||||||
| Promedio | Prueba de Bonferroni | |||||||
| 15 ddt | 30 ddt | 45 ddt | 60 ddt | |||||
| 1 | FC | 0.38 | 2.30 | a | 11.13 | a | 25.48 | a |
| 2 | -N | 0.28 | 0.60 | b | 1.08 | b | 1.08 | c |
| 3 | -P | 0.45 | 2.55 | a | 9.75 | a | 16.28 | b |
| 4 | -K | 0.38 | 1.39 | ab | 3.83 | b | 4.25 | c |
| 5 | -Ca | 0.35 | 2.20 | a | 11.10 | a | 20.45 | ab |
| 6 | -Mg | 0.40 | 2.73 | a | 9.98 | a | 21.15 | ab |
| 7 | -S | 0.43 | 2.33 | a | 11.65 | a | 22.83 | ab |
| 8 | -Zn | 0.40 | 2.35 | a | 11.30 | a | 21.23 | ab |
| 9 | -Cu | 0.38 | 2.33 | a | 13.30 | a | 25.15 | ab |
| 10 | -Fe | 0.33 | 2.60 | a | 11.85 | a | 19.13 | ab |
| 11 | -Mn | 0.33 | 1.78 | ab | 10.23 | a | 21.73 | ab |
| 12 | -B | 0.40 | 1.65 | ab | 3.83 | b | 4.18 | c |
| 13 | -Mo | 0.33 | 2.80 | a | 10.78 | a | 23.28 | ab |
| 14 | -Co | 0.30 | 2.55 | a | 11.18 | a | 24.95 | ab |
| Promedios con una letra común no son significativamente diferentes (p-valor > 0.05). ddt= Días después del trasplante. FC= Fertilización completa. | ||||||||
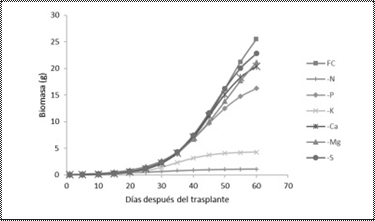
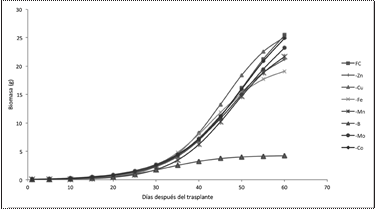
El modelo logístico de producción de biomasa para todos los tratamientos evaluados no indicó mayores diferencias en los primeros 30 ddt; es decir, durante estos días hubo una fase lineal en la curva; contrastante, con los días posteriores, donde se presentó una fase exponencial de producción de biomasa para todos los tratamientos como se puede observar en las Figuras 6 y 7.
En el caso de la producción de biomasa en deficiencia de los macronutrientes, el tratamiento con la fertilización completa presentó la mayor producción de biomasa seguido por los tratamientos de omisión de S, Mg, Ca y P. En tanto que los tratamientos que presentaron la menor producción de biomasa fueron los de omisión de K y N. Los coeficientes del modelo de regresión logístico normal presentó tres grupos logísticos. En el primer grupo se encontraron los tratamientos de fertilización completa, omisión de P, omisión de Ca, omisión de Mg y omisión de S; con un valor límite de producción de biomasa (α) de 32.80 g, 18.38 g, 22.96 g, 28.69 g, 26.44 g; respectivamente, la tasa de la amplitud de la curva (γ) estuvo en un rango de 0.11 g a 0.14 g. En el segundo grupo se encontró el tratamiento de omisión de K con un límite de producción de biomasa de 4.36 g y una amplitud de la curva de 0.16 g. En el tercer grupo se encontró el tratamiento de omisión de N con una producción de biomasa límite de 1.16 g y una amplitud de la curva de 0.09 g.
En el caso de la producción de biomasa de los tratamientos de omisión micronutrientes (Zn, Cu, Fe, Mn, Mo, Co) con excepción del B, fue muy similar a la del tratamiento con fertilización completa, lo que permite inferir que el requerimiento de estos micronutrientes a esta etapa fenológica del cultivo fue cubierta por la reserva de la semilla o liberación del sustrato; y por tanto, estuvieron en cantidades suficientes para que la biomasa no sea afectada (Havlin, Beaton, Tisdale, & Nelson, 2005). Los coeficientes del modelo de regresión logístico normal presentó 2 grupos logísticos. En el primer grupo se ubicaron los tratamientos de fertilización completa, omisión de Zn, omisión de Cu, omisión de Fe, omisión de Mn, omisión de Mo y omisión de Co; con un valor límite de producción de biomasa de 32.80 g, 24,27 g, 27.91g, 20.65 g, 25.40 g, 31.16 g y 32.53 g; respectivamente, y la tasa de amplitud de la curva entre 0.11 g a 0.15 g. En el segundo grupo logístico se encontró el tratamiento de omisión de B con un límite de producción de biomasa de 4.30 g y una amplitud de la curva de 0.15 g.
5. Conclusiones
Los elementos de mayor importancia en la nutrición del cultivo de quinua evaluado bajo invernadero hasta los 60 ddt fueron el N, B y K; ya que las variables estudiadas presentaron diferencias altamente significativas en los tratamientos donde existió la omisión de estos nutrientes; además, las plantas presentaron cambios notorios en la morfología y en el color. Sin embargo, las deficiencias de S y P en plantas de quinua fueron también evidentes, aunque en menor intensidad y en las etapas fenológicas más avanzadas (35 y 42 ddt; respectivamente).
Las plantas de quinua con deficiencias de K y S presentaron síntomas visuales un tanto diferentes a los mencionados por la literatura para otros cultivos. La deficiencia de K se manifestó con plantas de color verde muy intenso especialmente hasta los 42 ddt; y las deficiencias de S se presentaron primero en las hojas inferiores.
Los nutrientes Ca, Mg, Zn, Fe, Cu, Mn, Mo y Co no presentaron síntomas de deficiencias nutricionales para el cultivo de quinua bajo las condiciones evaluadas, debido muy probablemente a que la biodisponibilidad de estos nutrientes a través del sustrato, reserva de la semilla, o de las soluciones nutritivas (en el caso de Mo y Co que no fueron caracterizadas) utilizadas cubrió los requerimientos del cultivo durante las etapas fenológicas evaluadas.
La altura de planta y el color fueron las variables que mejor indicaron la deficiencia de N, P, K, S y B en las plantas de quinua a través de las distintas etapas fenológicas evaluadas. Sin embargo, también el contenido de clorofila permitió evidenciar el cambio en el nivel de fotosíntesis y consecuentemente en la tasa de crecimiento y producción de biomasa cuando existió la omisión de dichos nutrientes. Adicionalmente, la producción de biomasa fue una variable clave para confirmar la importancia jerárquica de los macro y micro nutrientes esenciales para este cultivo.
Finalmente, la tabla de colores fue una herramienta válida, que puede ser utilizada en el cultivo de quinua especialmente a partir de los 35 ddt; considerando el alto nivel de correlación observado con las lecturas del medidor de clorofila.
Referencias
Alcántar González, G., & Trejo-Téllez, L. I. (2007). Nutrición de cultivos.
Azcón-Bieto, J., & Talón, M. (2008). Fundamentos de fisiología vegetal.
Castaño, C. A., Morales, C. S., & Obando, F. H. (2008). Evaluación de las deficiencias nutricionales en el cultivo de la mora (Rubus glaucus) en condiciones controladas para bosque montano bajo. Agronomía, 16(1), 75-88
Castellanos, J. Z. (2009). Manual de producción de tomate en invernadero.
Consuegra, A., Maya, C., de Cantillo, S. H., & Marín, N. B. (1995). Determinación de deficiencias de elementos mayores en plántulas de Chachafruto Erythrina edulis. Acta Agronómica, 45(2-4), 73-78.
del Amor, F. M., & Marcelis, L. F. (2004). Regulation of K uptake, water uptake, and growth of tomato during K starvation and recovery. Scientia horticulturae, 100(1), 83-101.
Demmig-Adams, B., & Adams Iii, W. (1992). Photoprotection and other responses of plants to high light stress. Annual review of plant biology, 43(1), 599-626.
Dobermann, A., & Fairhurst, T. (2000). Rice: Nutrient disorders & nutrient management (First ed.): IRRI PPI-PPIC.
ProEcuador, P. (2015). Análisis Sectorial Quinua 2015: Obtenido de Pro Ecuador Instituto de promocion de exportaciones e inversiones. Recuperado de: http://www.proecuador.gob.ec/wpcontent/uploads/2015/10/PROEC_ AS2015_QUINUA2. pdf.
Ehret, D. L., Menzies, J. G., & Helmer, T. (2005). Production and quality of greenhouse roses in recirculating nutrient systems. Scientia horticulturae, 106(1), 103-113.
Fries, A. M., & Tapia, M. E. (2007). Guía de campo de los cultivos andinos: FAO, ANPE-PERÚ.
Giri, S., Shrivastava, D., Deshmukh, K., & Dubey, P. (2013). Effect of air pollution on chlorophyll content of leaves. Current Agriculture Research Journal, 1(2), 93-98.
Han, S., Tang, N., Jiang, H.-X., Yang, L.-T., Li, Y., & Chen, L.-S. (2009). CO 2 assimilation, photosystem II photochemistry, carbohydrate metabolism and antioxidant system of citrus leaves in response to boron stress. Plant Science, 176(1), 143-153.
Havlin, J. L., Beaton, J. D., Tisdale, S. L., & Nelson, W. L. (2005). Soil fertility and fertilizers: An introduction to nutrient management (Vol. 515). Hall Upper Saddle River, NJ: Pearson Prentice.
SAS Institute. (1999). SAS/STAT user’s guide, version 8. SAS Institute.
Jacobsen, S., & Sherwood, S. (2002). Cultivos de granos andinos en Ecuador: Informe sobre los rubros quinua, chocho y amaranto. Quito, Ecuador: Editorial Abya-Yala.
Kováčik, J., & Bačkor, M. (2007). Changes of phenolic metabolism and oxidative status in nitrogen- deficient Matricaria chamomilla plants. Plant and soil, 297(1-2), 255-265.
León, F., Viteri, D., & Mejía, C. (2004). Guía para la determinación de deficiencias nutricionales en babaco.
Manrique Reol, E. (2003). Los pigmentos fotosintéticos, algo más que la captación de luz para la fotosíntesis. Ecosistemas, 12(1).
Marschner, H. (2011). Marschner’s mineral nutrition of higher plants: San Diego: Academic press.
Martínez Teruel, A., Medina Blanco, M., & Gómez- Castro, A. (1985). Relación entre distintas características de plantas de Cistus ladanifer L.
Peralta, E., Mazón, N., Murillo, A., Rivera, M., & Monar, C. (2012). Manual agrícola de granos andinos. Quito: Instituto Nacional de Investigaciones Agropecuarias (INIAP).
Pier, P. A., & Berkowitz, G. A. (1987). Modulation of water stress effects on photosynthesis by altered leaf K+. Plant physiology, 85(3), 655-661.
Reuler, H. v., & Prins, W. (1993). role of plant nutrients for substainable food crop production in Sub-Saharan Africa. Dutch Association of Fertilizer Producers.
Rivadeneira Ruales, J. (1999). Determinacion de los niveles optimos de fertilizacion quimica en el cultivo de chocho (Lupinus mutabilis Sweet), en tres localidades de la Sierra ecuatoriana.
Salisbury, F., & Ross, C. (2000). Fisiología Vegetal: Desarrollo de las plantas y fisiología ambiental. España: Thomson editores Paraninfo.
Samra, J., & Arora, Y. (1997). Mineral nutrition. The mango: botany, production and uses. Oxfordshire, United Kingdom: CAB International.
Sánchez, P. A., & Camacho, E. (1981). Suelos del trópico: características y manejo: San José, Costa Rica: Instituto Interamericano de Cooperación Agropecuaria.
Steiner, A. A. (1968). Soilless culture.
Wang, Y.-H., Garvin, D. F., & Kochian, L. V. (2002). Rapid induction of regulatory and transporter genes in response to phosphorus, potassium, and iron deficiencies in tomato roots. Evidence for cross talk and root/rhizosphere-mediated signals. Plant physiology, 130(3), 1361-1370.
Wild, A., & Jones, L. (1992). Nutrición mineral de las plantas cultivadas: Condiciones del suelo y desarrollo de las plantas según Russel.
Wimmer, M. A., & Eichert, T. (2013). Mechanisms for boron deficiency-mediated changes in plant water relations. Plant Science, 203, 25-32.
Witt, C., Pasuquín, J., Mutters, R., & Buresh, R. (2005). Leaf color chart for effective nitrogen management in rice. Better Crops, 89(1), 36-39.
Notas de autor
spalvarado@uce.edu.ec

