



Emergencia y crecimiento inicial de festuca alta libre e infectada con endófitos silvestres o seguros
Emergence and initial growth of tall fescue free and infected with wild or safe endophytes
Revista de la Facultad de Agronomía
Universidad Nacional de La Plata, Argentina
ISSN: 1669-9513
Periodicidad: Semestral
vol. 120, núm. 1, 2021
Recepción: 11/11/2019
Aprobación: 18/08/2020
Autor de correspondencia: lpetigrosso@mdp.edu.ar
Resumen: El objetivo de este trabajo fue evaluar, durante la etapa temprana de implantación de festuca alta, el porcentaje y la velocidad de emergencia, la producción de biomasa y la proporción de raíz en plantas provenientes de una población naturalizada del sudeste de la Provincia de Buenos Aires (S) y del cv. Taita (T), libres (S- y T-, respectivamente) e infectadas con el endófito silvestre Epichloë coenophiala (S+) y con el endófito seguro AR584 (T+) respectivamente. Se sembraron ocho bandejas plantineras de 50 celdas para cada tratamiento (i.e. S-, S+, T- y T+) y se ubicaron de forma tal que la superficie superior de la misma quedara al ras del suelo en una parcela preparada para la siembra de una pastura. El número de plántulas emergidas en cada bandeja se registró diariamente hasta los 28 días desde la siembra y se determinó el porcentaje y la velocidad de emergencia. A los 47 días desde la siembra se determinó la materia seca de la parte aérea y radical de las plantas emergidas. A los 28 días desde la siembra, no se registraron diferencias significativas en el número de plantúlas emergidas dentro de las festucas infectadas (p=0,9965) ni entre las libres (p=0,7525). No se encontraron diferencias significativas (p=0,4738) entre las festucas en la velocidad de emergencia. Las festucas infectadas presentaron una biomasa total por planta superior a la de las libres debido a una mayor biomasa de raíces, aunque las diferencias para ambas variables sólo fueron significativas (p<0,001) en el caso del cv. Taita. En nuestras condiciones la presencia del endófito aumentó el porcentaje de plántulas emergidas tanto en la población naturalizada como en Taita, y promovió el desarrollo radical en este último.
Palabras clave: Festuca arundinacea, Epichloë coenophiala, porcentaje de emergencia, acumulación de materia seca, infección endofítica.
Abstract: The objective of this work was to assess, during the early stages of tall fescue implantation, the percentage of emergence, the emergence speed index, biomass production and root proportion of a naturalized population from Buenos Aires province (S) and cv. Taita (T), free (S- and T-, respectively) and infected with the wild endophyte Epichloë coenophiala (S+) and with the safe endophyte AR584 respectively (T+). Eight seedling trays with 50 cells were sown for each treatment (i.e. S-, S+, T- and T+) and placed on a bare soil in such a way that the upper surface of the trays was at soil level. The number of emerged seedlings was recorded daily up to 28 days after sowing and percentage and emergence speed index were calculated. At 47 days from sowing the biomass of shoot and roots of the plants was determined. At 28 days from sowing, no significant differences were registered in the number of emerged seedlings within endophyte-infected (p=0.9965) or endophyte-free (p=0.7525) treatments. No significant differences (p=0.4738) were found among treatments for the emergence speed index. The total biomass per plant for endophyte-infected tall fescues was higher than for endophyte-free ones due to a higher root biomass, although for both variables the differences were significant (p<0,001) only in cv. Taita. In our conditions, the presence of both endophytes allowed the respective tall fescues to increase the percentage of seedling emergence and to promote root development in cv. Taita.
Keywords: Festuca arundinacea, Epichloë coenophiala, percentage of emergence, biomass accumulation, endophytic infection.
INTRODUCCIÓN
Festuca alta, Schedonorus arundinaceus (Schreb.) Dumort [sinónimos: Festuca arundinacea Schreb., Lolium arundinaceum (Schreb.) S.J. Darbyshire, Schedonorus phoenix (Scop.) Holub], es una forrajera de clima templado muy valorada por su rusticidad, plasticidad fenotípica y calidad en los sistemas extensivos de producción ganadera (Lattanzi et al., 2007; Milne, 2009; Scheneiter et al., 2016). Al igual que otras gramíneas C3 puede establecer una relación simbiótica con hongos endófitos asexuales de transmisión vertical (Clay & Schardl, 2002; Schardl et al., 2004; Selosse & Schardl, 2007). Aunque se ha sugerido que entre un 20% y un 30% de las gramíneas pueden estar infectadas con endófitos sistémicos, los estudios de esta asociación se han centrado principalmente en F. arundinacea y Lolium perenne L. (Omacini et al., 2013).
El hongo endófito que infecta plantas de festuca alta, Epichloë coenophiala (Morgan-Jones & W. Gams). C.W. Bacon & Schardl (Leuchtmann et al., 2014) ex Neotyphodium coenophialum (Hill et al. 1990), crece sistémica y asintomáticamente en la parte aérea de la planta, no se dispersa ni por esporas ni por el polen, y se propaga a través de las semillas del hospedante (White et al., 1993). La asociación endófito-festuca es del tipo simbiótico-mutualista (Siegel et al., 1987; White & Torres, 2009). Los endófitos se benefician en la asociación por tener asegurada su nutrición, dispersión y supervivencia (Siegel et al., 1987). Las plantas de festuca colonizadas con endófitos se benefician por los alcaloides que produce el endófito (i.e. lolinas y peraminas) que les otorgan resistencia biótica y abiótica en condiciones de estrés (Clay, 1987; Lyons et al., 1990; Malinowski & Belesky, 2000; Omacini et al., 2001; Saikkonen et al., 2013; Bourguignon et al., 2015). Sin embargo, algunos de los alcaloides (i.e. ergoalcaloides) son tóxicos para el ganado en pastoreo y pueden causar diversos síndromes clínicos y subclínicos que provocan importantes pérdidas económicas en la producción ganadera (Bacon et al., 1977; Hoveland, 1993; Evans et al., 2012). Es por ello que se recomienda establecer pasturas de festuca alta empleando cultivares libres del endófito (Bouton et al., 2001; Ball et al., 2003; Petigrosso et al., 2019) o, alternativamente, cultivares que han sido inoculados con endófitos seguros (safe o non-toxic endophytes; Bouton et al., 2002). Estos endófitos se caracterizan por producir alcaloides de la familia de las lolinas y peraminas que otorgan resistencia a insectos, pero no producen toxinas para el ganado como ergoalcaloides y lolitremos (Schardl, 2009; Gundel et al., 2013; Johnson et al., 2013).
La germinación y la emergencia son las dos etapas más importantes en el ciclo de vida de las poblaciones vegetales (Harper, 1977; Baskin & Baskin, 2014). Éstas afectan directamente el desarrollo y sobrevivencia de las plántulas y determinan la eficiencia de uso de los nutrientes y la captación de agua disponible, lo que su vez determinará la habilidad competitiva de las plantas por un nicho ecológico (Forcella et al., 2000). La germinación de las semillas de gramíneas puede resultar afectada por la presencia de hongos endófitos. Por ejemplo, se han reportado porcentajes de germinación más altos en semillas infectadas de Lolium perenne L. y F. arundinacea Scherb. (Clay, 1987) y F. rubra L. (Wäli et al., 2009) que en semillas libres de endófito. Sin embargo, este efecto positivo del endófito no se ha observado en otros estudios, por ejemplo, en L. perenne (Rolston et al., 1986; Keogh & Lawrence, 1987), F. arizonica Vasey (Neil et al., 2003; Faeth et al., 2004), L. multiflorum Lam. (Gundel et al., 2006) y Phragmites australis (Cav.) Trin. (Shearin et al., 2017). La existencia de resultados contradictorios proporciona evidencia de la importancia de la interacción entre el genotipo del endófito y el de su hospedante, y de las condiciones experimentales (Marks et al., 1991; Clay, 1993; Gundel et al., 2006).
El objetivo de este trabajo fue evaluar, durante la etapa temprana de implantación de festuca alta, el porcentaje y la velocidad de emergencia, la producción de biomasa y la proporción de raíz en plantas provenientes de una población naturalizada del sudeste de la Provincia de Buenos Aires (S) y del cv. Taita (T), libres (S- y T-, respectivamente) e infectadas con el endófito silvestre Epichloë coenophiala (S+) y con el endófito seguro AR584 (T+) respectivamente.
MATERIALES Y MÉTODOS
Sitio experimental
Se realizó un experimento bajo condiciones semicontroladas a campo, en un predio de la Unidad Integrada Balcarce, Facultad de Ciencias Agrarias- Universidad Nacional de Mar del Plata – EEA Balcarce, Instituto Nacional de Tecnología Agropecuaria (latitud: 37° 45' 48" S; longitud: 58° 17' 51" O; altitud: 130 m.s.n.m.).
Obtención del material experimental
Se trabajó con cariópsides (comúnmente llamados semilla) de festuca alta de una población naturalizada y de un cultivar comercial ambos libres e infectados con hongo endófito. Así, los tratamientos fueron cuatro: 2 materiales de festuca x 2 estados de infección endófitica. La semilla original de festuca de la población naturalizada infectada con el endófito silvestre Epichloë coenophiala (S+) se cosechó en diciembre de 2015 en un pastizal del Partido de Mar Chiquita (37º 32' S; 57º 55' O, identificado previamente por Petigrosso et al., 2013), y se almacenó en heladera a 5°C para mantener la viabilidad del endófito hasta su utilización. La semilla de la misma población libre de endófito silvestre (S-) se obtuvo a partir de su almacenamiento a 20°C de temperatura y 52% HR durante 12 meses (Nosquese, 2017). El cultivar Taita fue provisto gentilmente por GENTOS S.A., libre e infectado con el endófito seguro AR584 (Grasslanz Technology Limited, Palmerston North, Nueva Zelanda) (T- y T+, respectivamente). Si bien la semilla del cv Taita infectada con AR584 no es comercializable en la Argentina, presenta interés agronómico debido a que está infectada por una de las cepas de endófito seguro actualmente comercializados en países como Australia y Nueva Zelanda (Lugtenberg et al., 2016). Con el objetivo de realizar el experimento con semilla cosechada en el mismo año y de comprobada condición endofítica, se cultivaron plantas provenientes de los cuatro tratamientos. Para ello, en marzo de 2018 se sembró la semilla de cada tratamiento (i.e. S-, S+, T- y T+) en 5 bandejas plantineras con 50 celdas a razón de una cariópside por celda. El sustrato empleado fue tierra del horizonte superficial de un suelo Argiudol típico. Las bandejas se ubicaron en un invernáculo y cuando las plantas comenzaron a macollar se determinó la presencia de endófito mediante la técnica de diagnóstico de Belanger (1996). Así, se eliminaron las plantas que no correspondían al estado endofítico del respectivo tratamiento. El resto de las plantas se trasplantaron y cultivaron al aire libre en macetas de 1 L hasta llegar a estado reproductivo. Se cosechó la semilla producida y se verificó la condición endofítica mediante el análisis microscópico de las mismas (Saha et al., 1988). La semilla se procesó para eliminar impurezas empleando un soplador de semillas para realizar el análisis de poder germinativo (ISTA, 2008). Las semillas de la población naturalizada de festuca alta libre e infectada con endófito silvestre registraron valores de poder germinativo de 87% y 90% respectivamente; y las del cv. Taita libre e infectado con el endófito seguro AR584 de 86% y 88%, respectivamente.
Conducción del experimento
El 8 de marzo de 2019 se llenaron bandejas plantineras de 50 celdas (54,5 cm x 28 cm x 6 cm) con un sustrato mezcla (1:1 v/v) de arena de río y tierra del horizonte superficial (0‑20 cm) de un suelo agrícola (9,6 ppm de P Bray I, 5,9% MO y 9,3 ppm N-NO3-) y se aplicó fósforo (P) y nitrógeno (N) a una dosis equivalente a 20 kg P/ha y 50 kg N/ha, para evitar deficiencias minerales. Para cada tratamiento, se sembraron ocho bandejas (repeticiones). En cada celda se colocó un cariópside a 5 mm de profundidad. Las bandejas se ubicaron de forma tal que la superficie superior de la bandeja quedara al ras del suelo en una parcela preparada para la siembra convencional de una pastura. Durante los primeros días posteriores a la siembra, las bandejas fueron cubiertas con media sombra para evitar daños por altas temperaturas y pájaros. Las bandejas se regaron diariamente a fin de mantenerlas con un contenido de humedad cercano a capacidad de campo y se controló manualmente la presencia de malezas.
Determinaciones
Emergencia de plántulas
Desde la siembra, el 8 de marzo de 2019, y hasta el 5 de abril de 2019 (28 días) se registró 4 veces por semana el número de plántulas emergidas (aparición del coleoptile) en cada tratamiento. Con estos datos, se efectuaron los siguientes cálculos:
Porcentaje de plántulas emergidas (ni/50)*100) para cada fecha de registro
Velocidad de emergencia al 05/04/19: VE = [Ʃ (di x ni)]/n
donde: VE es la velocidad de emergencia (en días); diel número de días desde la siembra; ni el número de plántulas emergidas en di; y n el número de plántulas emergidas al final del experimento.
Materia seca aérea y radical y diagnóstico de la infección endofítica en plantas
Las determinaciones de materia seca aérea y radical y el diagnóstico de la infección endofítica en plantas se llevaron a cabo el 24 de abril de 2019, a 40 días de la emergencia promedio (50% de las plántulas emergidas en cada unidad experimental) con 506°Cd acumulados (Tb = 4°C para festuca alta, Colabelli et al., 1998). Las plantas se cosecharon en ese momento para asegurar que, por un lado, estuvieran bien implantadas y, por otro, evitar que el reducido tamaño de las celdas de las bandejas plantineras limitara su crecimiento. La determinación de la viabilidad del endófito se realizó de acuerdo a la técnica de Belanger (1996) en 32 plantas por tratamiento (4 plantas seleccionadas al azar por repetición). El resto de las plantas de la bandeja plantinera (entre 10 y 18 plantas dependiendo del número de plantas emergidas en cada bandeja) se extrajeron, se lavaron con agua corriente y luego se fraccionaron en parte aérea y radical. Las fracciones individuales de cada planta se colocaron en sendos sobres de papel previamente rotulados, se secaron en estufa a 60ºC durante 48h y se pesaron en una balanza analítica. Se determinó la proporción de raíz a través de la relación entre la biomasa radical y la biomasa total (Di Benedetto & Tognetti, 2016).
Datos climáticos
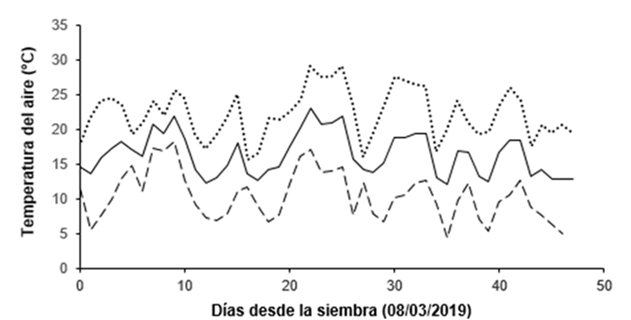
Los datos climáticos del período experimental (08/03/19-24/04/19) se obtuvieron de los registros de la Estación de Agrometereología de la EEA Balcarce del INTA, ubicada aproximadamente a 300 m del sitio experimental. Durante ese lapso se registraron 81,6 mm acumulados de precipitación. En la Figura 1 se muestran las temperaturas media, máxima y mínima del aire registradas en casilla meteorológica a 1,50 m de altura. La temperatura media varió entre 12,1°C y 23°C, la máxima entre 15,5°C y 29°C y la mínima a entre 4,3°C y 18,2°C. Estos valores están comprendidos dentro de los rangos registrados en los últimos diez años (periodo 2009-2018) los cuales fueron de 8,5°C a 28,2°C para la temperatura media, de 12,4°C a 32,4°C para la máxima y de 1,4°C a 21°C para la mínima.
Diseño experimental y análisis estadístico
El experimento se realizó empleando un diseño completamente aleatorizado con cuatro tratamientos (S-, S+, T- y T+) y ocho repeticiones (unidad experimental = bandeja plantinera). Para el análisis de la biomasa total y su partición, se consideraron las 8 repeticiones y se tomó el valor promedio de la cantidad de plantas emergidas por bandeja para cada tratamiento. El porcentaje de plántulas emergidas fue evaluado mediante un modelo lineal generalizado, distribución binomial y función de enlace logit, realizando el análisis de deviance correspondiente (α=0,05) que permitió comparar las medias de los cuatro tratamientos. La velocidad de emergencia, y los valores promedio de cada unidad experimental de biomasa seca total, aérea y radical por planta, y la partición a raíz, se analizaron mediante ANOVA y ante diferencias significativas entre tratamientos (α=0,05), las medias se compararon con la prueba de mínima diferencia significativa (MDS, p<0,05). Todos los análisis se realizaron utilizando el paquete estadístico R (R Core Team, 2018).
RESULTADOS
Emergencia de plántulas a campo
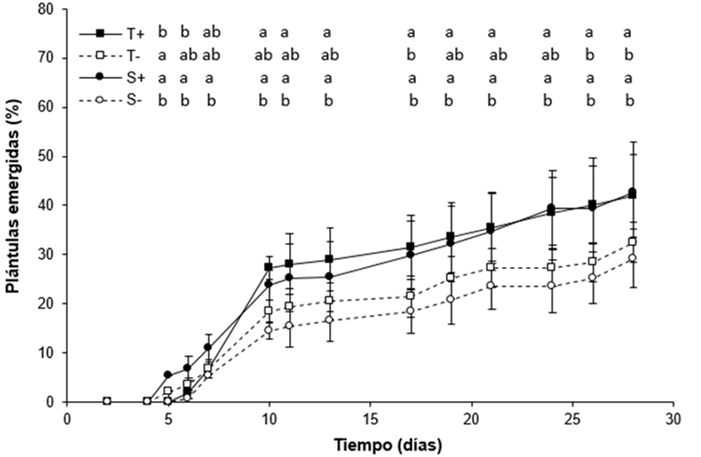
La dinámica de la emergencia de plántulas de los cuatro tratamientos se muestra en la Figura 2. A partir de los 10 días posteriores a la siembra resultó evidente el mayor número de plántulas emergidas en los tratamientos infectados con respecto a los libres. La última fecha en la que se registraron plántulas emergidas fue el 5 de abril de 2019 (i.e. 28 días desde la siembra) aunque las observaciones se realizaron hasta que se llevó a cabo la cosecha de las plántulas (i.e. 40 días desde la siembra). En general, se observó que las plantas infectadas presentaron mayores porcentajes de emergencia que las libres, aunque no siempre fue así en el caso del cultivar Taita (Figura 2). A los 28 desde la siembra no se registraron diferencias significativas entre las festucas infectadas (p=0,9965) ni entre las libres (p=0,7525). Tampoco se encontraron diferencias significativas (p=0,4738) entre los tratamientos en la velocidad de emergencia a los 28 días desde la siembra (S‑: 16,71±1,29, S+: 14,32±1,49, T-: 14,68±1,08, y T+: 14,08±1,27, medias ± error estándar, n=8).
Biomasa de las plantas al momento de la cosecha
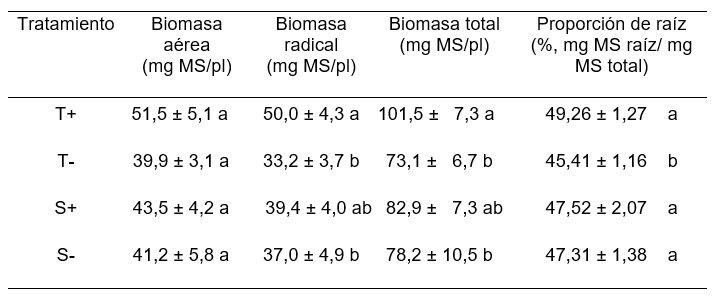
Al final del período experimental se detectaron diferencias significativas (p=0,048) en la biomasa total por planta (Tabla 1). Ello se debió a que las plantas infectadas con endófito, T+ y S+, presentaron los mayores valores de biomasa total. Sin embargo, el valor de biomasa de S+, al ser algo inferior al de T+, tampoco difirió significativamente de los hallados en las plantas libres de endófito (T- y S-). Un resultado similar se observó en la biomasa radical (p=0,019), y no se encontraron diferencias significativas en la biomasa aérea por planta (p=0,187). La proporción de raíz fue similar en los tratamientos T+, S+ y S-, y significativamente mayor a la registrada en T- (p<0,001) (Tabla 1).
Estado de infección endofítica de las plantas
Se constató la infección endofítica en todas las plantas (100% de infección) provenientes de los tratamientos S+ y T+. Por lo tanto, en ninguna de las festucas infectadas hubo fallas en la transmisión del endófito. Por otro lado, se corroboró la ausencia de endófito en las plantas provenientes de semilla de las festucas libres.
DISCUSIÓN
Los resultados de este experimento indican que la presencia del endófito silvestre en semillas de festuca alta proveniente de una población naturalizada (S+) y la del endófito seguro en el cultivar de festuca alta Taita (T+) favorecen la emergencia de las plántulas y coinciden con los hallados en numerosos estudios realizados con gramíneas infectadas con endófitos (e.g. F. arundinacea: Clay, 1987; Pinkerton et al., 1990; L. multiflorum, Gundel et al., 2006; L. perenne; Clay, 1987; Stipa sp., Li et al., 2007, F. pratensis Huds., Majidi y Mirlohi, 2016). Sin embargo, Majidi y Mirlohi (2016) reportaron que la presencia de endófito afectó negativamente el porcentaje y la velocidad de emergencia de las plántulas varios clones de festuca alta (‑23,3% para el porcentaje de emergencia y ‑35,2% para la velocidad de emergencia) y lo atribuyeron al costo metabólico que significa el mantenimiento del hongo debido a que depende de la energía y nutrientes de su hospedante.
Resultados contratantes también se han hallado en numerosos trabajos que han evaluado el efecto del endófito Epichloë sobre la germinación de semillas infectadas de diversas gramíneas. Por ejemplo, Zhang y Nan (2010) encontraron que la infección endófitica aumentó la germinación de Elymus dahuricus, una gramínea importante en la regeneración de pastizales degradados en el norte de China, lo que fue atribuido a un incremento en la actividad de enzimas protectoras que favorecen la adaptación a condiciones de estrés (e.g. superóxido dismutasa y peroxidasa). Del mismo modo, Majidi y Mirlohi (2016) encontraron que si bien la infección endofítica mejoró la germinación de festuca de los prados (F. pratensis infectada con E. uncinata W. Gams, Petrini & D. Schmidt ex N. uncinatum) lo contrario ocurrió en festuca alta. Recientemente, Riveira Rubin et al. (2017) evaluaron el efecto de la presencia del endófito seguro AR584 en la germinación de semillas de festuca infectadas (cultivares Aurora y Taita) bajo distintas combinaciones de temperatura y disponibilidad de agua. Según estos autores, la tasa de germinación fue menor en las semillas infectadas con endófitos que en las semillas libres de endófitos en ambos cultivares, excepto en el caso del cultivar Aurora a 5ºC, que mostró una respuesta opuesta.
Cuando se analiza el desarrollo de las plantas, las infectadas presentaron mayor biomasa seca total que las libres de endófito (Tabla 1), lo cual podría ser explicado por los mayores valores de biomasa radical. Sin embargo, el tratamiento S+ no difirió en la producción de biomasa de raíz respecto de los libres de endófito, S- y T-. La tendencia a una mayor producción de biomasa en las plantas infectadas coincide con los resultados obtenidos por otros autores para festuca alta (Clay, 1987; Cheplick et al., 1989; Hill et al., 1990; Owens et al., 2007). Owens et al. (2007) compararon el vigor de plantas provenientes de diferentes lotes de semillas de festuca alta (distintas variedades, estados de nivel endofitico y tipos de endófitos) sembradas bajo distintas densidades y cultivadas en un mismo ambiente y año, y encontraron que la biomasa de las plantas infectadas fue mayor respecto a las originadas de semillas libres, a pesar de que las semillas infectadas presentaron un menor porcentaje de emergencia que las semillas libres. Es decir, que una menor emergencia, podría compensarse con un mayor crecimiento de las plantas. Este resultado también podría deberse a una menor competencia por los recursos (i.e. luz, nutrientes) dado el menor número de plantas emergidas. Además, encontraron que los endófitos seguros conferirían un vigor superior a las plantas que el que proporcionaría el endófito silvestre, dado que las plantas provenientes de semillas con endófito seguro AR584 produjeron un mayor número de macollos por planta.
Se ha sugerido que una mayor partición de carbono hacia las raíces mejoraría la captura de recursos del suelo, lo que a su vez favorecería la supervivencia en condiciones de competencia (Vila-Aiub et al., 2005). Bajo nuestras condiciones experimentales, a los 40 días de la emergencia promedio, la presencia del endófito silvestre no afectó la partición a raíz en la población naturalizada, pero sí lo hizo la del endófito seguro en el cultivar Taita. De igual forma, Vila-Aiub et al. (2005) encontraron que L. multiflorum infectado con endófito silvestre E. occultans (Moon, C.D., B. Scott & M.J. Chr.) Schardl (Moon et al., 2000) presentaron una mayor partición de carbono hacia las raíces. De Battista et al. (1990) observaron que las gramíneas infectadas con endófito produjeron más compuestos auxínicos que las libres, lo que podría contribuir a un mayor desarrollo de las raíces en las plantas infectadas. Se desconoce si existen diferencias en la producción de auxinas entre las festucas infectadas estudiadas en este trabajo.
CONCLUSIONES
En las condiciones en que se realizó este trabajo, la presencia del endófito silvestre en la festuca naturalizada y del endófito seguro en el cultivar Taita confirió ventajas que permitieron aumentar el porcentaje de plántulas emergidas con respecto a las festucas no infectadas sin modificar la velocidad de emergencia. Además, los resultados indicarían que la presencia del endófito seguro promueve el desarrollo radical en las plantas del cv. Taita durante la etapa de implantación temprana.
Agradecimientos
El presente estudio se desarrolló en el marco del Proyecto 15/A306, AGR599/19 de la Facultad de Ciencias Agrarias de la Universidad Nacional de Mar del Plata
BIBLIOGRAFÍA
Bacon, C.W., J.K. Porter, J.D. Robbins & E.S. Luttrell. 1977. Epichloe typhina from toxic tall fescue grasses. Applied and Environment Microbiology 34: 576-581.
Ball, D.M., S.P. Schmidt, G.D. Lacefield, C.S., Hoveland & W.C. Young. 2003. Tall fescue/endophyte concepts. Oregon Tall Fescue Commission Special Publication. 1–03, Salem, OR. Disponible en http://www.aces.edu/pubs/docs/A/ANR-1239/ANR-1239.pdf?PHPSESSID =85ef5ee29a11f16fb8dffb89782a13aa. Ultimo acceso: marzo 2011.
Baskin, C. & J.M. Baskin. 2014. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination. Academic Press, San Diego pp. 150-162.
Belanger, F.C. 1996. A rapid seedling screening method for determination of fungal endophyte viability. Crop Science 36: 460-462.
Bourguignon, M., J.A. Nelson, E. Carlisle, H. Ji, R.D. Dinkins, T.D. Phillips & R.L. McCulley. 2015. Ecophysiological responses of tall fescue genotypes to fungal endophyte infection, elevated temperature, and precipitation. Crop Science 55: 2895–2909.
Bouton, J.H., R.N. Gates & C.S. Hoveland. 2001. Selection for persistence in endophyte-free Kentucky 31 tall fescue. Crop Science 4: 1026–1028.
Bouton, J.R., R. Gates, N. Hill & C. Hoveland. 2002. Agronomic traits with MaxQ tall fescue. Proc. Tall Fescue Toxicosis Workshop, SERAIEG-8, Wildersvillle, TN.27-29 Oct. Missouri Forage and Grassland Council. pp. 40-41.
Cheplick, G.P., K. Clay & S. Marks. 1989. Interactions between infection by endophytic fungi and nutrient limitation in the grasses Lolium perenne and Festuca arundinacea. New Phytologist 111: 89-97.
Clay, K. 1987. Effects of fungal endophytes on the seed and seedling biology of Lolium perenne and Festuca arundinacea. Oecologia 73: 358-362.
Clay, K. 1993. The ecology and evolution of endophytes. Agriculture, Ecosystem & Environment 44:39-64.
Clay, K. & C. Schardl. 2002. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses. American Naturalist 160: 99-127.
Colabelli, M., M. Agnusdei, A. Mazzanti & M. Labreveux. 1998. El proceso de crecimiento y desarrollo de gramíneas forrajeras como base para el manejo de la defoliación. INTA Balcarce. Boletín Técnico. N° 148. pp. 1 -14.
De Battista J.P., C.W. Bacon, R. Severson, R.D. Plattner & J.H. Bouton. 1990. Indole acetic acid production by the fungal endophyte of tall fescue. Agronomy Journal 82:878-880.
Di Benedetto, A. & J. Tognetti. 2016. Técnicas de análisis de crecimiento de plantas: su aplicación a cultivos intensivos. Revista de Investigaciones Agropecuarias 42: 258-282.
Evans, T.J., D.J. Blodgett, G.E. Rottinghaus. 2012. Fescue toxicosis. Veterinary Toxicology 87: 1166-1177.
Faeth, S.H., M.L. Helander & K.T. Saikkonen. 2004. Asexual Neotyphodium endophytes in a native grass reduce competitive abilities. Ecology Letters 7: 304–313.
Forcella, F., R.L. Benech-Arnold, R.A. Sánchez & C.M. Ghersa. 2000. Modeling seedling emergence. Field Crops Reserch 67: 123-139.
Gundel, P.E., PH. Maseda, M.M. Vila-Aiub, C.M.; C.M. Ghersa & R.L. Benech-Arnold. 2006. Neotyphodium fungi effects on Lolium multiflorum seed germination in relation to water availability. Annals of Botanny 97: 571-577.
Gundel, P.E., L.I. Pérez, M. Helander & K. Saikkonen. 2013. Symbiotically modified organisms: nontoxic fungal endophytes in grasses. Trends Plant Science 18: 420-427.
Harper, J.L. 1977. Plant population biology. Academic Press Cambridge, UK. 892 pp.
Hill, N.S., W.C. Stringer, G.E. Rottinghaus, D.P. Belesky, W.A. Partot & D.D. Pope. 1990. Growth, morphological and chemical component responses of tall fescue to Acremonium coenophialum. Crop Science 30: 156-161.
Hoveland, C.S. 1993. Economic importance of Acremonium endophytes. Agriculture, Ecosystem & Environment 44: 3-12.
International Seed Testing Association. 2008. International Rules for Seed Testing. ISTA. Bassersdorf, 280 pp.
Johnson, L., A. De Bonth, L. Briggs, J. Caradus, S. Finch, D. Fleetwood, L. Fletcher, D. Hume, R. Johnson, A. Popay, B. Tapper, W. Simpson, C. Voisey & S. Card. 2013. The exploitation of epichloae endophytes for agricultural benefit. Fungal Diversity 60: 171-188.
Keogh, R.G. & T. Lawrence. 1987. Influence of Acremonium lolii presence on emergence and growth of ryegrass seedlings. New Zealand Journal of Agricultural Research 30: 507-510.
Lattanzi, F.A., A. Mazzanti & M.H. Wade. 2007. Seasonal animal production of temperature and Mediterranean tall fescue cultivars under continuous variable stocking with close control of sward state. Australian Journal of Agricultural Research 58: 203-213.
Leuchtmann, A., C.W. Bacon, C.L. Schardl, J.F. White & M. Tadych. 2014. Nomenclatural realignment of Neotyphodium species with genus Epichloë. Mycology 106: 202–215.
Li, C.J., J.H. Gao & Z.B. Nan. 2007. Interactions of Neotyphodium gansuense, Achnatherum inebrians, and plant-pathogenic fungi. Mycology Research 111: 1220–1227.
Lugtenberg, B.J.J., J.R. Caradus & L.J. Johnson. 2016. Fungal endophytes for sustainable crop production. Microbiology Ecology 92:1-17.
Lyons, P.C., J.J. Evans & C.W. Bacon. 1990. Effects of the fungal endophyte Acremonium coenophialum on nitrogen accumulation and metabolism in tall fescue. Plant Physiology 92: 726-732.
Majidi, M.M. & A. Mirlohi. 2016. Impact of endophytic fungi on seed and seedling characteristics in tall and meadow fescues. International Journal of Plant Production 10(4): 469-478.
Malinowski, D. & D. Belesky. 2000. Adaptations of endophyte-infected cool-season grasses to environmental stresses: mechanisms of drought and mineral stress tolerance. Crop Science 40: 923-940.
Marks, S., K. Clay & G. Cheplick. 1991. Effects of fungal endophytes on interspecific and intraspecific competition in the grasses Festuca arundinacea and Lolium perenne. Journal of Applied Ecology 28: 194-204.
Milne, G.D. 2009. Management in New Zealand, Australia and South America. In: Tall fescue for the Twenty-first Century, volume 53. Fribourg, H.A., Hannaway, D.B., West, C.P., Ed. Agronomy Monographs. ASA, CSSA, and SSSA, Madison, WI. pp. 101-118.
Moon, C., B. Scott, C. Schardl & M. Christensen. 2000. The evolutionary origins of Epichloë endophytes from annual ryegrasses. Mycologia 92: 1103-1118.
Neil, K., R.T. Tiller & S.H. Faeth. 2003. Germination success of big Sacaton and Neotyphodium-infected and uninfected Arizona fescue. Journal of Range Managment 56: 612–622.
Nosquese, M.A. 2017. Efectividad de diferentes métodos de remoción de hongo endófito asintomático en semillas de festuca alta. Tesis de grado. Facultad de Ciencias Agrarias, UNMdP. Balcarce, Argentina. 51 pp.
Omacini, M., E. Chaneton, C. Ghersa & C. Muller. 2001. Symbiotic fungal endophytes control insect host-parasite interaction webs. Nature 409: 78-81.
Omacini, M., P. Gundel & M.G. Semmartin. 2013. Huellas de la simbiosis pasto-endófito en el agroecosistema. En: Rizósfera, Biodiversidad y Agricultura Sustentable. García de Salamone, I.E.; Vázquez, S.; Penna, C.; Cassan, F., Ed. División de Microbiología Agrícola y Ambiental, Asociación Argentina de Microbiología. Buenos Aires, Argentina. 73 pp.
Owens, H.T., C.H. Finneseth, T.M. Tillery & T.D. Phillips. 2007. Germination rate and seedling vigour of tall fescue as affected by endophyte status and seed density. In: Proceedings of the 6th International Symposium on Fungal Endophytes of Grasses. Grassland research and practice series No. 13. Popay, A.J., Thom, E.R., Ed. Dunedin, NZ: New Zealand Grassland Association pp. 271–274.
Petigrosso, L.R., M.N. Colabelli, O.N. Fernández, V. Ispizúa & M.G. Cendoya. 2013. Incidence of the endophyte fungus Neotyphodium coenophialum in pastures of tall fescue differing in age and soil characteristics. African Journal of Agricultral Research 8(22): 2655-2662.
Petigrosso, L.R., P. Gundel, M.N. Colabelli, O.N. Fernández & S.G. Assuero. 2019. Revisión: “Hongos endófitos en festuca alta: del problema a las soluciones”. Revista de Investigaciones Agropecuarias 45(2): 292-303.
Pinkerton, B.W., J.S. Rice & D.J. Undersander. 1990. Germination in Festuca arundinacea as affected by the fungal endophyte, Acremonium coenophialum. In: Quinsenberry S.S-, Joost, R.E., Ed. Proceedings of the International Symposium on Acremonium/Grass Interactions, Baton Rouge, USA. pp. 176-180.
R Core Team. 2018. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Disponible en http://www.R-project.org/. Ultimo acceso: agosto de 2018.
Riveira Rubin, M.A., D. Batlla, L.J. Iannone, M.A. Martínez-Ghersa & P.E. Gundel. 2017. Seed functional traits in tall fescue cultivars affected by the selected non-toxic fungal endophyte AR584. 9th International Herbage Seed Group (IHSG) Conference. Pergamino, Bs. As. Argentina.
Rolston, M.P., M.D. Hare, K.K. Moore & M.J. Christensen. 1986. Viability of Lolium endophyte fungus in seed stored at different seed moisture contents and temperature. New Zealand Journal of Experimental Agriculture 14: 297-300.
Saha, C.D., M.A. Jackson & J.M. Johnson-Cicalese. 1988. A rapid staining method for detection of endophytic fungi in turf and forage grass. Phytopathology 78: 237-239.
Saikkonen, K., P. Gundel & M. Helander. 2013. Chemical ecology mediated by fungal endophytes in grasses. Journal of Chemical Ecology 39:962–968.
Schardl, C.L. 2009. Fungal endophytes in Lolium and Festuca species. En: Molecular Breeding of Forage and Turf. Yamada T., Spangenberg G., Ed. NY: Springer Science & Bussiness Media, New York pp. 285–298.
Schardl, C.L., A. Leuchtmann & M.J. Spiering. 2004. Symbioses of grasses with seedborne fungal endophytes. Annual Review of Plant Biology 55:315–340.
Scheneiter, J.O., I. Kaufmann, A.R. Ferreyra & R.T. Llorente. 2016. The herbage productivity of tall fescue in the Pampas region of Argentina is correlated to its ecological niche. Grass and Forage Science 71(3): 403-412.
Selosse, M.A. & C.L. Schardl. 2007. Fungal endophytes of grasses: hybrids rescued by vertical transmission? An evolutionary perspective. New Phytologist 173: 452 – 458.
Shearin Z.R.C., M. Filipek, R. Desai, W.A. Bickford, K.P. Kowalski & K. Clay. 2017. Fungal endophytes from seeds of invasive, non-native Phragmites australis and their potential role in germination and seedling growth. Plant Soil 422:183-194.
Siegel, M.R., G.C.M. Latch & M.C. Johnson. 1987. Fungal endophytes of grasses. Annual Review of Phytopathology 25: 193-315.
Vila-Aiub, M.M., P.E. Gundel & C.M. Ghersa. 2005. Fungal endophyte infection changes growth attributes in Lolium multiflorum Lam. Austral Ecology 30:49–57.
Wäli, P.R., M. Helander, I. Saloniemi, J. Ahlholm & K. Saikkonen. 2009. Variable effects of endophytic fungus on seedling establishment of fine fescues. Oecologia 159:49-57.
White, J.F. Jr., G. Morgan-Jones & A.C. Morrow. 1993. Taxonomy, life cicle, reproduction and detection of Acremonium endophytes. Agriculture, Ecosystem & Environment 44: 13-37.
White, J.F. Jr. & M. Torres. 2009. Defensive mutualism in microbial symbiosis. CRC Press. Boca Raton, FL. pp. 333-334.
Zhang, Y.P. & Z.B. Nan. 2010. Germination and seedling anti-oxidative enzymes of endophyte-infected populations of Elymus dahuricus under osmotic stress. Seed Science Technology 8: 522–527.
Notas de autor
lpetigrosso@mdp.edu.ar

