

INFLUENCIAS DE LOS PARÁMETROS FISICOQUÍMICOS EN LAS CONCENTRACIONES DE PROTEÍNAS Y CARBOHIDRATOS EN TEJIDOS DE Anodonta luteola Lea 1858, (BIVALVA: UNIONIDAE) EN LA ARENOSA, PANAMÁ OESTE.
Influences of the physicochemical parameters in the concentrations of proteins and carbohydrates in tissues of Anodonta luteola lea 1858, (bivalva: unionidae) in La Arenosa, Panamá West.
Centros: Revista Científica Universitaria
Universidad de Panamá, Panamá
ISSN-e: 2304-604X
Periodicidad: Anual
vol. 7, núm. 2, 2018
Recepción: 25 Octubre 2017
Aprobación: 30 Junio 2018

Resumen: La composición bioquímica permite establecer el valor alimenticio y proporciona información que ayuda a entender el balance energético de los moluscos. En tal sentido en este trabajo se evaluaron los sustratos energéticos (proteínas y carbohidratos), en el tejido gonadal, pie muscular, branquias y resto del tejido del mejillón de agua dulce Anodonta luteola, en bancos naturales de un sector del lago Gatún, en el poblado La Arenosa, área del Canal de Panamá, desde mayo del 2010 a abril del 2011. Se obtuvieron registros mensuales de los parámetros fisicoquímicos (temperatura, pH, oxígeno disuelto, solidos disueltos y conductividad), en el lago hasta tres metros de profundidad. También se observó la influencia de estos parámetros sobre los sustratos energéticos. Las concentraciones de proteínas y carbohidratos de los tejidos, fueron comprobadas colorimétricamente mediante espectrofotometría. Los mayores valores de proteínas y carbohidratos se obtuvieron en las gónadas y resto del tejido. Los factores fisicoquímicos analizados (temperatura, pH, solidos disueltos y conductividad), mostraron poca influencia sobre las concentraciones de proteínas y carbohidratos de las gónadas, excepto el oxígeno disuelto en la concentración de proteínas.
Palabras clave: Sustratos energéticos, temperatura, pH, oxígeno disuelto, solidos disueltos, conductividad.
Abstract: The biochemical composition sets the nutritional value and provides information that helps to understand the energy balance of molluscs. In that sense this paper energy substrates (proteins and carbohydrates) in the gonadal tissue, muscular foot, gills and other tissue freshwater mussel Anodonta luteola, natural banks of a sector of Lake Gatun were evaluated in the populated La Arenosa, Panama Canal area, from May 2010 to April 2011. monthly records of physico-chemical parameters (temperature, pH, dissolved oxygen, dissolved solids and conductivity) were obtained in the lake up to three meters deep. the influence of these parameters on energy substrates was also observed. Concentrations of protein and carbohydrates of the tissues were tested colorimetrically by spectrophotometry. The highest values of protein and carbohydrates were obtained in the gonads and other tissue. Physico-chemical factors analyzed (temperature, pH, dissolved solids and conductivity), showed little influence on concentrations of protein and carbohydrates of the gonads, except the dissolved oxygen in the concentration of protein.
Keywords: Energy substrates, temperature, pH, dissolved oxygen, dissolved solids y conductivity.
INTRODUCCIÓN
La respuesta de los organismos a las alteraciones del ambiente puede diferir de acuerdo a su estado del ciclo de vida, condición nutricional, sexo, estado de muda, estacionalidad o una previa exposición al factor ambiental, entre muchos otros factores que pueden actuar de manera separada o de forma sinérgica. En consecuencia, la variación estacional en la composición bioquímica de los tejidos bivalvos es el resultado de interacciones complejas entre factores ambientales y
los procesos metabólicos (Thompson & MacDonald 1990), que se refleja en las fluctuaciones en el peso de los diferentes tejidos del cuerpo (Shafee 1981).
El metabolismo energético en moluscos bivalvos está relacionado con la movilización y consumo de energía, la cual es indispensable para el mantenimiento, reproducción y crecimiento (Gabbott 1983). En tal sentido, los organismos obtienen del alimento ingerido la energía necesaria para el mantenimiento basal, crecimiento y reproducción. No obstante, esta puede ser almacenada en órganos y/o tejidos de reserva, particularmente en la glándula digestiva, músculo aductor y manto, en forma de proteínas y carbohidratos. Una vez que el organismo ha obtenido la energía del ambiente, puede suceder: 1. utilización inmediata, 2. almacenamiento en órganos especializados, y/o 3. utilización y almacenamiento, según sus necesidades. Por lo tanto, evaluar en los diferentes órganos los cambios que ocurren en su composición bioquímica, permite inferir sobre la movilización de la energía en función de las necesidades metabólicas que el organismo requiere, en un periodo dado (Acosta et al. 2010).
En los moluscos bivalvos se encuentran diferentes órganos relacionados con el almacenamiento de nutrientes (glucógeno, proteínas, lípidos y otros) y destaca, por su importancia, el epitelio gonadal (Dzyuba & Maslenniskova 1987).
La mayoría de los cambios metabólicos observados en tejidos de los moluscos bivalvos se deben principalmente a las variaciones en el contenido de carbohidratos (principalmente del glucógeno), cuyos patrones anuales de acumulación y utilización reflejan la compleja interacción entre factores exógenos como la disponibilidad de alimento y la temperatura, y factores endógenos como el crecimiento y el ciclo anual de reproducción (Gabbott 1976). Históricamente, se ha hecho hincapié en que la temperatura es el factor ambiental más importante que controla la fisiología de ostras (Galtsoff 1964). En clima templado, la variación estacional de la temperatura conduce el ciclo reproductivo de la ostra, afectando
índice de condición, la proteína, la concentración de lisozima, la aglutinación, y la densidad de hemocitos (Pernet et al. 2007).
Los objetivos de este artículo es analizar las variaciones temporales de las concentraciones de los sustratos energéticos (proteínas y carbohidratos) de diversos tejidos del cuerpo de la almeja Anodonta luteola y evaluar la influencia de los parámetros físicos químicos (temperatura, pH, oxígeno disuelto, solidos disueltos y conductividad) como factores exógenos en las concentraciones de las reservas energéticas almacenadas en las gónadas de un bivalvo de agua dulce.
MATERIAL Y METODOS
Descripción del área de estudio: el poblado de La Arenosa está entre las Provincia de Panamá Oeste y Panamá Centro, en los distritos de Panamá Centro (corregimiento Ancón) y La Chorrera (Corregimiento Iturralde), la población es de 181 habitantes y 47 viviendas, está ubicado a 8°51’34” N y 79°58’34” O, a unos 100 metros de altitud, bordeada por el Lago Gatún. La Arenosa en el Lago Gatún ha sido considerada por muchos pescadores como uno de los mejores lugares de pesca de agua dulce del mundo por la gran población de sargentos, sábalos, oscares, entre otras especies.
El Lago Gatún es un área de 425 km², ubicada a 30 minutos de la ciudad de Panamá Centro, fue creado entre 1907 y 1913 debido a la construcción de la Represa de Gatún sobre el río Chagres; con la edificación de este lago artificial la orografía del área se transformó de un bosque húmedo aun magnifico lago con innumerables islas e islotes. Este enorme lago cuyas aguas abastecen al Canal de Panamá por encima de 26 m. sobre el nivel del mar, provee unos 52 millones de galones de agua dulce que fluyen a través de las esclusas y se vierten en el océano. Un recorrido de 37.8 kilómetros desde las esclusas de Gatún hasta el extremo norte de la vía interoceánica, conocido como Corte Gailard o Culebra contribuye al tránsito de grandes buques que navegan por la vía acuática de todas
partes del mundo. El agua para subir y bajar las naves en cada juego de esclusas se obtiene por gravedad del Lago Gatún, que se formó a razón del estancamiento del caudaloso río Chagres.
La profundidad de las aguas está entre los 13.7 a 25.9 metros. Este geológicamente se compone de finos granos de piedra arenosa, semiduro, arcillosos, variablemente calcáreos, entremezclados con finas tufas volcánicas y ocasionalmente extractos de conglomerados delgados.
Metodología realizada en campo: se realizaron recolectas de la almeja de agua dulce Anodonta luteola, cada 18 días del mes, mediante un muestreo al azar, desde el mes de mayo del 2010 hasta abril del 2011 buceando hasta tres metros en un área del Lago Gatún, Canal de Panamá en el sector de La Arenosa (Fig. 1). Se recolectaron un total 480 individuos (40 individuos por mes) de esta almeja, los cuales se lavaron y midieron la longitud, alto y ancho de la concha en mm con un Vernier de Central Tool Company (Callil & Mansur 2007). Para obtener el peso húmedo se removió la carne de cada ejemplar, luego se secó con papel absorbente y finalmente se colocaron individualmente en una balanza analítica (OHAUS modelo Scout SC2020) de 0.01 g de precisión.
Medición de los parámetros fisicoquímicos: los registros de la temperatura, pH, el oxígeno disuelto, los sólidos disueltos y la conductividad se realizaron en el sitio de muestreo a los 18 días de cada mes a lo largo de un año, el mismo día de la recolecta de los ejemplares, realizando una medición a tres metros de la superficie y a 10 metros de profundidad para el fondo, empleando diferentes instrumentos de acuerdo al tipo de medición requerida (temperatura, conductividad y sólidos disueltos se midieron con un instrumento ExStik EC400; el pH con el HI 98129 y el oxígeno disuelto con el medidor HI 9142) (Callil & Mansur 2007).
Determinación de los sustratos energéticos: los sustratos energéticos proteínas y carbohidratos totales, fueron determinados en las gónadas y cada uno de los tejidos somáticos (branquias, pie y resto del tejido que incluye músculos aductores y manto). La técnica de Bio Rad fue utilizada para medir los niveles de proteínas totales (Villaláz 1992). El contenido de carbohidratos totales fue comprobado mediante las técnicas de Dubois et al. (1956) y Hassid & Abraham (1957), las concentraciones de ambos sustratos fueron comprobadas colorimétricamente por medio de un Bio Rad SmartSpec Plus Spectrophotometer.
Análisis estadístico: para saber si estas almejas llevaban un desarrollo normal en su crecimiento y engorde se realizó la prueba no paramétrica de Kruskal-Wallis para una probabilidad menor de 0.05, la cual nos indicaba si había diferencias significativas en las medidas de longitud, ancho y alto de este bivalvo tomadas mensualmente. Para determinar si existían diferencias en la concentración de proteínas y carbohidratos dependiendo de las tallas se usó una ANOVA con el diseño completamente al azar (DCA). Los supuestos de homogeneidad de varianza, así como la normalidad de residuales fue comprobada mediante una prueba de Leven y Shapiro Wilk respectivamente. Todos los análisis se realizaron usando el software Past 3.0
Se buscó los valores de correlación múltiple (r), el coeficiente de determinación (R2) y la probabilidad (P) para determinar qué tipo de correlación paramétrica hay
entre los parámetros fisicoquímicos (temperatura, pH, el oxígeno disuelto, los sólidos disueltos y la conductividad) y las diferentes concentraciones de los sustratos energéticos proteínas y carbohidratos totales en las gónadas utilizando el programa Excel de Microsoft Office 2010.
RESULTADOS Y DISCUSIÓN
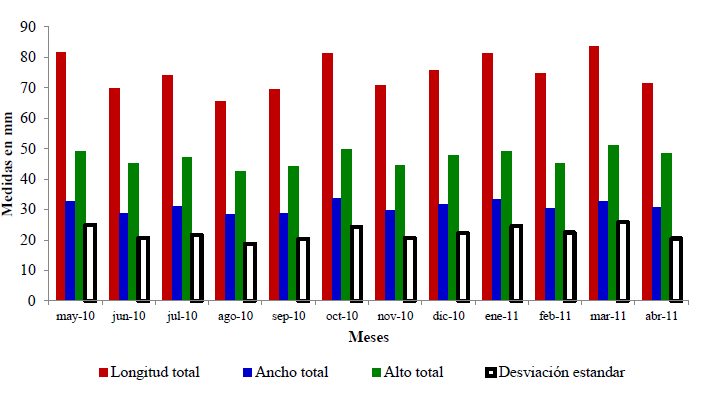
Biometría: el promedio para la longitud fue ± 75.0 mm y la desviación estándar 5.9, para el alto el valor promedio es ± 31.0 mm y la desviación estándar 1.8 y finalmente el registro promedio para el ancho estuvo en ± 47.0 mm y la desviación estándar resulto ser 2.7; el rango de las tallas estuvo entre 65.57 - 83.71 mm para la longitud, 42.68 - 50.97 mm el alto y 28.32 - 33.74 mm para ancho.
El mayor registro de la longitud en la temporada seca se obtuvo en el mes de marzo del 2011 y en la lluviosa en octubre del 2010, el mejor valor del alto total en la estación seca fue en el mes de enero 2011 y en la lluviosa en el mes de octubre 2010, y el ancho total resulto mayor en los meses de marzo 2011 en la época seca y octubre 2010 para la lluviosa (Fig. 2).
El peso total (valva más carne) fue mayor en la temporada lluviosa en el mes de octubre del 2010 y en la seca en el mes de marzo del 2011. El peso fresco (solo carne) fue ligeramente mayor en el mes de marzo del 2011 (época seca) y en octubre del 2010 (lluviosa) (Fig. 3).
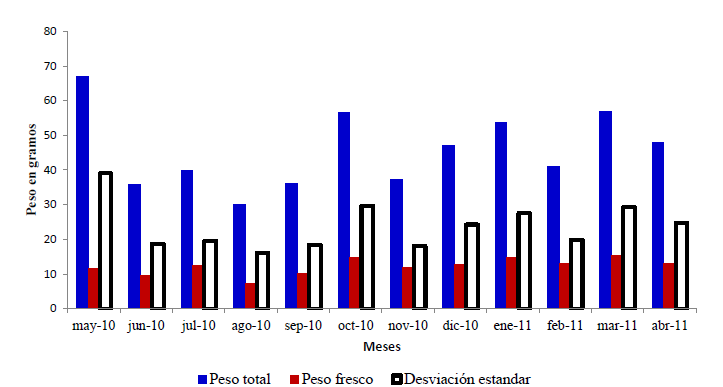
Como el peso total de toda la población A. luteola muestreada mensualmente, se mostró muy variable entre 30.17 g y 66.89 g, no es un factor cuantificable que
pueda ser utilizado como indicador del aumento de peso del animal, al respecto Vega (1994) sugiere que el mismo se encuentra influenciado por factores como: el desgaste natural de la concha, el peso del agua retenida por el molusco y las partículas adheridas a la concha, siendo factores no estables y pueden alterar este parámetro.
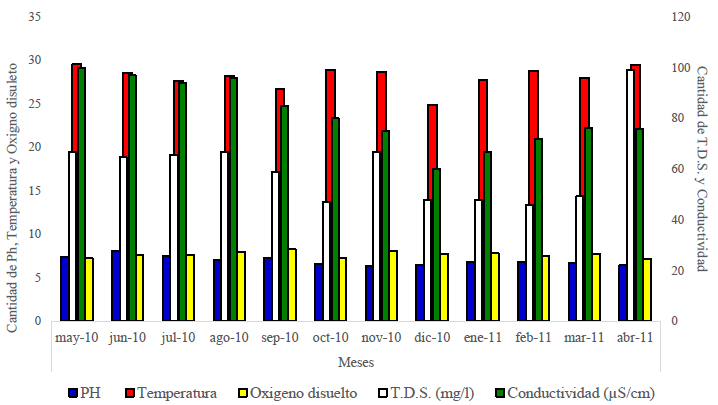
Parámetros fisicoquímicos: en los meses de estudio de mayo – diciembre (temporada lluviosa) las distintas medidas de temperatura de la superficie del agua mantuvieron un rango entre 24.9 y 29.54°C, y en los meses de enero – abril (temporada seca) de 27.8 y 29.52°C. En el fondo los rangos fueron 24.1 y 30.95°C para la temporada lluviosa, mientras que en la temporada seca fueron 27.8 y 29.5°C. La temperatura del agua tuvo un valor promedio de 28.12°C en la superficie y 28.77°C en el fondo, esta estuvo muy constante en ambos sectores. De mayo – diciembre las distintas medidas de pH de la superficie del agua mantuvieron un rango entre 6.4 y 8.14 neutro a ligeramente alcalino, y en los meses de enero – abril (temporada seca) de 6.44 y 6.86 casi neutro. En el fondo, los rangos fueron 5.61 y 6.88 ligeramente acido a neutro, para la temporada lluviosa, mientras que en la temporada seca fueron 6.54 y 6.80 casi neutro. El pH del agua tuvo un valor promedio de 6.99 en la superficie y 6.36 en el fondo. Las distintas medidas de oxígeno disuelto en el agua de la superficie mantuvieron un rango entre 7.23 mg O2/l y 8.26 mg O2/l en los meses de mayo – diciembre y entre los meses de enero – abril de 7.14 mg O2/l y 7.84 mg O2/l. En el fondo los rangos fueron 1.66 mg O2/l y 5.88 mg O2/l para la temporada lluviosa, mientras que en la temporada seca fueron 7.03 mg O2/l y 7.42 mg O2/l. El oxígeno disuelto en el agua tuvo un valor promedio de 7.68 mg O2/l en la superficie y 4.76 mg O2/l en el fondo (Fig. 4).
Variación de la concentración de proteínas totales (mg/l) en los diferentes intervalos de tamaños (mm): la concentración de proteínas en los diferentes tejidos va ascendiendo desde las tallas de 50 mm hasta 115 mm. Los tejidos con mayor concentración de proteínas fueron el resto del tejido y las gónadas (Fig. 5).
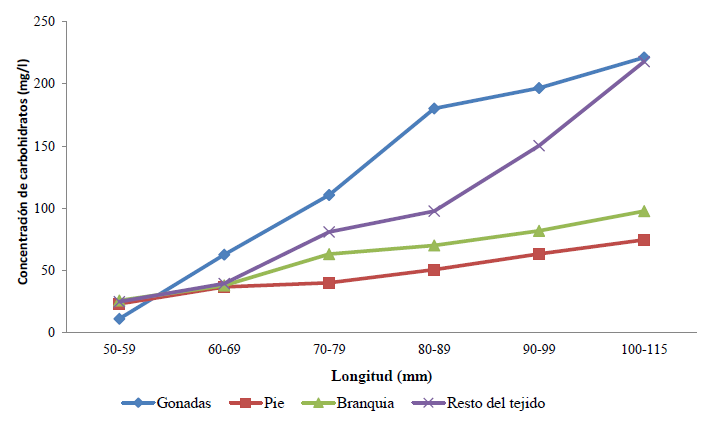
Variación de la concentración de carbohidratos totales (mg/l) en los diferentes intervalos de tamaños (mm): la concentración de carbohidratos en los diferentes tejidos va ascendiendo desde las tallas de 50 mm hasta 115 mm. Los tejidos con mayor concentración de carbohidratos fueron las gónadas y el resto del tejido; debido a que en el pie y las branquias baja un poco la concentración de este sustrato (Fig. 6).
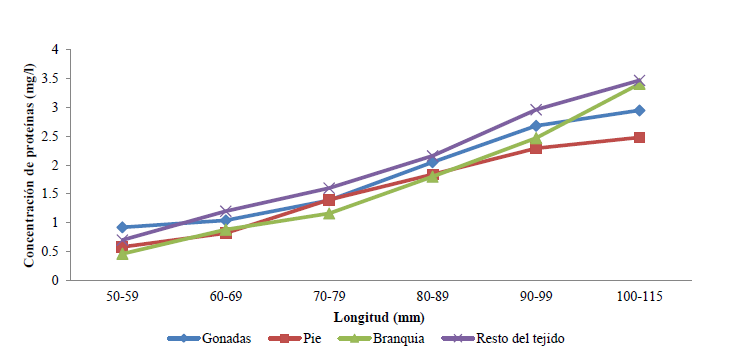
Para Vite-García (2005) el incremento en la concentración de proteínas desde las tallas de 50 mm y 60 mm hasta las de 100 mm y 115 mm, se debe a que las proteínas cumplen un papel importante como reserva energética y como elemento
estructural en moluscos bivalvos adultos, principalmente durante la gametogénesis. También desempeñan un rol importante en el suministro de energía y elementos estructurales para la formación de tejido gonadal, estos resultados siguen un patrón similar a lo reportado para otras especies de bivalvos como Pteria sterna y Pinctada mazatlanica.
El aumento en la concentración de carbohidratos en las tallas de 50 a 60 mm hasta las de 100 a 115 mm en los tejidos somáticos (pie y branquia) y en los otros tejidos (gónadas y resto del tejido) se debe según Racotta et al. (1998) a que los carbohidratos, en especial el glucógeno son empleados como combustible en la gametogénesis además de que pueden ser utilizados como sustrato para la síntesis de lípidos y proteínas que son transferidos al vitelo de los ovocitos en desarrollo durante el proceso de la gametogénesis.
Según Gabbott (1983), el metabolismo energético en moluscos bivalvos está relacionado con la movilización y consumo de energía, la cual es indispensable para el mantenimiento, reproducción y crecimiento.
Análisis estadísticos: la H = 123.3, p < 0.05 en la prueba de Kruskal-Wallis para las variables longitud, alto y ancho y la probabilidad fue 3.84 x 10-21 valor menor a 0.05, lo cual nos indica que la comparación mensual de la talla resulto significativamente diferente.
El análisis estadístico de la ANOVA con el diseño completamente al azar (DCA) indica que existen diferencias significativas en las concentraciones de proteínas en las diferentes tallas (F5, 18 = 49.9 P < 0.05). También que existen diferencias en las concentraciones de carbohidratos en las diferentes tallas (F5, 18 = 6.748 P < 0.05).
Cuando se observa la relación de longitud total (crecimiento del ejemplar) con las concentraciones de proteínas y carbohidratos en los tejidos, nos damos cuenta que las concentraciones de estas reservas energéticas en cada uno de estos
tejidos dependen directamente del crecimiento de las almejas, posiblemente por el tipo de alimento que ingieren. Esto se debe a que el crecimiento de los bivalvos está relacionado con factores exógenos como la cantidad de alimento y la temperatura y endógenos como el tamaño y estado reproductivo (Iglesias et al. 1992).
Relación entre los parámetros fisicoquímicos y las concentraciones de proteínas y carbohidratos en las gónadas: solo se encontró correlación entre el O2 y la concentración de proteínas en las gónadas, en el resto de los parámetros fisicoquímicos y las diferentes concentraciones de sustratos energéticos (proteínas y carbohidratos) no hubo correlación (Cuadro 1).
| Dependencia | Valor de r | Valor de R2 | P | Relación |
| Oxígeno disuelto con la concentración de proteínas | 0.87 | 0.76 | 0.0002 | Muy Buena |
| Oxígeno disuelto con la concentración de carbohidratos | 0.51 | 0.26 | 0.08 | No hubo |
| Temperatura del lago con las concentraciones de proteínas | 0.44 | 0.19 | 0.15 | No hubo |
| Temperatura con las concentraciones de carbohidratos | 0.15 | 0.02 | 0.61 | No hubo |
| pH con la concentración de proteínas | 0.47 | 0.22 | 0.11 | No hubo |
| pH con la concentración de carbohidratos | 0.14 | 0.02 | 0.65 | No hubo |
| Solidos totales disueltos con la concentración de proteínas | 0.20 | 0.04 | 0.52 | No hubo |
| Solidos totales disueltos con la concentración de carbohidratos | 0.19 | 0.04 | 0.54 | No hubo |
| Conductividad con la concentración de proteínas | 0.11 | 0.01 | 0.73 | No hubo |
| Conductividad con la concentración de carbohidratos | 0.42 | 0.18 | 0.17 | No hubo |
En las relaciones de los parámetros físico químicos con las concentraciones de los sustratos energéticos dígase proteínas y carbohidratos, el oxígeno disuelto es el parámetro que afecto significativamente la concentración de proteínas en las gónadas, debido a que el aumento del oxígeno disuelto en el agua es indicativo de un incremento en la productividad primaria en el ambiente y por lo tanto de una
mayor disponibilidad de alimento para los bivalvos filtroalimentadores, los cuales almacenan más sustratos energéticos convertidos en proteínas en sus gónadas (comunicación personal de la Dra. Blanca C. Farfan 2014).
CONCLUSIÓN
Los tejidos con mayor acumulación de sustrato energético llámese proteínas o carbohidratos fueron las gónadas. La concentración de carbohidratos presente en los tejidos, fue mayor que la de proteínas, a lo largo de todo el año de experimentación.
El oxígeno disuelto en el agua del lago Gatún es el parámetro físico químico que influye en las concentraciones de proteínas en las gónadas.
Agradecimientos
Expreso mi eterno agradecimiento a todas las personas, como a las instituciones, que me brindaron su apoyo para hacer posible el desarrollo de este artículo, brindándome la oportunidad de explorar nuevos horizontes en la investigación. Al Doctor Enrique Medianero, a los Magister Ricardo Pérez, Ana María Jiménez y Alonso Santos, al Profesor Arnold Russell y al Instituto de Investigaciones Tropicales Smithsonian; la Autoridad del Canal de Panamá; la Universidad de Panamá, Facultad de Ciencias Naturales, Exactas y Tecnología, Museo de Malacología, al Laboratorio de Ciencias del Mar de isla Naos y a la Ingeniera Zedna Guerra de la Autoridad de los Recursos Acuáticos de Panamá (ARAP) por el apoyo en equipo e infraestructura brindado durante el desarrollo de este artículo.
Referencias
Acosta, V., Natera, Y., Lodeiros, C., Freites, L. y Vásquez, A. (2010). Componentes bioquímicos de los tejidos de Perna perna y P. viridis (Lineo, 1758) (Bivalvia: Mytilidae), en relación al crecimiento en condiciones de cultivo suspendido. Latin American Journal of Aquatic Research, 38(1), 37-46.
Callil, C.T. & Mansur, M.C. (2007). Gametogênese e dinâmica da reprodução de Anodontites trapesialis (Lamarck) (Unionoida, Mycetopodidae) no lago Baía do Poço, planicie de inundação do rio Cuibá, Mato Grosso, Brasil. Revista Brasileira de Zoología, 24(3), 825-840.
Dubois, M.G., Hamilton, J.K., Rebes, P.A. & Smith, F. (1956). Colorimetric method for determination of sugars and relates subtances. Analytical Chemistry, 28, 350- 356.
Dzyuba, S.M. & Maslenniskova, L.A. (1987). Gametogenesis of the bivalve mollusck Mya japonica. Biologiya Morya, 1, 37-43.
Gabbot, P. (1976). Energy metabolism. In Bayne, B.L. (ed.) Marine mussels, their ecology and physiology. United States: Cambridge, University Press New York.
Gabbott, P. (1983). Developmental and seasonal metabolic activities in marine mollusks. In Hochachka, P.W. (ed.). The Mollusca 2: environmental biochemistry and physiology, United States: Academic Press New York.
Ga l t sof f , P. S. ( 1964 ) . T he Am e r i can o yst er . Fishery bulletin. United States Fish and Wildlife Service , 64,1-480.
Hassid, W. & Abraham, S. (1957). “Chemical procedures for analysis of polisacharides”. In Colowik, S.P. and Kaplan, N.O. (ed.), Methods in enzymology. United States: Academic Press New York.
Iglesias, J.I.P., Navarro, E., Alvarez, J.P. & ARMENTIA, I. (1992). Feeding, particle selection and absorption in cockles Cerastodema edule (L.) exposed to variable conditions of food concentration and quality. Journal of Experimental Marine Biology and Ecology, 162, 177-198.
Macdonald, B.A., Bacon, G.S. & Ward, J.E. (1998). Physiological responses of infaunal (Myarenaria) and epifaunal (Placopecten magellanicus) bivalves to variations in the concentration and quality and suspended particles. 2. Absorption efficiency and scope for growth. Journal of Experimental Marine Biology and Ecology, 219(1-2), 127-141.
Pernet, F., Gauthier-Clerc, S. & Mayrand, E. (2007). Change in lipid c om pos i t ion in ea ste rn o yste r ( Crassostrea virginica , Gm e l in ) exposed to constant or fluctuating temperature regimes. Comparative Biochemistry and Physiology, 147, 557-565.
Racotta, I.S., Ramírez, J.L., Avila, S. & Ibarra, A.M. (1998). Biochemical composition of gonad and muscle in the catarina scallop, Argopecten ventricosus, after reproductive conditioning under two feeding systems. Aquaculture, 163, 111-122.
Sánchez, S.J. (2012). Cambios histológicos y bioquímicos asociados al ciclo de maduración de la almeja de sifón, Panopea globosa en San Felipe, B.C. México (Tesis de Maestrías). Universidad Autónoma de Baja California, Facultad de Ciencias Marinas, Instituto de Investigaciones Oceanológicas, México.
Saucedo, P.E. & Southgate, P.C. (2008). Reproduction, Development, and Growth. In Southgate P.C. & Lucas J.S. (Eds.). The Pearl Oyster: Biology and Culture. Holanda: Elsevier Science.
Shafee, M.S. (1981). Seasonal changes in the biochemical composition and caloric content of the black scallop Chlamys varia (Linnaeus) from Lanveoc, Bay of Brest Oceanol Acta, 4, 331-341.
Skinner, A., Young, M. & Hastie, L. (2003). Ecology of the Freshwater Pearl Mussel. Conserving Natura 2000 Rivers Ecology Series No. 2 English Nature, United Kingdom: Peterborough.
Thompson, R.J. & Macdonald, B.L. (1990). The role of environmental conditions in the seasonal synthesis and utilization of biochemical energy reserves in the gigant scallop, Placopecten magellamicus. Canadian Journal of Zoology, 68, 750- 756.
Vega, A.J. (1994). Estructura de población, rendimiento y épocas reproductivas de Anadara sp. (Bivavia: Arcidae) en la Reserva Forestal Térraba-Sierpe, Puntarenas, Costa Rica. Con recomendaciones para su manejo (Tesis de Maestría). Universidad de Costa Rica, Costa Rica.
Villaláz, J.R. (1992). Reproductive biology of Argopecten ventricosus Thesis Doctoral). University of Delaware, United States.

